基于磷酸盐沉淀分离电镀污泥中铬铁的热力学研究
来源期刊:稀有金属2018年第10期
论文作者:张文娟 马保中 王成彦
文章页码:1084 - 1092
关键词:铬铁分离;磷酸盐沉淀法;热力学;
摘 要:电镀污泥酸性浸出液中的铬铁分离是影响铬资源化回收的一大技术难题。目前已开发的磷酸盐选择性沉淀法分离效果好、操作简单,是一种具有发展前景的铬铁分离工艺。研究有关该体系沉淀过程的相关理论对于寻找最佳工作条件具有重要的指导意义。通过热力学计算,绘制了25℃时Cr3+-Fe3+-PO43--H2O系和Cr3+-Fe2+-PO43--H2O系的热力学平衡图,并考察了磷酸盐加入量和溶液中总铁浓度等相关参数对分离效果的影响。结果表明:在酸性溶液中,采用磷酸盐沉淀法分离Cr3+和Fe3+是不可行的;而在Cr3+-Fe2+-PO43--H2O系中,CrPO4(s)单独稳定区的存在,为Cr3+和Fe2+的分离提供了一条途径;通过热力学分析,获得了Cr3+和Fe2+分离的最佳工作窗口。结合已有研究,进一步验证了理论计算的准确性。
网络首发时间: 2018-07-19 13:33
稀有金属 2018,42(10),1084-1092 DOI:10.13373/j.cnki.cjrm.xy18010015
张文娟 马保中 王成彦
北京科技大学冶金与生态工程学院
电镀污泥酸性浸出液中的铬铁分离是影响铬资源化回收的一大技术难题。目前已开发的磷酸盐选择性沉淀法分离效果好、操作简单, 是一种具有发展前景的铬铁分离工艺。研究有关该体系沉淀过程的相关理论对于寻找最佳工作条件具有重要的指导意义。通过热力学计算, 绘制了25℃时Cr3+-Fe3+-PO43--H2O系和Cr3+-Fe2+-PO43--H2O系的热力学平衡图, 并考察了磷酸盐加入量和溶液中总铁浓度等相关参数对分离效果的影响。结果表明:在酸性溶液中, 采用磷酸盐沉淀法分离Cr3+和Fe3+是不可行的;而在Cr3+-Fe2+-PO43--H2O系中, CrPO4 (s) 单独稳定区的存在, 为Cr3+和Fe2+的分离提供了一条途径;通过热力学分析, 获得了Cr3+和Fe2+分离的最佳工作窗口。结合已有研究, 进一步验证了理论计算的准确性。
中图分类号: X781.1
作者简介:张文娟 (1989-) , 女, 陕西咸阳人, 博士, 研究方向:固体废弃物处理、资源回收;E-mail:zwjuan1109@163.com;;*王成彦, 教授;电话:010-62333170;E-mail:chywang@yeah.net;
收稿日期:2018-01-05
基金:中国博士后科学基金项目 (2017M610766) ;中国博士后科学基金特别资助项目 (2018T110045) 资助;中央高校基本科研业务费项目 (FRF-TP-17-037A1, FRF-BD-17-010A);
Zhang Wenjuan Ma Baozhong Wang Chengyan
School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing
Abstract:
Separation of chromium and iron from acidic lixivium of electroplating sludge is a problem in the recovery of chromium.The selective phosphate precipitation is a promising method to separate Cr and Fe due to the characters of effective separation and simple operation. Therefore, the study of related theory of the precipitation process is vital for optimizing operation conditions. According to thermodynamic calculation, the equilibrium diagrams of Cr3+-Fe3+-PO43--H2O system and Cr3+-Fe2+-PO43--H2O system were established at 25 ℃. The effect of phosphate dosage and initial iron concentration on the separation was also investigated. The results indicated that it was in feasible to separate Cr3+and Fe3+by phosphate precipitation. By contrast, there existed a stable region of CrPO4 ( s) in Cr3+-Fe2+-PO43--H2O system, which provided an approach for separation Cr3+and Fe2+. Through thermodynamic analysis, the optimal operating window was obtained. Furthermore, the existing works further illustrated the correctness of the theoretic calculation.
Keyword:
Cr/Fe separation; phosphate precipitation; thermodynamic;
Received: 2018-01-05
电镀污泥是电镀行业产生的主要固体废弃物, 因含有铬、铜、铅、锌、镍等重金属, 在《国家危险废物名录》中被列为T (toxicity) 型毒性废物。据统计, 我国电镀行业每年产出约1000万吨电镀污泥, 富含有大量的有价金属, 其资源化和无害化处理一直是相关领域的研究热点。目前, 国内外对电镀污泥中有价金属的回收主要分为湿法和热化学法[1,2,3,4]。由于电镀污泥含水率高达80%, 湿法处理相比于热化学法更具优势。酸浸法由于对金属浸出率高成为湿法处理中应用最广泛的方法之一, 但酸性条件下多种金属同时浸出难以分离。而目前的研究多集中于铜、镍、锌等金属的分离和提取, 对含量较高且毒性最大的铬未进行回收利用。究其原因, 主要是酸性溶液中Cr3+和Fe3+难以深度分离, 致使金属回收率低, 从而限制了铬的资源化回收。
近年来, 人们对酸性溶液中的铬铁分离进行了大量探索研究, 主要分为溶剂萃取法和化学沉淀法。李雪飞[5]采用P204萃取分离酸性溶液中的铬铁, 但该方法在萃取铁的同时, 铬的共萃率太高, 造成铬的大量损失。胡国荣等[6]针对铬铁合金硫酸浸出液, 采用针铁矿法进行除铁, 也难以避免除铁过程中铬的损失率过高。王亲猛[7]利用草酸亚铁溶度积较小的性质, 通过控制草酸用量, 达到了98.5%的除铁率, 但该方法要求严格控制草酸用量, 且由于沉淀pH较高, 溶液中和负荷较重。邬建辉等[8]采用莫尔盐结晶法分离铬和铁, 可以有效分离铬铁, 且金属损失率较低, 但该方法蒸发耗时较长, 冷却操作复杂。上述这些方法均是通过从铬铁混合溶液中优先分离铁来实现铬铁的分离, 在铁的提取过程中难以避免的造成铬的损失并带来铬的二次污染。为此, 徐志峰等[9,10]反其道而行, 提出了优先提取铬的方法。该方法在溶液中Fe3+预还原的基础上, 采用磷酸盐选择性沉淀铬, 在最佳条件下, 铬的沉淀率可达98.53%, 铁的沉淀率仅1.42%。该方法可有效分离铬铁, 工艺过程简单且易于操作, 解决了分离过程金属损失率高的问题。
目前, 以磷酸盐做沉淀剂进行电镀污泥酸性浸出液中铬、铁分离的方法已在实验中获得突破, 现有的研究也主要集中于工艺条件的优化, 关于分离过程中的平衡问题特别是理论研究还不够透彻。本文作者拟通过热力学分析, 绘制出磷酸盐选择性沉淀分离铬、铁的热力学平衡图并进行系统的热力学分析, 从理论上预测最佳的工作窗口, 以期能深化认知并为该方法的实践提供一定的理论指导。
1热力学数据及计算方法
以Cr3+-Fe3+-PO43--H2O系和Cr3+-Fe2+-PO43--H2O系为研究对象, 溶液中可能存在的游离组分有H+, OH-, PO3-4, HPO2-4, H2PO-4, H3PO4, Cr3+, Cr OH2+, Cr (OH) 2+, Cr HPO4+, Fe2+, Fe OH+, Fe (OH) 2, Fe (OH) 3-, Fe (OH) 42-, Fe HPO4, Fe H2PO4+, Fe3+, Fe OH2+, Fe (OH) 2+, Fe (OH) 3, Fe HPO4+, Fe H2PO42+, Fe HPO44+;可能存在的固相组分有Cr PO4 (s) , Fe3 (PO4) 2·8H2O (s) , Cr (OH) 3 (s) , Fe (OH) 2 (s) , Fe PO4 (s) , Fe (OH) 3 (s) 。这些组分之间可能存在的化学反应及平衡常数如表1所示。根据各组分之间的平衡关系, 各游离组分的平衡浓度所满足的方程列于表1中[11,12,13,14]。
此外, 根据质量平衡原理, 平衡时溶液中总磷[P]T、总铁[Fe]T、总铬[Cr]T浓度分别满足表2中方程 (26) ~ (28) 。随着溶液pH的变化, 体系中会出现不同的固相组成, 因此他们的溶解平衡需要分别加以考虑。在不同的固相稳定区内, 根据物料守恒, 体系中[P]T, [Fe]T和[Cr]T之间存在如表2所示的关系。当体系中生成不同沉淀时, 溶液中各离子的浓度需要满足的方程列于表3中。根据这些平衡关系和方程, 即可计算出各固相成分稳定存在的p H区间以及溶液中各离子的平衡浓度。
考虑到实际计算过程中, 缺乏相关离子的活度系数数据, 且体系沉淀过程中大多数游离组分的浓度很低, 故计算时各离子的活度均用浓度代替[15]。根据同时平衡原理, 联立各离子之间的平衡方程, 计算出各沉淀组分稳定存在的pH区域, 以及溶液中各离子的平衡浓度, 在此基础上即可获得磷酸盐沉淀法分离铬铁的最佳工作窗口。
2结果与讨论
2.1 Cr3+-Fe3+-PO43--H2O系
图1为Cr3+-Fe3+-PO43--H2O系相关组分的分布图, 其中初始浓度[P]Ti, [Fe]Ti和[Cr]Ti分别为0.18, 0.09和0.09 mol·L-1。从图1可以看出, 随着p H增大, 固体沉淀CrPO4 (s) , FePO4 (s) , Cr (OH) 3 (s) , Fe (OH) 3 (s) 之间的相互转化使得体系形成了6个优势区域。当体系0≤p H≤0.58时, 体系中没有固相生成;当p H为0.58时, CrPO4 (s) 和FePO4 (s) 同时沉淀, 在0.58≤pH≤2.8区间内, CrPO4 (s) +FePO4 (s) 两相共存, 并且其溶解度随pH的升高而降低, 溶液中大量Cr3+被配位形成。随着pH增大到2.8~5.87, 溶液中总[P]T逐渐增加, FePO4 (s) 逐渐转变为Fe (OH) 3 (s) , 出现了CrPO4 (s) +FePO4 (s) +Fe (OH) 3 (s) 的三相共存区;当5.87≤pH≤10.5, FePO4 (s) 完全转变为Fe (OH) 3 (s) , 此时为CrPO4 (s) +Fe (OH) 3 (s) 的两相共存区;随着p H增大, 体系开始有Cr (OH) 3 (s) 沉淀产生, 此时溶液中游离含铬组分主要为;当pH增大到10.67, 体系中CrPO4 (s) 完全消失, 溶液中总浓度[P]T达到初始0.15 mol·L-1;当10.67≤pH≤14, 可以发现为Cr (OH) 3 (s) +Fe (OH) 3 (s) 的稳定共存区。综上可以看出, 整个p H范围内没有出现CrPO4 (s) , FePO4 (s) , Cr (OH) 3 (s) , Fe (OH) 3 (s) 的单独物相稳定区。因此, 采用磷酸盐沉淀法难以实现Cr3+和Fe3+的分离, 这一结果与前人的实验结果相吻合。值得注意的是, CrPO4 (s) 和FePO4 (s) 在碱度增加的条件下都能转变为氢氧化物, 这一点可以用于从CrPO4 (s) 或FePO4 (s) 中回收磷。上述分析表明, 在含有Cr3+和Fe3+的酸性溶液中, 通过加入磷酸盐实现铬铁分离的方法不具有可行性。
表1 选择性沉淀体系的热力学平衡方程及其在25℃下的平衡常数Table 1 Thermodynamic equilibrium equations and constants of precipitation system at 25℃[11,12,13,14] 下载原图
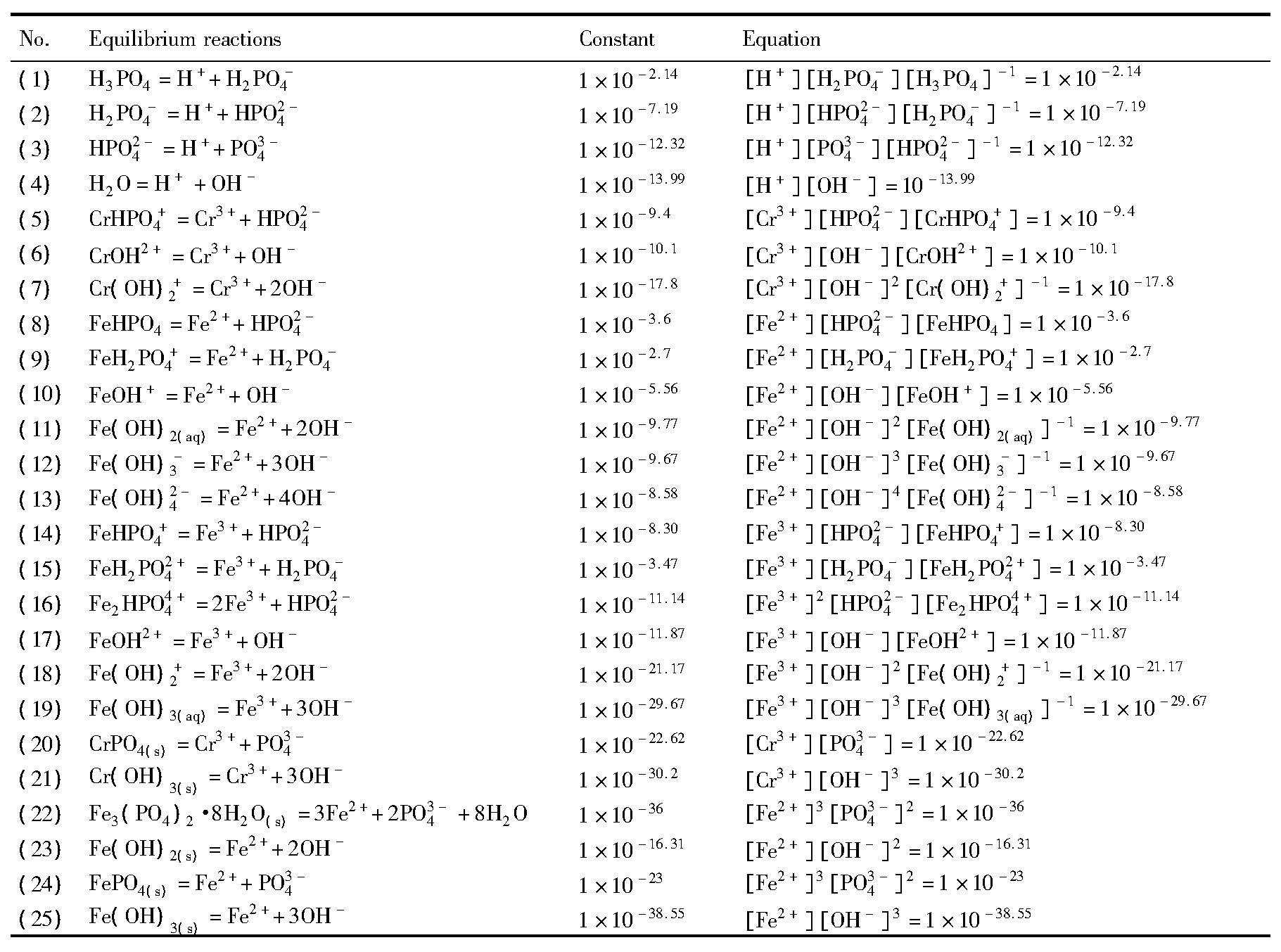
表1 选择性沉淀体系的热力学平衡方程及其在25℃下的平衡常数Table 1 Thermodynamic equilibrium equations and constants of precipitation system at 25℃[11,12,13,14]
表2 选择性沉淀体系的质量守恒方程Table 2 Mass balance equations of precipitation system 下载原图

Note:“[]”in equation designating species equilibrium concentrations;[P]T, [Fe]T, [Cr]Tdesignating total concentrations of phosphate, iron and chromium in equilibrium conditions, respectively;[P]Ti, [Fe]Ti[Cr]Tidesignating initial total concentrations of phosphate, iron and chromium before precipitation of solid phases, respectively
表2 选择性沉淀体系的质量守恒方程Table 2 Mass balance equations of precipitation system
表3 体系处于固体稳定区时的平衡方程Table 3 Systems of equations depending on nature of solid phase (s) 下载原图

表3 体系处于固体稳定区时的平衡方程Table 3 Systems of equations depending on nature of solid phase (s)
图1 Cr3+-Fe3+-PO43--H2O系的相关组分分布图Fig.1 c-p H (a) ;lgc-p H (b) ;chromium soluble species distribution (c) ;iron soluble species distribution (d) and molar ratio of solid species of Cr3+-Fe3+-PO43--H2O system (e)
虽然磷酸盐沉淀法无法实现铬铁的分离, 但仍适用于酸性溶液中除Fe3+或除Cr3+。例如, 杨秋菊等[16]采用磷酸盐除铁工艺处理高铁含铜溶液, 在p H为1.5的条件下, 铁的去除率达到了99%。张帆[17]针对高铁、低锌浸出液, 通过加入磷酸钠, 在初始pH为1.04时, 去除了98%的铁。可以看出, 上述实验所采用的pH值均在本文的热力学计算结果的范围内。
2.2 Cr3+-Fe2+-PO43--H2O系
图2为Cr3+-Fe2+-PO43--H2O系相关组分的分布图, 其中初始浓度[P]Ti, [Fe]Ti和[Cr]Ti分别为0.09, 0.09和0.09 mol·L-1。从图1可以看出, 随着pH增大, 沉淀组分的优势区域分别为CrPO4 (s) , CrPO4 (s) +Fe3 (PO4) 2·8H2O (s) , CrPO4 (s) +Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) , Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) , Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) +Fe (OH) 2 (s) , Cr (OH) 3 (s) +Fe (OH) 2。与Cr3+-Fe3+-PO43--H2O系不同的是, 在该体系内, 当0.6≤p H≤4.93时, 出现了CrPO4 (s) 单独物相的稳定区, 并且其溶解度随pH的升高而降低, 溶液中总铬浓度[Cr]T由初始的0.09 mol·L-1降至约1×10-5mol·L-1。当体系4.93≤pH≤6时, CrPO4 (s) 和Fe3 (PO4) 2·8H2O (s) 同时沉淀。值得注意的是, 在此区域内Fe3 (PO4) 2·8H2O (s) 虽然形成沉淀, 但溶液中总[Fe]T变化甚微, 这主要是因为溶液中的磷全部用来沉淀CrPO4 (s) , 没有足够的磷与铁形成更多沉淀。这一磷酸盐的沉淀差异, 正好可以用于选择性沉淀分离铬和铁。随着pH升高, 溶液中的铬由Cr3+和转变为, CrPO4 (s) 的溶解度增大。当pH值为6时, CrPO4 (s) 开始转变为Cr (OH) 3 (s) , 随着pH值升高, 释放出的磷增多, Fe3 (PO4) 2·8H2O (s) 沉淀量增加, 溶液中总铁浓度[Fe]T急剧下降。当6≤pH≤10.28时, 为CrPO4 (s) +Fe3 (PO4) 2·8H2O (s) +Cr (OH) 3 (s) 的三相共存区。当10.28≤pH≤10.8, CrPO4 (s) 完全转变为Cr (OH) 3 (s) , 此时为Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) 的两相共存区。当p H增大到11.07, 体系中Fe3 (PO4) 2·8H2O (s) 完全消失, 溶液中总浓度[P]T达到初始0.09mol·L-1;当11.07≤pH≤14, 可以发现为Cr (OH) 3 (s) +Fe (OH) 2 (s) 的稳定共存区。
图2 Cr3+-Fe2+-PO43--H2O系相关组分的分布图Fig.2 c-p H (a) ;lgc-p H (b) ;chromium soluble species distribution (c) ;iron soluble species distribution (d) and molar ratio of solid species of Cr3+-Fe2+-PO43--H2O system (e)
上述分析表明, 采用磷酸盐沉淀分离Cr3+和Fe2+在一定pH范围内是可行的。很明显, p H对于Cr3+和Fe2+分离是一个非常重要的控制因素。当pH值从0.7增大到2.1, 铬的沉淀率从23.5%增加到97.2%。在pH 2.1~6.0的范围内, 铬的沉淀率维持在99.9%。因此, 在该体系设定的初始条件下, 磷酸盐沉淀分离铬铁的最佳p H范围为2.1~6.0。在此范围内铁主要以Fe2+形式存在, 溶液中残留的总铬浓度基本维持在1×10-5mol·L-1左右。
2.3磷酸盐用量对分离效果的影响
在实际操作中, 影响分离效果的因素往往有很多, 如反应温度、磷酸盐加入量、反应时间、p H值等。在此结合热力学分析, 本文通过绘制一定初始总磷浓度时各游离组份的浓度变化, 来分析磷酸盐用量对沉淀分离铬铁的影响。图3为溶液中初始游离总磷浓度[P]Ti分别为0.15和0.12 mol·L-1时Cr3+-Fe2+-PO43--H2O系相关组分的分布图, 其中[Fe]Ti和[Cr]Ti均为0.09 mol·L-1。
从图3中可以看出, 当[P]Ti∶[Cr]Ti摩尔比分别为4∶3和5∶3时, CrPO4 (s) 的单独物相稳定区均未发生明显变化, 沉淀分离铬铁的最佳pH范围都在1.5~3.1之间。控制溶液pH在此范围内, 热力学上可将铬的浓度降至5×10-4mol·L-1。但与图2对比, 当[P]Ti∶[Cr]Ti摩尔比为1∶1时, CrPO4 (s) 的单独物相稳定区明显增大, 工作窗口也明显扩大。究其原因, 当磷的加入量为铬摩尔量的1倍时, 铬消耗了溶液中所有的磷, 没有足够的磷与铁结合。因此, Fe3 (PO4) 2·8H2O (s) 的生成需要靠CrPO4 (s) 转化为Cr (OH) 3 (s) 时释放的磷, 这就导致Fe3 (PO4) 2·8H2O (s) 与CrPO4 (s) 之间存在一个争夺磷的关系。显然在低pH条件下, CrPO4 (s) 要比Fe3 (PO4) 2·8H2O (s) 更加稳定。而图3中所加入的磷均超过了铬摩尔量的1倍, 溶液中有足够的磷使铁过早沉淀, 致使CrPO4 (s) +Fe3 (PO4) 2·8H2O (s) 的两相稳定区在更低的pH下存在。比较图2和3可以看出, 随着磷加入量的减小, CrPO4 (s) 的溶解度减小, CrPO4 (s) 转变为Cr (OH) 3 (s) 的p H值减小, 溶液中铁的存在形态也发生了变化。当加入磷为铬摩尔量的1倍时, 最佳工作区域内铁主要以游离的Fe2+存在, 随着磷浓度增加, Fe2+逐渐转变为FeH2PO4+。因此, 增大磷酸盐用量只会促进Fe3 (PO4) 2·8H2O (s) 的生成, 对溶液中总铬浓度无影响。表4为磷加入量不同时, 铬和铁在不同pH时的沉淀率。可以看出, 随着磷加入量增大, 铁共沉淀时p H值越低。因此, 在实际操作过程中, 为了防止铁的共沉淀, 建议磷加入量尽可能接近溶液中铬摩尔量的1倍。
图3 初始总磷浓度[P]Ti对铁铬分离的影响Fig.3 Effect of initial total concentrations of phosphorous on separation of chromium and iron (a) [P]Ti=0.15 mol·L-1; (b) [P]Ti=0.12 mol·L-1
表4 初始总磷浓度[P]Ti对铁铬沉淀率的影响Table 4 Effect of initial total concentrations of phosphor-ous on precipitation rate of Cr and Fe 下载原图
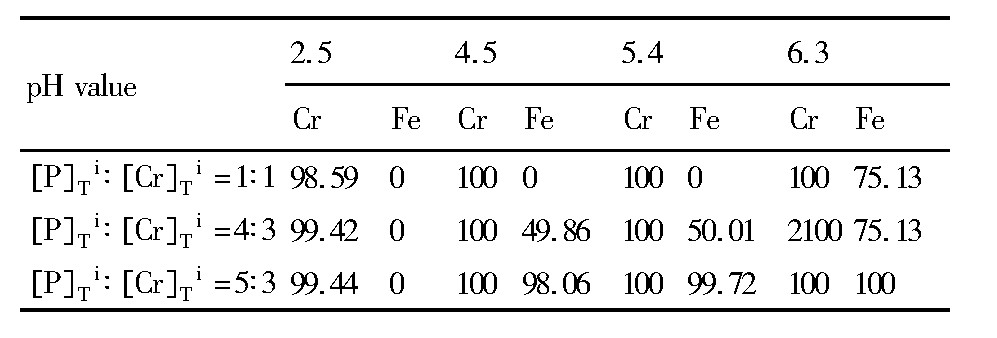
表4 初始总磷浓度[P]Ti对铁铬沉淀率的影响Table 4 Effect of initial total concentrations of phosphor-ous on precipitation rate of Cr and Fe
2.4总铁浓度对分离效果的影响
图4为初始游离总铬浓度为0.09mol·L-1, 初始游离总磷浓度分别为[P]Ti=[Cr]Ti+2/3[Fe]Ti和[P]Ti=[Cr]Ti时, 不同初始游离总铁浓度[Fe]Ti下Cr3+-Fe2+-PO43--H2O系的c-pH图。由图4可知, Fe3 (PO4) 2·8H2O (s) 的初始沉淀pH值随着溶液中游离总铁浓度的增加逐渐向低p H方向移动, 而CrPO4 (s) 沉淀时体系中游离总铬的平衡浓度并未发生明显变化。也就是说, 初始总铁浓度的增加会使最佳工作窗口缩小, 要求分离过程中对p H值的控制更加精准和严格。对比图4 (a, b) 可以进一步说明, 采用磷酸盐沉淀分离铬、铁时, 磷酸盐加入量为铬摩尔量1倍时, 最佳的工作窗口明显较宽, 而磷酸盐超过铬摩尔量1倍时, 多余的磷会加剧铁的共沉淀。表5列出了不同初始游离总铁浓度时的最佳p H区间。
2.5实验检验
为了验证本文热力学计算的可靠性, 查阅了相关研究结果。徐志峰等[18]以含Cr3+4.51 g·L-1, Fe3+2.07 g·L-1的酸性溶液为对象, 探索了磷酸盐沉淀法对铁铬选择性分离的适用性。在p H值为2, PO43-/Cr3+摩尔比为0.49, 反应温度90℃, 反应时间40 min的条件下, 铁的沉淀率为60.46%, 铬的沉淀率为36.83%。该研究结果证明, 采用磷酸盐沉淀法难以实现Cr3+和Fe3+的分离, 这与本文热力学计算的结果相符合。
袁文辉和徐志峰[19]用含Cr3+6.0 g·L-1, Fe2+3.0 g·L-1的电镀污泥浸出液, 在温度为80℃, 反应时间为60 min, PO43-/Cr3+摩尔比为1.1的条件下, 以磷酸钠为沉淀剂, 研究了溶液初始pH对Cr3+, Fe2+沉淀率的影响。由图5可以看出, 溶液pH对铁铬的分离及沉淀过程影响较大。在p H值1~2的范围内, 铬的沉淀率从77.9%增大到95.5%, 铁的沉淀率甚微。在初始p H值为2时, 铬的沉淀率可达96%, 铁沉淀率仅为0.68%, 反应终点的p H为2.5左右。该实验结果证明, 磷酸盐沉淀法分离Cr3+和Fe2+的最佳pH与理论计算相符, 进一步验证了理论计算的正确性。
图4 不同[Fe]Ti时Cr3+-Fe2+-PO43--H2O系的c-p H图Fig.4 c-p H diagram for Cr3+-Fe2+-PO43--H2O system at different initial total concentrations of iron (a) [P]Ti=[Cr]Ti+2/3[Fe]Ti; (b) [P]Ti=[Cr]Ti
表5 不同[Fe]Ti时铬铁分离的最佳窗口Table 5 Optimal operating windows at different initial total concentrations of iron 下载原图
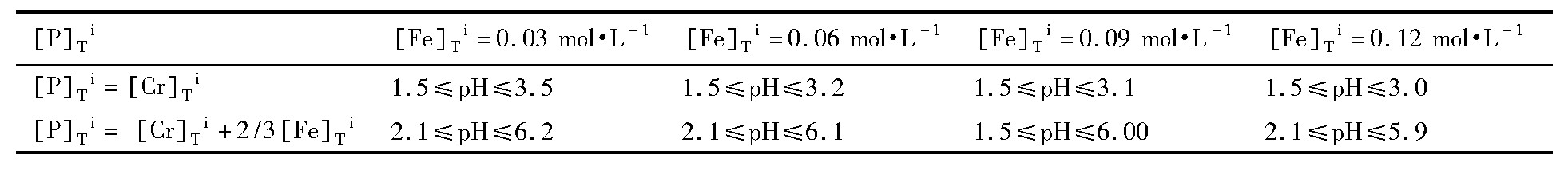
表5 不同[Fe]Ti时铬铁分离的最佳窗口Table 5 Optimal operating windows at different initial total concentrations of iron
图5 溶液初始p H对铬铁沉淀率的影响Fig.5 Effect of initial p H value on precipitation rate of chro-mium and iron[19]
3结论
1.运用已有热力学数据, 通过计算, 绘制了25℃时Cr3+-Fe3+-PO43--H2O系和Cr3+-Fe2+-PO43--H2O系的热力学平衡图, 并考察了不同初始游离总磷浓度和不同初始游离总铁浓度对Cr3+-Fe2+-PO43--H2O系平衡的影响。
2.通过热力学分析, 验证了在Cr3+-Fe3+-PO43--H2O体系中, 采用磷酸盐沉淀法分离电镀污泥酸浸液中的Cr3+和Fe3+是不可行的。。而Cr3+-Fe3+-PO43--H2O系的平衡结果则证实了磷酸盐沉淀法分离Cr3+和Fe2+的可行性。
3.热力学分析结果表明, 影响Cr3+和Fe2+分离的关键因素是p H值。随着pH增大, Cr3+-Fe2+-PO43--H2O系沉淀组分的优势区域分别为CrPO4 (s) , CrPO4 (s) +Fe3 (PO4) 2·8H2O (s) , CrPO4 (s) +Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) , Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) , Cr (OH) 3 (s) +Fe3 (PO4) 2·8H2O (s) +Fe (OH) 2 (s) , Cr (OH) 3 (s) +Fe (OH) 2。而Cr3+和Fe2+的分离可以在CrPO4 (s) 的单独物相稳定区内实现。在最佳工作区间内, 热力学上可将溶液中的铬沉淀99.9%左右。
4.溶液中游离总铁浓度的增加对于平衡时的游离铬浓度影响甚微, 但会使Fe3 (PO4) 2·8H2O (s) 的初始沉淀p H值向低p H方向移动, 进而缩小铬铁分离的最佳工作窗口。
5.通过分析前人的研究结果, 进一步验证了本文热力学计算的正确性。
参考文献
[12] Speight J G. Lange's Handbook of Chemistry[M].New York:McGraw-Hill, 2005. 8. 9.
[13] Nriagu J O, Moore P B. Phosphate Minerals[M].Springer Science&Business Media, 2012. 174

