碳铵沉淀-沸腾回流制备Mn-Zn铁氧体
李康康,彭长宏,方艳,朱云
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:以高磁导率锰锌铁氧体废料浸出液为原料,采用NH4HCO3作为沉淀剂,通过沸腾回流法制备尖晶石Mn-Zn铁氧体粉料。通过理论分析和实验验证确定共沉淀的pH、相转化的pH和反应时间。用电感耦合等离子体原子发射光谱(ICP-AES)、X线衍射仪(XRD)和电子扫描电镜(SEM)等分析手段对目标产物进行表征。研究结果表明:反应24 h回流产物相转化程度高,晶化程度好,粉料杂质含量低,产物颗粒粒径小,存在较明显的团聚现象。
关键词:Mn-Zn铁氧体;碳铵沉淀剂;沸腾回流;相转化
中图分类号:TQ136.1 文献标志码:A 文章编号:1672-7207(2012)04-1217-05
Mn-Zn ferrite powder prepared by refluxing method using ammonium bicarbonate
LI Kang-kang, PENG Chang-hong, FANG Yan, ZHU Yun
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The Mn-Zn ferrite was prepared by refluxing method using high permeability ferrite waste and NH4HCO3.The pH of co-precipitation and phase transformation, reaction time were determined through theoretical analysis and experiment verification. The techniques such as ICP-AES, XRD, and SEM were used to describe their crystal structure and morphology. The results show that Mn-Zn ferrite powder refluxed for 24 h has high degree of phase transformation and good crystallization by XRD analysis. The product has low impurity content. And the powder with small particle size has conglomeration phenomena.
Key words: Mn-Zn ferrite; ammonium bicarbonate; refluxing method; phase transformation
尖晶石锰锌软磁铁氧体具有优良的高频性能,即在较高的应用频率下,仍保持高磁导率、低损耗和高稳定性等特点。因此,在电子通讯高频领域有着广泛的应用,如被应用于各种电感磁芯、天线和脉冲变压磁芯等[1-3]。近年来,国内外研究者主要采用湿化学法合成锰锌铁氧体前驱体,如共沉淀法[4]、水热合成法[5]、溶胶-凝胶法[6]、超临界流体干燥法[7]等。其中水热法制备Mn-Zn铁氧体材料因其粉料活性大、颗粒呈纳米级且分布均匀、操作简便等优点受到国内外学者的广泛关注,如Lu等[8]采用水热合成法制备了晶相单一的锰锌铁氧体;桑商斌等[9]通过加入添加剂制备了粒径为10~20 nm的锰锌铁氧体纳米晶。但水热法存在高温高压的反应条件对反应设备要求苛刻,以及原辅材料价格较高等不足之处,限制了该方法的工业应用。在锰锌软磁铁氧体的制备和加工过程中,产生大量的废器件和抛光废料。目前,国内对上述废料的处理方式为简单堆存或出售给模具公司,做低廉的配料使用,这些处理方式存在占用土地、污染环境、资源浪费的问题。如能将锰锌铁氧体废料中的Fe,Mn和Zn有效利用,采用碳酸氢铵等廉价原料作原辅材料,则水热法的原料成本问题得以解决;若采用沸腾回流开放体系,则能克服水热法对高温高压设备的苛刻要求。研究结果表明[10-11],在硫酸强化条件下,实现了锰锌铁氧体废料中Fe,Mn和Zn的完全浸出。基于碳酸氢铵沉淀Zn2+和Mn2+的反应模式[12]和水热反应合成锰锌铁氧体晶粒机理[13],本文作者研究了碳酸氢铵沉淀-沸腾回流制备锰锌铁氧体的工艺条件。
1 实验
1.1 实验原料
铁锰锌硫酸浸出液的制备:以浙江天通公司的锰锌铁氧体废料为原料,采用文献[11]方法制备硫酸浸出液,主成分含量采用化学滴定测定,杂质元素采用ICP-AES测定,其化学成分(质量浓度)见表1。
其他原料有:农用碳铵和工业级烧碱。
表1 废料浸出液的化学成分
Table 1 Chemical composition of leached liquids g/L

1.2 锰锌铁氧体制备
量取一定体积的浸出液,根据计算称取相应量的碳酸氢铵,控制沉淀终点pH。将共沉淀的悬浮液抽滤,滤饼洗至无NH4+,重新配置成悬浮液,用5.0 mol/L NaOH调节pH至预定值,加热至沸腾,回流反应若干小时,冷却至室温,真空抽滤,滤饼洗至无硫酸根离子,烘干即得锰锌铁氧体粉料。
1.3 样品表征
实验采用荷兰Philips PW1840型X线粉末衍射仪对所得产物进行物相分析,用Cu Kα射线。采用日本JSM-6360LV型扫描电子显微镜观察产物的粒径与形貌。锰锌铁氧体粉料中Fe,Mn和Zn 3种主成分含量采用GB 11436—89《软磁铁氧体材料成品、半成品化学分析方法》中的化学滴定法测定,杂质元素含量采用美国Intrepid Ⅱ XSP型电感耦合等离子体发射光谱测定。
2 实验结果与讨论
2.1 共沉淀pH的选择
沸腾回流法制备锰锌铁氧体粉料首先进行的是共沉淀反应,要使共沉淀完全,需要寻找各组分共沉淀合适的pH范围,作为共沉淀的最佳热力学条件。本实验研究采用锰锌铁氧体废料的硫酸浸出液为原料,同时为避免NaOH沉淀剂引起的Na+杂质的影响,采用碳酸氢铵作沉淀剂。由于Fe3+在水溶液体系中与HCO3-发生强烈的双水解反应,且Fe3+在pH大于4.0的情况下能完全沉淀生成Fe(OH)3,所以本研究的共沉淀反应体系可以简化为Mn(Ⅱ)-Zn(Ⅱ)-NH4HCO3- H2O。为确保Mn2+/Zn2+共沉淀完全,需要确定其共沉淀合适的pH范围作为共沉淀的最佳热力学条件,该体系可能存在的化学反应和相应的平衡常数如表2所示[14]。
表2 Mn(Ⅱ)-Zn(Ⅱ)-NH4HCO3-H2O体系可能的化学反应及平衡常数
Table 2 Possible reactions and equilibrium constant in system of Mn(Ⅱ)-Zn(Ⅱ)-NH4HCO3-H2O

根据体系中化学平衡和质量守恒定律,得到Mn和Zn 2种金属离子总浓度随pH变化的关系(图1)。
从图1可以看出:金属离子Mn2+和Zn2+沉淀完全的pH范围为6.0~7.0。实验过程中将终点酸度控制在pH=6.3,pH=6.5,pH=6.8,通过化学滴定法检测实验过程中共沉淀母液中Fe3+,Mn2+和Zn2+含量,经计算在pH分别为6.3,6.5,6.8的条件下,3种金属Fe3+,Mn2+,Zn2+的沉淀率均达到99.0%以上。通过实验验证了理论分析的正确性,同时也确保了沉淀产物中主成分配比与理论配方的一致性。

图1 不同pH下Mn2+和Zn2+的溶解度曲线
Fig.1 Solubility diagram of Mn2+ and Zn2+ ions under different pH
2.2 相转化pH的确定
沸腾回流相转化过程是常压沸腾状态下的水热反应,其反应机理是Zn(OH)2,Mn(OH)2和Fe(OH)3之间羟基的相互作用,逐步脱去水分子而形成尖晶石锰锌铁氧体[13]。以NH4HCO3为共沉淀剂制备的共沉粉料主要由Fe(OH)3,ZnCO3和MnCO3等组成,要使相转化反应顺利进行,碳酸盐应转化为相应的氢氧化物。实验过程中通过提高反应体系中的碱度,使平衡反应MeCO3(s)+2OH- Me(OH)2(s)+CO32-向生成Me(OH)2(Me代表Mn2+和Zn2+)的方向进行,因此相转化过程中体系pH的控制是关键。假定Zn(OH)2(s)和Mn(OH)2(s)不随pH的变化而发生相态的转变,根据表1中的平衡反应3,4,9和14,得到平衡反应发生转移的临界pH(图2)。
Me(OH)2(s)+CO32-向生成Me(OH)2(Me代表Mn2+和Zn2+)的方向进行,因此相转化过程中体系pH的控制是关键。假定Zn(OH)2(s)和Mn(OH)2(s)不随pH的变化而发生相态的转变,根据表1中的平衡反应3,4,9和14,得到平衡反应发生转移的临界pH(图2)。
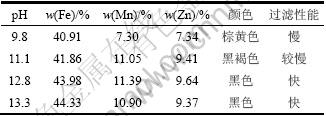
从图2可知:ZnCO3(s)和 MnCO3(s)发生平衡移动的pH分别是10.3和11.2,要使相转化能顺利进行,必须控制体系的pH在临界值以上。为检验上述理论分析结论,通过实验考察了反应体系pH对合成锰锌铁氧体粉料的影响规律,结果见表2。
从表2可以看出:当体系初始pH<11时,回流产物Fe,Mn,Zn的相对含量低,颜色呈现棕褐色,过滤性能较差。究其原因是pH较低时,Mn和Zn主要以碳酸盐的形式存在,体系中能参与相转化反应的氢氧化物含量较少,相转化过程不完全,氢氧化铁含量较多,导致颜色呈棕褐色和过滤性能差。随着pH升高,平衡向着生成氢氧化物的方向转变,有利于相转化过程的进行,得到的产物主成分相对含量有所上升,相转化程度增高,体系呈现铁酸盐的黑色;随着体系中氢氧化铁胶体的降低,过滤性能也随之改善。但是,当反应初始pH>13时,产物中Zn的含量有所降低,这是因为体系中高浓度的OH-使中间产物Zn(OH)2发生羟基络合,以Zn(OH)42-的形式返溶到溶液中。
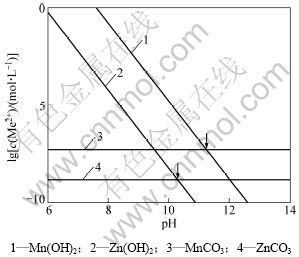
图2 MeCO3(S)和Me(OH)2(S)的平衡曲线
Fig.2 Equilibrium curve of MeCO3(S) and Me(OH)2(S)
表3 反应体系pH对实验结果的影响
Table 3 Effect of pH in reaction system on results of experiments
由以上理论分析和实验研究可以得出,反应体系的pH是控制产物中金属元素含量及影响产物性质的关键因素之一,要使回流相转化反应能顺利进行,体系中需要维持一定的碱度。综合理论分析和实验结果,确定沸腾回流相转化的最佳pH=12.5~13.0。
2.3 反应时间对锰锌铁氧体纳米晶的影响
由于回流反应是在沸腾状态下进行的,其反应的温度是恒定的,所以在体系初始pH确定的情况下,反应时间的长短就基本上决定了反应进行的程度。图3所示为反应不同时间粉料的XRD图谱,表3所示为不同反应时间粉料的主成分相对含量(质量分数)。
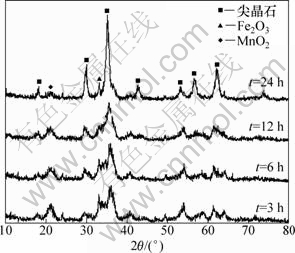
图3 不同反应时间下回流产物的XRD谱
Fig.3 XRD pattern of refluxed powder prepared at different time
由图3可以看出:当反应时间为t=3 h和6 h,已有明显的锰锌铁氧体的衍射峰存在,说明锰锌铁氧体晶体已有一定程度的生长,但是产物的XRD衍射峰较弱,存在明显的宽化现象,表明晶化过程较慢,晶化不完全。随着反应时间的延长,当t=24 h时,产物的衍射峰趋于尖化,强度增强,晶型较好,说明反应时间的延长有利于晶体的进一步生长。在2θ为22.1°和33.1°的位置出现杂峰,经分析为MnO2和Fe2O3。杂相的形成其原因可能是:在体系存在含量较大的Fe(OH)3,反应初期Mn和Zn以碳酸盐的形式存在,缺少合成锰锌铁氧体的氢氧化物前躯体,相对过量的Fe(OH)3与Fe(OH)3微粒之间发生羟基的脱水生成Fe2O3晶相;MnO2杂相可能是在反应过程中Mn(Ⅱ)与体系中的Fe(Ⅲ)发生氧化还原作用而形成的。随着反应时间的延长,杂相MnO2和Fe2O3的峰强也越来越弱,说明较长的反应时间有利于减少杂相的形成。反应中出现的Fe2O3和MnO2在相转化过程中是杂相,但在锰锌铁氧体的烧结工艺中却是原材料,因此,杂相Fe2O3和MnO2的存在在一定程度上是允许的。
从表3可知:随着反应时间的延长,Fe,Mn和Zn的含量都有所上升,产物的颜色由棕黄色变为黑色,说明反应时间的延长有利于锰锌铁氧体晶体的生长,这与XRD图谱的分析结果相一致。
2.4 回流产物杂质含量和SEM分析
为降低产物中杂质成分含量,对回流转化产物进行高温水洗精制,精制产物送测试中心进行ICP-AES检测,杂质成分含量(质量分数)结果见表4。
表4 反应时间对反应生成物的影响
Table 4 Effect of reaction time on experiments results
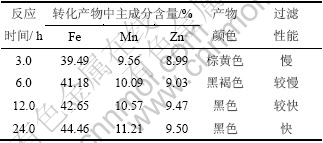
表5 回流产物杂质元素含量
Table 5 Impurity content of refluxed powder 10-6

从表4可以看出,杂质Si,Mg和Al等对锰锌铁氧体性能影响显著的杂质元素含量基本达到铁氧体材料制备的要求,产物中杂质Ca和Cu的含量是提高锰锌铁氧体品质因素的适宜范围[15-16]。
为考察沸腾回流转化过程对锰锌铁氧体纳米晶形貌结构的影响,对回流产物进行了电镜扫描检测,实验结果见图4。
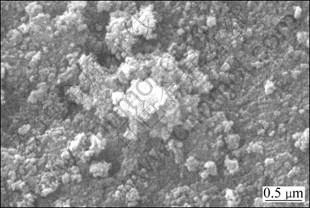
图4 回流转化产物的SEM像
Fig.4 SEM image of Mn-Zn ferrite refluxed powders
从图4可以看出:所制样品粉料颗粒细小,形貌不规则,存在较严重的结块与团聚现象。其原因可能是碱性体系下过量的Fe(OH)3胶体在烘干过程中发生结块,同时回流产物颗粒细小且粉料具有磁性而发生结块团聚现象。
3 结论
(1) 以锰锌软磁废料为主要原料,以工业级碳酸氢铵为共沉淀剂,采用沸腾回流法在水溶液中直接合成锰锌铁氧体粉体。合成的粉末粒径小、活性高。
(2) 沸腾回流法制备Mn-Zn铁氧体的条件为:共沉淀pH为6.0~7.0之间,相转化pH控制在12.5~13.0,反应时间为24 h;回流产物的杂质元素含量已符合制备高性能锰锌铁氧体的要求;回流产物粉料颗粒粒径小,但存在较明显的团聚现象,有待在今后的实验工作中解决颗粒团聚问题。
参考文献:
[1] 余声明. 迈向新21世纪的磁性科学技术[J]. 磁性材料及器件, 1998, 29(5): 1-9.
YU Sheng-ming. Magnetic science and technology advancing towards new century[J]. Journal of Magnetic Materials and Devices, 1998, 29(5): 1-9.
[2] 车平, 陈博, 甘树才. 铁氧体磁性材料应用的进展及合成方法[J]. 世界地质, 2000, 19(2): 205-208.
CHE ping, CHEN Bo, GAN Shu-cai. The progress of ferrite magnetic material and the synthesize technique[J]. World Geology, 2000, 19(2): 205-208.
[3] 王笑天, 宋晓平, 陈仲敏. 硬、软磁性材料的最新研究进展[J]. 稀有金属材料与工程, 1994, 23(2): 7-12.
WANG Xiao-tian, SONG Xiao-ping, CHEN Zhong-min. Recent advances in hard and soft magnetic materials[J]. Rare Metal Materials and Engineering, 1994, 23(2): 7-12.
[4] Yokoyama M, Ohta E, Sato T, et al. Magnetic properties of ultrafine particles and bulk material of cadmium ferrite[J]. J Magn Magn Mater, 1998, 183(1/2): 173-175.
[5] LIU Yan, CAO Jiang-wei, YANG Zheng, et al. The structure and magnetic properties of Mn-Zn ferrite thin films fabricated by alternately sputtering[J]. Materials Science and Engineering, 2006, 127: 108-111.
[6] Lee W J, Fang T T. The effect of the molar ratio of barium ferrite using a citrate process[J]. Journal of Materials Science, 1995, 30(17): 4349-4354.
[7] YAO Zhi-qiang, WANG Qin, ZHONG Bing. Preparation of the ultrafine powder of MnZn ferrite by the supercritical fluid drying[J]. Magn Mater Devices, 1998, 29(1): 6-9.
[8] LU Xiao, TAO Zhou, JIA Meng. Hydrothermal synthesis of Mn-Zn ferrites from spent alkaline Zn-Mn batteries[J]. Particuology, 2009, 7(6): 491-495.
[9] 桑商斌, 古映莹, 唐爱东. 添加剂对锰锌铁氧体纳米晶水热制备的影响[J]. 中南工业大学学报: 自然科学版, 2000, 31(4): 327-329.
SANG Shang-bin, GU Ying-ying, TANG Ai-dong, et al. The effect of additives on hydrothermal preparation of nanometer MnZn ferrite particles[J]. Journal of Central South University of Technology: Natural Science, 2000, 31(4): 327-329.
[10] 彭长宏, 李景芬, 陈带军. 锰锌铁氧体废料浸出液定比例还原[J]. 中南大学学报: 自然科学版, 2008, 39(5): 887-890.
PENG Chang-hong, LI Jing-fen, CHEN Dai-jun. Proportion reduction in leaching solution of Mn-Zn ferrite wastes[J]. Journal of Central South University of Technology: Natural Science, 2008, 39(5): 887-890.
[11] 彭长宏, 李景芳, 李基森. 锰锌铁氧体废料的浸出工艺[J]. 中南大学学报: 自然科学版, 2009, 40(1): 19-24.
PENG Chang-hong, LI Jing-fen, LI Ji-sen. Leaching process of Waste Mn-Zn ferrites powder[J]. Journal of Central South University: Science and Technology, 2009, 40(1): 19-24.
[12] 张保平, 张金龙, 唐谟堂, 等. 共沉法制备锰锌软磁铁氧体前躯体的热力学分析[J]. 江西有色金属, 2005, 19(2): 35-37.
ZHANG Bao-ping, ZHANG Jin-long, TANG Mo-tang, et al. Thermodynamic analysis on the preparation of Mn-Zn soft magnetic ferrite precursor by Co-precipitation method[J]. Jiangxi Nonferrous Metals, 2005, 19(2): 35-37.
[13] 桑商斌, 古映莹, 黄可龙. 锰锌铁氧体纳米晶的水热晶化机理[J]. 中南工业大学学报: 自然科学版, 2002, 33(4): 367-370.
SANG Shang-bin, GU Ying-ying, HUANG Ke-long. The crystallization mechanism of MnZn ferrite nanoscale particle in hydrothermal process[J]. Journal of Central South University of Technology: Natural Science, 2002, 33(4): 367-370.
[14] Wangman D D, Evans W H, Parker V B. NBS化学热力学性质表[M]. 北京: 中国标准出版社, 1998: 138-191.
Wangman D D, Evans W H, Parker V B. The NBS tables of chemical thermodynamic properties[M]. Beijing: China Criterion Press, 1998: 138-191.
[15] 杨声海, 唐朝波, 唐谟堂. “直接-共沉法”生产低功耗锰锌软磁铁氧体粉料[J]. 矿冶工程, 2004, 24(2): 61-64.
YANG Sheng-hai, TANG Chao-bo, TANG Mo-tang. Preparation of Mn-Zn soft magnetic ferrite powder with a low power loss by direct Co-precipitation[J]. Mining and Metallurgical Engineering, 2004, 24(2): 61-64.
[16] 张秀峰. 工业级硫酸盐制备锰锌功率铁氧体的研究[D]. 长沙: 中南大学冶金科学与工程学院, 2010: 39-45.
ZHANG Xiu-feng. Study on the preparation of Mn-Zn power ferrite from industrial grade sulfate[D]. Changsha: Central South University. School of Metallurgy Science and Technology, 2010: 39-45.
(编辑 赵俊)
收稿日期:2011-03-05;修回日期:2011-06-15
基金项目:国家“863”计划项目(2006AA06Z373)
通信作者:彭长宏(1966-),男,湖南长沙人,教授,从事磁性材料及功能性离子液体合成与应用;电话:0731-88836940;E-mail:peng9103@163.com