文章编号:1004-0609(2016)-07-1473-07
醚溶剂种类及组成对锂硫电池电化学性能的影响
卢 海,袁 艳,覃富荣,张 凯,赖延清,刘业翔
(中南大学 冶金与环境学院,长沙 410083)
摘 要:选择4种结构相似但链长不同的链状醚(Gn,n=1~4)和环状醚1,3-二氧戊环(DOL)作为锂硫电池的电解液溶剂,研究不同的醚种类及组成对锂硫电池电化学性能的影响规律,探讨溶剂性质与锂硫电池性能之间可能存在的内部联系。结果表明:高黏性溶剂会降低锂硫电池的低电位放电平台;使用纯链状醚作溶剂时,溶剂的施主数(DN值)与锂硫电池性能密切相关,锂硫电池在高DN值溶剂中虽易发生过充、库仑效率低,但若控制DN小于19时,锂硫电池循环期间放电容量更高。因此,在合理范围内,增加多硫化物在电解液中的溶解性有利于提高活性材料的利用率;而当引入DOL与链状醚混合使用时,金属锂/电解液的界面性质一定程度上决定锂硫电池的性能水平,DOL由于成膜作用可以降低界面阻抗、改善锂硫电池的循环性能,且锂硫电池容量与库仑效率均随混合溶剂中DOL含量的增加而逐步提高,但DOL含量不宜过高,锂硫电池在适中的混合溶剂配比下才具有较好的循环稳定性。
关键词:锂硫电池;电解液;醚;溶剂;电化学性能
中图分类号:O646 文献标志码:A
锂硫电池由于具有比能量高、成本低、原料来源丰富、对环境友好等优点,被认为是最有发展前景的二次储能装置之一,有望在电动汽车等领域推广应用。然而,就目前技术水平而言,该电池仍然存在着许多不足之处,主要表现为循环性能差、库仑效率低、自放电严重等[1]。而产生这些问题的原因是多方面的,包括单质硫的绝缘本质、多硫化物中间产物的溶解、穿梭效应的形成、不溶产物在电极表面的沉积等[2]。
针对上述问题,众多学者从正极材料入手开展改性研究工作[3-5],主要通过优化正极组成与结构(如将硫与多孔碳或聚合物材料复合),增强电极导电性、提高活性材料利用率,同时限域多硫化物。但是电解液作为锂硫电池的另一关键组成,对锂硫电池性能的影响同样不容忽视,优化电解液组成亦是提升电池性能的有效途径[6]。由于碳酸酯与多硫化物中间产物性质上的不兼容性[7],锂硫电池电解液通常使用各种醚类溶剂,如BARCHASZ等[8]考察一系列纯链状醚溶剂及其混合环状醚1,3-二氧戊环(DOL)的电解液在锂硫电池上的应用;BARCHASZ等[9]还研究四乙二醇二甲醚搭配DOL的双元电解液对锂硫电池放电容量与循环性能的影响。为了更清楚地认识醚溶剂体系,有必要深入探讨溶剂性质与锂硫电池性能二者之间的关系,这可以为电解液优化工作提供指导依据,然而这类研究当前鲜见报道。
本文作者选择4款结构相似但链长不同的乙二醇二甲醚系列溶剂(Gn,n=1~4)作为研究对象,并将其与环状醚DOL搭配使用,研究不同的醚种类及组成对锂硫电池性能的影响规律,并挖掘溶剂性质与电池电化学性能之间可能存在的潜在联系。
1 实验
1.1 电解液原料与配制
实验中使用的锂盐为二(三氟甲基磺酰)亚胺锂(LiTFSI, 99.95%, Aldrich(质量分数))。乙二醇二甲醚(G1, 99%(质量分数))、二乙二醇二甲醚(G2, 99%(质量分数))、三乙二醇二甲醚(G3, 99%(质量分数))、四乙二醇二甲醚(G4, 99%(质量分数))、DOL(99%(质量分数))均购于Adamas公司。在充满氩气的手套箱中,将1 mol/L的LiTFSI充分溶解至各种醚溶剂组成中制得实验所用的电解液。
1.2 电极制作与锂硫电池组装
将单质硫、导电炭黑和聚偏氟乙烯(PVDF)按质量比为6:3:1在N-甲基吡咯烷酮(NMP)中混合均匀,所得浆料均匀涂覆在铝箔上,60 ℃下真空干燥12 h。将制备的硫电极片、多孔隔膜和金属锂片,在手套箱中以三明治形式层叠,滴加各种实验电解液后,组装成CR2025型扣式锂硫电池。实验中以锂片为工作电极、另一片锂片为对电极和参比电极,还组装了一系列的Li/Li对称锂硫电池。
1.3 电化学性能表征
采用LAND充放电测试仪对锂硫电池进行恒流充放电测试,充放电电流为0.1C,根据电极片上硫活性材料的质量计算比容量。记录每次循环下的库仑效率,并以此计算出整个循环期间的平均库仑效率值。采用电化学工作站(PARSTAT 2273)对组装的Li/Li对称锂硫电池进行交流阻抗测试(EIS),频率范围为0.1 Hz~100 kHz,振幅为±5 mV。
2 结果与讨论
2.1 醚溶剂基本性质
实验中使用的几款醚溶剂的基本理化性质见表1[10]。其中,Mw为相对分子质量;θm为熔点;η为黏度;DN为施主数(Donor number);ε为介电常数。从表1中可看到,Gn属于链状醚类,随着n值的增大,其分子链长度和分子量随之增加,介电常数也相应增大。然而,n值的增加同时意味着溶剂黏度升高,这一定程度会影响电解液中离子的传输扩散。另一方面,4款链状醚的DN值由大到小依次为G2、G1、G4、G3。DN值表征溶剂络合能力的大小,在锂硫电池中可用于衡量多硫化物中间产物在电解液中的溶解性[11],如果溶剂的DN值高,则多硫化物在其中的溶解性也高,这是由于高DN值的溶剂会减弱锂离子和多硫根阴离子之间的静电力,特别对于分子链较长的多硫化物[12]。G2具有相对最高的DN值,更倾向于与锂离子结合,此时锂离子和多硫根阴离子之间的相互作用力降至最低,因此多硫化物更易溶解于G2组成的电解液中,而G3则反之。与上述4款链状醚不同的是,DOL属于环状醚类,具有与G1接近的介电常数与黏度,但DN值在几款醚溶剂中最高。
2.2 纯链状醚作溶剂
首先研究锂硫电池在不同纯链状醚溶剂组成的电解液中的性能。图1所示为锂硫电池在纯链状醚溶剂中的首次充放电曲线。由图1可看出,锂硫电池在首次放电时均出现了两个放电平台,其中低电位放电平台随溶剂n值的增加而逐步下降,这是电解液的高黏性产生极化所致。锂硫电池的首次充电在纯G1或G2中均出现了严重的过充(充电容量超过理论容量),而在纯G3和G4中虽有一定的过充但能够在理论容量(1675 mA·h/g)范围内完成3V充电。溶解在电解液中的多硫化物会在正负极之间产生穿梭效应,引起锂硫电池内部自放电,阻止充电电压的上升,由此产生过充,多硫化物更易溶解于高DN值的G1或G2组成的电解液中,因此,锂硫电池过充在这些电解液中相对更为严重。
图2所示为锂硫电池在不同纯链状醚溶剂中的循环性能曲线。由图2可以看到,随着循环次数的增加,锂硫电池在不同电解液中的容量均衰减较快,经过仅20次循环,容量即已损失大半,说明无论单独使用何种纯链状醚作溶剂,均不利于维持锂硫电池的稳定循环。相比较而言,锂硫电池在纯G2中的容量发挥要好于在其他醚中,但在循环至后期,由于充电电压始终很难达到3V截止电压(见图3,锂硫电池需要通过手动跳转完成充电,此时充放电效率非常低),锂硫电池发生了严重过充导致大量的不可逆容量损失,这应该是多硫化物的穿梭效应在循环期间不断累积负面影响、最终失控的结果。而G3虽然在几款溶剂中DN值最低,但锂硫电池的循环性能最差,说明多硫化物溶解并不是造成锂硫电池容量衰减的唯一原因。
表1 实验中使用的几款醚溶剂的基本理化性质
Table 1 Basic physico-chemical properties of several ethers in experiment
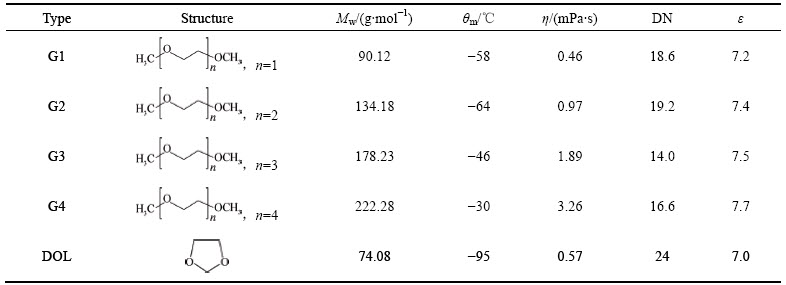
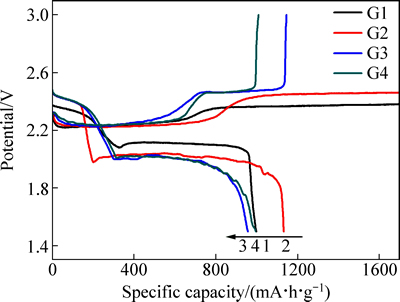
图1 锂硫电池在纯链状醚溶剂电解液中的首次充放电曲线
Fig. 1 First charge-discharge curves of Li/S cells in electrolytes with various single chain ethers as solvent
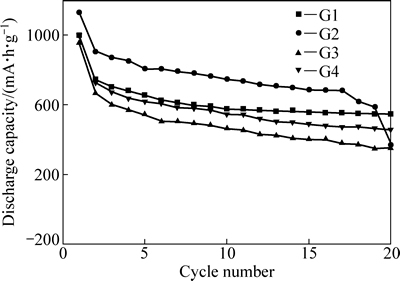
图2 锂硫电池在纯链状醚溶剂电解液中的循环性能
Fig. 2 Cycle performances of Li/S cells in electrolytes with various single chain ethers as solvent
图4所示为溶剂DN值与锂硫电池循环性能数据的关系曲线。由图4可见,锂硫电池循环期间的平均库仑效率基本上随溶剂DN值的增加而减少,这是多硫化物穿梭效应加剧的直接表现。但G3是个例外,这可能是使用G3的锂硫电池循环期间严重的容量衰减影响了效率所致。另一方面,当使用较高DN值的链状醚时,锂硫电池循环后保持的可逆容量相对更多,说明此时增加多硫化物在电解液中的溶解性反而有利于提高活性物质的利用率。探究其原因,可能由于更多的多硫化物溶于电解液使得硫物种之间的氧化还原多发生在液/液均相中[13],由此更能促进电化学反应的可逆进行。而G2在此又是一个例外,由于其循环后期的过充失控导致了大幅容量损失。可见多硫化物的溶解还需控制在合理范围内(如DN小于19),否则难以抵挡穿梭效应的负面影响。整体来看,使用G1的锂硫电池虽库仑效率偏低、但容量保持相对较好。这也从另一个角度说明了,在锂硫电池体系中,低效率的充放电不一定总是意味着活性物质的低利用率。
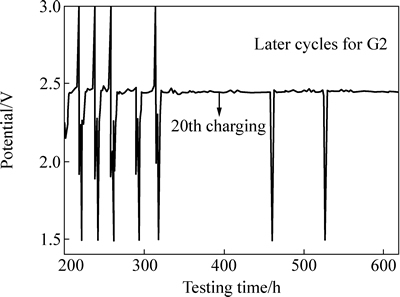
图3 锂硫电池在G2电解液中循环后期的充放电曲线
Fig. 3 Charge-discharge curves of Li/S cell in electrolyte with single G2 during later cycles
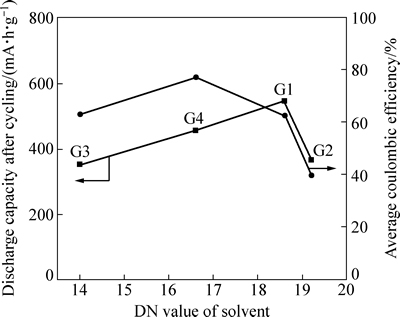
图4 使用纯链状醚溶剂的锂硫电池循环后容量、循环期间平均库仑效率与溶剂DN值之间的关系
Fig. 4 Relationships between discharge capacity after cycles and average coulombic efficiency during
cycling and DN value of applied ether in electrolyte for Li/S cell with single chain ether as solvent
2.3 混合醚作溶剂
本文作者还研究链状醚Gn混合环状醚DOL的电解液体系。图5所示为锂硫电池的首次充放电曲线。由图5可以看出,在混合醚溶剂中,首次放电的低电位平台仍遵循着“高黏度-低平台”的变化规律。而首次充电时,锂硫电池无论在何种混合醚组成中均发生持续过充,可能是由于电解液中引入了更高DN值的DOL溶剂进一步加剧了多硫化物的溶解与穿梭。
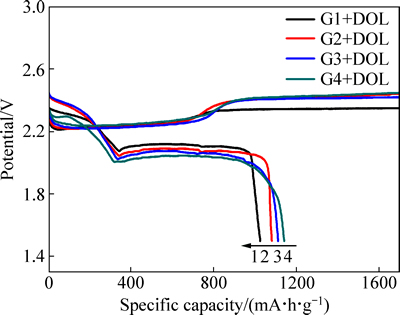
图5 锂硫电池在混合醚溶剂电解液中的首次充放电曲线
Fig. 5 First charge-discharge curves of Li/S cells in electrolytes with various mixed ethers as solvent
然而,将锂硫电池在纯链状醚和混合醚溶剂中的循环性能数据进行比较发现(见图6):链状醚与DOL混合后,即便首次循环普遍过充,但相比使用相应的纯链状醚时,锂硫电池循环期间的平均库仑效率仍都出现不同幅度的提升,说明锂硫电池过充在随后循环的过程中得到缓和。另一方面,相比相应的纯链状醚体系,锂硫电池在混合醚电解液中循环后保持的可逆容量也有所增加,说明电解液中的DOL起到改善锂硫电池循环性能的作用(特别对于G1而言,性能改善效果最为明显)。对于G2,虽然其库仑效率提升幅度很大,但比容量的增加有限,可能是G2与DOL两款高DN值溶剂搭配产生的负面影响超出了DOL的正面改善作用所致。
为了探究DOL对锂硫电池性能的改善作用机制,将Li/Li对称锂硫电池在不同电解液中的EIS谱进行对比,其结果如图7所示。在Li/Li对称锂硫电池中,当电解液与金属锂发生接触时,由于金属锂存在较高的反应活性,固体电解质相界面层(SEI)将立即形成,EIS谱在高频区出现的半圆即代表了这个界面层的阻抗[14]。从图7中可以看到,使用纯链状醚的界面阻抗很大,但是如果链状醚与DOL混合,界面阻抗均出现大幅度下降。由于Li/Li对称锂硫电池的SEI构成只可能来源于锂金属与电解液组分之间相互反应,因此,电解液中所使用的溶剂直接影响着SEI的结构与性能[14]。DOL被报道能够通过参与成膜改善电极的表面钝化、减少锂金属的腐蚀[15-16],所以这应该是界面阻抗在混合醚中得以减少的主要原因,同时,也应该是锂硫电池在混合醚中的循环性能优于在纯链状醚中的关键所在(如图6所示)。由此可见,金属锂/电解液的界面性质一定程度上决定了锂硫电池性能的发挥水平,高界面阻抗总是不利于锂硫电池性能(如界面阻抗在G2、G3和G2+DOL中相对较高,锂硫电池性能相对较差),但是界面阻抗的大小与锂硫电池性能的好坏并无线性对应关系,因此,其仅适用于定性评估。
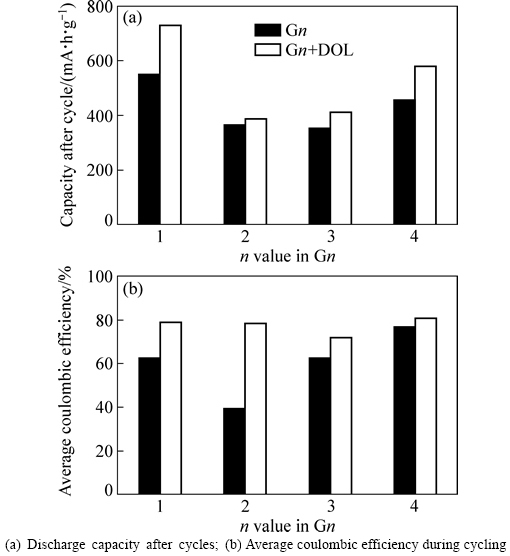
图6 电池在不同组成电解液中的循环数据对比
Fig. 6 Comparison of cycle performances for Li/S cells in different electrolytes:
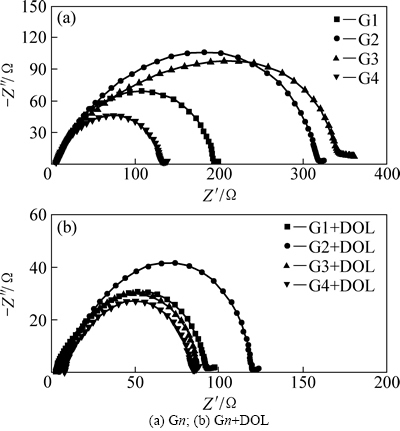
图7 Li/Li对称锂硫电池在不同组成电解液中的EIS谱对比
Fig. 7 Comparison of EIS spectra for Li/Li symmetrical Li/S cells in different electrolytes:
由于锂硫电池在G1与DOL的混合溶剂中的循环性能综合表现相对更为优异,因此,本研究进一步考察该混合体系的配比优化情况。如图8所示,当G1和DOL的体积比为1:4或4:1时,锂硫电池性能相比纯G1时并无实质性提升。而G1与DOL的混合配比适中时,锂硫电池则具备良好的循环性能,特别是当G1和DOL体积比为1:2或1:1时,循环期间的放电容量保持在较高水平。
将DOL在混合溶剂中的含量与锂硫电池循环性能数据建立直接关系时发现(见图9):一定范围内提高DOL含量(即DOL在(G1+DOL)中的体积分数从0%增加到66.7%),锂硫电池循环后的放电容量出现了一个逐步增加的趋势,而平均库仑效率在此期间也略有提升,这应该是DOL的成膜作用逐步增强的结果;但进一步提高DOL含量至80%时,锂硫电池循环性能快速恶化。DOL含量过高时,锂盐LiTFSI带入的痕量酸会诱发DOL自身的聚合[8-9],这会损害锂硫电池性能。因此,添加DOL虽可以起到改善金属锂/电解液的界面性质、减少界面阻抗的作用,但其在混合溶剂中的含量需适中为宜。
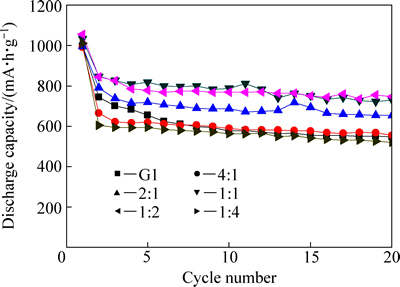
图8 锂硫电池在不同G1/DOL混合醚配比中的循环性能
Fig. 8 Cycle performances of Li/S cells in electrolytes with various volume ratios of G1 and DOL
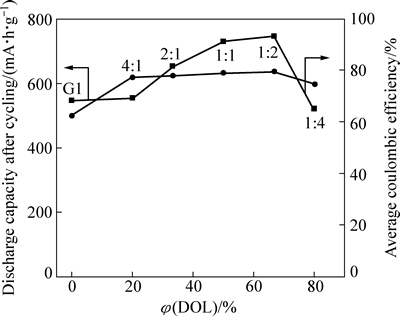
图9 不同G1和DOL体积比混合溶剂的锂硫电池循环后容量、循环期间平均库仑效率与混合溶剂中DOL含量之间的关系
Fig. 9 Relationships between discharge capacity after cycles and average coulombic efficiency during cycling
and DOL content in mixed solvents for Li/S cell in binary electrolyte with different volume ratios of G1 and DOL
3 结论
1) 醚溶剂的黏度影响锂硫电池的低电位放电平台,大体遵循“高黏度-低平台”的变化规律。
2) 单独使用链状醚时,醚溶剂DN值与锂硫电池性能密切相关,使用高DN值溶剂可促进多硫化物在电解液中的溶解,这虽然会引发穿梭效应和严重过充,但若控制DN<19时,有利于提高活性材料的利用率、增加锂硫电池的可逆容量。
3) 链状醚与DOL混合时,DOL的成膜作用可以减少金属锂/电解液之间的界面阻抗,改善锂硫电池的循环性能,此时,金属锂/电解液的界面性质一定程度上决定锂硫电池性能的发挥水平。
4) 增加混合溶剂中DOL含量可以提高锂硫电池的放电容量与库仑效率,但是DOL含量不宜过高,在适中的混合溶剂配比下(如G1和DOL体积比为1:2或1:1),锂硫电池才具有较好的循环性能。
REFERENCES
[1] SONG M K, CAIRNS E J, ZHANG Y. Lithium/sulfur batteries with high specific energy: Old challenges and new opportunities[J]. Nanoscale, 2013, 5(6): 2186-2204.
[2] 刁 岩, 谢 凯, 洪晓斌, 熊仕昭. Li-S 电池硫正极性能衰减机理分析及研究现状概述[J]. 化学学报, 2013, 71(4): 508-518.
DIAO Yan, XIE Kai, HONG Xiao-bin, XIONG Shi-zhao. Analysis of the sulfur cathode capacity fading mechanism and review of the latest development for Li-S battery[J]. Acta Chimica Sinica, 2013, 71(4): 508-518.
[3] DENG Zhao-feng, ZHANG Zhi-an, LU Hai, LAI Yan-qing, LIU Jin, LI Jie, LIU Ye-xiang. Vapor-grown carbon fibers enhanced sulfur-multi walled carbon nanotubes composite cathode for lithium/sulfur batteries[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(1): 158-163.
[4] ZHOU W, YU Y, CHEN H, DISALVO F J, ABRUNA H D. Yolk-shell structure of polyaniline-coated sulfur for lithium-sulfur batteries[J]. Journal of the American Chemical Society, 2013, 135(44): 16736-16743.
[5] 袁 艳, 陈白珍, 陈 亚. 锂/硫电池用纳米硫的液相沉积法制备及性能[J]. 中国有色金属学报, 2013, 23(10): 2863-2867.
YUAN Yan, CHEN Bai-zhen, CHEN Ya. Preparation and characterization of sulfur nanomaterial by liquid phase precipitation method for Li/S battery[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2863-2867.
[6] BARGHAMADI M, BEST A S, BHATT A I, HOLLENKAMP A F, MUSAMEH M, REES R J, RUTHER T. Lithium–sulfur batteries—The solution is in the electrolyte, but is the electrolyte a solution?[J]. Energy & Environmental Science, 2014, 7(12): 3902-3920.
[7] YIM T, PARK M S, YU J S, KIM K J, IM K Y, KIM J H, JEONG G, JO Y N, WOO S G, KANG K S, LEE I, KIM Y J. Effect of chemical reactivity of polysulfide toward carbonate-based electrolyte on the electrochemical performance of Li-S batteries[J]. Electrochimica Acta, 2013, 107: 454-460.
[8] BARCHASZ C, LEPRETRE J C, PATOUX S, ALLOIN F. Electrochemical properties of ether-based electrolytes for lithium/sulfur rechargeable batteries[J]. Electrochimica Acta, 2013, 89: 737-743.
[9] BARCHASZ C, LEPRETRE J C, PATOUX S, ALLOIN F. Revisiting TEGDME/DIOX binary electrolytes for lithium/sulfur batteries: Importance of solvation ability and additives[J]. Journal of the Electrochemical Society, 2013, 160(3): 430-436.
[10] SCHEERS J, FANTINI S, JOHANSSON P. A review of electrolytes for lithium–sulphur batteries[J]. Journal of Power Sources, 2014, 255: 204-218.
[11] PARK J W, UENO K, TACHIKAWA N, DOKKO K, WATANABE M. Ionic liquid electrolytes for lithium–sulfur batteries[J]. The Journal of Physical Chemistry C, 2013, 117(40): 20531-20541.
[12] MA Guo-qiang, WEN Zhao-yin, JIN Jun, WU Mei-fen, ZHANG Gao-xiao, WU Xiang-wei, ZHANG Jing-chao. The enhanced performance of Li-S battery with P14YRTFSI-modified electrolyte[J]. Solid State Ionics, 2014, 262: 174-178.
[13] ZHANG S S. Liquid electrolyte lithium/sulfur battery: Fundamental chemistry, problems, and solutions[J]. Journal of Power Sources, 2013, 231: 153-162.
[14] XIONG Shi-zhao, DIAO Yan, HONG Xiao-bin, CHEN Ying-chao, XIE Kai. Characterization of solid electrolyte interphase on lithium electrodes cycled in ether-based electrolytes for lithium batteries[J]. Journal of Electroanalytical Chemistry, 2014, 719: 122-126.
[15] 金朝庆, 谢 凯, 洪晓斌. 锂硫电池电解质研究进展[J]. 化学学报, 2014, 72(1): 11-20.
JIN Zhao-qing, XIE Kai, HONG Xiao-bin. Review of electrolyte for lithium sulfur battery[J]. Acta Chimica Sinica, 2014, 72(1): 11-20.
[16] WANG Wei-kun, WANG You, HUANG Ya-qin, HUANG Chong-jun, YU Zhong-bao, ZHANG Hao, WANG An-bang, YUAN Ke-guo. The electrochemical performance of lithium– sulfur batteries with LiClO4 DOL/DME electrolyte[J]. Journal of Applied Electrochemistry, 2009, 40(2): 321-325.
Effect of ether type and constitution on electrochemical performance of Li/S battery
LU Hai, YUAN Yan, QIN Fu-rong, ZHANG Kai, LAI Yan-qing, LIU Ye-xiang
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: Four kinds of chain ethers with similar glyme-based structure and different chain length (Gn, n=1~4) and cyclic ether of 1,3-dioxolane (DOL) were selected as electrolyte solvent for lithium/sulfur (Li/S) battery. The effects of ether type and constitution on electrochemical performance of the cell were investigated, and possible relationships between basic properties of these ethers and cell performance were discussed. The results show that the low-potential discharging plateau of the cell will decline if the viscosity of the ether is high relatively. The cell performance is closely associated to the donor number (DN) of the ether when single chain ether is used as electrolyte solvent. For the case with high DN value, the severe overcharging behavior arises more easily, and the coulombic efficiency is lower than that of low DN value, but the higher reversible capacity can be obtained if the DN below is controlled to less than 19. So, increasing the solubility of polysulfides in the electrolyte within reasonable range is beneficial to improve the utilization of active material and the cell capacity. On the other hand, the interfacial properties between Li metal and electrolyte play a key role in the cell performance when mixing different chain ethers with DOL. The presence of DOL reduces distinctly the impedance of the Li/electrolyte interface and improves the cycling capability of the cell. The discharge capacity and coulombic efficiency increase with the increase of DOL content in the mixed solvent system, but excess DOL in the electrolyte should be avoided. The optimized cycle performance appears in the appropriate mixing ratio of G1 to DOL.
Key words: lithium sulfur battery; electrolyte; ether; solvent; electrochemical performance
Foundation item: Project(51574288, 51474243) supported by the National Natural Science Foundation of China; Project(13JJ1003) supported by the National Natural Science Foundation of Hunan Province, China
Received date: 2015-08-25; Accepted date: 2016-04-08
Corresponding author: LAI Yan-qing; Tel: +86-731-88830474; E-mail: laiyanqingcsu@163.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51574288,51474243);湖南省自然科学基金资助项目(13JJ1003)
收稿日期:2015-08-25;修订日期:2016-04-08
通信作者:赖延清,教授,博士;电话:0731-88830474;E-mail: laiyanqingcsu@163.com