铬渣NaCl浸出动力学
柴立元,赵 堃,舒余德,朱文杰
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:通过研究铬渣NaCl浸出过程中Cr(Ⅵ)浓度随时间的变化,建立该反应的动力学方程,确定初始pH值、振荡速度对反应速率常数的影响,并计算相应的反应表观活化能。结果表明,铬渣NaCl浸出过程为0.26级反应,反应速率常数为3.38×10-7 mol/(L?s);pH值和振荡速度增大,反应速率常数不断增大,CaCrO4溶解率增加,溶解速率加快;该反应的表观活化能为34.24 kJ/mol,Cr(Ⅵ)浸出速率受温度影响较大。
关键词:铬渣;NaCl;浸出;动力学
中图分类号:X70 文献标识码:A 文章编号:1672-7207(2007)03-0445-05
Kinetics of chromium-containing slag leached by NaCl
CHAI Li-yuan, ZHAO Kun, SHU Yu-de, ZHU Wen-jie
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The effects of initial pH value and shaking speed on reaction rate constant were confirmed with the change of Cr(Ⅵ) concentrations in leaching chromium-containing slag process by NaCl. Kinetic equation was established and the corresponding apparent activation energy was calculated. The results indicate that the leaching process is a 0.26 order reaction, and the reaction rate constant is 3.38×10-7 mol/(L?s). The reaction rate constant increases with the increase of pH value and shaking speed. And dissolution rate of CaCrO4 increases too. The apparent activation energy is 34.24 kJ/mol and temperature has great influence on Cr(Ⅵ) leaching rate.
Key words: chromium-containing slag; NaCl; leaching; kinetics
铬渣是铬盐及铁合金等行业在生产过程中排放的有毒废渣[1],铬渣中的Cr(Ⅵ)被列为对人体危害最大的8种化学物质之一,是国际公认的3种致癌金属物之一,同时也是美国EPA公认的129种重点污染物之一[2]。近年来,由于铬渣及含铬废水对环境造成的危害日益严重,各种污染事件屡见不鲜[3-4]。如何加强铬渣的治理和综合利用以及探索新的治理方法成为环保工作者的当务之急。目前,世界各国对铬渣解毒大多采用化学方法将Cr(Ⅵ)转变为Cr(Ⅲ)[5],以消除其对环境的危害,概括起来有2种方法,即:干法焙烧还原解毒和湿法还原解毒[6]。目前,这些方法存在解毒不彻底、成本高或有二次污染等缺点。因此在微生物处理含铬废水研究[7]的启示下,作者[8]已经分离出一株还原碱性介质高浓度Cr(Ⅵ)的短杆状细菌,经鉴定为无色细菌属杆状菌(Achromobacter sp.),将其命名为Ch-1菌,并研发了细菌还原铬渣新工艺。Ch-1菌彻底还原Cr(Ⅵ)的关键在于铬渣中微溶的铬酸钙(CaCrO4)的溶出[9],而作为培养基成分之一的NaCl对于铬酸钙的溶解起到了一定促进作用。为确定解毒全过程的反应速率及反应控制步骤,研究细菌培养基成分NaCl浸出铬渣过程的动力学十分必要。
本研究选取常年被雨水冲淋的铬渣(即陈渣)作为研究对象,拟通过考察铬渣NaCl浸出过程中Cr(Ⅵ)浓度随时间的变化,建立动力学方程,考察各因素对反应速率的影响,计算反应表观活化能,确定反应控制步骤,以期找到影响铬渣NaCl浸出反应速率的关键因素及其影响程度,提高浸出的反应速率,为实施铬污染治理工程提供理论依据。
1 实 验
1.1 铬渣的处理和分析
样品采自原长沙铬盐厂,其组成成分见表1。采集渣样时按照废渣堆采样法进行采样[10-11],剔除粗大颗粒。将采集的样品放在烘箱内100 ℃干燥4 h,烘干后进行振动磨床磨渣,过0.125 mm孔筛,混均后继续于100 ℃干燥。按4%的比例加入水泥,混匀后造粒,平均直径为5 mm,自然风干后,将样品置于密闭容器中干燥保存。实验进行前,预先将铬渣浸泡4 h,使其中水溶性Na2CrO4溶出,保证实验过程中参与NaCl浸出铬渣反应的仅为微溶的CaCrO4。
表1 铬渣的化学组成
Table 1 Chemical composition of chromium-containing slag

1.2 实验方法
1.2.1 浸取液和分析液的制备
称取一定量的铬渣小球置于250 mL锥形瓶中,以液固比5?1加入相应浓度的NaCl溶液。将其垂直固定在水平恒温振荡器上,振荡速度按实验要求确定,每隔一定时间间隔吸取溶液0.1 mL对Cr(Ⅵ)质量浓度进行分析,同时补充相应体积的溶液[12]。
1.2.2 Cr(Ⅵ)质量浓度分析方法
溶液中低质量浓度的Cr(Ⅵ)采用二苯碳酰二肼分光光度法进行分析,波长为540 nm;高质量浓度的Cr(Ⅵ)利用硫酸亚铁铵容量法滴定分析[13]。
2 结果与讨论
2.1 动力学方程的测定
铬渣NaCl浸出由如下反应表示:
2NaCl+CaCrO4→CaCl2+Na2CrO4; (1)
CaCl2+H2O→Ca(OH)2+2HCl。 (2)
式(1)与式(2)相加得:
2NaCl+CaCrO4+H2O→Ca(OH)2+2HCl+Na2CrO4。(3)
其中NaCl作为传递物质参与该反应,反应前后NaCl的量不变。
CaCrO4微溶[14],溶度积为2.3×10-2,而Ca(OH)2的溶度积为5.5×10-6,故随液相中NaCl质量浓度增加,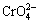 质量浓度也将随之增大。
质量浓度也将随之增大。
式(3)的反应速率方程可表示为
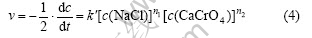
CaCrO4溶解度很小,将其活度近似看作一常数,H2O活度为1,则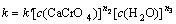 ,故式(4)转化为
,故式(4)转化为

由式(3)可知:
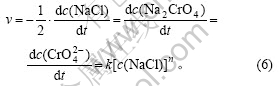
在NaCl初始质量浓度分别为0.5,1.0,2.0,3.0,4.0 g/L,温度为30 ℃,pH=10,振荡速度为100 r/min的条件下,得到Cr(Ⅵ)浓度—t的关系曲线如图1所示。
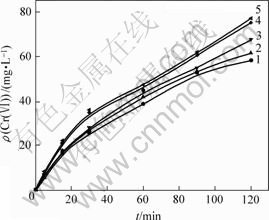
ρ(NaCl)/(mg?L-1): 1—0.5;2—1.0;3—2.0;4—3.0;5—4.0
图1 初始NaCl质量浓度不同时Cr(Ⅵ)质量浓度随时间的变化
Fig.1 Relationship between Cr(Ⅵ) concentration and initial NaCl concentration at different initial NaCl concentrations
采用初始浓度微分法测定动力学参数[15]。
根据式(4)和图1中的数据,求出NaCl初始质量浓度不同且t=0时的反应速率 ,结果见表2。
,结果见表2。
表2 t=0时NaCl初始浓度ρ0对反应速率的影响
Table 2 Effect of NaCl initial concentration on reaction rate at beginning of reaction

由式(5)得:
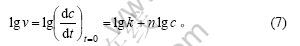
根据表2和方程式(7),以lg v对lg c作图,如图2所示。
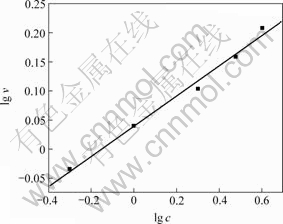
图2 lg c—lg v曲线及其线性拟合关系
Fig.2 Relationship between lg c and lg v measured and fitted
由图2可得反应速率常数为:k=1.094 4 mg/(L?min) =3.38×10-7 mol/(L?s)。
反应级数为:n=0.259 69≈0.26。
由式(7)可得铬渣NaCl浸出反应为0.26级反应,故得其速率方程式为

可近似写为

2.2 反应速率常数的影响因素
2.2.1 初始pH值对反应速率常数的影响
在温度为30 ℃,振荡速度为100 r/min,NaCl质量浓度分别为0.5,1.0,2.0,3.0和4.0 g/L,反应pH值分别为8,9,10,11和12时,得到Cr(Ⅵ)质量浓度与时间t的关系曲线,其中,pH=8时c—t曲线如图3所示,同样采用初始浓度微分法求速率常数k。以lg v对lg c作图,得图4所示直线。由图4求得pH=8时,速率常数k=1.22×10-7 mol/(L?s);同理可得pH=9,10,11,12时的速率常数k,结果见表3。
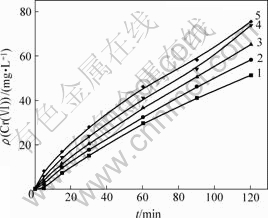
ρ(NaCl)/(mg?L-1): 1—0.5;2—1.0;3—2.0;4—3.0;5—4.0
图3 pH=8且NaCl质量浓度不同时Cr(Ⅵ)质量浓度随时间的变化
Fig.3 Relationship between Cr(Ⅵ) concentration and time at different NaCl concentrations when pH=8
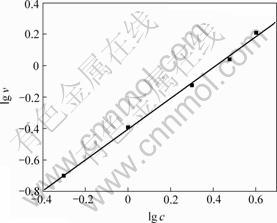
图4 lg v-lg c及其线性拟合关系
Fig.4 Relationship between lg c and lg v measured and fitted
表3 初始pH值对反应速率常数k的影响
Table 3 Effect of initial pH values on rate constant k

由表3可以看出,随着pH值的增大,k不断增大。原因是pH增加,式(3)中产物HCl浓度减小,反应右移,故CaCrO4溶解速率增加。
2.2.2 振荡速度对反应速率常数的影响
在温度为30 ℃,pH=10,NaCl质量浓度分别为0.5,1.0,2.0,3.0和4.0 g/L,振荡速度分别为0,50,100,150和200 r/min时,得到Cr(Ⅵ)质量浓度与t的关系曲线,图5和图6所示是转速为0 r/min时c— t曲线及lg v—lg c曲线,采用上述相同方法,求得各种振荡速度下的反应速率常数k,结果见表4。
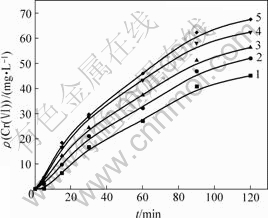
ρ(NaCl)/(mg?L-1): 1—0.5;2—1.0;3—2.0;4—3.0;5—4.0
图5 转速为0 r/min且NaCl质量浓度不同时Cr(Ⅵ) 质量浓度随时间的变化
Fig.5 Relationship between Cr(Ⅵ) concentration and time at different NaCl concentrations and rotation velocity is 0 r/min
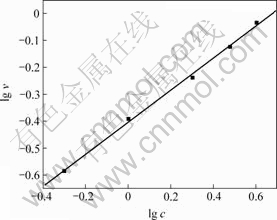
图6 lg v—lg c及其线性拟合图
Fig.6 Relationship between lg v and lg c measured and fitted
表4 振荡速度对反应速率常数k的影响
Table 4 Effect of shaking speed on rate constant k

由表4可以看出,随振荡速度增大,k不断增大。表明振荡速率大,反应粒子碰撞几率增大,故CaCrO4溶解速率增大。
2.3 表观活化能的测定
当初始pH值为10,振荡速度100 r/min,初始NaCl浓度0.5,1.0,2.0,3.0和4.0 g/L,温度分别为25,30,35,40和45 ℃时,由初始浓度微分法求得不同温度下的速率常数k,结果见表5。
表5 不同温度下的速率常数
Table 5 Effect of temperature on rate constant

根据阿累尼乌斯方程[16]: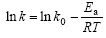 ,以ln k对
,以ln k对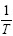 作图,得到1条直线,如图7所示,其斜率为
作图,得到1条直线,如图7所示,其斜率为
-4 117.9,截距为13.71,r=0.997 0。经计算,表观活化能为Ea=-(-4 117.9×8.314)=34.24 kJ/mol,表明Cr(Ⅵ)浸出速率受温度影响较大[17]。k与温度的关系式为:k(T)=exp(13.71-4 117.9/T)。
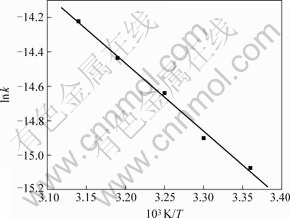
图7 ln k—1/T及其线性拟合关系
Fig.7 Relationship between ln k and 1/T measured and fitted
3 结 论
a. 铬渣NaCl浸出的动力学方程为: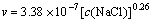 。
。
b. pH值增大,k增大,CaCrO4溶解率增加,溶解速率加快。
c. 振荡速度增大,k增大,CaCrO4溶解速率增大。
d. 铬渣NaCl浸出反应表观活化能为34.24 kJ/mol,Cr(VI)浸出速率受温度影响较大,k与温度的关系式为:k(T)=exp(13.71-4 117.9/T)。
参考文献:
[1] 成思危. 铬盐生产工艺[M]. 北京: 化学工业出版社, 1988.
CHENG Si-wei. Production techniques of chromium salts[M]. Beijing: Chemical Industry Press, 1988.
[2] 韩英魁. 环保治理, 刻不容缓[J]. 铬盐工业, 2000(2): 22-30.
HAN Ying-kui. It is of great urgency for environmental protection and treatment[J]. Chromium Salts Industry, 2000(2): 22-30.
[3] 丁 翼. 铬渣治理工作回顾及经验教训[J]. 化工环保, 1994, 14(6): 210-213.
DING Yi. Review, experience and lessons of chromium- containing slag treatment[J]. Chemical Environmental Protection, 1994, 14(6): 210-213.
[4] 杨 扬. 中国铬盐废渣污染触目惊心[J]. 化工管理, 2003(1): 4-6.
YANG Yang. It is very serious of chromium salts waste slag pollution in China[J]. Chemical Industry Management, 2003(1): 4-6.
[5] QUAN Xue-jun, TAN Huai-qin, ZHAO You-cai, et al. Detoxification of chromium slag by chromate resistant bacteria[J]. Journal of Hazardous Materials, 2006, 137: 836-841.
[6] CHAI Li-yuan, HE De-wen, YU Xia, et al. Technological progression detoxification and comprehensive utilization of chromium containing slag[J]. Trans Nonferrous Met Soc, 2002, 12(3): 514-519.
[7] 龙腾发, 柴立元, 郑 粟, 等. 生物法解毒六价铬技术的应用现状与进展[J]. 安全与环境工程, 2004, 11(3): 22-25.
LONG Teng-fa, CHAI Li-yuan, ZHENG Su, et al. Current application situation and development on detoxification of Cr(Ⅵ) by microorganisms[J]. Safety and Environmental Engineering, 2004, 11(3): 22-25.
[8] 龙腾发, 柴立元, 傅海洋. 碱性介质中还原高浓度Cr(Ⅵ)细菌的分离及其特性[J]. 应用与环境生物学报, 2006, 12(1): 80-83.
LONG Teng-fa, CHAI Li-yuan, FU Hai-yang. Isolation and characteristics of bacteria reducing high concentration of Cr(Ⅵ) in alkaline solution[J]. Journal of Applied & Environmental Biology, 2006, 12(1): 80-83.
[9] James B R. Hexavalent chromium solubility and reduction in alkaline solids enriched with chromite ore processing residue[J]. J Environ Qual, 1994, (23): 227-233.
[10] 工业固体废物有害特性试验与监测分析方法组. 工业固体废物有害特性试验与监测分析方法(试行)[M]. 北京: 中国环境科学出版社, 1986.
Group of testing and monitoring analysis methods of harmful characteristics of industial solid wastes. Testing and monitoring analysis methods of harmful characteristics of industial solid wastes[M]. Beijing: Environmental Science Press of China, 1986.
[11] 王明杰, 王素芳. 固体废物的样品采集和制备方法研究[J]. 中国环境监测, 1993, 9(1): 1-8.
WANG Ming-jie, WANG Su-fang. Study on methods of solid wastes sample collection and preparation[J]. Environmental Monitoring in China, 1993, 9(1): 1-8.
[12] 龙腾发, 柴立元, 傅海洋, 等. 铬渣浸出毒性试验研究[J]. 环境工程, 2004, 22(6): 71-73.
LONG Teng-fa, CHAI Li-yuan, FU Hai-yang, et al. Test study on toxicity of chromium-containing slag leaching[J]. Environmental Engineering, 2004, 22(6): 71-73.
[13] 魏复盛, 国家环保局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002: 157-162.
WEI Fu-sheng, National Environmental Protection Bureau “Monitoring and analyzing methods of water and waste water”edit committee. Monitoring and analyzing methods of water and waste water[M]. Beijing: Environmental Science Press in China, 2002: 157-162.
[14] 纪 柱. 治理铬渣的两个关键[J]. 无机盐工业, 2004, 36(5): 1-4.
JI Zhu. The two key factors for disposal of chrome residue[J]. Inorganic Chemicals Industry, 2004, 36(5): 1-4.
[15] 傅献彩, 沈文霞, 姚天扬. 物理化学[M]. 4版. 北京: 高等教育出版社, 1990.
FU Xian-cai, SHEN Wen-xia, YAO Tian-yang. Physical Chemistry[M]. 4th ed. Beijing: Advanced Education Press, 1990.
[16] Sohn H Y, Wadsworth M E. 提取冶金速率过程[M]. 郑蒂基, 译. 北京: 冶金工业出版社, 1984.
Sohn H Y, Wadsworth M E. Velocity process of extracting metallurgy[M]. ZHENG Di-ji, translates. Beijing: Metallurgy Industry Press, 1984.
[17] 莫鼎成. 冶金动力学[M]. 长沙: 中南工业大学出版社, 1987.
MO Ding-cheng. Metallurgy kinetics[M]. Changsha: Central South Industial University Press, 1987.
收稿日期:2006-11-25
基金项目:国家自然科学基金资助项目(20477059); 教育部高等学校博士点专项科研基金资助项目(20040533048); 教育部新世纪优秀人才支持计 划资助项目(NCET-05-0689)
作者简介:柴立元(1966-),男,江西万年人,教授,博士生导师,从事三废处理及环境材料的研究
通讯作者:柴立元,教授;电话: 0731-8836921; E-mail: lychai@mail.csu.edu.cn; zhaokun820409@163.com