杜仲皮中桃叶珊瑚甙的提取及纯化
陈晓青,贺前锋,曹 慧,柳 娜,曹占芳
(中南大学 化学化工学院,湖南 长沙,410083)
摘要: 研究了杜仲皮中桃叶珊瑚甙的提取及纯化工艺,并采用高效液相色谱法测定了桃叶珊瑚甙的含量;分别用8种大孔吸附树脂对提取液进行分离纯化处理,以不同体积分数的乙醇水溶液进行梯度洗脱;在C18反相色谱柱上,以21%甲醇水溶液为流动相,流速为1.0 mL/min,在波长210 nm处,用高效液相色谱法对杜仲提取液中桃叶珊瑚甙的含量进行了测定。研究结果表明: 杜仲皮中桃叶珊瑚甙的最佳提取条件是提取溶剂为72%(体积分数)乙醇水溶液,料液比为1∶12, 在65 ℃提取2次,每次60 min, 桃叶珊瑚甙提取率达85%;S-8型树脂对桃叶珊瑚甙的选择性好,吸附量大,用60%乙醇水溶液可将其完全洗脱;经干性炮制后的杜仲皮中桃叶珊瑚甙含量最高可达2.87%。
关键词: 杜仲; 桃叶珊瑚甙; 大孔树脂; 高效液相色谱法
中图分类号:O658; R9 文献标识码:A 文章编号: 1672-7207(2005)01-0060-05
Extraction and Purification of Aucubin from
Eucommia Ulmoide Oliver
CHEN Xiao-qing,HE Qian-feng,CAO Hui,LIU Na,CAO Zhan-fang
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: The extraction, purification and determination of aucubin from Eucommia Ulmoide Oliver were studied. The extraction solution of Eucommia was separated by eight kinds of different macro-reticular resins column chromatography, gradient eluted ethanol-water solutions with different volume fractions. The aucubin of Eucommia Ulmoide Oliver was determined by high performance liquid chromatography (HPLC) at 210 nm under the conditions as follows: ODS-C18 column,21% CH3OH-H2O solution as mobile phase and the velocity of flow of 1.0 mL/min. The powder of Eucommia was extracted twice with 72%(volume fraction) ethanol-water solution at 65 ℃ for 60 min each time, the ratio of mass of raw material to volume of extraction solvent was 1∶12. The extraction rate of aucubin reaches 85%. The results show that S-8 resin has high selectivity, high absorption capability and easiness of being eluted. The content of aucubin of roasted bark is the highest.
Key words: Eucommia Ulmoide Oliver; aucubin; macro-reticular resins; HPLC
杜仲(Eucommia Ulmoide Oliver)是我国传统的名贵药材,以皮入药,有降压、止痛、镇静、补肝肾、强筋骨和安胎等作用[1,2]。近年来,国内外一些研究者对杜仲所含的化学成分进行了分离纯化,得到了66种化学单体,并对它们的药理作用进行了研究[3]。我国、日本与英国等研究者在杜仲有效成分提取、组织培养物利用和药用研究应用方面取得了许多成果[4,5]。桃叶珊瑚甙(aucubin)是杜仲中有效活性成分之一,属环烯醚帖类,具有抗炎、抗菌、清湿热、利小便、升血压等药理作用。在此,作者研究了杜仲皮中桃叶珊瑚甙的提取及纯化工艺,并采用高效液相色谱法(HPLC)测定其含量[6,7]。
大孔树脂吸附分离是一种新型的分离纯化手段,被广泛应用于植物药活性成分的提取,是分离有机化合物尤其是水溶性化合物的有效手段[8-10]。为此,对杜仲进行提取后,选用8种不同型号的大孔树脂对提取液中的桃叶珊瑚甙进行分离纯化。
1 实 验
1.1 仪器与试剂
a. 仪器:Shimadzu LC-10AS型高效液相色谱仪(日本岛津公司制造);Shimadzu SPD-6AV检测器;SCL-6B型数据处理机;ODS-C18色谱柱(其高×内径为200 mm×4.6 mm,填料粒径为5 μm);756MCUV-vis分光光度计(上海分析总厂制造);R201型旋转蒸发仪;恒温水浴锅;层析柱(自制,高×直径为400 mm×26 mm)。
b. 试剂:氯仿、乙醇,均为分析纯;甲醇,为色谱纯;桃叶珊瑚甙标样(≥95%,购自日本);大孔吸附树脂(天津南开大学化工厂生产);杜仲样品(来自湖南张家界)。
1.2 桃叶珊瑚甙的提取
称取杜仲样品10.000 g,用120 mL体积分数为72%乙醇水溶液在65 ℃恒温水浴锅中对样品进行提取,每次60 min,共提取2次,合并提取液,将提取液离心分离、过滤,将滤液浓缩后转入100 mL容量瓶中,用蒸馏水稀释至刻度备用[11,12]。
1.3 HPLC测定条件
流动相为21%(体积分数)甲醇水溶液;流速为1.0 mL/min;检测波长为210 nm;色谱柱为ODS-C18 反相柱;取样品溶液10 μL经0.2 μm膜过滤后,进样检测。
2 结果与讨论
2.1 测定方法的选择
检测桃叶珊瑚甙的方法有对二甲氨基苯甲醛法、硫酸铜分光光度法、薄层色谱分离分光光度法和HPLC法等。由于采用硫酸铜分光光度法所测结果偏低,采用对二甲氨基苯甲醛法所测结果偏高,采用薄层色谱分离分光光度法人为影响因素过多,故采用这3种方法所测结果均不理想,而高效液相色谱法具有高效率、高选择性和高灵敏度的特点,反相高效液相色谱适用于检测桃叶珊瑚甙[13,14],其方法简单易行,选择性好,精确度高。
2.2 测定波长的选择
取标准溶液在756MCUV-vis分光光度计上进行紫外线扫描。由扫描结果可知,桃叶珊瑚甙的最大吸收峰在210 nm和231 nm处,因桃叶珊瑚甙在210 nm处吸光系数较大,故采用210 nm作为测定波长。
2.3 流动相的选择
以不同体积分数的甲醇水溶液作流动相,通过实验对测定结果进行比较,发现采用21%甲醇水溶液作为流动相,在流速为1.0 mL/min时,对杜仲样品各组分的分离效果较好,桃叶珊瑚甙峰形完好,分离度达到色谱分析的要求。桃叶珊瑚甙标准
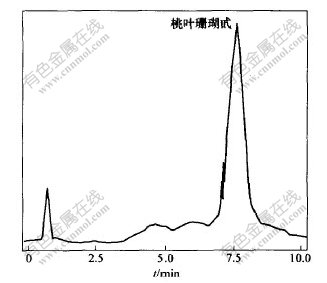
图 1 桃叶珊瑚甙的色谱图
Fig. 1 HPLC chromatogram of standard aucubin
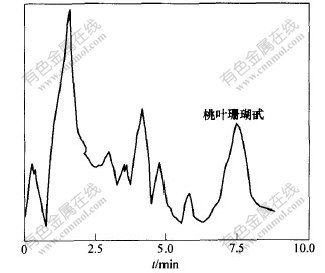
图 2 杜仲样品的色谱图
Fig. 2 HPLC chromatogram of Eucommia
2.4 标准曲线的绘制
吸取质量浓度为0.168 g/L的桃叶珊瑚甙标准样品2,4,6,8,10 μL进行高效液相色谱分析,保留时间为7.5 min。桃叶珊瑚甙质量浓度ρ与峰面积A之间呈良好的线性关系,其线性回归方程为:
ρ=0.8472A+0.0197,
相关系数r=0.9994。
2.5 原料的选择
称取5.000 g杜仲粉样品置于索氏提取器中,用氯仿提取6 h,除去杜仲胶等脂溶性成分。残留物挥发;氯仿被除去后,以甲醇提取6 h,将甲醇提取液减压浓缩,转入50 mL容量瓶,用甲醇定容,作为样品溶液,用HPLC测定其中的桃叶珊瑚甙含量,结果见表1。由表1可知,不同杜仲皮中桃叶珊瑚甙含量差异较大,以新鲜杜仲皮中含量最低,10 a生炮制后的杜仲皮中含量最高,故选用10 a生的炮制杜仲皮为原料进行实验。
表 1 不同杜仲原料中桃叶珊瑚甙的含量
Table 1 Content of aucubin in eucommia

2.6 桃叶珊瑚甙提取条件的优化
2.6.1 提取溶剂的选择
杜仲中的有效活性成分大多为水溶性成分,常用甲醇、乙醇和水等溶剂来提取,以不同体积分数的甲醇和乙醇水溶液作为提取剂,结果如图3所示。由图3可见,65%的甲醇和72%乙醇的浸提效果最[CM(22*3] 好,当乙醇含量高于72%时,浸提率下降;随着提取剂浓度的升高,所提取溶液的颜色加深,粘度增大,给后处理带来困难。考虑到提取溶剂的毒害性及生产成本,选择72%的乙醇水溶液作为提取溶剂。
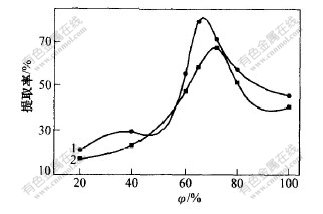
1—甲醇; 2—乙醇
图 3 提取溶剂体积分数φ对桃叶珊瑚甙提取率的影响
Fig. 3 Effects of extraction solvent on
extraction rate of aucubin
2.6.2 浸提条件的选择
a. 提取温度。在72%乙醇水溶液提取60 min的条件下,考察了温度对桃叶珊瑚甙提取率的影响,结果如图4所示。可见:随着提取温度的升高,桃叶珊瑚甙的浸出量增加,到65 ℃达最大值。由于桃叶珊瑚甙含有甙键,是易氧化的活性成分,所以,当温度超过65 ℃后,桃叶珊瑚甙氧化分解速度加快,使得浸出量呈下降趋势。故选提取温度为65 ℃。
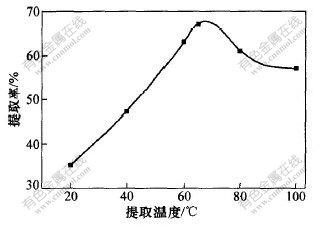
图 4 提取温度对桃叶珊瑚甙提取率的影响
Fig. 4 Effects of extraction temperature on
extraction rate of aucubin
b. 提取时间。在以72%乙醇水溶液为提取溶剂,于65 ℃提取1次的条件下,考察了提取时间对桃叶珊瑚甙提取率的影响,结果如图5所示。可见,当浸提时间在60 min内,桃叶珊瑚甙的提取率随提取时间的延长而增加,随着提取时间的增加,桃叶珊瑚甙的氧化分解量也逐渐增加,使得桃叶珊瑚甙的提取率显著下降,故选择提取时间为60 min。
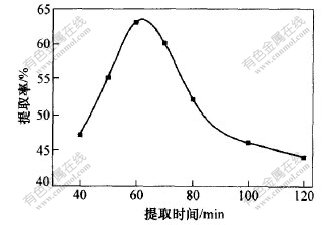
图 5 提取时间对桃叶珊瑚甙提取率的影响
Fig. 5 Effects of extraction time on
extraction rate of aucubin
c. 提取溶剂体积。在以72%乙醇水溶液为提取溶剂,于65 ℃提取60 min的条件下,考察了料液比(即每克杜仲样品中所需提取溶剂体积)对桃叶珊瑚甙提取率的影响,结果如图6所示。可见:提取溶剂体积越大,桃叶珊瑚甙的提取效果越好,但当料液比大于1∶12后,桃叶珊瑚甙的提取率无显著升高,为节约提取溶剂,选取料液比为1∶12。
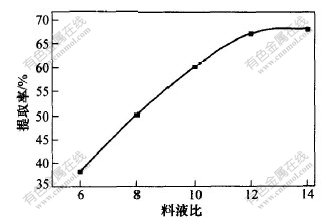
图 6 料液比对桃叶珊瑚甙提取率的影响
Fig. 6 Effects of ratio of mass of eucommia
to volume of solvent on extraction
rate of aucubin
d. 提取次数。在以72%乙醇水溶液为提取溶剂,料液比为1∶12,于65 ℃提取60 min的条件下,考察了提取次数对桃叶珊瑚甙提取率的影响。实验结果表明,桃叶珊瑚甙提取率随着提取次数的增加而升高。但在提取2次后,再增加提取次数,桃叶珊瑚甙提取率无显著升高,且提取次数过多,提取液体积增大,加大了浓缩量。故选择提取次数为2次。
由以上研究可知,杜仲中桃叶珊瑚甙的最佳提取条件为:以72%乙醇水溶液作为提取剂,料液比为1∶12,在65 ℃的提取温度下,提取2次,提取时间为60 min。在此条件下,桃叶珊瑚甙提取率可达85%。
2.7 提取溶液的大孔树脂分离纯化处理
称取杜仲粉样10 g,按上述最佳条件进行提取,对所得提取液进行离心分离,取上层清液,减压浓缩至10 mL,采用干法装柱。依次用去离子水和10%,20%,30%,40%,50%,60%, 70%, 80%,90%,100%乙醇溶液洗脱,收集洗脱液,采用高效液相色谱即时检测,各种不同树脂吸附洗脱结果见表2,其中D4020型树脂的40%乙醇洗脱液和S-8型树脂的60%洗脱液的色谱图分别如图7和图8所示。从表2可以看出,这8种大孔树脂均对桃叶珊瑚甙表现出吸附作用,并能用乙醇水溶液作洗脱剂,进行解吸附,但其中只有D4020和S-8型树脂对桃叶珊瑚甙表现了良好的选择性。从图7和图8可以看出,S-8型的选择性最好。
表 2 浸提溶液的大孔树脂纯化处理结果
Table 2 Results of column chromatogram
purification

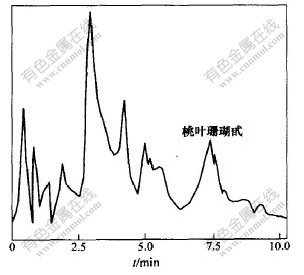
图 7 D4020型树脂洗脱液(40%乙醇洗脱液)色谱图
Fig. 7 HPLC chromatogram of D4020 resin with
40% ethanol-water solution as eluate
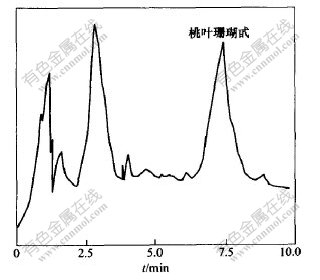
图 8 S-8型树脂洗脱液(60%乙醇洗脱液)色谱图
Fig. 8 HPLC chromatogram of S-8 resins with
60% ethanol-water solution as eluate
用HPLC法对S-8型树脂的洗脱液即50%和60%乙醇洗脱液进行检测,所得桃叶珊瑚甙色谱峰形简单,将S-8型树脂的60%洗脱液浓缩至粘膏状,冷冻干燥,得固体粉末样品336.8 mg,经检测,样品的纯度为78.3%。
3 结 论
a. 杜仲皮中桃叶珊瑚甙的最佳提取条件为:以体积分数为72%的乙醇水溶液作为提取剂, 料液比为1∶12,在65 ℃的提取温度下,提取2次,提取时间为60 min。在此条件下,桃叶珊瑚甙提取率达85%。
b. 建立了以HPLC法测定杜仲皮中桃叶珊瑚甙含量的方法。测定条件为:流动相为甲醇水溶液;流速为1.0 mL/min;检测波长为210 nm;色谱柱为ODS-C18反相柱(高×直径为200 mm×4.6 mm,填料粒径为5 μm)。
c. 杜仲皮炮制后桃叶珊瑚甙的含量可达2.87%,高于生皮中的2.17%,建议炮制后入药。
d. S-8极性树脂可对杜仲提取液进行纯化分离,用极性较大的60%乙醇水溶液对桃叶珊瑚甙进行洗脱,所得桃叶珊瑚甙的纯度可达78.3%。
参考文献:
[1]杨峻山,张聿梅. 杜仲研究的现状与展望[J]. 自然资源学报,1997,12(1):60-67.
YANG Jun-shan,ZHANG Yu-mei. Recent Situation and Prospects of the Study of Eucommia Ulmoides[J]. Journal of Natural Resources,1997,12(1):60-67.
[2]赵军太,张诚. 杜仲不同部位的化学成分研究与应用[J]. 实用医技杂志. 2003,10(9):1025-1026.
ZHAO Jun-tai, ZHANG Cheng. Research and Application of Chemical Ingredients in Different Partial of Duzhong[J]. Journal of Practical Medical Techniques,2003,10(9):1025-1026.
[3]TAKESHI D, TAKAKO I, SHIZUKE K. The Constituents of Eucommia Ulmoides Oliver II. Isolation and Structures of Three New Lignan Glycosides[J]. Chem Pharm Bull, 1985, 33(9): 3651-3657.
[4]DEYAMA T, NISHIBE S, NAKEZAWA Y. Constituents and Pharmacological Effects of Eucommia and Siberian Ginseng[J]. Acta Pharmacal Sin,2001,22(12):1057-1070.
[5]唐建军,张禄源,何鸣筱. 杜仲的研究与应用进展[J]. 植物学通报,1998,15(6):47-51.
TANY Jian-jun, ZHANG Lu-yuan, HE Ming-xiao. Advances in Research of Eucommia Ulmoides Oliver and Its Utilization[J]. Chinese Bulletin of Botany,1998, 15(6): 47-51.
[6]张华宣,程斐. 高效液相色谱法测定海滨车前中桃叶珊瑚甙的含量[J]. 四川师范大学学报(自然科学版),1997,20(6):102-106.
ZHANG Hua-xuan,CHENG Fei. Quantitative Determination of Aucubin in Root of Hetaodahuang(Plantago Camtchatica) by HPLC [J]. Journal of Sichuan Normal University(Natural Science),1997, 20(6):102-106.
[7]马柏林,梁淑芳,张康健. 杜仲种子中桃叶珊瑚甙的提取分离研究[J]. 西北林学院学报,1999,14(4):69-72.
MA Bai-lin,LIANG Shu-fang,ZHANG Kang-jian. Extraction and Separation of Aucubin from Eucommia Seeds[J]. Journal of Northwest Forestry University,1999,14(4):69-72.
[8]陈晓青,李宇萍,彭密军. 杜仲中松脂醇二葡萄糖甙的提纯[J]. 中南工业大学学报(自然科学版),2003,34(3):262-265.
CHEN Xiao-qing,LI Yu-ping,PENG Mi-jin. The Extraction and Purification of Pinoresinol Diglucoside in Eucommia Ulmoide Oliver[J]. Journal of Central South University of Technology(Natural Science),2003,34(3):262-265.
[9]彭密军,钟世安,周春山,等. 大孔吸附树脂分离纯化杜仲中活性成分[J]. 离子交换与吸附,2004,20(1):13-22.
PENG Mi-jun,ZHONG Shi-an,ZHOU Chun-shan, et al. Separation and Purification of Active Components of Eucommia on Macroporous Adsorption Resin[J]. Ion Exchange and Adsorption,2004,20(1):13-22.
[10]TAKESHI D, TAKAKO I, SHIZUKE K. The Constituents of Eucommia Ulmoides Oliver VI Isolation of a New Sesquilignan and Neolignan Glycosides[J]. Chem Pharm Bull, 1987, 35(5): 1803-1807.
[11]董娟娥,马柏林,仝小林,等.提高杜仲叶中主要活性物质提取率的研究[J]. 西北林学院学报,2002,17(1):64-67.
DONG Juan-e,MA Bai-lin, TONG Xiao-lin. A Study on the Extraction of the Bioactive Constituents in the Leaves of Eucommia Ulmoids [J]. Journal of Northwest Forestry University,2002,17(1):64-67.
[12]邓勇,彭明.杜仲叶有效成分的提取[J].农业工程学报,1997,13(3):230-234.
DENG Yong,PENG Ming. Extraction of Useful Ingredients from Ulmoides Olives Leaves[J].Transactions of the CSAE,1997,13(3):230-234.
[13]马柏林,梁淑芳,张康健. 薄层色谱分离和分光光度法测定桃叶珊瑚甙[J].分析化学,2000,28(3):346-348.
MA Bai-lin,LIANG Shu-fang,ZHANG Kang-jian. Determination of Aucubin by Thin Layer Chromatographic Separation and Spectrophotometry[J]. Chinese Journal of Analytical Chemistry,2000,28(3):346-348.
[14]董娟娥,马柏林,贾二红. 杜仲叶中桃叶珊瑚甙测定方法的研究[J]. 西北林学院学报. 2001,16(1):53-55.
DONG Juan-e,MA Bai-lin,JIA Er-hong. Study on Measuring Method of Aucubin in Eucommia Ulmoids Leaf[J]. Journal of Northwest Forestry University, 2001, 16(1): 53-55.
收稿日期:2004-06-21
基金项目:国家自然科学基金资助项目(90209047); 湖南省科研计划项目(02JZY3029); 湖南省计委科研基金资助项目(2002-772)
作者简介:陈晓青(1965-),女,湖南长沙人,教授,从事现代化学分离及天然药物活性成分提取研究
论文联系人: 陈晓青,女,教授;电话:13807489250(手机);E-mail: xqchen@263.net