Li1.6Mn1.6O4酸洗后离子筛在盐湖卤水中的吸附性能
石西昌,张志兵,周定方,周喜诚,唐天罡,尹世豪
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:通过对前躯体Li1.6Mn1.6O4酸洗制备离子筛进行正交实验分析,得出最优化的酸洗条件,然后分别应用伪一级、伪二级动力学方程对吸附过程进行研究,考察离子筛对卤水中各主要金属离子的分离性能以及在卤水中的循环吸附性能,对离子筛吸附锂、脱锂后样品进行锰平均化合价及锂锰摩尔比测定。研究结果表明:最优酸洗条件为酸洗温度70 ℃,搅拌速率500 r/min,酸洗时间24 h,盐酸浓度0.5 mol/L,液固比400 mL/g。此实验条件下得出锂的迁出率为96.28%,锰的溶损率为7.46%。酸洗后所得离子筛对锂离子有较好的特定选择性;离子筛对Li+的吸附过程服从伪二级动力学方程,即为化学吸附过程;离子筛有较优异的循环吸附性能;离子筛的实际吸附容量只有其理论容量的1/3,离子筛始终未达到最大饱和吸附容量。
关键词:Li1.6Mn1.6O4;前躯体;离子筛;酸洗;吸附;循环性能
中图分类号:TB34 文献标志码:A 文章编号:1672-7207(2013)03-0892-09
Adsorption performance of ion-sieve obtained after Li1.6Mn1.6O4 pickled in brine
SHI Xichang, ZHANG Zhibing, ZHOU Dingfang, ZHOU Xicheng, TANG Tiangang, YIN Shihao
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The process that Li1.6Mn1.6O4 was pickled for ion-sieve was first investigated by orthogonal experiment, Then the adsorption process was studied by pseudo-first-order and pseudo-second-order kinetics equation, respectively. The separation performance of the ion-sieve for the main metal ions in brine and its cyclic adsorption performance were investigated. Finally, the average valences of manganese and mole ratio of lithium to manganese were measured, respectively. The results show that the optimal pickling condition is as follows: pickling temperature is 70℃, stirring speed 500 r/min, pickling time 24 h, hydrochloric acid concentration 0.5 mol/L and liquid-solid ratio 400 mL/g. The lithium extracted rate is 96.28% and the dissolved loss rate of manganese is 7.46% under the optimal pickling condition. The ion-sieve obtained after pickling has good specific selective for lithium; the adsorption process is well fitted to pseudo-second-order kinetics equation and proved to be chemical adsorption; it also has good circulation adsorption performance; the adsorption capacity of the ion-sieve only reaches one third of its theoretical capacity, and it has not reached its maximum saturation adsorption capacity.
Key words: Li1.6Mn1.6O4; precursor; ion-sieve; pickling; adsorption; cyclic adsorption performance
随着世界经济的快速发展,锂及锂化合物的应用领域不断被拓宽,近年来,世界范围内锂的消费量以每年7%~10%的速度快速增长[1],2008年,全世界消耗的锂折合成碳酸锂约为12.2万t[2]。从锂辉石、锂磷铝石、锂霞石和透锂长石等矿石中提取锂产品的成本高、流程长、能耗大,已远远不能满足市场需求[3-5]。而盐湖卤水锂的含量较高,资源丰富(约占锂资源总量70%~80%),提取成本低,将逐渐取代锂辉石成为锂工业生产的主要原料[6-7]。目前,世界上主要的锂生产国中,美国、阿根廷和智利主要以盐湖卤水为原料,中国也在积极研究开发盐湖锂资源,但以矿石生产为主,生产成本高,没有市场竞争力[8-10]。据预测[11-12],到21世纪中叶,伴随着锂镁铝轻质合金在飞机制造中的大量使用、动力电池和储备电池的发展以及可控热核反应的实用化,世界对锂的需求将更加迫切。离子筛吸附剂法是目前公认的最有前途的盐湖卤水提锂方法,而锰氧化物离子筛是研究得最多、综合性能最好的无机锂离子吸附剂。锂锰氧化物Li1.6Mn1.6O4是完全不同于传统富锂尖晶石锰氧化物系列Li1+xMn2-xO4 (0≤x≤0.33)的新型离子筛前躯体[13]。它具有更高的理论锂含量(达68 mg/g),且其锂锰摩尔比达到了1,高于传统富锂尖晶石系列中的LiMn2O4和Li1.33Mn1.67O4。Li1.6Mn1.6O4酸洗后制得的锂离子筛MnO·0.5H2O被认为目前对锂吸附容量最大的锂离子吸附剂,而且还具有性质稳定、锰溶损小、无污染、循环使用寿命长等优点[14-15]。因此,研究开发性能优异的离子筛前躯体Li1.6Mn1.6O4及其离子筛,对开发丰富的盐湖卤水资源有非常大的经济价值及意义,也将大大缓解世界市场对锂盐生产的迫切需求,从而促进世界经济的快速发展。本文作者首先将固相法制得的前躯体Li1.6Mn1.6O4进行酸洗正交实验条件分析,得出制取离子筛的最优化酸洗条件,然后再将离子筛置于盐湖卤水中进行循环吸附实验,考察离子筛对卤水中主要金属离子的分离特性及其循环吸附性能,从而为开发性能优异的离子筛MnO·0.5H2O提供一定的技术参考。
1 实验
1.1 酸洗正交实验设计
酸洗制备离子筛过程中的主要影响因素包括酸洗温度、搅拌速率、酸洗时间、盐酸浓度、液固比等。因此,本文选择的5个相关因素为酸洗温度A,搅拌速率B,酸洗时间C,盐酸浓度D和液固比E。各因素所选取的水平如表1所示。以锂的迁出率和锰的溶损率为考察指标进行酸洗正交实验。从表1可以看出,正交实验表应选用L18(37)比较合适。
1.2 盐湖卤水组成及其性质
实验所用的卤水为来自新疆罗布泊的盐湖卤水,其主要成分含量及物理性质如表2及表3所示。
从表2可知,盐湖老卤卤水的成分非常复杂,含有近20种元素离子,其中Mg,K,Na,S的质量浓度比较高,分别为107 700,1 409,2 613和6 439 mg/L。但是Li质量浓度比较低,只有246.4 mg/L,因此,该老卤卤水的镁锂质量比非常高,达到了437.094。另外,从表3可知:此老卤卤水偏酸性,且密度和黏度都较大。
1.3 实验过程
首先,通过将离子筛前躯体Li1.6Mn1.6O4用盐酸进行酸洗洗脱正交实验得出制备离子筛H1.6Mn1.6O4(一般记为MnO2·0.5H2O)的最佳酸洗洗脱条件,然后,分别应用伪一级、伪二级动力学方程对吸附锂过程进行表观动力学分析,再将制得的离子筛置于盐湖老卤卤水中进行循环吸附实验,考察离子筛对盐湖卤水中主要金属离子的分离特性及其循环吸附性能。实验采用原子吸收分光光度计(北京普析仪器有限公司制造)来测定循环实验各溶液中的锂含量,同时运用XRD和SEM等分析手段对离子筛脱锂、吸附锂后的样品进行了表征,最后对循环吸附实验个阶段样品的锰平均化合价、Li与Mn摩尔比进行了测定。
表1 正交实验各因素的水平选取结果
Table 1 Selected factors and levels for orthogonal experiment

表2 新疆罗布泊盐湖老卤卤水主要成分
Table 2 Main component content of old bittern brine from Lop Nor, Xinjiang mg/L

表3 新疆罗布泊盐湖老卤卤水的主要物理性质
Table 3 Main physical properties of old bittern brine from Lop Nor, Xinjiang

2 结果与讨论
2.1 酸洗正交实验结果分析
按所设计的正交实验表进行相关正交实验,所得正交实验结果及分析如表4所示。从表4可以看出,对锂迁出率来说,极差最大的是A,其次是D和E,各因素对锂迁出率这一指标的影响重要性由大到小依次为:A,D,E,C,B,即A,D和E是关键因素,其他都为次要因素,最优水平为A3D3E3;对锰溶损率来说,极差最大的是D,其次是A,各因素对锰溶损率这一指标的影响重要性由大到小依次为:D,A,C,B,E,即D和A为关键因素,其他都为次要因素,最优水平为A1D1,其他因素水平根据实际情况选取。对酸洗过程来说,既要尽可能提高锂的迁出率,又必须控制锰的溶损率不能太高,所以经综合分析权衡得出酸洗过程的优化水平为A3B1C2D1E3 ,即酸洗温度为70 ℃,搅拌速率500 r/min,酸洗时间24 h,盐酸浓度0.5 mol/L,液固比400 mL/g。此优化水平即为表4中第7号实验,实验得出锂的迁出率为96.28%,锰的溶损率为7.46%。
表4 正交实验直观分析计算数据
Table 4 Intuitive analysis data of orthogonal experiment
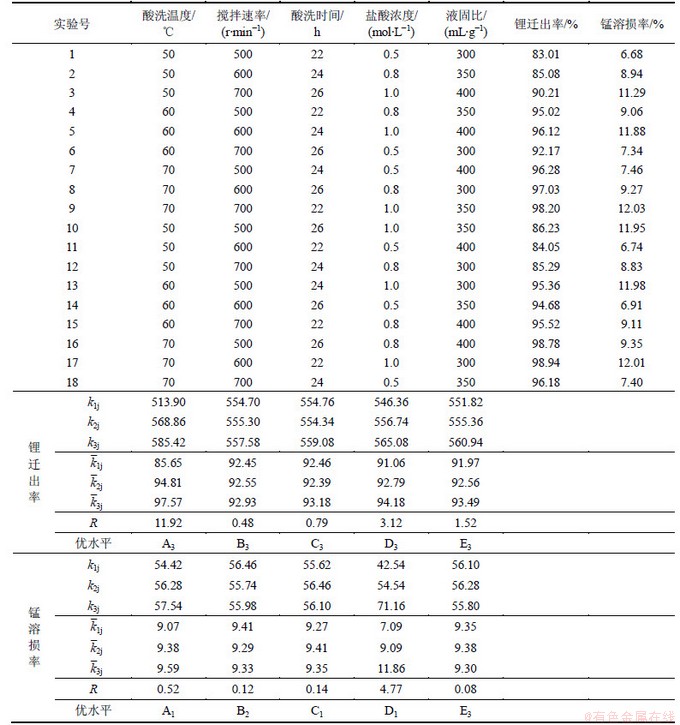
2.2 不同温度下离子筛在卤水中的吸附
分别称取0.2 g左右离子筛于各反应瓶中,然后加入70 mL卤水,再分别置于30,40,50和60 ℃下进行吸附实验,隔一定时间间隔取样分析卤水中的剩余锂含量,实验结果如图1所示。
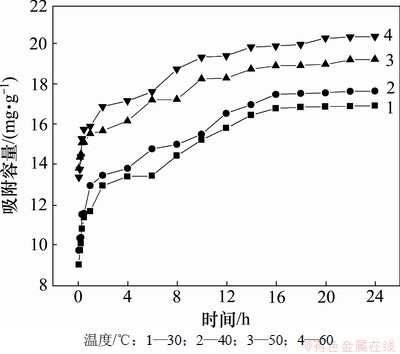
图1 离子筛在卤水中不同温度下吸附容量随时间的变化
Fig.1 Variation of adsorption capacity of ion-sieve in brine over time at different temperatures
从图1可以看出,一定温度下,离子筛的吸附容量是随着吸附时间的增加而增加,在吸附开始后的比较短的一段时间里,吸附容量随吸附时间呈爆发性增长,而后增长稍微缓慢些,当吸附时间到了16 h以后吸附容量基本达到了平衡。同时还可以看出温度的升高也有助于吸附容量的提升,60 ℃时平衡吸附容量达到了20.35 mg/g,高于30 ℃时的16.92 mg/g。通过比较离子筛分别在模拟锂溶液和老卤卤水中的吸附容量可知,离子筛在老卤卤水中的吸附容量要比在模拟锂溶液中低出许多,这可能是因为一方面老卤卤水中成分比较复杂,其他杂质成分干扰了离子筛对锂的吸附;另一方面卤水的密度和黏度都非常大,不利于离子的扩散,阻碍了离子交换反应的有效进行。
2.3 离子筛对卤水中锂离子的吸附表观动力学
动力学的研究有助于理解反应的历程和机理,关于吸附反应的动力学模型已有不少报道,目前伪一级动力学模型(式(1))和伪二级动力学模型(式(2))被广泛用来研究吸附机理[16-18],确定吸附反应的速率常数。
 (1)
(1)
 (2)
(2)
式中:qe (mg·g-1)和qt(mg·g-1)分别为在吸附平衡与吸附时间为t时吸附剂对Li+的吸附容量;k1(h-1)和k2(g·mg-1·h-1)分别为伪一级动力学模型和伪二级动力学模型吸附速率常数。
分别采用伪一级动力学方程和伪二级动力学方程对离子筛在新疆罗布泊盐湖卤水中30,40,50,60和70 ℃下对锂的吸附数据进行线性拟合,拟合结果分别如图2和3所示。
从图2和3可以看出,用伪一级动力学方程拟合的相关系数都不太理想,一般为0.73左右,最好的为0.951 1,而用伪二级动力学方程拟合的都比较好,线性相关系数都达到0.998以上,故可以认为离子筛对锂的吸附过程符合伪二级动力学方程,即为化学吸附过程。

图2 离子筛在不同温度下对锂的吸附数据用伪一级动力学线性拟合图
Fig.2 Linear fitting patterns for adsorption data of ion-sieve for lithium with pseudo-first-order equation at different temperatures

图3 离子筛在不同温度下对锂的吸附数据用伪二级动力学线性拟合图
Fig.3 Linear fitting patterns for adsorption data of ion-sieve for lithium with pseudo-second-order equation at different temperatures
2.4 离子筛对卤水中的主要金属离子的分离特性
由于盐湖老卤卤水成分比较复杂,含有许多种金属离子与非金属离子,为了能有效地从复杂卤水体系中提取锂,离子筛对锂离子的特定选择性是关系锂离子筛的性能与实用价值的关键指标。衡量离子筛对各金属离子的分离性能的好坏通常用分配比D(式(3))和分离系数b(式(4))来表示。分配比反映了某一溶质在两相中的迁移能力及分离效能,而分离系数表示某一分离流程将2种不同物质分离的程度,它反映出两组分分离的难易程度。
 (3)
(3)
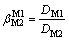 (4)
(4)
式中:D为某金属离子分配系数,L/g;C0为吸附前溶液中金属离子的浓度,mg/L;V为溶液的体积,L;M为离子筛的质量,g;Ce为吸附后溶液中金属离子的浓度,mg/L;DM1,DM2分别是金属离子M1与M2的分配系数。
将一定量的离子筛置于适量的盐湖老卤卤水中60 ℃下进行吸附16 h后,再测定卤水吸附前后各主要成分的含量(见表5),主要考察了Li+,Mg2+,K+,Na+等主要金属离子的分配比及Li+对其他离子的分离系数,相关实验结果如表6所示。
从表6中可以看出DLi>> DNa>DK>DMg ,即离子筛对各金属离子吸附的优先顺序为:Li+,Na+,K+,Mg2+。同时还可知,Li+对Mg2+,K+和Na+的分离系数都远远大于1,表明离子筛对Li+与Mg2+,K+和Na+有较好的分离性能,对锂离子有较好的特定选择性。
2.5 离子筛在卤水中的循环吸附性能
称取一定量的离子筛前躯体不断进行酸洗-吸附-洗脱-吸附的循环吸附实验,考察离子筛的循环吸附性能。酸洗洗脱控制条件为:酸洗温度70 ℃,搅拌速率500 r/min,酸洗时间24 h,盐酸浓度0.5 mol/L,液固比400 mL/g。卤水吸附实验控制条件为:吸附温度60 ℃,吸附时间16 h,液固比350 mL/g,搅拌速率500 r/min。
表5 老卤卤水吸附前后各主要成分的含量变化
Table 5 Content changes of main ingredient in brine before and after adsorption mg/L

表6 离子筛对卤水中各主要金属离子的分配系数及Li+对Mg2+,Na+,K+的分离系数
Table 6 Distribution coefficient of ion-sieve for main metal ions in brine and separation coefficient of Li+ to Mg2+, Na+, K+

图4所示为离子筛吸附量/解吸量随循环次数的变化图,从图4可以看出,第1次循环时离子筛的解吸量非常高,每克离子筛释放出67.37 mg Li+。这是因为第1次循环酸洗洗脱时用的离子筛为实验固相法制备的离子筛前驱体,其理论含锂量为68.13 mg/g。同时还可看出第1次循环时离子筛的吸附容量只有18.37 mg/g,远低于第1次循环洗脱步骤时的解吸量,但离子筛的吸附容量还是比较稳定,经8次循环吸附实验后,吸附容量仅从18.37 mg/g降低到16.39 mg/g,且第2次循环以后,离子筛的解吸量与吸附量基本持平。这表明离子筛具有比较优异的循环吸附性能,但是离子筛实际的吸附容量只有不到其理论吸附容量的1/3,离子筛始终未达到饱和吸附状态,这可能是因为离子筛在四面体间隙位的能垒低于八面体间隙位,吸附锂时比较容易在四面体间隙位发生锂的嵌入/脱嵌反应,而在八面体间隙位不发生或者很难发生[19]。

图4 离子筛吸附量/解吸量随循环次数的变化
Fig.4 Change of quantity of adsorption/desorption of ion-sieve with cycle times
图5所示为离子筛锰溶损随循环次数的变化。从图5可以看出,锰的溶损率是随着循环次数的增加而不断降低的,当循环达5次以后,锰的溶损率基本趋于稳定,为2.4%左右。
图6所示为循环实验不同阶段所得样品的XRD图谱。由图6可以看出,8次循环实验所得各样品的衍射特征峰的位置基本不变,但衍射峰的强度则随着循环次数的增加而逐渐减弱。这说明了离子筛在循环吸附实验过程中,始终都维持尖晶石型的基本结构不变,只是局部发生了细微的规整。可见离子筛有较好的结构稳定性,从而也保证了其循环利用价值及寿命。

图5 离子筛锰溶损随循环数的变化
Fig.5 Manganese dissolve loss of ion-sieve with change of cycle times

图6 循环实验不同阶段所得样品的XRD图谱
Fig.6 XRD patterns of samples from different periods of cyclic experiment
图7所示为离子筛循环过程中酸洗或吸附锂所得样品的SEM像。从图7可以看出,在循环实验过程中,离子筛颗粒刚开始时粒度比较大,为30~50 mm,且团聚比较严重,随着循环实验的进行,团聚颗粒可能由于搅拌、酸浸、吸附反应等物理或化学的因素慢慢被破碎,颗粒变得越来越均匀,同时也越来越细,粒度基本在10 mm以下。团聚现象严重,颗粒过于粗大,会导致离子筛与溶液接触的比表面积降低,润湿性不好,从而会阻碍离子交换反应的有效进行,影响酸洗或吸附反应离子筛的锂迁出率和吸附容量。

图7 离子筛循环过程中酸洗或吸附锂所得样品的SEM像
Fig.7 SEM images of samples after adsorption or pickling in circulation process
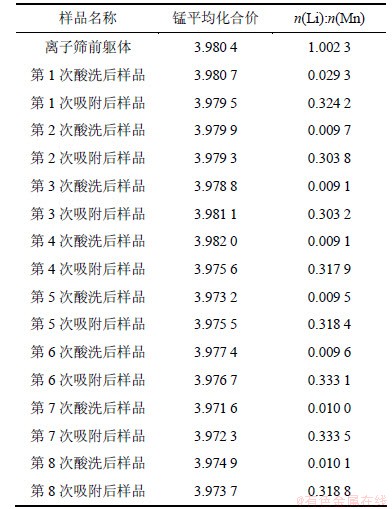
表7所示为循环实验过程中离子筛酸洗或吸附锂后样品的锰平均化合价及锂锰摩尔比。从表7可以看出,在循环实验的过程中,离子筛的锰平均化合价基本没有发生多大变化,都维持在+4价左右,说明离子筛中的锰是比较稳定的,其始终能和氧维持其面心密堆积的尖晶石结构。另外,从表7还可以看出:离子筛前躯体的Li与Mn摩尔比为1.002 3,但是在随后的循环实验中,吸附后样品的Li与Mn摩尔比只有0.3左右,远低于前躯体的1.002 3,这是因为离子筛在卤水中的实际吸附容量只有20 mg/g左右,将近其理论容量的1/3,离子筛始终未达到最大饱和吸附容量,故其吸附后样品的Li与Mn摩尔比与理论值有较大偏差。同时还可知,循环过程中各酸洗后样品的Li与Mn摩尔比还是比较小,这说明吸附锂后的离子筛中绝大多数的锂能够被洗脱下来。
表7 循环实验过程中离子筛酸洗或吸附锂后样品的锰平均化合价及锂锰摩尔比
Table 7 Average valence of manganese and mole ratio of Lithium to manganese for samples after pickling or adsorption
3 结论
(1) 选用正交表L18(37)进行了前躯体酸洗相关正交实验,得出优化酸洗实验条件为:酸洗温度70℃,搅拌速率500 r/min,酸洗时间24 h,盐酸浓度0.5 mol/L,液固比400。此实验条件下得出锂的迁出率为96.28%,锰的溶损率为7.46%。
(2) 一定温度下,离子筛的吸附容量是随着吸附时间的增加而增加,在吸附开始后的比较短的一段时间里,吸附容量随吸附时间呈爆发性增长,而后增长稍微缓慢些,当吸附时间到16 h以后吸附容量基本达到了平衡。
(3) 离子筛对Li+的吸附能较好地符合伪二级动力学方程,吸附过程为化学吸附过程。
(4) 离子筛对Li+与Mg2+,K+,Na+有较好的分离性能,对锂离子有较好的特定选择性。
(5) 离子筛有较好的循环吸附性能,但其在卤水中的实际吸附容量只有20 mg/g左右,将近其理论容量的1/3,离子筛始终未达到最大饱和吸附容量。
参考文献:
[1] 张荣国, 杨顺林, 郭丽萍, 等. 盐湖卤水提锂的研究进展[J]. 无机盐工业, 2005, 37(3): 1-4.
ZHANG Rongguo, YANG Shunlin, GUO Liping, et al. Research progress of extraction of lithium from salt lake brine[J]. Inorganic Chemicals Industry, 2005, 37(3): 1-4.
[2] 封国富, 张晓. 世界锂工业发展格局的变化和对中国锂工业的影响和对策[J]. 稀有金属, 2003, 27(1): 57-61.
FENG Guofu, ZHANG Xiao. Variation in feature of world lithium industry and its influence on lithium industry in China[J]. Chinese Journal of Rare Metals, 2003, 27(1): 57-61.
[3] 张荣国, 杨顺林, 雷家珩, 等. 锂锰氧化物离子筛盐湖提锂的研究现状及应用前景[J]. 化学与生物工程, 2004, 21(4): 4-6.
ZHANG Rongguo,YANG Shunlin, LEI Jiaheng, et al. Current status and application prospect for recovery of lithium from salt lake brine by lithium manganese oxide ion-sieve[J]. Chemistry & Bioengineering, 2004, 21(4): 4-6.
[4] 袁俊生, 纪志永. 海水提锂研究进展[J]. 海湖盐与化工, 2003, 32(5): 29-33.
YUAN Junsheng, JI Zhiyong. The progress of extracting lithium from seawater[J]. Journal of Salt and Chemical Industry, 2003, 32(5): 29-33.
[5] 邓菲菲. 锂提取方法的研究进展[J]. 沈阳工程学院学报: 自然科学版, 2010, 6(3): 285-288.
DENG Feifei. Progress on the extraction of lithium[J]. Journal of Shenyang Institute of Engineering: Natural Science, 2010, 6(3): 285-288.
[6] 邢红, 应毅, 金芳. 盐湖卤水提锂进展研究[J]. 科技资讯, 2011(19): 230-233.
XING Hong, YING Yi, JIN Fang. The progress of extracting lithium from brine[J]. Science & Technology Information, 2011(19): 230-233.
[7] 潘立玲, 朱建华, 李渝渝. 锂资源及其开发技术进展[J].矿产综合利用, 2002(2): 28-33.
PAN Liling, ZHU Jianhua, LI Yuyu. Lithium resources and the progress of their exploitation techniques[J]. Multipurpose Utilization of Mineral Resources, 2002(2): 28-33.
[8] 刘元会, 邓天龙. 国内外从盐湖卤水中提锂工艺技术研究进展[J]. 世界科技研究与发展, 2006, 28(5): 69-75.
LIU Yuanhui, DENG Tianlong. Progresses on the process and technique of lithium recovery from salt lake brines around the world[J]. World Sci-Tech R & D, 2006, 28(5): 69-75.
[9] 林大泽. 锂的用途及其资源开发[J]. 中国安全科学学报, 2004, 14(9): 72-76.
LIN Daze. Uses of lithium and its resource exploitation[J]. China Safety Science Journal, 2004, 14(9): 72-76.
[10] 王宝才. 我国卤水锂资源及开发技术进展[J]. 化工矿物与加工, 2000, 29(10): 4-6.
WANG Baocai. Lithium-bearing brine resources status and its progress of development technology in China[J]. Industrial Minerals and Processing, 2000, 29(10): 4-6.
[11] 肖小玲, 戴志锋, 祝增虎, 等. 吸附法盐湖卤水提锂的研究进展[J]. 盐湖研究, 2005, 13(2): 66-69.
XIAO Xiaoling, DAI Zhifeng, ZHU Zenghu, et al. Extracting lithium from brines by absorption method[J]. Journal of Salt Lake Research, 2005, 13(2): 66-69.
[12] 游清治. 世界锂的资源、生产与应用前景[J]. 世界有色金属, 2008(5): 42-45.
YOU Qingzhi. Resource,production and market prospect of lithium in the world[J]. World Nonferrous Metals, 2008(5): 42-45.
[13] Ariza M J, Jones D J, Roziere J, et al. Probing the local structure and the role of protons in lithium sorption processes of a new lithium-rich manganese oxide[J]. Chemistry of Materials, 2006, 18(7): 1885-1890.
[14] 王禄, 马伟, 韩梅, 等. 高效锂离子筛吸附剂MnO2·0.5H2O的软化学合成及吸附性能研究[J]. 化学学报, 2007, 65(12): 1135-1139.
WANG Lu, MA Wei, HAN Mei, et al. Soft chemical synthesis and adsorption properties of MnO2·0.5H2O, a high performance ion sieve for lithium[J]. Acta Chimica Sinica, 2007, 65(12): 1135-1139.
[15] NI Zheming, XIA Shengjie, WANG Ligeng, et al. Treatment of methyl orange by calcined layered double hydroxides in aqueous solution: Adsorption property and kinetic studies[J]. Journal of Colloid and Interface Science, 2007, 316(2): 284-291.
[16] ZHOU Limin, WANG Yiping, LIU Zhirong, et al. Characteristics of equilibrium, kinetics studies for adsorption of Hg(Ⅱ), Cu(Ⅱ), and Ni(Ⅱ) ions by thiourea-modified magnetic chitosan microspheres[J]. Hazardous Materials. 2009, 161(2): 995-1002.
[17] Barkat M, Nibou D, Chegrouche S, et al. Kinetics and thermodynamics studies of chromium (Ⅵ) ions adsorption onto activated carbon from aqueous solutions[J]. Chemical Engineering and Processing. 2009, 48(1): 38-47.
[18] Benhammou A, Yaacoubi A, Nibou L, et al. Adsorption of metal ions onto moroccan stevensite: Kinetic and isotherm studies[J]. Colloid and interface science. 2005, 282(2): 320-326.
[19] Chitrakar R, Kanoh H, Miyai Y, et al. A new type of manganese oxide (MnO2·0.5H2O) derived from Li1.6Mn1.6O4 and its lithium ion-sieve properties[J]. Chemistry of Materials, 2000, 12(10): 3151-3157.
(编辑 赵俊)
收稿日期:2012-03-10;修回日期:2012-06-15
基金项目:国家“十一五”科技支撑计划项目(2008BAB35B04);中央专项中南大学前沿研究计划重点项目(2010QZZD003)
通信作者:石西昌(1969-),男,甘肃西和人,博士,副教授,从事材料冶金和盐湖资源综合利用方面的研究;电话:0731-88877352;E-mail: xichang.shi@gmail.com