DOI:10.19476/j.ysxb.1004.0609.2018.04.14
3D打印Ti6Al4V钛合金支架的力学性能及生物相容性
刘 畅1,王辰宇2,刘 贺2,王中汉2,林高用1
(1. 中南大学 材料科学与工程学院,有色金属材料科学与工程教育部重点实验室,长沙 410083;
2. 吉林大学 第二医院骨科,长春 130041)
摘 要:以3D打印技术制备的多孔Ti6Al4V钛合金支架为研究对象,研究其显微结构特征与力学性能的关系,利用骨髓间充质干细胞研究多孔钛合金支架的生物相容性,以及在家兔全层骨缺损模型中研究支架周围骨质的生长情况。结果表明:3D打印的多孔Ti6Al4V钛合金支架的力学性能受其多孔特性的影响,具有较适合人体需求的初始强度;同时材料具有良好的细胞生物相容性;且多孔支架中的立体网格结构为细胞提供了生长空间,增加了骨髓间充质干细胞的增殖能力,促进了钛合金支架微孔中骨组织长入的速度。
关键词: Ti6Al4V多孔支架;3D打印;力学性能;骨髓间充质干细胞;骨长入;生物相容性
文章编号:1004-0609(2018)-04-0758-08 中图分类号:TG146;TG174 文献标志码:A
自20世纪中叶以来,钛及钛合金具有低密度、高强度、无磁性以及耐蚀性等优点被应用于医学领域,而其中应用最广的即为Ti6Al4V合金,它除了含有6%(质量分数)以上的Al元素之外,还因为添加了少量的V后引入了少量的β相,从而使其拉伸强度更高,热稳定性以及抗腐蚀性更好,特别是多孔Ti6Al4V钛合金的弹性模量还与人骨的相似,具有良好的生物相容性及合适的力学性能,目前被普遍认为是制造骨科植入物的优良材料之一[1-3]。
三维立体的孔隙结构能维持成骨细胞形态并促进成骨细胞的粘附、增殖以及增强细胞的生物活性,促进成骨相关的I和V型胶原的分泌,以达到骨质向内生长和长期固定[4-6]。多孔钛合金材料具有表面及内部互通微孔结构,在植入后可以诱发骨长入过程,即骨组织向多孔孔隙内部生长并形成稳固的骨-假体接合界面[7]。相比于传统制造技术,3D打印的优点在于可以制造出有着联通孔隙的生物材料。孔隙率与孔隙尺寸及形状也为预先设定的规律形状,而非传统技术制造的不规则尺寸及形状。多孔结构也可以降低材料的弹性模量,使得弹性模量远高于人体骨的钛合金假体具有与骨相近的数值而避免应力遮挡效应[8]。此外,3D打印技术可以实现从显微组织到宏观结构的可控制造。例如在制造复合材料时,将复合材料组织设计制造与外形结构设计制造同步完成,在微观到宏观尺度上实现同步制造,实现结构体的“设计-材料-制造”一体化[9]。当骨科植入物用于人体时,应充分考虑该假体的生物相容性及骨长入能力,而目前此类研究报道较少。
为使3D打印钛合金支架应用于临床提供更多的研究基础和理论依据,本文作者通过力学性能测试,以及于体外细胞实验和家兔全层骨缺损模型中进行支架移植,分别研究3D打印Ti6Al4V钛合金多孔支架的显微组织和力学性能的关系、细胞生物相容性和细胞粘附和增殖能力,以及其在体内周围骨质的长入情况。
1 实验
1.1 试样制备
委托北京爱康医疗公司以Ti6Al4V钛合金粉为原料,通过电子束熔融技术(Electron beam melting, EBM)制造出钛合金多孔支架,多孔支架的微孔直径参数设置为400 μm,分别打印适用于力学实验及动物体内实验的直径8 mm×10 mm的圆柱和适用于体外细胞实验的直径10 mm×3 mm的圆片两组样品。打印好的钛合金多孔支架经去离子水冲洗、干燥。
1.2 分析方法
1.2.1 微观形貌和物理及力学性能
3D打印后钛合金支架样品的密度采用阿基米德法测定,利用排气法测试样品的开孔率。用Instaon-3369型力学性能测试仪测试多孔支架的抗压强度和剪切强度。将样品置于金属载物台上喷金处理后,利用场发射扫描电镜(Nova400)和配套的能谱仪(IE350PentaFETX-3)观察分析样品的表面及断口形貌,并分析其成分。
1.2.2 生物相容性及骨长入能力
应用SPSS13.0软件进行统计学分析,数据以均 值±标准差(x±s)表示,各组间比较采用单因素方差分析,两样本之间进行t检验,P<0.05有统计学意义(P为统计学差异)。
在健康10周龄家兔髂骨处取骨髓血10 mL,应用Percoll密度梯度离心法分离出单核细胞并在低糖Dulbecco改良的Eagle培养基(LG-DMEM)中培养,培养液含有10%(质量分数)的胎牛血清(FBS)和1%的青霉素-链霉素。4 d后除去非贴壁的细胞,当细胞生长至80%的比例时,用0.25%胰蛋白酶/EDTA在37 ℃下消化贴壁细胞3 min并传代,第三代的骨髓间充质干细胞(Mesenchymal stem cell, BMSCs)供实验使用。
用于细胞实验的钛合金支架经去离子水冲洗、高压蒸汽灭菌后备用。将圆片型钛合金支架置于48孔板中,将原代培养的骨髓间充质干细胞稀释至密度为2×105 mL-1,使用移液器吸取1 mL细胞悬液滴加至支架,3D打印钛合金支架与骨髓间充质干细胞立体联合培养24 h后,用梯度浓度酒精(60%,65%,70%,75%,80%,85%,90%,95%,100%)将培养的标本脱水,将样品置于金属载物台上喷金处理后,用SEM观察3D打印钛合金支架表面的细胞粘附形貌。同时,使用移液器吸取1 mL细胞悬液滴加至支架(作为实验组)和培养皿中(作为对照组),联合培养后24 h,使用移液器将48孔板中培养液吸走,再用Hanks液冲洗后,滴加1 μL 钙黄绿素染色液并置于恒温培养箱中孵育30 min。之后在避光环境下,通过激光共聚焦显微镜下观察细胞染色情况,每组重复3次,从形态学上分析3D打印钛合金支架中的骨髓间充质干细胞。
在分析骨髓间充质干细胞在3D打印钛合金支架上的粘附作用时,将支架置于48孔板中,将培养的骨髓间充质干细胞稀释至密度为2×105 mL-1,使用移液器吸取1 mL细胞悬液滴加至支架(作为实验组)和培养皿中(作为对照组),培养24 h后,用磷酸缓冲盐溶液(Phosphate buffer saline, PBS)轻轻冲洗3次去除未贴壁的细胞,每孔加入CCK-8试剂10 μL,将48孔板放入恒温培养箱继续孵育3 h后,吸取待测孔中培养液(150 μL /孔)转移至96孔板中,用酶标仪在450 nm测定每孔吸光度数值(A)。细胞粘附率Ar为实验组A值与对照组A值的比值,表示为:Ar=(Aexp/Acon)×100%。
在测定骨髓间充质干细胞在3D打印钛合金支架中的增殖能力中,先在3D打印钛合金及48孔板塑料平板与骨髓间充质干细胞立体联合培养后1、7、14 d的3个时间点,使用CCK-8法测定细胞增殖活性。在相应检测时间点每孔加入CCK-8试剂10 μL,将48孔板放入恒温培养箱继续孵育3 h后,吸取待测孔中培养液(150 μL /孔)转移至96孔板中,用酶标仪在450 nm测定每孔吸光度数值(A)。细胞增值率Pr为测量的A值与第一天测量的A值的比值,表示为:Pr= (Adet/Abas)×100%。每组重复3次。
在测试家兔全层骨缺损中的骨长入能力方面,先将家兔(n=6)用3%戊巴比妥钠(50mg/kg)麻醉后,暴露左膝关节、备皮和消毒后沿髌骨沟内侧入路切开皮肤显露关节腔,并将髌骨向外侧半脱位。后使用手钻创造膝关节骨和软骨全层缺损(直径8 mm,深度10 mm),然后将钛合金支架植入缺损处,之后将髌骨复位并逐层缝合关节囊、肌肉和皮肤。手术后让家兔在笼内自由运动,术后3 d内,每天肌肉注射青霉素(1.5 mg/kg)以防止感染。术后第3个月处死实验动物,暴露左膝关节金属支架,拍照记录支架在缺损处的外相。用小动物X线仪分析股骨远端骨质在支架内长入情况。
2 结果与分析
2.1 3D打印钛合金多孔支架的制备
图1(a)和(b)所示分别为3D打印钛合金支架的实物图和扫描电镜图谱(SEM),从图中可以明显看出,试样的表面存在孔隙结构,其孔隙分布均匀,大小基本一致。经SEM观察可以发现,3D打印的钛合金支架中颗粒紧密接触,构成的孔隙结构连通良好,平均直径约为400 μm,与制备参数相符。同时,对图1(b)所示的区域进行了EDS分析,其成分见表1,Ti、Al和V 3种元素的质量分数非常接近名义原料配比。SEM和EDS分析表明获得了成分符合要求的具有多孔结构的钛合金支架,并且在制备过程中基本没有氧化现象发生。采用阿基米德法测定试样的密度为3.25 g/cm3,并根据Ti6Al4V合金的理论密度(4.5 g/cm3),计算相对密度为72.2%。而采用排气法测试样品的开孔率为25.2%,开孔率较好。
表1 钛合金支架扫描区的成分
Table 1 Compositions of scanning area shown in Fig. 1(b) (mass fraction, %)


图1 3D打印Ti6Al4V钛合金多孔支架的形貌
Fig. 1 Morphologies of Ti6Al4V porous scaffolds by 3D printing
2.2 3D打印钛合金多孔支架的力学性能
将打印的实际尺寸为直径7.8 mm×10 mm圆柱形Ti6Al4V合金多孔支架在5kN的拉压试验机上,通过逐渐增加在竖轴方向上的压力,绘制压缩载荷和压缩位移之间的曲线关系,测试速度为1.00 mm/min,其中在曲线中的最大压力值定义为极限抗压值,其结果如图2(a)所示。由图2(a)可见,测试样品到压缩位移约为2.0 mm时,抗压应力达到峰值,为1.32 kN,可换算出极限抗压强度为27.6 MPa,与文献报道的多孔钛合金的抗压强度范围相吻合[10]。另外,3D打印获得的Ti6Al4V合金支架的应力会随着应变的增加而增大,但在实验中,发现试样的变形阻力在弹性形变阶段会随着形变的增大而呈阶梯形增加,这是因为在施压过程中孔隙在逐渐减少。
对实际尺寸为直径7.4 mm×10 mm的样品施加与水平方向呈90°的剪切力,研究纯剪切作用下断裂类型,从侧面定性的分析材料的塑韧性。根据测试结果绘制多孔Ti6Al4V合金支架的剪切载荷与剪切位移关系曲线,如图2(b)所示。由图图2(b)可知,当对材料施加447.36 N时的纯剪切力时,材料的剪切强度达到峰值(10.4 MPa),此时的剪切位移为1.4 mm,随后随着剪切位移的继续增大,剪切强度迅速下降。采用3D打印获得的Ti6Al4V合金支架因其存在多孔结构,极限抗压强度和剪切强度较致密的Ti6Al4V合金的都有所降低,但其力学强度刚好与人体松质骨强度范围相符[11],满足作为人体植入骨的需求。
3D打印获得的Ti6Al4V合金支架经剪切后的断口形貌如图3所示。从图3可以看出,组成3D打印钛合金支架的粉末颗粒的平均粒径约为460 μm,颗粒表面粗糙,经剪切后的样品的孔隙仍为有规则的环形,孔隙平均尺寸约为1520 μm,相比于剪切前试样,其孔隙尺寸明显变大。从断裂方式观察,经剪切后样品的断裂绝大部分为合金颗粒间断裂(见图3(b)),少部分从合金颗粒内部断裂(见图3(c))。

图2 3D打印钛合金多孔支架压缩及剪切载荷与位移变化曲线
Fig. 2 Curves of compressive load-displacement and shear load-displacement of titanium alloy porous scaffolds by 3D printing

图3 钛合金多孔支架经剪切后在不同放大倍率下的断口形貌
Fig. 3 Fracture morphologies of titanium alloy porous scaffolds after shearing at different magnifications
2.3 3D打印钛合金多孔支架的生物相容性
细胞的粘附和增殖实验可以很好地展示支架的生物相容性,图4所示为骨髓间充质干细胞在打印钛合金支架上培养24 h后的SEM像。由图4可以看出,细胞在钛合金支架表面形态规则,贴壁牢固,有少量的伪足伸出贴附于支架表面,表现出良好的生物相容性。据文献报道可知,平均微孔直径为400 μm的钛合金支架具有足够的力学强度,而且与人体松质骨具有类似的孔隙结构,最有利于骨组织长入[12]。在本实验中,EBM打印的Ti6Al4V钛合金多孔支架的孔隙直径与以上研究相似,因此,在到一定程度上可以推断该支架的网格设计有利于骨组织长入。

图4 骨髓间充质干细胞在3D打印钛合金支架上培养24 h后的SEM像
Fig. 4 SEM image of BMSCs on Ti6Al4V porous scaffolds by 3D printing after culture for 24 h
图5所示为骨髓间充质干细胞在48孔塑料平板和钛合金支架上培养24 h后的钙黄绿素染色的SEM像。实验结果表明,在3D打印钛合金支架和平板对照组中均可见多量绿色荧光染色的活细胞,而相对于平板中细胞的平均分布而言,支架组细胞间通过主要支架孔隙相互连接,细胞分布均匀,密度较高,高倍视野可见细胞有伪足伸出,显示出良好的贴壁细胞生长状态,有利于细胞增殖,但支架孔隙中无细胞存在,显示出良好的贴壁细胞生长状态。
图6所示为骨髓间充质干细胞在48孔塑料平板和3D打印钛合金支架上培养24 h细胞粘附的情况,细胞立体培养粘附实验结果表明,培养24 h时,3D打印钛合金支架的细胞粘附能力要低于平板对照组,占56.06%,其原因可能是多孔钛合金支架的孔隙结构不利于细胞的初期粘附。因此,以后的研究可以通过表面修饰增加材料的亲水性来解决粘附率较低的问题。而在增殖实验中(见图7),立体联合培养1、7、14 d时结果显示:随着时间的延长,钛合金支架组中细胞数量增加较快,并在14 d时明显高于平板对照组,这是因为多孔钛支架可以为干细胞的增殖提供立体的生长空间,增加了供细胞贴壁面积,证明3D打印钛合金支架有利于细胞的增殖行为。
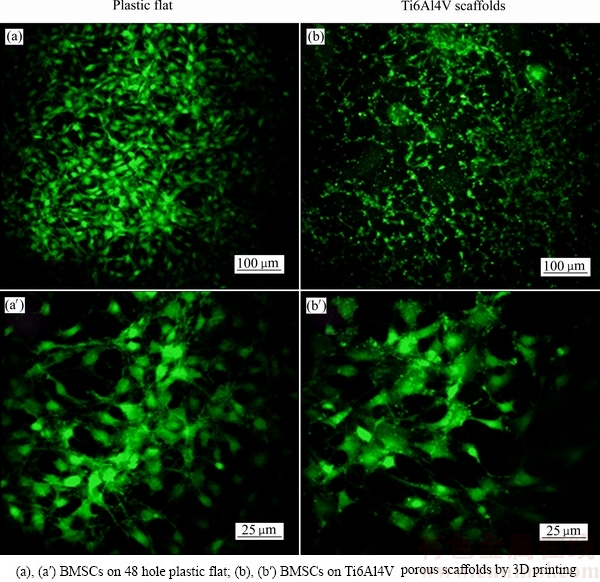
图5 骨髓间充质干细胞在48孔塑料平板和3D打印钛合金支架上培养24 h后的钙黄绿素染色图像
Fig. 5 Calcein dyeing images of BMSCs after culture for 24 h

图6 骨髓间充质干细胞在48孔塑料平板和3D打印钛合金支架上培养24 h细胞粘附的情况(n=3,  , *P<0.05)
, *P<0.05)
Fig. 6 BMSCs adhesion on 48 hole plastic flat and Ti6Al4V porous scaffolds by 3D printing after culture for 24 h (n=3,  , *P<0.05)
, *P<0.05)

图7 骨髓间充质干细胞在48孔塑料平板和3D打印钛合金支架上培养1、7、14 d细胞增殖的情况(n=3,  , *P<0.05)
, *P<0.05)
Fig. 7 BMSCs proliferation on 48 hole plastic flat and Ti6Al4V porous scaffolds by 3D printing after culture for 1 d, 7 d and 14 d (n=3,  , *P<0.05)
, *P<0.05)
体内实验严格按照无菌操作完成,先将家兔膝关节备皮消毒(见图8(a)),沿髌骨内侧纵向切开,并将髌骨推向外侧,暴露髌下关节面(见图8(b)),用直径8 mm的钻头钻孔,直至穿透对侧皮质骨,制备膝关节处骨缺损(见图8(c)),将合金支架缓慢移植于骨缺损中,使之稳定地固定于其中(见图8(d))。手术过程可见支架与缺损匹配良好,有丰富的血运填充于3D打印支架孔隙。支架体内移植3个月后的实验结果表明:支架与周围组织结合牢固,无明显的炎性组织产生(见图9(a)),X线正侧位可见支架孔隙中有高密度组织长入,尤其是支架的周边部位,其与周围骨组织密度相似,表明具有良好的骨长入能力(见图9(b)和(c))。

图8 3D打印钛合金支架在兔股骨远端移植流程图
Fig. 8 Scheme of Ti6Al4V porous scaffold transplantation in rabbit distal femur

图9 3D打印钛合金支架体内移植3个月后外相以及支架在股骨远端的正侧位X线光片
Fig. 9 X-ray images of Ti6Al4V porous scaffolds by 3D printing after transplantation for 3 months
就实验结果看,3D打印Ti6Al4V钛合金在生物相容性方面仍存在其不足,如细胞早期粘附率较低、细胞在孔隙间的增殖较差等。针对以上情况,可以利用非晶化、表面纳米化和微晶化以及表面改性和活化技术,提高其生物相容性和化学稳定性,并改善其综合力学性能,促进其在骨科植入物方面的临床应用[13-15]。
3 结论
1) 3D打印的Ti6Al4V钛合金多孔支架的孔隙分布均匀,大小基本一致,颗粒间紧密接触,构成的孔隙结构连通良好。样品开孔率较好,微孔直径符合制备设定参数。
2) 微孔直径为400 μm左右、孔隙率为25.2%的Ti6Al4V钛合金支架的力学性能受显微结构(主要是孔隙率的影响),具有较适合人体的初始强度,极限抗压强度为27.6 MPa,极限剪切强度为10.4 MPa,符合人体松质骨的力学强度范围。
3) 3D打印多孔钛合金支架具有良好的细胞生物相容性,多孔支架中的立体网格结构为细胞提供生长空间,增加了骨髓间充质干细胞的增殖能力。此外,多孔支架有利于干细胞和成骨细胞的体内扩增,可以促进钛合金支架微孔中骨组织长入的速度。
REFERENCES
[1] FRYDMAN A, SIMONIAN K. Review of models for titanium as a foreign body[J]. J Calif Dent Assoc, 2014, 42(12): 829-833.
[2] 金和喜, 魏克湘, 李建明, 周建宇, 彭文静. 航空用钛合金研究进展[J]. 中国有色金属学报, 2015, 25(2): 280-292.
JIN He-xi, WEI Ke-xiang, LI Jian-ming, ZHOU Jian-yu, PENG Wen-jing. Research development of titanium alloy in aerospace industry[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(2): 280-292.
[3] AMER M A,  P A, RENOU S J, GUGLIELMOTTI M B. Use of human fascia lata in rat calvarial bone defects[J]. Acta Odontol Latinoam, 2015, 28(3): 231-235.
P A, RENOU S J, GUGLIELMOTTI M B. Use of human fascia lata in rat calvarial bone defects[J]. Acta Odontol Latinoam, 2015, 28(3): 231-235.
[4] KOKUBO T, YAMAGUCHI S. Suppl 1-M2: Bioactive titanate layers formed on titanium and its alloys by simple chemical and heat treatments[J]. Open Biomedical Engineering Journal, 2015, 9(Suppl 1): 29-41.
[5] CHIKARAKARA E, FITZPATRICK P, MOORE E, LEVINGSTONE T, HIGGINBOTHAM C. In vitro fibroblast and pre-osteoblastic cellular responses on laser surface modified Ti-6Al-4V[J]. Biomed Mater, 2015, 10(1): 015007.
[6] HRABE N W, HEINL P, BORDIA R K,  C, FERNANDES R J. Maintenance of a bone collagen phenotype by osteoblast-like cells in 3D periodic porous titanium (Ti-6Al-4V) structures fabricated by selective electron beam melting[J]. Connect Tissue Res, 2013, 54(6): 351-360.
C, FERNANDES R J. Maintenance of a bone collagen phenotype by osteoblast-like cells in 3D periodic porous titanium (Ti-6Al-4V) structures fabricated by selective electron beam melting[J]. Connect Tissue Res, 2013, 54(6): 351-360.
[7] 陈良建, 张思慧, 李益民, 崔晓明, 郑 遥, 李 挺. 改性后不同孔隙度多孔钛对成骨细胞的影响[J]. 中国有色金属学报, 2010, 20(4): 749-755.
CHEN Liang-jian, ZHANG Si-hui, LI Yi-min, CUI Xiao-ming, ZHENG Yao, LI Ting. Effect of porosity of modified porous titanium on osteoblastic cells[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(4): 749-755.
[8] BALLA V K, BANERJEE S, BOSE S, BANDYOPADHYAY A. Direct laser processing of a tantalum coating on titanium for bone replacement structures[J]. Acta Biomater, 2010, 6(6): 2329-2334.
[9] 卢秉恒, 李涤尘. 增材制造(3D打印)技术发展[J]. 机械制造与自动化, 2013, 42(4): 1-4.
Lu Bing-heng, Li Di-chen. Development of the additive manufacturing (3D printing) technology[J]. Machine Building and Automation, 2013, 42(4): 1-4.
[10] 喻 岚, 李益民, 邓忠勇, 李笃信. 采用氢化钛粉制备Ti-6Al-4V合金[J]. 湖南冶金, 2004, 32(5): 17-19.
YU Lan, LI Yi-ming, DENG Zhong-yong, LI Du-xing, Preparation of Ti-6Al-4V alloy by powder metallurgy using titanium hydride powder[J]. Hunan Metallurgy, 2004, 32(5): 17-19.
[11] 王春晓, 李 祥, 罗 云. 多孔钛合金支架结构设计及其抗压强度分析[J]. 上海交通大学学报, 2016, 50(2): 165-168.
WANG Chun-xiao, LI Xiang, LUO Yun. Design and strength analysis of porous titanium scaffold[J]. Journal of Shanghai Jiaotong University, 2016, 50(2): 165-168.
[12] XU J, WENG X J, WANG X, HUANG J Z, ZHANG C, MUHAMMAD H. Potential use of porous titanium-niobium alloy in orthopedic implants: Preparation and experimental study of its biocompatibility in vitro[J]. PLoS One, 2013, 8(11): e79289.
[13] CHENG A, HUMAYUN A, COHEN D J, BOYAN B D, SCHWARTZ Z. Additively manufactured 3D porous Ti-6Al-4V constructs mimic trabecular bone structure and regulate osteoblast proliferation, differentiation and local factor production in a porosity and surface roughness dependent manner[J]. Biofabrication, 2014, 6(4): 045007.
[14] 缪卫东, 陈 桂, 袁志山, 朱 明. 我国生物钛合金功能材料发展现状及趋势[J]. 新材料产业, 2013, 2(2): 7-11.
MIU Wei-dong, CHENG Gui, YUAN Zhi-shan, ZHU Ming. Present situation and trend of the biological function development of titanium alloy materials[J]. Advanced Materials Industry, 2013, 2(2): 7-11.
[15] KRISHNA B V, BOSE S, BANDYOPADHYAY A. Low stiffness porous Ti structures for load-bearing implants[J]. Acta Biomater, 2007, 3(6): 997-1006.
Mechanical properties and biocompatibility of 3D printing Ti6Al4V titanium alloy scaffolds
LIU Chang1, WANG Chen-yu2, LIU He2, WANG Zhong-han2, LIN Gao-yong1
(1. School of Materials Science and Engineering, Key Laboratory of Nonferrous Metal Materials Science and Engineering, Ministry of Education, Central South University, Changsha 410083, China;
2. Department of Orthopedics, The Second Hospital, Jilin University, Changchun 130041, China)
Abstract: Taking titanium alloy Ti6Al4V porous scaffolds by 3D printing as research object, the relationship between the microstructure characteristics and the mechanical properties was preliminarily investigated. Moreover, the bone marrow mesenchymal stem cells were used to investigate the biological compatibility, and the in vivo bone ingrowth ability of the Ti6Al4V porous scaffolds in a rabbit full-thickness bone defect model was detected. The results show that the mechanical properties of Ti6Al4V porous scaffolds prepared by 3D printing are affected by the porous microstructures with the incipient intensity that is suitable for human body. The Ti6Al4V porous scaffolds also have good biocompatibility and absorbability. The detailed grid structure in Ti6Al4V porous scaffolds provides a unique space for cells to grow, which can increase the proliferative ability of the bone marrow mesenchymal stem cells, and promote the ingrowth speed of the surrounding bone tissue in prosthetic microporous.
Key words: Ti6Al4V porous scaffold; 3D printing; mechanical property; bone marrow mesenchymal stem cell; bone ingrowth; biocompatibility
Foundation item: Project(81671804) supported by the National Natural Science Foundation of China; Projects (20160101109JC, 20150414006GH, 20150312028ZG, 20130206060GX) supported by the Natural Science Foundation of Jilin Province, China
Received date: 2017-01-13; Accepted date: 2017-04-03
Corresponding author: LIN Gao-yong; Tel: +86-731-88879341; E-mail: gylin6609@csu.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(81671804);吉林省自然科学基金资助项目(20160101109JC,20150414006GH,20150312028ZG,20130206060GX)
收稿日期:2017-01-13;修订日期:2017-04-03
通信作者:林高用,教授,博士;电话:0731-88879341;E-mail: gylin6609@csu.edu.cn