文章编号:1004-0609(2008)S1-0096-05
硫酸盐还原菌对不同碳源的利用率
曹俊雅1,张广积1, 2,毛在砂1,方兆珩1,杨 超1, 2
1. 中国科学 院过程工程研究所,绿色过程与工程重点实验室,北京 100190
2. 中国科学院 过程工程研究所,生化工程国家重点实验室,北京 100190
摘 要:考察低分子有机酸、醇类、挥发性脂肪酸盐和糖类等作为SRB碳源时对硫酸盐去除效果的影响。结果表明:在不同碳源培养基中,SRB的生长速率存在明显差异,SRB对于碳源的利用率由大到小依次为:低分子有机酸、挥发性脂肪酸盐、醇类、糖类;综合硫酸根去除效果和操作成本,价廉的甲酸可作为硫酸盐还原菌生物还原工艺的首选碳源,硫酸盐去除率可高达97%。
关键词:硫酸盐还原菌; 碳源;硫酸盐;去除率
中图分类号:Q 89 文献标识码:A
Availability of sulfate reducing bacteria on carbon sources
CAO Jun-ya1, ZHANG Guang-ji1, 2, MAO Zai-sha1, FANG Zhao-heng1, YANG Chao1, 2
(1. Key Laboratory of Green Process and Engineering, Institute of Processing Engineering, Chinese Academy of Sciences, Beijing 100190, China)
(2. National Key Laboratory of Biochemical Engineering, Institute of Processing Engineering, Chinese Academy of Sciences, Beijing100190, China)
Abstract: The influence of various carbon sources on the growth and activity of SRB was studied, including low molecular mass organic acids, alcohols, volatile fatty acid salts and carbohydrates. The results show that sulfate reducing activity decreases in the order of low molecular mass organic acids, volatile fatty acid salts, alcohols and carbohydrates. Considering the removal rate of sulfate and the running cost, formic acid was top priority as the carbon source in the experiments, and the removal rate of sulfate with it reaches 97%.
Key words: sulfate reducing bacteria(SRB); carbon sources; sulfate; removal rate
细菌堆浸已成功地应用于低品位次生硫化铜矿的浸出[1],但实现其他矿物的生物堆浸还需要解决若干关键技术问题。其中一个主要问题是如何从生物堆浸获得的高杂质浓度浸出液中,经济有效地分离出有价金属。采用萃取或离子交换树脂提取工艺存在技术难度大和操作费用高的问题[2-3],严重阻碍了生物堆浸工艺的推广应用。硫化氢沉淀法是从低浓度溶液中富集和提取有价金属的重要手段之一[4],但由于硫化氢是有毒气体,操作条件苛刻。而采用微生物方法,利用硫酸盐还原菌(Sulfate reducing bacteria, SRB)还原硫酸盐的方法来产生硫化氢是一种很有潜力的替代方法。
近年来,用SRB微生物法已受到国内外部分学者的广泛关注,但主要是研究如何处理含硫酸盐废水特别是酸性矿山废水[5-6],而对处理生物冶金浸出液的研究相当匮乏。碳源作为SRB生长的能源和电子供体,是影响SRB生长的限制因子,也是影响硫酸盐生物还原工艺的一个重要经济因素。然而,关于这方面的系统研究较少。因此,本文作者研究考察了低分子有机酸、醇类、挥发性脂肪酸盐、糖类等作为SRB碳源时对硫酸盐的去除效果的影响,从而为SRB还原工艺提供必要的基础数据。
1 实验
1.1 菌种
实验中SRB混合菌种从污泥中筛选得到,经定向驯化培育和固定化培养,获得可以在pH值为7左右高效还原 的硫酸盐还原菌菌种[7]。
的硫酸盐还原菌菌种[7]。
1.2 培养基
所用的培养基为略加改动的Postgate B 培养基[8],其成分(g/L)为:KH2PO4 0.5, NH4Cl 1.0, CaSO4 1.0, 乳酸钠C3H5O3Na 3.5, MgSO4·7H2O 2.0, 酵母浸膏粉 1.0, 抗坏血酸C6H8O6 0.1, 巯基乙酸C2H4O2S 0.1, K2SO4 1.6。
1.3 实验方法
采用250 mL的具塞三角瓶进行考察碳源利用率的硫酸盐还原实验,内部填充聚氨酯泡沫作为SRB的固定化载体。分别考察低分子有机酸、醇类、挥发性脂肪酸盐、糖类等作为SRB碳源时的利用率以及硫酸盐的去除效果。碳源实验的培养基按照化学需氧量(Chemical Oxygen Demand,COD)一致的原则将Postgate B培养基中的乳酸钠换算成对应量的碳源即可,其它成分不变,用NaOH将培养基的pH值调至7.0。实验中分别添加180 mL培养基,接种20 mL富集的SRB菌液,35 ℃恒温培养,定时取样分析。
1.4 分析项目及方法
分析项目包括pH值、氧化还原电位(Oxidation reduction potential,ORP)、 浓度、挥发性脂肪酸(Volatile fatty acid,VFA)浓度。pH值和ORP用pH计(上海雷磁公司PHS-3E)测定。
浓度、挥发性脂肪酸(Volatile fatty acid,VFA)浓度。pH值和ORP用pH计(上海雷磁公司PHS-3E)测定。 浓度采用硫酸钡比浊法[9]测定,在420 nm下测量吸光度(美国LabTech, UV 2000)。VFA用高效液相色谱(美国Agilent 1100)测定[10]。
浓度采用硫酸钡比浊法[9]测定,在420 nm下测量吸光度(美国LabTech, UV 2000)。VFA用高效液相色谱(美国Agilent 1100)测定[10]。
2 结果与讨论
2.1 低分子有机酸作为SRB碳源
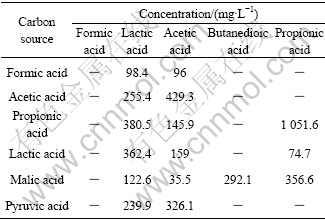
分别考察甲酸、乙酸、丙酸、乳酸、苹果酸和丙酮酸作为SRB碳源时的硫酸盐还原效果,实验结果如图1所示。一周后取样分析各体系的VFA含量,结果如表1所示。从图1中可以看出,甲酸作为碳源时,体系的pH值逐渐升高至8.5左右,SRB利用甲酸每还原1 mol的硫酸根就会产生4 mol的碳酸氢根,从而导致体系的pH值升高。与甲酸相反,丙酮酸体系的pH值呈现降低趋势,其余4种有机酸体系的pH值变化趋势基本一致,在7左右波动。12 h时甲酸基质中硫酸根的还原率达到74%,其余5种基质碳源体系的硫酸根还原率分别为60%、56%、65%、57%和47%。以上结果表明,不同低分子有机酸作碳源对SRB硫酸盐去除效率影响较大;分子量低的甲酸能够优先被SRB利用,其次是含有羟基或羰基不饱和支链的有机酸。乳酸或苹果酸作为碳源对SRB去除硫酸盐效果差别较小,可能是因为它们都属于羟基酸,化学结构类似。SRB对乙酸的利用率较低,有研究表明SRB不易利用乙酸,即使在硫酸盐过量的情况下也不能完全利用乙酸[11],而且乙酸在非离解状态下对SRB有一定的毒害作用[12]。由表1结果发现,以丙酸为碳源基质的体系丙酸含量较高,大量积累,而乙酸的含量不高,这意味着SRB对丙酸的不完全氧化很快失效,由于丙酸体系SRB对硫化物很敏感,起始产生的硫化物很快抑制SRB的活性导致丙酸积累,使得整个过程恶化。由于实验采用的SRB混合菌种以乳酸钠为碳源培养,乳酸钠水解产生乳酸,再降解为丙酸、乙酸,出于快速利用基质和储存能量的目的,使得利用这些挥发性脂肪酸的一类SRB迅速繁殖起来,成为优势种群。但由于乳酸降解的限速步骤是丙酸向乙酸的转化,因此,乳酸为碳源时,SRB对硫酸盐的还原效果比甲酸稍弱。
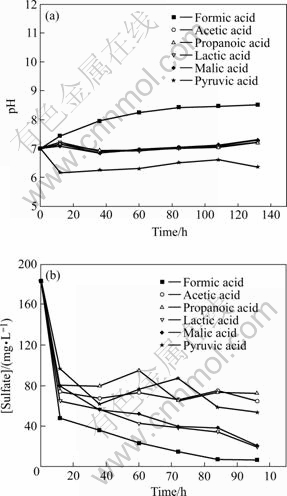
图1 低分子有机酸作为SRB碳源时各体系相关参数的变化
Fig.1 Variations of analytical objects at simple organic acids as carbon sources with time during batch culture: (a) pH; (b) Concentration of sulfate
表1 各体系内挥发性脂肪酸含量
Table 1 Testing results of concentration of volatile fatty acids
2.2 醇类作为SRB碳源
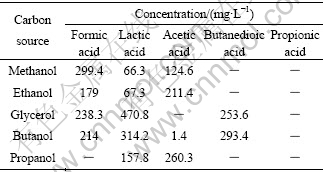
分别考察甲醇、乙醇、丙醇、丙三醇、正丁醇作为SRB碳源时的硫酸盐还原效果。定时取上层清液测定分析项目,结果如图2所示。一周后取样分析各体系的挥发性脂肪酸含量,结果见表2。从图2中可以看出,甲醇、乙醇和正丁醇作为碳源时,体系的pH值变化趋势基本相同,在7.0~7.5之间波动;丙三醇体系中的pH值呈下降趋势,在6.0~6.5之间变化。丙醇体系在前80 h内pH值一直下降,是由于丙醇初期降解产生的酸含量较高所致;随后升高与甲、乙、正丁醇体系的pH值基本吻合。从硫酸根的去除效果来看,接种12 h时几乎所有基质碳源体系中50%左右的硫酸根被还原。SRB利用醇类作为碳源对硫酸根还原率由大到小的顺序依次为:丙醇(87%)>正丁醇(76%)>乙醇(70%)>甲醇(62%)>丙三醇(61%)。由于甲醇价格便宜,而且可以直接被SRB利用,因此,将其作为电子供体受到广大学者[13-15]的关注;但是其它厌氧菌种也可以直接或间接利用甲醇,因此,甲醇在厌氧反应器中的利用率取决于产甲烷菌、硫酸盐还原菌和同型乙酸菌的竞争作用。对于甲醇基质来说,SRB无法与产甲烷菌竞争,硫酸盐还原菌利用甲醇的速率较低[16]。重碳酸盐存在的情况下,同型产乙酸菌可将甲醇转化为乙酸根,可由表2结果验证。乙醇也是一种可被SRB利用的电子供体,利用乙醇的一个缺点是SRB利用其生长速率比较低;与其它电子供体类似,用乙醇会产生乙酸导致出口COD浓度升高。对于结构复杂的丙三醇,SRB的利用率相对较低,是因为在存在复杂的碳源或者基质充分的情况下,SRB的热力字和动力学优势并不显著,往往缺乏对碳源的竞争力。
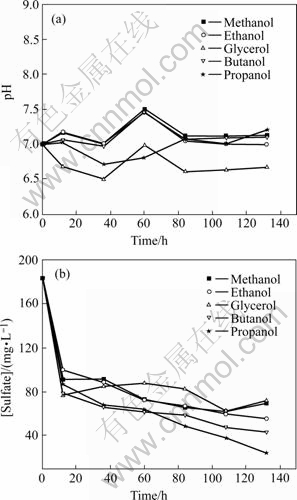
图2 醇类作为SRB碳源时各体系相关参数的变化
Fig.2 Variations of analytical objects at different alcohols as carbon sources with time during batch culture: (a) pH;(b) Concentration of sulfate
表2 各体系内挥发性脂肪酸含量
Table 2 Testing results of concentrations of volatile fatty acids
2.3 挥发性脂肪酸盐作为SRB碳源
分别考察甲酸钠、乙酸钠、丙酸钠、乳酸钠作为SRB碳源时的硫酸盐还原效果。定时取上层清液测定分析项目,结果如图3所示。易见,乙酸钠、乳酸钠、丙酸钠作为碳源时,体系的pH值变化趋势较为接近,接种24 h内小幅度下降,此后缓慢上升;与此相反,甲酸钠体系中的pH值在接种24 h内先明显增高,此后变化趋势同丙酸钠。从硫酸根的去除效果来看,接种24 h时几乎所有基质碳源体系中60%左右的硫酸根被还原。SRB利用挥发性脂肪酸盐作为碳源对硫酸根还原率的由大至小依次为:乳酸钠(86%)、甲酸钠(84%)、丙酸钠(83.5%)、乙酸钠(66%)。乳酸钠作为碳源效果最好,这与POSTGATE等很多学者的研究结果一致[12]。该结果与2.1节中采用甲酸钠、乳酸钠或者丙酸钠作为碳源时,SRB去除硫酸盐的速率相似,而对乙酸钠的利用率较低;可能是由于乙酸钠体系产生的乙酸含量较高,对SRB产生一定的毒害作用,在与其它厌氧菌种竞争时已不是优势菌种所致。与前面低分子有机酸相比,由于有效成分含量的不同,从而体系内代谢途径、细菌种群竞争能力不同,因此,结果有所差异。

图3 挥发性脂肪酸盐作为SRB碳源时各体系相关参数的变化
Fig.3 Variations of analytical objects at volatile fatty acid salts as carbon sources with time during batch culture: (a) pH; (b) Concentration of sulfate
2.4 糖类作为SRB碳源
分别考察葡萄糖、蔗糖作为SRB碳源时的硫酸盐还原效果,结果如图4所示。由图4可见,葡萄糖、蔗糖作为碳源时,体系的pH值变化趋势类似,蔗糖体系的pH值变化幅度较大,两体系中pH值的变化都是先下降,在60 h时小幅度增高,这与2.2节结果类似,此后基本不变。与前面实验结果相比,硫酸根的去除速率大大降低;此后,蔗糖体系的硫酸根浓度基本不变,实验结束时硫酸根的去除率仅为53%。蔗糖作为硫酸盐还原的电子供体,首先被厌氧发酵产生乳酸,再被SRB作为电子供体和碳源利用。蔗糖的一个缺点是产酸发酵过程产物的积聚会降低生物量的活性从而导致出口有较高的剩余COD浓度,会影响硫酸盐还原的效果。图4中所示的糖类作为SRB碳源时,各体子相关子数的变化蔗糖体系中SRB的活性低,对硫酸根的还原去除主要集中在接种后12 h以内,前12 h内去除硫酸根效率较高,与葡萄糖体系基本相同,此后SRB基本不起作用,可能是由于蔗糖发酵代谢过程中产生了高浓度的有机酸,对SRB的生长有抑制作用,使得SRB在与其他厌氧菌种的基质竞争中处于劣势。
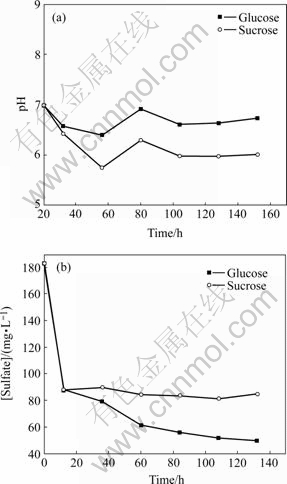
图4 糖类作为SRB碳源时各体系相关参数的变化
Fig.4 Variations of analytical objects at saccharine as carbon sources with time during batch culture: (a) pH; (b) Concentration of sulfate
3 结论
1) 由大到小SRB对碳源的利用有较强的选择性,对碳源的利用率依次为:低分子有机酸、挥发性脂肪酸盐、醇类、糖类。
2) 对于低分子量有机酸,甲酸能够优先被SRB利用,其次是含有羟基或羰基不饱和支链的有机酸;对于醇类,厌氧菌种的竞争对硫酸盐去除影响较大;对于糖类基质,前期的产酸发酵过程对SRB硫酸盐还原不利,整体去除效果不好。
3) 甲酸是较优的碳源选择,SRB活性高,SO42-的最终去除率可高达97%,且操作成本低,具有较高的经济效益。
REFERENCES
[1] EHRLICH H L. Past, present and future of biohydrometallurgy [J]. Hydrometallurgy, 2001, 59(2/3): 127-134.
[2] PINTO D V B S, MARTINS A H. Electrochemical elution of a cation-exchange polymeric resin for yttrium and rare earth recovery using a statistical approach [J]. Hydrometallurgy, 2001, 60(1): 99-104.
[3] MURESAN L, MAURIN G, ONICIU L, AVRAM S. Effects of additives on zinc electrowinning from industrial waste products [J]. Hydrometallurgy, 1996, 40(3): 335-342.
[4] BHATTACHARYYA D, JUMAWAN A B, SUN G, SUND-HAGELBERG C, SCHWITZGEBEL K. Precipitation of heavy metals with sodium sulfide: Bench-scale and full-scale experimental results [J]. AIChE Symposium Series, 1981, 77(209): 31-38.
[5] FOUCHER S, BATTAGLIA B F, IGNATIADIS I, MORIN D. Treatment by sulfate-reducing bacteria of cheesy acid-mine drainage and metals recovery [J]. Chemical Engineering Science, 2001, 56(4): 1639-1645.
[6] GARCIA C, MORENO D A, BALLESTER A, BLAZQUEZ M L, GONZALEZ F. Bioremediation of an industrial acid mine water by metal-tolerant sulphate-reducing bacteria [J]. Minerals Engineering, 2001, 14(9): 997-1008.
[7] 曹俊雅, 张广积, 毛在砂, 方兆珩, 韩宝玲. 硫酸盐还原菌的固定化[J]. 过程工程学报, 2007, 7(5): 1009-1013.
CAO Jun-ya, ZHANG Guang-ji, MAO Zai-sha, FANG Zhao-heng, HAN Bao-ling. Immobilization of sulfate reducing bacteria[J]. The Chinese Journal of Process Engineering, 2007, 7(5): 1009-1013.
[8] POSTGATE J R. The sulphate reducing bacteria [M]. Cambridge, England: Cambridge University Press, 1984: 21-28.
[9] KOLMERT A, WIKSTROM P, HALLBERG K B. A fast and simple turbidimetric method for the determination of sulfate in sulfate-reducing bacterial cultures [J]. Journal of Microbiological Methods, 2000, 41(3): 179-184.
[10] 刘晨明, 曹宏斌, 曹俊雅, 李玉平, 张 懿. 梯度洗脱高效液相色谱法快速检测厌氧菌代谢物中的有机酸[J]. 分析化学, 2006, 34(9): 1231-1234.
LIU Chen-ming, CAO Hong-bin, CAO Jun-ya, LI Yu-ping, ZHANG Yi. Fast Detection of Organic Acid in Anaerobe Medium with Gradient Elution-High Performance Liquid Chromatography [J]. Chinese Journal of Analytical Chemistry, 2006, 34(9): 1231-1234.
[11] LENS P, VALLERO M, ESPOSITO G, ZANDVOORT M. Perspectives of sulfate reducing bioreactors in environmental biotechnology [J]. Reviews in Environmental Science and Biotechnology, 2002, 1(4): 311-325.
[12] KOLMERT A, JOHNSON D B. Remediation of acidic waste waters using immobilised, acidophilic sulfate-reducing bacteria [J]. Journal of Chemical Technology & Biotechnology, 2001, 76(8): 836-843.
[13] TSUKAMOTO T K, MILLER G C. Methanol as a carbon source for microbiological treatment of acid mine drainage [J]. Water Research, 1999, 33(6): 1365-1370.
[14] WEIJMA J, CHI T M, HULSHOFF POL L W, STAMS A J M, LETTINGA G. The effect of sulphate on methanol conversion in mesophilic upflow anaerobic sludge bed reactors[J]. Process Biochemistry, 2003, 38(9): 1259-1266.
[15] GLOMBITZA F. Treatment of acid lignite mine flooding water by means of microbial sulfate reduction [J]. Waste Management, 2001, 21(2): 197-203.
[16] LIAMLEAM W, ANNACHHATRE A P. Electron donors for biological sulfate reduction [J]. Biotechnology Advances, 2007, 25(5): 452-463.
基金项目:国家重点基础研究发展计划资助项目(2004CB619203);国家自然科学基金资助项目(50404009, 50574081, 20590206)
通讯作者:张广积,副研究员;电话:010-62554558;E-mail: gjzhang@home.ipe.ac.cn
(编辑 龙怀中)