文章编号:1004-0609(2008)S1-0230-06
MgCO3·3H2O晶体生长及晶形的影响因素
程文婷,李志宝,柯家骏
(中国科学院 过程工程研究所 绿色过程工程实验室,北京 100080)
摘 要:提出一种新的反应结晶过程,即采用Na2CO3溶液为沉淀剂,选择合适条件与MgCl2溶液进行均相(不加晶种)结晶反应,实现从卤水中沉淀镁,制得MgCO3·3H2O晶体。研究温度、反应液初始浓度及滴加速率对MgCO3·3H2O晶体生长及晶形的影响,采用XRD和SEM对得到的晶体进行表征。结果表明:MgCO3·3H2O晶体的收率为98.1%,纯度为99.9%,所得到的晶体为MgCO3·3H2O,且温度、反应液初始浓度及滴加速率对MgCO3·3H2O晶体的生长、形态及颗粒大小都有着显著的影响。
关键词:MgCO3·3H2O;晶体生长;沉淀剂
中图分类号:TQ 132.2 文献标识码:A
Effect factors of crystal growth and morphology of MgCO3·3H2O
CHENG Wen-ting, LI Zhi-bao, KE Jia-jun
(Laboratory of Green Process and Engineering, Institute of Process Engineering, Chinese Academy of Sciences,Beijing 100080, China)
Abstract: MgCO3·3H2O was selected as target precipitate in extraction of magnesium from brine due to its good filtration properties and its excellent dewatering characteristics. A novel homogeneous (unseeded) precipitation of MgCO3·3H2O by the reaction of MgCl2 with Na2CO3 in supersaturated solutions was investigated for the precipitation of magnesium from brine. The factors influenced the crystal growth and morphology of MgCO3·3H2O, such as reaction temperature, initial concentration and titration speed were studied. The results show that the yield of MgCO3·3H2O is 98.1% and the purity of MgCO3·3H2O is 99.91%. MgCO3?3H2O as prepared were characterized by X-ray diffraction(XRD) and scanning electron microscope(SEM). The results show that the product is club-shaped MgCO3·3H2O and the temperature, initial concentration and titration speed all have significant effect on the crystal growth, crystal morphology and particle size distribution.
Key words: MgCO3·3H2O; crystal growth; precipitate
盐湖卤水中含有大量的化合物[1],例如MgCl2、NaCl、KCl、LiCl 以及其它一些氯化物。MgCl2在工业上有着广泛的应用,它是生产MgO、Mg(OH)2和金属镁的原材料。青海钾肥各厂每年总共排出的水氯镁石(MgCl2)达2000万t,这不仅造成镁资源的巨大浪费,还给盐湖的生态平衡造成了严重破坏。1 000 L MgCl2饱和卤水能生产107 kg金属镁。因此,从卤水中提取镁已经成为生产金属镁的一个重要途径。国内外研究从卤水中提取镁的主要方法为[2-6]:沉淀法、溶剂萃取法、离子筛吸附法和煅烧法等。一种镁化合物——MgCO3·3H2O[7](nesquehonite)因其具有良好的过滤性和脱水性,被选作从卤水中沉淀镁的最终沉淀物。本文作者提出一种新的反应结晶过程,即以Na2CO3溶液为沉淀剂与MgCl2溶液反应,控制反应条件选择性地生成MgCO3·3H2O结晶沉淀。MgCO3·3H2O在较高温度的情况下很容易转化为碱式碳酸镁(Mg5(CO3)4(OH)2·4H2O)[8]。碱式碳酸镁作为一种重要的无机化工产品,应用前景十分广阔[9]。MgCO3·3H2O还可作为制备高纯MgO的原料[10-12]。
针对镁的沉淀,国内外已经做了大量的研究工作,提出了不同的工艺路线。例如MITSUHASHI等[13]利用CO2的碳酸化作用与Mg(OH)2水溶液反应生成针状的MgCO3·3H2O晶体。KLOPROGGE等[14]指出反应温度、搅拌时间和陈化时间等反应条件影响MgCO3·3H2O晶体的生长,可得到两种不同形态的MgCO3·3H2O晶体,一种为多层的薄片状,另一种为形态规则的针状。ZHANG等[15-16]利用K2CO3溶液与Mg(NO3)2溶液反应,指出反应温度和pH值对晶体的生长有很大影响,得到了不同形状的MgCO3·xH2O晶体和Mg5(CO3)4(OH)2·4H2O晶体。WANG等[8]将(NH4)2CO3溶液滴加到相同浓度的MgCl2溶液中,系统研究了反应温度、反应液初始浓度、滴加速率和陈化时间对所得晶体MgCO3·3H2O晶形的影响。本文作者研究了温度、反应液初始浓度及Na2CO3溶液的滴加速率对MgCO3·3H2O晶体生长及其晶形的影响,制备出晶形良好的针状MgCO3·3H2O晶体,为沉淀镁的工作打下了基础。
1 实验
1.1 实验原料
无水Na2CO3 ,分析纯,含量不小于98%(北京北化精细化学品有限责任公司);MgCl2·6H2O,分析纯,含量不小于99.8%(北京北化精细化学品有限责任公司);去离子二次蒸馏水(电导率小于0.1 μS/cm)。
1.2 实验方法
用天平称取一定质量配比的无水Na2CO3和MgCl2·6H2O,分别加蒸馏水后配置成相同浓度的Na2CO3溶液和MgCl2溶液。取配好的MgCl2溶液200 mL置于体积为500 mL的三口烧瓶中,三口烧瓶置于水槽中,将嵌入式加热器打开,升温至反应温度。取Na2CO3溶液200 mL,加热至反应温度后置于恒压漏斗中。将搅拌器调到一定转速,在搅拌的同时调节恒压漏斗的活塞,将Na2CO3溶液以一定的速率滴入到MgCl2溶液中。滴加完毕后继续搅拌进行陈化,大约3 h后将母液过滤并将滤饼用蒸馏水洗涤3次。最后将洗涤后的滤饼放入323 K烘箱干燥10 h后取出,即得晶体。
1.3 实验装置
本实验装置图如图1所示。

图1 结晶装置图
Fig.1 Schematic diagram of experimental set-up used in precipitation process: 1—Thermostatic heater; 2—Standardized burette; 3—Stirrer; 4—pH meter; 5—Three-necked flask; 6—Sink
2 结果与讨论
2.1 反应条件对晶体生长及晶形的影响
2.1.1 反应温度对晶体生长的影响
取初始浓度为0.1 mol/L的Na2CO3溶液与MgCl2溶液各200 mL,分别在283.2、293.2、303.2和313.2 K的温度条件下进行反应。在Na2CO3溶液滴加到MgCl2溶液的反应过程中,每隔一段时间用移液管取一定体积的反应液,过滤后用一定浓度的EDTA标准溶液滴定其中的Mg2+含量,结果如图2所示。由图2可看出,随着温度的升高,最终溶液中c(Mg2+)降低,达到恒定所需的时间减少;在滴加时间相同的条件下,313.2 K时,溶液中c(Mg2+)降低到最低。这是由于温度越高,反应速率越快,反应所需的时间越短,反应也就越完全。随着反应液初始浓度的升高,最终溶液中的c(Mg2+)也相应升高。
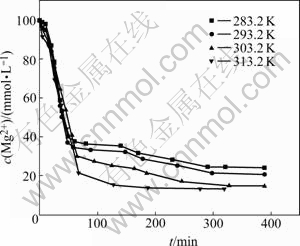
图2 不同反应温度下c(Mg2+)随时间的变化
Fig.2 Variety of c(Mg2+) with time at different temperatures
2.1.2 反应温度对晶形的影响
对反应液初始浓度为0.5 mol/L,反应温度分别为283.2和313.2 K反应条件下制得的晶体分别进行SEM分析,结果如图3所示。由图3可看出,MgCO3·3H2O晶体均为针状;在313.2 K时,晶体尺寸比较均一且表面光滑;在283.2 K时,晶体尺寸不规则,晶体表面附着一些微小的针状及片状颗粒。

图3 反应温度对MgCO3·3H2O晶形的影响
Fig.3 Effects of different temperatures on morphology of MgCO3·3H2O: (a) 283.2 K; (b) 313.2 K
2.1.3 反应液初始浓度对晶体生长的影响
取相同初始浓度的Na2CO3溶液与MgCl2溶液(0.1、0.5、1 mol/L)各200 mL,在313.2 K的反应温度条件下进行反应。分析测试方法同2.1.1节。结果如图4所示。由图4可看出,当反应液初始浓度为0.5 mol/L时,最终溶液中c(Mg2+)降得最低,说明这时反应是最完全的。
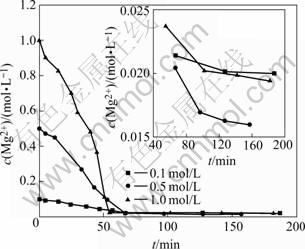
图4 不同反应液初始浓度时c(Mg2+)随时间的变化
Fig.4 Variety of c(Mg2+) with time at different initial MgCl2 concentrations
2.1.4 反应液初始浓度对晶形的影响
在313.2 K时,对不同反应液初始浓度(0.1、0.5、1 mol/L)下制得的MgCO3·3H2O晶体进行SEM分析,结果如图5所示。由图5可看出,当反应液初始浓度为0.1 mol/L时,晶体尺寸不均一,且表面附着许多细小的不规则颗粒;当反应液初始浓度为0.5 mol/L时,晶体尺寸比较均一,且表面光滑;当反应液初始浓度为1 mol/L时,晶体尺寸也比较规则,但在晶体表面附着一些片状的细小颗粒。因此,选择反应液初始浓度为0.5 mol/L是比较合适的。

图5 反应液初始浓度对MgCO3·3H2O晶形的影响
Fig.5 Effects of initial MgCl2 concentrations on morphology of MgCO3·3H2O: (a) 0.1 mol/L; (b) 0.5 mol/L; (c) 1 mol/L
2.1.5 滴加速率对晶体生长的影响
在313.2 K时,取初始浓度为0.5 mol/L的Na2CO3溶液与MgCl2溶液各200 mL,将Na2CO3溶液分别以1.4、3.3和6.7 mL/min的速率滴加到MgCl2溶液中。分析测试方法同2.1.1节。结果如图6所示。由图6可看出,滴加速率越慢,最终溶液中Mg2+的浓度降得越低,反应越完全。
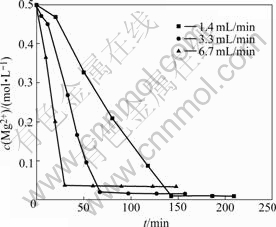
图6 不同滴加速率下c(Mg2+)随时间的变化
Fig.6 Variety of c(Mg2+) with time at different titration speeds
2.1.6 滴加速率对晶形的影响
在温度为313.2 K,反应液初始浓度为0.5 mol/L时,对在不同Na2CO3溶液的滴加速率(1.4、3.3和6.7 mL/min)下制得的晶体进行SEM分析,结果如图7所示。由图7可看出,在滴加速率较慢的情况下,晶体为针状晶体,晶体表面光滑,晶体尺寸均匀;且随着滴加速率增大,晶体尺寸不断减小,且不均匀。

图7 不同滴加速率对MgCO3·3H2O晶型的影响
Fig.7 Effects of different titration speeds on morphology of MgCO3·3H2O: (a) 1.4 mL/min; (b) 3.3 mL/min; (c) 6.7 mL/min
2.2 XRD对晶体的表征
在283.2、293.2、303.2和313.2 K温度下对所得的晶体分别进行XRD分析,结果如图8所示。与GIESTER等[17]报道的MgCO3·3H2O(nesquehonite)的XRD谱比较可知,本研究在283.2~313.2 K范围内所得的晶体均为MgCO3·3H2O。

图8 不同反应温度对MgCO3·3H2O晶体的影响
Fig.8 Effects of different temperatures on MgCO3·3H2O crystals
2.3 反应过程中pH值的变化
反应过程中pH值随时间的变化曲线如图9所示。由图9可看出,在a点(t=26 min),pH值上升到8.79后又开始下降;在b点(t=45 min),pH值开始上升直到滴加过程结束,也就是c点,这是整个反应pH值的最高点;从c点开始一直到陈化结束,pH值略微下降,基本上稳定在9.70左右。
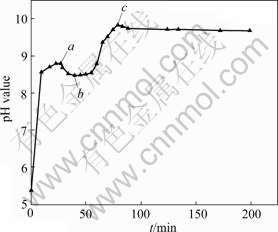
图9 反应过程中pH值随时间的变化
Fig.9 Variety of pH values with time in reaction process
采用Na2CO3为沉淀剂与MgCl2反应,Na2CO3为弱碱盐,在水中容易发生水解,生成NaHCO3:
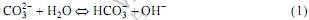
MgCl2在溶液中电离产生Mg2+与Cl-,Mg2+进一步与 反产生成MgCO3·3H2O沉淀:
反产生成MgCO3·3H2O沉淀:
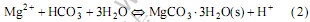
在整个反应过程中,式(1)与(2)是同时进行的。开始滴加Na2CO3溶液时,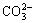 水解产生OH-使得反应中的pH值突然上升,而式(2)中产生的H+很少,不足以影响反应的pH值;随着Na2CO3溶液的加入,式(2)反应平衡向右移动,所产生的H+不断增多,使得反应的pH值有所下降;继续加入Na2CO3溶液后,式(2)反应平衡继续向右移动,使得 pH值继续上升,且上升到更高值;当滴加完毕后,式(1)达到平衡,不再产生OH-,因而,pH值略微下降。
水解产生OH-使得反应中的pH值突然上升,而式(2)中产生的H+很少,不足以影响反应的pH值;随着Na2CO3溶液的加入,式(2)反应平衡向右移动,所产生的H+不断增多,使得反应的pH值有所下降;继续加入Na2CO3溶液后,式(2)反应平衡继续向右移动,使得 pH值继续上升,且上升到更高值;当滴加完毕后,式(1)达到平衡,不再产生OH-,因而,pH值略微下降。
2.4 晶体纯度及产率的测定
晶体的纯度采用EDTA标准溶液滴定Mg2+含量的方法来测定。称取数克晶体加入过量稀盐酸溶解后,用已知浓度的EDTA标准溶液滴定Mg2+含量来计算晶体的纯度。
晶体产率的计算式为

实验所得晶体纯度及产率如表1和2所列。由表1可看出,温度升高,晶体的纯度提高,最高纯度达99.91%;且随着温度的升高,产率也相应提高,最高产率达到98.1%;在同一温度下,反应液初始浓度为0.5 mol/L时,晶体的纯度相对较高。由表2可知,随着滴加速率的增大,晶体的纯度降低,且产率明显降低。
表1 不同温度下晶体的纯度及产率
Table 1 Purity and yield of crystals synthesized at different temperatures

表2 在不同滴加速率下晶体的纯度及产率
Table 2 Purity and yield of crystals synthesized at different titration speeds

3 结论
1) 由晶体的XRD谱与标准谱对比可知,在283~313 K范围内均可制得MgCO3·3H2O晶体。
2) 温度越高,MgCO3·3H2O结晶反应进行的越完全,相对反应所得晶体的纯度越高;反应物的初始浓度过高或者过低,都影响所得晶体的纯度;滴加速率越慢,反应进行得越完全。
3) 晶体为针状结晶,温度越高,晶体的晶形越规则,表面越光滑;反应物初始浓度过高或过低都影响晶体的晶形,当初始浓度为0.5 mol/L时,所得晶体的晶形最规则,表面也最光滑;滴加速率较低时,晶体尺寸较均一,表面较光滑。
REFERENCES
[1] 张彭熹, 张保珍, 唐 渊, 杨存道, 黄师强, 吴景泉. 中国盐湖自然资源及其开发利用[M]. 北京: 科学出版社, 1999: 99-107.
ZHANG Peng-xi, ZHANG Bao-zhen, TANG Yuan, YANG Cun-dao, HUANG Shi-qiang, WU Jing-quan. Saline lake resources of China and its exploitation [M]. Beijing: Science Press, 1999: 99-107.
[2] JOSEPH R N, THEODORE E A. Extraction of lithium values from brines containing calcium salts in the presence of ammonia. US 3307922 [P]. 1967.
[3] MEHTA V C. Process for recovery lithium from salt brines. US 723962 [P]. 1988.
[4] PAUL M A, CHEN X D. Lithium extraction from multi- component mixture using supported liquid membrances [J]. Separation Science and Technology, 2000, 35(15): 2513-2533.
[5] HARBEN P, EDWARDS G. Salts of the Atacama [J]. Industrial Minerals, 1997, 358: 43-61.
[6] BUKOWSKY H, UHLEMANN E, STEINBORN D. The recovery of pure lithium chloride from “brines” containing higher contents of calcium chloride and magnesium chloride [J]. Hydrometallurgy, 1991, 27: 317-325.
[7] KONIGSBERGER E, KONIGSBERGER L C, GAMSJAGER H. Low-temperature thermodynamic model for the system Na2CO3-MgCO3-CaCO3-H2O [J]. Geochimica et Cosmochimica Acta, 1999, 63: 3105-3119.
[8] WANG Yong, LI Zhi-bao. Controlled precipitation of nesquehonite (MgCO3?3H2O) by the reaction of MgCl2 with (NH4)2CO3 [J]. Journal of Crystal Growth, 2008, 310: 1220-1227.
[9] 袁春华, 李海民. 碱式碳酸镁的应用及合成方法[J]. 盐湖研究, 2005, 13: 40-44.
YUAN Chun-hua, LI Hai-ming. Study on synthetic methods and application of basic magnesium carbonate [J]. Journal of Salt Lake Research, 2005, 13: 40-44.
[10] WANG Xiao-li, XUE Dong-feng. Direct observation of the shape evolution of MgO whiskers in a solution system [J]. Materials Letters, 2006, 60: 3160-3164.
[11] YAN Cheng-lin, XUE Dong-feng. Novel self-assembled MgO nanosheet and its precursors [J]. Journal of Physical Chemistry B, 2005, 109: 12358-12361.
[12] LANAS J, ALVAREZ J I. Dolomitic lime: Thermal decomposition of nesquehonite [J]. Thermochimica Acta, 2004, 421: 123-132.
[13] MITSUHASHI K, TAGAMI N, TANABE K, OHKUBO T, SAKAI H, KOISHI M, ABE M. Synthesis of microtubes with a surface of “House of Cards” structure via needlelike particles and control of their pore size [J]. Langmuir, 2005, 21: 3659-3663.
[14] KLOPROGGE J T, MARTENS W N, NOTHDURFT L, DUONG L V. Low temperature synthesis and characterization of nesquehonite [J]. Journal of Materials Science Letters, 2003, 22(11): 825-829.
[15] ZHANG Zhi-ping, ZHENG Ya-jun, NI Yu-wen, LIU Zhong-min, CHEN Ji-ping, LIANG Xin-mao. Temperature-and pH- dependent morphology and FT-IR analysis of magnesium carbonate hydrates [J]. Journal of Physical Chemistry B, 2006, 110: 12969-12973.
[16] ZHANG Zhi-ping, ZHENG Ya-jun, ZHANG Ji-xiu, ZHAN Qing, CHEN Ji-ping, LIU Zhong-min, LIANG Xin-mao. Synthesis and shape evolution of monodisperse basic magnesium carbonate microspheres [J]. Crystal Growth & Design, 2007, 7: 337-342.
[17] GIESTER G, LENGAUER C L, RIECK B. The crystal structure of nesquehonite, MgCO3·3H2O, from Lavrion, Greece [J]. Mineralogy and Petrology, 2000, 70: 153-163.
基金项目:国家重点基础研究发展计划资助项目(2007CB613501)
通讯作者:李志宝,研究员,博士;电话:010-62551557;E-mail: zhibaoli@home.ipe.ac.cn
(编辑 李艳红)