DOI:10.19476/j.ysxb.1004.0609.2019.01.18
废旧三元锂离子电池正极材料的淀粉还原浸出工艺及其动力学
赖延清1,杨健1,张刚2,汤依伟3,蒋良兴1,杨声海1,李劼1
(1. 中南大学 冶金与环境学院,长沙 410083;
2. 中天新兴材料有限公司,南通 226010;
3. 广东佳纳能源科技有限公司,广州 511495)
摘 要:根据淀粉在稀酸或加热条件下可水解为还原性单糖的性质,以淀粉作为还原剂,采用酸浸出方法对从废旧三元锂离子电池正极材料中回收Li、Ni、Co、Mn的浸出工艺进行研究;分别考察酸度、淀粉浓度、固液比、浸出温度和浸出时间对4种有价金属浸出率的影响。结果表明:在最佳条件即2 mol/L H2SO4、4 g/L 淀粉、固液比50 g/L、浸出温度80 ℃、浸出时间120 min时,Li、Ni、Co、Mn的浸出率分别达到98.55%、97.6%、96.73%以及91.92%。此外,基于对数定律方程对浸出动力学参数进行了拟合,表现出较好的线性相关度,计算得出Li、Ni、Co、Mn的表观活化能分别为14.8、21.3、24以及26.4 kJ/mol。浸出渣的XRD谱和SEM像显示其主要物相为C和MnO2。
关键词:废旧锂离子电池;正极材料;有价金属;酸浸出;淀粉;浸出动力学
文章编号:1004-0609(2019)-01-0153-08 中图分类号:TM912 文献标志码:A
相较于其他二次电池(如铅酸电池、镍氢电池、镍铬电池等),锂离子电池具有能量密度高,电压平台高,自放电小,无记忆效应,高低温性能以及循环寿命好等优势已经被作为重要的储能手段之一[1]。在过去的25年中,随着各类电子产品的大量涌现,尤其是新能源汽车的迅猛发展,锂离子电池(锰酸锂、钴酸锂、三元、磷酸亚铁锂)的应用越来越广泛,用量也越来越大。随之而来的是报废锂离子电池的急剧增长。锂离子电池一般由金属、有机物以及塑料构成,其中包括5%~20% Co(质量分数)、5%~7% Li、15%有机化合物以及7%的塑料[2-4]。一方面,废旧锂离子电池中的有毒物质对环境和人类健康产生危害;另一方面,电池中含有的众多有价金属(Li、Ni、Co、Mn、Cu和Al等),如直接丢弃或掩埋,将造成资源的极大浪费和环境污染。因此,废旧锂离子电池需进行高效的回收利用和无害化处理。
目前,已经报道的回收废旧锂离子电池的方法主要步骤可概括为机械-热处理,机械-化学以及溶解过程。化学过程通常是利用湿法冶金的方法例如酸浸 出、氨浸出,化学沉淀以及电化学等手段实现废旧锂离子电池中有价金属的回收[5]。已有报道证实Li、Ni、Co、Mn可以被酸从废旧锂离子电池中浸出,常见的酸有HCl[6-7]、H2SO4[8-10]、HNO3[11]以及一些有机酸,如柠檬酸、草酸等[12-13]。酸浸出过程中常常需加入还原剂,使电池中的Co3+、Mn4+在水溶液中不稳定存在的高价离子还原为在水溶液中稳定存在的低价态Co2+以及Mn2+以提升钴锰的浸出率[14]。目前,使用最多的还原剂为H2O2,但是其稳定性较差,不宜长时间存储,且价格较高。此外,先前的有关报道中对浸出过程中动力学行为研究的较少。
由于单糖具有还原性,也被用于废旧锂离子电池的还原浸出[9],而淀粉在稀硫酸或加热条件下可水解为单糖。因此,本文使用价格便宜、方便存储的淀粉作为浸出过程中的还原剂,研究酸浓度、固液比、浸出时间、温度以及淀粉加入量对金属浸出率的影响,得出了淀粉作为还原剂时硫酸浸出LNCM有价金属的最佳条件。对Li、Ni、Co、Mn浸出过程中的动力学行为也进行了研究,通过动力学模拟获得了有价金属元素的浸出过程表观活化能。
1 实验
1.1 电池拆解以及正极活性物质分离
实验用废旧锂离子电池由广东佳纳能源科技有限公司提供,电池拆解之前先用5%的NaCl溶液进行盐水放电至电压在1.0 V以下,然后人工拆解出正极材料,剪裁成2 cm×2 cm左右的碎片送入焙烧工序。正极活性材料粉末的TG-DSC曲线结果如图1所示。实验中选择焙烧温度为600 ℃,焙烧1 h后去除粘结剂、导电剂等有机物,过筛获得黑色粉末进行后继的浸出研究。所得黑色粉末使用ICP-AES (Thermo ScientificTM iCETM 3000)测定各种元素含量,结果如表1所示。使用激光粒度分析仪(Malvern, UK)对样品进行粒度分析,样品粒径<20 μm,平均粒径在10~15 μm之间。实验中所用试剂均为分析纯。
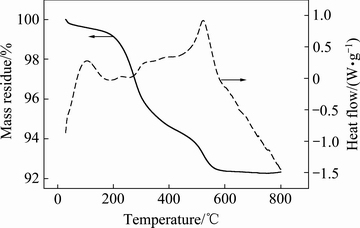
图1 正极活性材料粉末的TG-DSC曲线
Fig. 1 TG-DSC curves of cathode material powder
1.2 浸出实验
所有浸出实验均在500 mL的三颈烧瓶中进行,将三颈烧瓶放入磁力搅拌水浴锅(DF-101S,上海实验仪器厂)中并固定,安装回流冷凝管以防止浸出液的蒸发。之前有报道[15]证实,转速对金属的浸出率影响很小,所以本文中所有浸出实验均设置转速为400 r/min。考察了酸度(1~3 mol/L H2SO4)、淀粉浓度(0~10 g/L)、固液比(30~120 g/L)、浸出时间(30~240 min)、浸出温度(40~90 ℃)对各金属浸出率的影响。使用ICP-AES测量不同浸出液样品中各金属离子的浓度,金属浸出率ηMe通过式(1)计算获得:
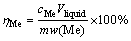 (1)
(1)
式中:cMe为金属离子在浸出液中的浓度,g/L;Me指Li,Ni,Co,Mn等金属;Vliqiud为对应实验浸出液的体积,L;m为加入黑色粉末物质的质量,g;w(Me)黑色粉末中对应各金属的质量分数(见表1)。
表1 正极活性材料粉末中主要元素的含量
Table 1 Content of main elements in cathode material powder (mass fraction, %)

2 结果与讨论
2.1 样品的物相分析
图2所示为实验所得黑色粉末的XRD谱。通过XRD谱看出,样品粉末主要由LiNi0.5Co0.2Mn0.3O2以及少量的C组成。

图2 正极活性材料粉末的XRD谱
Fig. 2 XRD pattern of cathode material powder
2.2 浸出过程
2.2.1 酸度的影响
在淀粉浓度 4 g/L、固液比 50 g/L、浸出时间120 min、浸出温度80 ℃下分别考察不同硫酸浓度(1、1.5、2、2.5和3 mol/L)对Li、Ni、Co、Mn浸出率的影响,结果如图3所示。由图3可知,当硫酸浓度大于2 mol/L时,4种离子的浸出率基本维持不变;当硫酸浓度小于2 mol/L时,4种金属离子的浸出率随着酸度的升高呈现出一个增长的趋势,因此,选择最佳的硫酸浓度为2 mol/L,此时Li、Ni、Co、Mn的浸出率分别达到98.55%、97.6%、96.73%以及91.92%。从图3还可以看出,Mn的浸出率最低,且硫酸浓度对Mn的浸出率影响最大。三元LNCM正极材料中Mn为正四价,高价锰难于被酸浸出,需要添加还原剂使其转换为低价态Mn2+来提其浸出率[16-17]。由Mn4+还原到Mn2+需要较高的酸度和较强的还原性环境,当酸度较低时淀粉水解的驱动力小,淀粉的水解程度低,生成的还原剂葡萄糖的量就少[10, 18]。因此,随着酸度的升高,Mn的浸出率显著增加,但反应过程中酸的消耗会使溶液的酸度逐渐降低,从而不利于Mn的还原浸出。
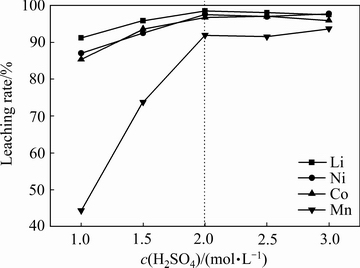
图3 酸度对金属浸出率的影响
Fig. 3 Effect of acid concentration on leaching of cathode active material
2.2.2 淀粉加入量的影响
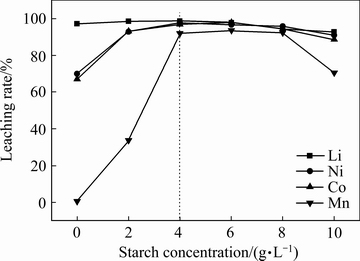
图4 淀粉浓度对金属浸出率的影响
Fig. 4 Effect of starch concentration on leaching rate of cathode active material
在硫酸浓度 2 mol/L、固液比 50 g/L、浸出时间120 min、浸出温度80 ℃下分别考察不同淀粉浓度(0、2、4、6、8以及10 g/L)对Li、Ni、Co、Mn浸出率的影响,其结果如图4所示。由图4可知,当淀粉浓度小于4 g/L时,随着淀粉浓度的升高,4种金属离子的浸出率呈现出一个增长的趋势,这可能是由于淀粉浓度升高,水解产生的葡萄糖浓度增大,从而促进了Li、Ni、Co特别是Mn的浸出率;当淀粉浓度为4~8 g/L时,4种金属离子的浸出率基本维持不变;当淀粉浓度继续升高时,4种金属离子的浸出率反而呈现出一个下降的趋势,这可能是由于淀粉浓度过高导致未水解的淀粉增多累积在溶液中造成溶液粘度增大进而导致金属的浸出率降低。综上所述,当淀粉浓度为4 g/L时最佳。
2.2.3 固液比的影响
在硫酸浓度2 mol/L、淀粉浓度4 g/L、浸出时间120 min、浸出温度80 ℃下分别考察不同固液比(30、50、70、90以及120 g/L)对Li、Ni、Co、Mn浸出率的影响,结果如图5所示。由图5可知,随着固液比的逐渐增大,Li、Ni、Co以及Mn的浸出率主要呈现出逐渐减小的趋势,特别是Mn的浸出率在固液比大于50 g/L后急剧降低,而Li、Ni以及Co 3种金属的浸出率降低幅度很小。其原因可能是随着反应的进行氢离子的浓度不断降低,在高固液比时反应后段,氢离子攻击的强度变弱使浸出的驱动力不够,从而导致浸出速率下降,浸出率下降,综合考虑,固液比取50 g/L为宜。
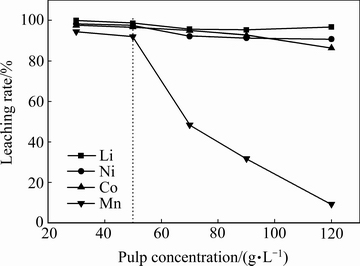
图5 固液比对浸出浸出率的影响
Fig. 5 Effect of S/L ratio on leaching rate of cathode active material
2.2.4 浸出温度的影响
在硫酸浓度2 mol/L、淀粉浓度4 g/L、固液比50 g/L、浸出时间120 min下分别考察不同浸出温度(40、50、60、70、80以及90 ℃)对Li、Ni、Co、Mn浸出率的影响,其结果如图6所示。由图6可知,随着温度的升高,Li、Ni、Co以及Mn的浸出率呈现出一个增大的趋势,其原因可能是温度升高使反应初始的驱动力大,进而增大了反应速率和反应进行的程度,当温度高于80 ℃时,4种金属的浸出率变化不大且浸出液的蒸发量大幅增加对设备安全性的要求增大,所以既要保证安全性又要得到一个较高的金属浸出率,综合考虑浸出温度取80℃为宜。Mn的平均浸出率最低说明Mn最难被浸出,这和2.3节中的动力学分析结果相一致。
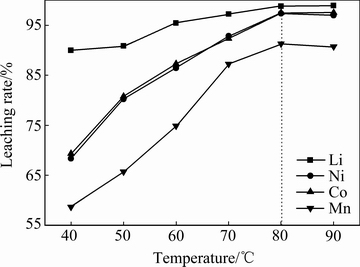
图6 温度对金属浸出率的影响
Fig. 6 Effect of temperature on leaching rate of cathode active material
2.2.5 浸出时间的影响
在硫酸浓度2 mol/L、淀粉浓度4 g/L、固液比50 g/L、浸出温度80 ℃下分别考察不同浸出时间(30、60、90、120、150、180以及240 min)对Li、Ni、Co、Mn浸出率的影响,结果如图7所示。由图7可以看出,Li、Ni、Co、Mn的浸出率受温度影响较大,这是由于正极材料的浸出过程是吸热过程,高的温度有利于浸出反应速率的提升进而提升金属的浸出率[19]。随着浸出时间的延长,Li、Ni、Co、Mn的浸出率呈现出一个逐渐增大的趋势,当浸出时间大于120 min后,4种金属的浸出率在一个特定值上下波动,说明继续延长浸出时间对浸出率已无明显提升,浸出反应已基本完成。综合考虑,浸出时间取120 min为宜。
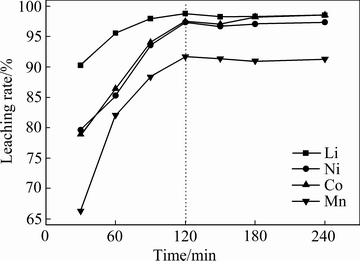
图7 反应时间对金属浸出率的影响
Fig. 7 Effect of reaction time on leaching rate of cathode active material
2.3 浸出动力学分析
为了更好地了解浸出过程,研究了Li、NiCo、Mn的浸出率在不同温度下随时间的变化曲线,并以此对浸出动力学进行了研究。不同温度下Li、Ni、Co和Mn这4种元素的浸出率随时间的变化规律如图8(a)~(d)所示,基于化学控制和扩散控制的收缩核反应模型,本文尝试拟合了Li、Ni、Co、Mn的动力学数据,其中化学反应控制模型的反应动力学方程如式(2)所示,扩散控制模型又分为外扩散控制模型和内扩散控制模型,其反应动力学方程分别如式(3)和式(4)所示[20]:
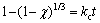 (2)
(2)
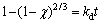 (3)
(3)
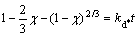 (4)
(4)
式中:χ为对应时间t(min)时金属的浸出率;kc为化学反应速率常数;kd和kd*分别为外扩散反应速率常数和内扩散反应速率常数。事实上基于以上3种控制模型拟合的Li、Ni、Co、Mn浸出动力学数据线性相关度整体较差(为了简洁本文中没有给出),相关系数R2的值在0.46~0.95之间波动,这可能是由于浸出反应过程中伴随着氧化还原反应[20]。
与以上3种控制模型相似,基于实证模型的对数定律方程也常常被用于化学反应动力学的研究[20-23],如式(5)所示:
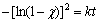 (5)
(5)
式中:k为反应速率常数。根据图8(a)~(d)数据做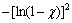 对t的曲线结果如图9(a)~(d)所示,结果表明按对数定律方程拟合浸出过程具有高的线性相关系数(
对t的曲线结果如图9(a)~(d)所示,结果表明按对数定律方程拟合浸出过程具有高的线性相关系数(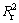 >0.97)。
>0.97)。
反应速率常数和温度之间的关系可用阿伦尼乌斯方程表示(式(6)),由此可以估算浸出过程的活化能:
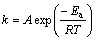 (6)
(6)
式中:A为频率因子;Ea为表观活化能,kJ/mol;T为温度,K;R为摩尔气体常数,8.314 J/(mol·K))。对ln k-1/T作图,结果如图10所示。由图10可知,拟合直线具有高的相关系数(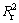 >0.96)。根据图10拟合直线的斜率可计算出Li、Ni、Co、Mn的表观活化能(Ea)分别为14.8、21.3、24以及26.4 kJ/mol。表观活化能越大发生反应需要的驱动力就越大[24],Mn的表观活化能最大,说明Mn最难被浸出,这和2.2.4节中Mn的浸出率较低相一致。各元素的浸出表观活化能均小于40 kJ/mol,说明的论文条件下Li、Ni、Co、Mn的浸出速率很快,除金属Li外,表观活化能均大于20 kJ/mol,浸出过程均受扩散过程和化学反应过程的混合控制,这应当是单纯以化学反应或扩散过程控制模型拟合时数据拟合度不高的主要原因。
>0.96)。根据图10拟合直线的斜率可计算出Li、Ni、Co、Mn的表观活化能(Ea)分别为14.8、21.3、24以及26.4 kJ/mol。表观活化能越大发生反应需要的驱动力就越大[24],Mn的表观活化能最大,说明Mn最难被浸出,这和2.2.4节中Mn的浸出率较低相一致。各元素的浸出表观活化能均小于40 kJ/mol,说明的论文条件下Li、Ni、Co、Mn的浸出速率很快,除金属Li外,表观活化能均大于20 kJ/mol,浸出过程均受扩散过程和化学反应过程的混合控制,这应当是单纯以化学反应或扩散过程控制模型拟合时数据拟合度不高的主要原因。
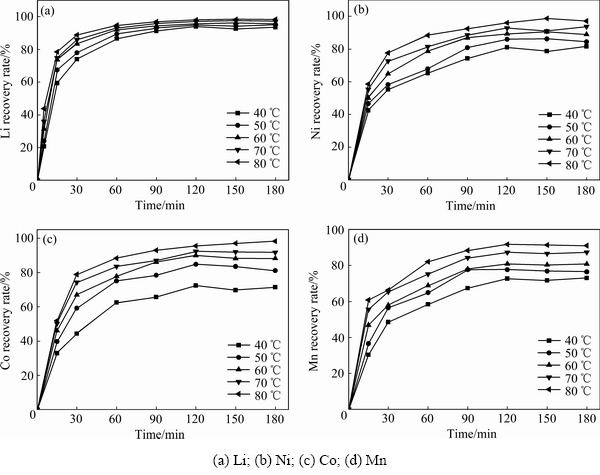
图8 不同温度在不同时间节点下金属的浸出率
Fig. 8 Effect of temperature on recovery of different metals from LIBs at different time intervals
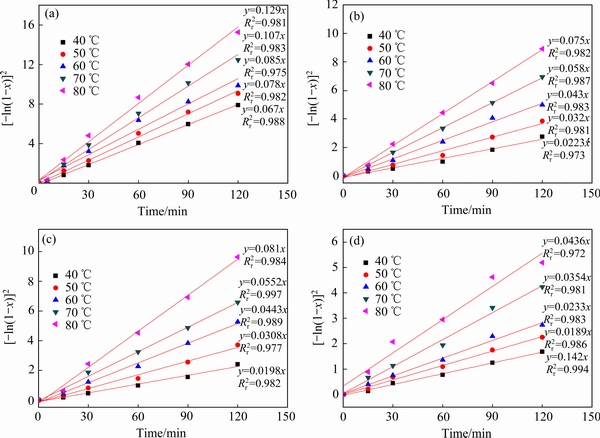
图9 对数定律方程在不同温度下拟合动力学参数
Fig. 9 Logarithmic law equation for kinetics of leaching rate of Li(a), Ni(b), Co(c), Mn(d) at different temperatures
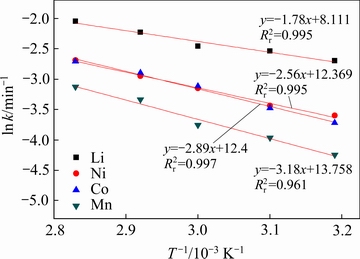
图10 Li、Ni、Co和Mn的阿伦尼乌斯方程曲线
Fig. 10 Arrhenius plot for Avrami equation kinetic model for Li, Ni, Co and Mn
2.4 浸出渣的XRD和SEM分析
在最佳浸出条件2 mol/L H2SO4、4 g/L淀粉、固液比50 g/L、浸出温度80 ℃、浸出时间120 min下所得浸出渣的XRD谱如图11所示。从图11可以看出,浸出渣的主要物相为MnO2和C,没有发现Li、Ni、Co这3种金属的明显衍射峰相,说明这3种金属基本被完全浸出,此现象和最佳浸出结果相一致。C相主要是由于焙烧过程中未完全燃烧造成的少量残余。如前面所述Mn4+(MnO2)还原成Mn2+需要较强的酸度和还原性条件,造成Mn相对于Li、Ni、Co最难被浸出。随着反应的进行,溶液的酸度、还原剂浓度逐渐降低,使浸出Mn的驱动力减弱造成少部分Mn以MnO2的形式残留在渣中,与浸出率的结果一致。
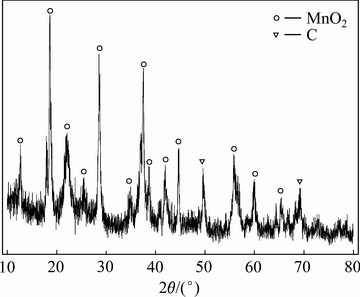
图11 浸出渣的XRD谱
Fig. 11 XRD pattern of leaching residue
粉末样品和浸出渣的SEM像如图12所示。从图12可以看出,浸出前后样品粉末的形貌发生了较明显的变化,浸出前(见图12(a))的粉末是由形状不规则尺寸大小不一的细小颗粒组成;浸出过程中这些颗粒不断被浸出剂溶蚀,形状被破坏变成无定形态(见图12(b))。对浸出渣元素成份进行SEM-EDS分析发现,浸出渣的主要元素组分是C、O以及Mn,未检测到Li、Ni、Co的存在,这与XRD分析结果相一致。

图12 样品粉末在浸出前后的SEM像
Fig. 12 SEM images of sample powder before and after leaching
3 结论
1) 利用淀粉在稀酸或者加热条件下易水解为单糖的特性,用淀粉充当还原剂作为废旧三元LNCM锂离子电池正极材料的酸浸出工序是完全可行的,使镍钴锰以低价态离子(Ni2+、Co2+、Mn2+)进入到浸出液中。
2) 最佳浸出条件如下:2 mol/L H2SO4、4 g/L淀粉、固液比50 g/L、浸出温度80 ℃、浸出时间120 min,此时,Li、Ni、Co、Mn的浸出率分别达到98.55%、97.6%、96.73%以及91.92%,余下的浸出渣主要为MnO2和未完全燃烧的C。
3) 温度范围40~80 ℃内基于对数定律方程拟合浸出动力学参数显示出了良好的拟合度,计算得出Li、Ni、Co、Mn的表观活化能分别为14.8、21.3、24以及26.4 kJ/mol。
REFERENCES
[1] VIKSTROM H, DAVIDSSON S, HOOK M. Lithium availability and future production outlooks[J]. Applied Energy, 2013, 110: 252-266.
[2] 卢毅屏, 夏自发, 冯其明, 龙 涛, 欧乐明, 张国范. 废锂离子电池中集流体与活性物质的分离[J]. 中国有色金属学报, 2007, 17(6): 997-1001.
LU Yi-ping, XIA Zi-fa, FENG Qi-ming, LONG Tao, OU Le-ming, ZHANG Guo-fan. Separation of current collectors and active materials from spent lithium-ion secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(6): 997-1001.
[3] FOUAD O A, FARGHALY F I, BAHGAT M. A novel approach for synthesis of nanocrystalline γ-LiAlO2, from spent lithium-ion batteries[J]. Journal of Analytical & Applied Pyrolysis, 2007, 78(1): 65-69.
[4] KANG J, SENANAYAKE G, SOHN J, SHIN S M. Recovery of cobalt sulfate from spent lithium ion batteries by reductive leaching and solvent extraction with cyanex 272[J]. Hydrometallurgy, 2010, 96(3): 168-171.
[5] MESHRAM P, PANDEY B D, MANKHAND T R. Extraction of lithium from primary and secondary sources by pre-treatment, leaching and separation: A comprehensive review[J]. Hydrometallurgy, 2014, 150: 192-208.
[6] 常 伟, 满瑞林, 尹晓莹, 张 建. 电化学还原技术从废旧锂离子电池中浸出LiCoO2[J]. 中国有色金属学报, 2014, 24(3): 787-792.
CHANG Wei, MAN Rui-lin, YIN Xiao-ying, ZHANG Jian. Leaching LiCoO2 from spent lithium-ion batteries by electrochemical reduction[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(3): 787-792.
[7] GRANATA G, MOSCARDINI E, PAGNANELLI F, TRABUCCO F, TORO L. Product recovery from Li-ion battery wastes coming from an industrial pre-treatment plant: Lab scale tests and process simulations[J]. Journal of Power Sources, 2012, 206(1): 393-401.
[8] ZOU H, GRATZ E, APELIAN D, WANG Y. A novel method to recycle mixed cathode materials for lithium ion batteries[J]. Green Chemistry, 2012, 15(5): 1183-1191.
[9] PINNA E G, RUIZ M C, OJEDA M W, RODRIGUEZ M H. Cathodes of spent Li-ion batteries: Dissolution with phosphoric acid and recovery of lithium and cobalt from leach liquors[J]. Hydrometallurgy, 2016, 167: 66-71.
[10] MESHRAM P, PANDEY B D, MANKHAND T R. Hydrometallurgical processing of spent lithium ion batteries (LIBs) in the presence of a reducing agent with emphasis on kinetics of leaching[J]. Chemical Engineering Journal, 2015, 281: 418-427.
[11] 周 旭, 朱曙光, 次西拉姆, 贺文智, 李光明, 黄菊文. 废锂离子电池负极材料的机械分离与回收[J]. 中国有色金属学报, 2011, 21(12): 3082-3086.
ZHOU Xu, ZHU Shu-guang, CIXI La-mu, HE Wen-zhi, LI Guang-ming, HUANG Ju-we. Mechanical separation and recovery process of anode materials from spent lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(12): 3082-3086.
[12] LI L, GE J, WU F, CHEN R, CHEN S, WU B. Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J]. Journal of Hazardous Materials, 2010, 176(1): 288-293.
[13] LI L, GE J, CHEN R, WU F, CHEN S, ZHANG X. Environmental friendly leaching reagent for cobalt and lithium recovery from spent lithium-ion batteries[J]. Waste Management, 2010, 30(12): 2615-2621.
[14] 陈 亮, 唐新村, 张 阳, 瞿 毅, 王志敏. 从废旧锂离子电池中分离回收钴镍锰[J]. 中国有色金属学报, 2011, 21(5): 1192-1198.
CHEN Liang, TANG Xin-cun, ZHANG Yang, QU Yi, WANG Zhi-min. Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1192-1198.
[15] ZENG X, LI J, SHEN B. Novel approach to recover cobalt and lithium from spent lithium-ion battery using oxalic acid[J]. Journal of Hazardous Materials, 2015, 295: 112-118.
[16] YANG Y, XU S, HE Y. Lithium recycling and cathode material regeneration from acid leach liquor of spent lithium-ion battery via facile co-extraction and co-precipitation processes[J]. Waste Management, 2017, 64: 219-227.
[17] 姚 路. 废旧锂离子电池正极材料回收再利用研究[D]. 新乡: 河南师范大学, 2016.
YAO Lu. Study on recycling of cathode material from waste lithium ion batteries[D]. Xinxiang: Henan Normal University, 2016.
[18] 孙秀萍. 酸水解淀粉制备淀粉微晶及其结晶结构与性质的研究[D]. 天津: 天津大学, 2003.
Study on the preparation of starch microcrystalline by acid hydrolysis of starch and the crystalline structure and properties of starch microcrystalline[D]. Tianjing: Tianjing University, 2003.
[19] KAMBLE M P, YADAV G D. Kinetic resolution of (R,S)-α-tetralol by immobilized Candida antarctica lipase B: Comparison of packed bed over stirred tank batch bioreactor[J]. Industrial & Engineering Chemistry Research, 2017, 56(7): 1750-1757.
[20] 贺 凤, 满瑞林, 刘 琦, 孙祖梅, 徐 娟, 张 建. 燕麦秸秆酸浸回收废旧锂电池中Co的动力学[J]. 中国有色金属学报, 2015, 25(4): 1103-1108.
HE Feng, MAN Rui-lin, LIU Qi, SUN Zu-mei, XU Juan, ZHANG Jian. Kinetics of acid leaching cobalt from waste lithium-ion batteries using oat straw[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(4): 1103-1108.
[21] SUN L, QIU K. Organic oxalate as leachant and precipitant for the recovery of valuable metals from spent lithium-ion batteries[J]. Waste Management, 2012, 32(8): 1575-1582.
[22] 徐筱群, 满瑞林, 张 建, 刘 琦, 徐 娟, 孙祖梅. 电解剥离-生物质酸浸回收废旧锂电池[J]. 中国有色金属学报, 2014, 24(10): 2576-2581.
XU Xiao-qun, MAN Rui-lin, ZHANG Jian, LIU Qi, XU Juan, SUN Zu-mei. Electrolytic stripping-biomass acid leaching- recycling spent Li-ion battery[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(10): 2576-2581.
[23] LI L, BIAN Y, ZHANG X, GUAN Y, FAN E, WU F. Process for recycling mixed-cathode materials from spent lithium-ion batteries and kinetics of leaching[J]. Waste Management, 2018, 71: 362-371.
[24] RENDONANGELES J C, MATAMOROSVELOZA Z, VELOZA A M, PEREZGARIBAY R, RODRIGUEZGALICIA J L, KAZUMICHI Y. Facile synthesis of perovskite-structured powders using barite-celestite ore under hydrothermal alkaline conditions[J]. Industrial & Engineering Chemistry Research, 2017, 56(36): 9942-9952.
Optimization and kinetics of leaching valuable metals from cathode materials of spent ternary lithium ion batteries with starch as reducing agent
LAI Yan-qing1, YANG Jian1, ZHANG Gang2, TANG Yi-wei3, JIANG Liang-xing1, YANG Sheng-hai1, LI Jie1
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
2. Zhongtian New Material Co., Ltd., Nantong 226010, China;
3. Guangdong Jiana Energy Technology Co., Ltd., Guangzhou 511495, China)
Abstract: Based on the properties that starch can be hydrolyzed into reduced monosaccharide under dilute acid or heating conditions, starch was used as a reducing agent by acid leaching method for recovering Li, Ni, Co, Mn from cathode materials of spent ternary lithium ion battery. The effects of acid concentration, starch concentration, solid to liquid ratio, leaching temperature and leaching time on the leaching rate of four valuable metals were investigated. The results show that the leaching rates of Li, Ni, Co and Mn reach 98.55%, 97.6%, 96.73% and 91.92%, respectively under the optimum conditions of 2 mol/L H2SO4, 4 g/L starch, solid-liquid ratio at 50 g/L, leaching temperature at 80 ℃ and leaching time at 120 min. In addition, a good linear correlation is shown by fitting the kinetic parameters of leaching based on the logarithmic law equation, and the apparent activation energies of Li, Ni, Co and Mn are 14.8 kJ/mol, 21.3 kJ/mol, 24 kJ/mol and 26.4 kJ/mol, respectively. The analysis results of XRD and SEM show that the main phases of the leaching residue was C and MnO2.
Key words: spent lithium ion battery; cathode material; valuable metal; acid leaching; starch; leaching kinetics
Received date: 2018-01-16; Accepted date: 2018-05-14
Corresponding author: JIANG Liang-xing; Tel: +86-731-88830474; E-mail: lxjiang@csu.edu.cn
(编辑 龙怀中)
收稿日期:2018-01-16;修订日期:2018-05-14
通信作者:蒋良兴,副教授,博士;电话:0731-88830474;E-mail:lxjiang@csu.edu.cn