网络首发时间: 2016-04-25 08:58
稀有金属 2017,41(04),404-409 DOI:10.13373/j.cnki.cjrm.XY15121101
氧化铪废料碱分解工艺研究
孙玉璞 张建东 吴明 闫国庆 彭家庆 王力军
北京有色金属研究总院稀有金属冶金材料研究所
摘 要:
以氢氧化钾、氢氧化钠和氢氧化锂为分解剂对氧化铪靶材废料进行了碱分解的对比实验。结果表明:反应温度在500~800℃范围内, 分解剂与氧化铪摩尔比3∶1, 反应时间2 h, 氧化铪粒度38~45μm时, 选择KOH为碱分解剂, 氧化铪的分解率明显高于选用其他两种分解剂的分解率, 因此选择氢氧化钾为分解剂进行氧化铪靶材废料的碱分解实验。实验研究了反应温度、配比、原料粒度和反应时间等因素对氧化铪分解率的影响。结果表明:提高反应温度、物料配比、反应时间和减小原料粒径均能提高氧化铪的分解率, 在温度为800℃, 氢氧化钾与氧化铪的摩尔比2.7∶1.0, 原料粒度45~53μm, 反应时间2 h的实验条件下, 氧化铪的分解率可达到96%以上。研究配比对产物影响表明:当KOH/HfO2摩尔比为3∶1, 高于理论值 (2∶1) 时, 发生反应:HfO2+2KOH=K2HfO3;KOH/HfO2摩尔比为1∶1时, 在反应的初始阶段, 氢氧化钾与氧化铪反应生成K2HfO3, K2HfO3包裹在颗粒表面与氧化铪继续发生反应:K2HfO3+HfO2=K2Hf2O5, 生成K2Hf2O5。
关键词:
氧化铪废料;氢氧化钾;碱分解;分解率;
中图分类号: TQ134.13
作者简介:孙玉璞 (1989-) , 男, 河南商丘人, 硕士研究生, 研究方向:稀有金属冶金, E-mail:13683557631@163.com;;王力军, 教授, 电话:010-82241310, E-mail:gold@grinm.com;
收稿日期:2015-12-22
基金:国家十二五科技支撑计划项目 (2012BAB10B10) 资助;
Decomposition Process of Hafnia Scrap via Alkali Fusion
Sun Yupu Zhang Jiandong Wu Ming Yan Guoqing Peng Jiaqing Wang Lijun
Division of Rare Metals Metallurgy and Materials, General Research Institute for Nonferrous Metals
Abstract:
The contrast experiment of alkali decomposition for HfO2 scrap was performed with KOH, Na OH and Li OH as decomposition agent under the same conditions. The results showed that when selecting KOH as decomposition agent, the decomposition rate of hafnium oxide was significantly higher than the other two kinds of decomposition agent with molar ratio of alkali to hafnia of 3∶ 1, particle size of 38 ~ 45 μm, reaction temperature of 500 ~ 800 ℃ for 2 h. Consequently, potassium hydroxide was selected as the decomposition agent. The effects of reaction temperature, mole ratio of alkali to hafnium oxide, particle size and alkali fusion time on the decomposition of hafnium oxide were primarily investigated. The investigation showed that decomposition rate of hafnia increased with the reaction temperature, mole ratio of alkali to hafnium oxide, alkali fusion time increasing and the particle size decreasing, the decomposition rate was over 96% when KOH/HfO2 molar ratio was 2. 7 ∶ 1. 0, particle size of hafnia was 45 ~ 53 μm at 800 ℃ for 2 h. The study of effects of molar ratio (KOH/HfO2) on decomposition rate showed that when KOH/HfO2 molar ratio was 3∶ 1, higher than the theoretical value (2∶ 1) , HfO2+ 2KOH = K2 HfO3occurred; when the KOH/HfO2 molar ratio was 1∶ 1, in the initial stage of reaction, the reaction of potassium hydroxide and hafnia generated K2 HfO3, which was wrapped in particle surface, and then reacted with hafnia:K2Hf2O5∶ K2 HfO3+ HfO2= K2Hf2O5.
Keyword:
hafnia scrap; potassium hydroxide; alkali decomposition; decomposition rate;
Received: 2015-12-22
随着光学镀膜技术的飞速发展, 二氧化铪具有优异的光学性能, 特别是有从近紫外 (230 nm) 到中红外 (10μm) 的良好透光性, 同时还有很好的热稳定性、化学稳定性, 较好的机械特性和较高的抗激光损伤阀值, 成为制备高功率激光器的首选折射材料和抗激光损伤的薄膜材料[1,2,3,4,5,6]。二氧化铪薄膜还具有较高的介电常数与宽的光学能隙, 未来有望替代Si O2成为最有前途的高k栅介质材料, 将促进电子器件与大规模集成电路的迅速发展[7,8]。二氧化铪高熔点 (约2900℃) , 耐腐蚀, 化学稳定好, 热中子捕获能力强, 使其在先进陶瓷和原子能工业中具有很高的使用价值[9]。铪原子具有高密度, 高的原子序数和较高的X射线吸收能力, 所以铪的氧化物是具有良好应用前景的闪烁材料基体;另外氧化铪还可以作为制备高纯金属铪和其他铪化合物的原料[10,11,12]。
氧化铪圆片靶材镀膜过程利用率低[13,14] (一般不超过10%) , 多年工业生产残存了大量的氧化铪靶材废料。实验用氧化铪原料为氧化铪靶材废料, 氧化铪靶材在制备过程中经过高温烧结处理, 靶材的密度接近物理密度 (9.68 g·cm-3) 的90%, 氧化铪薄膜的制备主要通过电子束蒸发、磁控溅射、原子层沉积等方法[15,16,17], 残留靶材致密度高, 回收困难。本文主要研究氧化铪靶材废料的碱分解工艺条件, 探讨氢氧化钾与氧化铪的反应机制, 以期为氧化铪靶材废料回收利用提供理论指导[18,19]。
1 实验
实验用原料化学成分见表1, 由XRD图谱 (见图1) 可知, 氧化铪废料中的主要物相是氧化铪 (Hf O2) 。实验用其他试剂氢氧化钾、氢氧化钠、氢氧化锂、盐酸等均为分析纯。
氧化铪靶材废料经过破碎、筛分处理之后备用。处理后的氧化铪原料粒度与目数对照表见表2。
表1 氧化铪原料中成分组成Table 1 Hf O2chemical compositions (%, mass fraction) 下载原图

表1 氧化铪原料中成分组成Table 1 Hf O2chemical compositions (%, mass fraction)

图1 氧化铪原料的XRD图谱Fig.1 XRD pattern of Hf O2
碱熔实验在箱式电阻炉中进行。实验用坩埚为Pt坩埚, 将一定配比的原料在坩埚内混合均匀, 待达到设定温度时, 将坩埚装入炉内, 反应一段时间后取出。坩埚冷却完毕, 将坩埚中的固体产物取出, 加盐酸酸化, 过滤, 清洗, 残留物经过干燥称重。通过式 (1) 计算氧化铪的分解率。

式中:ω为氧化铪的分解率;m1 (Hf O2) 为氧化铪的初始质量 (g) ;m2 (Hf O2) 为经酸化、过滤干燥的残留物的质量 (g) 。
选择日本S-4800型冷场发射扫描电子显微镜 (SEM) 观察产物形貌;采用德国SPECTRO ARCOS EOP型电感耦合等离子体光谱仪 (ICP-AES) 分析原料成分组成;采用Philips APD-10型X射线衍射仪 (XRD) 分析产物的相结构。
2 结果与讨论
2.1 分解试剂的选择
选择常用的3种分解试剂KOH, Na OH, Li OH进行氧化铪靶材废料分解实验, 图2的反应时间为2 h, 原料粒度38~45μm, 碱分解剂与氧化铪的摩尔比为3∶1时, 考察不同温度下碱分解剂对氧化铪分解率的影响, 从图2中可以看出, 在500~800℃温度范围内, 随着反应温度升高, 氧化铪分解率逐渐增加, 800℃时, Li OH, Na OH, KOH 3种分解剂对应氧化铪的分解率分别为51.49%, 83.54%, 99.65%, 以KOH为分解剂时氧化铪的分解率明显高于另外两种, 在后续条件实验中, 选择KOH为氧化铪靶材废料的分解剂。
表2 原料粒度与目数对照表Table 2 Comparison between granularity and mesh of raw material 下载原图

表2 原料粒度与目数对照表Table 2 Comparison between granularity and mesh of raw material
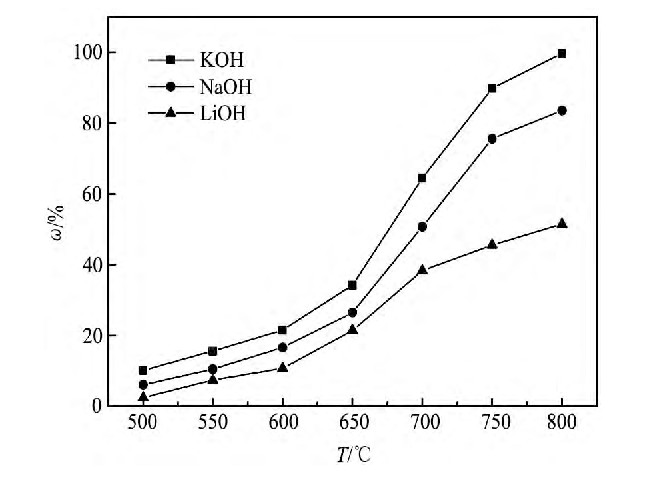
图2 不同分解试剂对氧化铪分解率的影响Fig.2Effect of different decomposition agents on decomposi-tion rate
2.2 配比和反应温度对氧化铪分解率的影响
图3为氧化铪原料粒度38~45μm, 反应时间2 h, 考察物料配比 (KOH和Hf O2的摩尔比) 、反应温度为对氧化铪分解率的影响。从图3可以看出, 随着反应温度的升高, 氧化铪的分解率逐渐增加。当反应温度为700, 750, 800, 850℃, 配比5∶1时, 氧化铪分解率分别为71.625%, 95.000%, 99.750%, 99.760%, 这是由于温度升高化学反应速率加快, 降低了KOH的粘度, 反过来增强了液固界面的质量传递[20,21], 当温度超过800℃时, 氧化铪分解率曲线趋于平缓。

图3 配比、温度对氧化铪分解率的影响Fig.3 Effect of temperature on decomposition rate with differ-ent material ratios
反应温度为800℃, 物料配比2.5∶1.0, 3.5∶1.0时, 氧化铪分解率分别为96.50%, 99.75%, KOH量的继续增加对氧化铪分解率的提高意义不大, 而且碱含量过高在冷却过程中易造成碱熔物料板结, 产物变硬结块导致难以取出, 不利于后续处理。800℃时较低的配比 (2.5∶1.0) 条件分解率能达到96%以上, 综合考虑选定最佳反应温度为800℃。
在反应温度为800℃, 反应时间2 h, 原料粒度38~45μm的实验条件下, 增加物料配比2.6∶1.0, 2.7∶1.0, 2.8∶1.0, 2.9∶1.0, 3.0∶1.0, 进一步考察配比对氧化铪分解率的影响, 实验结果见图4。由图4可知, 当配比在2.7∶1.0时分解率为99.35%, KOH的量继续提高对分解率的提高意义不大, 所以物料配比在2.5~2.7之间均可。
2.3 反应时间对分解率的影响
根据图3和4的实验结果, 在反应温度为800℃, 原料粒度38~45μm, 物料配比2.7∶1.0的实验条件下, 考察反应时间对氧化铪分解率的影响, 实验结果见图5。由图5可知, 随着反应时间的延长, 氧化铪的分解率显著增加, 当反应时间超过2 h时, 分解率基本保持不变, 所以选定最佳反应时间为2 h。
2.4 氧化铪粒度对分解率的影响
表3是反应温度为800℃, 物料配比2.7∶1.0, 反应时间2 h的条件下, 不同粒度原料的氧化铪分解率。表3表明随着颗粒粒度的减小, 氧化铪的分解率逐渐增加, 因为粒度的减小增加了颗粒的比表面积和它的活性, 加速反应进行[20]。原料粒度为45~53μm和38~45μm时, 氧化铪的分解率分别为96.67%, 99.35%, 所以综合考虑选取粒度范围为45~53μm的氧化铪原料。

图4 配比对氧化铪分解率的影响Fig.4 Effect of different material ratios on decomposition rate
2.5 产物XRD分析
在反应温度800℃, 物料配比为3∶1, 1∶1, 反应时间2 h, 原料粒度范围38~45μm的实验条件下, 对产物进行XRD分析, 结果见图6。
由图6 (a) 可知, 氢氧化钾与氧化铪的物质量比是3∶1时, 产物的主要物相是K2Hf O3和KOH。由此可以推测, 当氢氧化钾和氧化铪配比高于理论值 (2∶1) 时, 氢氧化钾和氧化铪可能发生式 (2) 反应。图6 (b) 可知, 氢氧化钾与氧化铪的物质量比是1∶1时, 产物的主要物相是K2Hf2O5, Hf O2和K2Hf O3。由此可以推测, 在反应的初始阶段, 氢氧化钾与氧化铪的反应按式 (2) 进行, 产物K2Hf O3包裹在氧化铪表面;K2Hf O3与氧化铪按式 (3) 继续反应生成K2Hf2O5。

表3 氧化铪粒度对分解率的影响Table 3 Effect of particle size on decomposition rate 下载原图

表3 氧化铪粒度对分解率的影响Table 3 Effect of particle size on decomposition rate

图6 800℃配比KOH/Hf O2=3∶1和1∶1时碱分解产物的XRD图谱Fig.6XRD patterns of decomposition products of molar ratio3∶1 (a) and 1∶1 (b) at 800℃
3 结论
氢氧化钾、氢氧化钠和氢氧化锂都可以分解氧化铪靶材废料, 在反应温度500~800℃范围内, 选择KOH为碱分解剂时, 氧化铪的分解率明显高于选用其他两种分解剂。在氧化铪碱分解实验中, 氧化铪分解率随着反应温度、配比、和反应时间的增加而升高, 氧化铪颗粒越小越有利于反应的进行。当反应温度为800℃, 氢氧化钾和氧化铪的物质量比为2.7∶1.0, 反应时间2 h, 原料粒度为45~53μm时氧化铪分解率高于96%。当氢氧化钾和氧化铪配比高于理论值 (2∶1) 时, 氢氧化钾和氧化铪可能发生反应:Hf O2+2KOH=K2Hf O3+H2O;当氢氧化钾与氧化铪的物质量比是1∶1时, 在反应的初始阶段, 氢氧化钾与氧化铪反应生成K2Hf O3, 产物K2Hf O3包裹在氧化铪表面, K2Hf O3与氧化铪按式Hf O2+K2Hf O3=K2Hf2O5反应继续反应生成K2Hf2O5。
参考文献
[1] Wang C, Zhou X, Hou L T, Zhou J, Li W, Wu G D, Liu Y W, Ming L, Pan J R.Research on the preparation and properties of Hf O2thin films[J].Nanoscience&Nanotechnology, 2013, 10 (1) :43. (王成, 周新, 侯令涛, 周俊, 李伟, 吴干德, 刘义稳, 明莉, 潘家荣.氧化铪薄膜的制备及其性能研究[J].纳米科技, 2013, 10 (1) :43.)
[2] Liu W T, Liu Z T, Xu N, Lu Q Q, Yan F.Preparation and properties of Hf O2[J].Journal of Function Materials, 2007, 38 (S1) :309. (刘文婷, 刘正堂, 许宁, 鹿芹芹, 闫峰.Hf O2薄膜的制备与光学性能[J].功能材料, 2007, 38 (S1) :309.)
[3] Ai W J, Xiong S M.Characteristics of single layer Hf O2thin films[J].Opto-Electronic Engnineering, 2012, 39 (2) :134. (艾万军, 熊胜明.单层二氧化铪 (Hf O2) 薄膜的特性研究[J].光电工程, 2012, 39 (2) :134.)
[4] Traylor Kruschwiz J D, Pawlewiicz W T.Optical and durability properties of infrared transmitting thin films[J].Appl.Opt., 1997, 36 (10) :2157.
[5] Alvisi M, Tomasi F D, Perrone, M R, Protopapa M L, Rizzo A.Laser damage dependence on structural and optical properties of ion-asistcd Hf O2thin films[J].Thin Solid Films, 2001, 396 (1) :44.
[6] Khoshman J M, Khan A, Kordesch M E.Amorphous hafnium oxide thin films for antireflection optical coatings[J].Surface&Coatings Technology, 2008, 202 (11) :2500.
[7] Miotti L, Tatsch F, Driemeier C, Bastos, K P, Edon V, Hugon M C, Agius B, Baumoal I J R, Krug C.Compositon, stability and oxygen transport in lanthanum and hafnium aluminates thin films on Si[J].Nuclear Instruments and Methods in Physics Research, 2006, 249 (1/2) :366.
[8] Parramon J S, Modreanu M, Bosch S, Stchakovsky M.Optical characterization of Hf O2by spectroscopic ellipsometry:dispersion models and direct data inversion[J].Thin Solid Films, 2008, 516 (22) :7990.
[9] Jiang D Y.The brief introduction of the application of hafnium compounds in fine ceramics[J].Rare Metals Letters, 2007, 26 (1) :22. (蒋丹宇.铪化合物在先进陶瓷中的应用[J].稀有金属快报, 2007, 26 (1) :22.)
[10] Meng J, Li Q.Preparation of cubic Y stable Hf O2and its PL spectra[J].Spectroscopy and Spectral Analysis, 2010, 30 (11) :29. (孟婧, 李强.钇稳定立方氧化铪的合成及光谱性能研究[J].光谱学与光谱分析, 2010, 30 (11) :29.)
[11] Tian S J, Liu Y, Chen G, Gao R X.Separation techniques and application of Zr and Hf[J].Uranium Mining Metallurgy, 2006, 25 (2) :103. (田胜军, 刘艳, 陈刚, 高仁喜.锆铪的分离技术及应用[J].铀矿冶, 2006, 25 (2) :103.)
[12] Peng J Q, Yin Y X, Wang X, Li J S, Wang L J.Research status and progress in single crystal growth of zirconium, hafnium and their alloys[J].Chinese Journal of Rare Metals, 2015, 39 (6) :562. (彭家庆, 尹延西, 王鑫, 李京社, 王力军.锆铪及其合金单晶制备研究现状与进展[J].稀有金属, 2015, 39 (6) :562.)
[13] Zhen S Y, Chen N J, Tang G Z, M X X.Etched behavior of Cu target in magnetron sputtering[J].Heat Theatment of Metals, 2003, 38 (2) :99. (甄淑颖, 陈倪娇, 唐光泽, 马欣新.磁控溅射铜靶材的刻蚀行为[J].金属热处理, 2003, 38 (2) :99.)
[14] Zhao J X, Jin F Y.Investigation of utilization ratio and calculating method of familiar magnetron sputtering targets[J].Nuclear Fusion and Plasma Physics, 2007, 27 (1) :66. (赵嘉学, 金凡亚.常见磁控溅射靶材利用率及其计算方法的探讨[J].核聚变与等离子体物理, 2007, 27 (1) :66.)
[15] Kariper I A.Production of Hf O2thin films using different methods:chemical bath decomposition, SILAR and sol-get process[J].International Journal of Metals, Metallurgy and Materials 2014, 21 (8) :832.
[16] Min-Jung Choia, Hyung-Ho Parkb, Doo Seok Jeonga, Jeong Hwan Kimc, Jin-Sang Kima, Seong Keun Kima.Atomic layer deposition of Hf O2thin films using H2O2as oxidant[J].Applied Surface Science, 2014, 301 (10) :451.
[17] T J Bright, J I Watjen, Z M.Zhang, Muratore C, Voevodin A A.Optical properties of Hf O2thin films depositted by magnetron sputtering:from the visible the farinfrared[J].Thin Solid Films, 2012, 520 (22) :6793.
[18] Liu J Q, Zhen Q, He W M, Pan Q Y.Preparation andcharacterization of nano-hafnia powders[J].Function Materials, 2004, 35 (6) :730. (刘建强, 甄强, 何伟明, 潘庆谊.纳米氧化铪粉体的制备及表征[J].功能材料, 2004, 35 (6) :730.)
[19] Biswas R K, Habib M A, Karmakar A K, Islam M R.A novel method for processing of Bangladeshi zircon:part I:baking, and fusion with Na OH[J].Hydrometallurgy, 2010, 103 (1/4) :124.
[20] Xue T Y, Wang L N, Qi T, Chu J L, Qu J K, Liu C H.Decomposition kinetics of titanium slag in sodium hydrxide system[J].Hydrometallurgy, 2009, 95 (1/2) :22.
[21] Liu Y M, Qi T, Chu J L, Tong Q J, Zhang Y.Decomposition of ilmenite by concentrated KOH solution under atmospheric pressure[J].Int.J.Miner.Process, 2006, 81 (2) :79.