DOI:10.19476/j.ysxb.1004.0609.2019.05.20
没食子酸对锡电解精炼过程的影响
徐志峰1, 李 柱1, 路永锁2, 宁建平2, 钟晓聪1, 李金辉1, 詹有北2
(1. 江西理工大学 冶金工程学院, 赣州 341000;
2. 江西自立环保科技有限公司 企业技术中心, 抚州 344113)
摘 要:传统锡电解精炼采用H2SO4-SnSO4-甲酚磺酸电解液体系,然而,甲酚磺酸气味重、有毒有害,亟待寻找新型绿色环保添加剂替代甲酚磺酸。通过线性扫描、Tafel测试、滴定分析和扫描电子显微镜对比研究了甲酚磺酸和没食子酸对电解液稳定性和Sn(II)阴极沉积行为的影响。结果表明:没食子酸的还原性强于甲酚磺酸的还原性,显著抑制析氢副反应。添加没食子酸可以使电解液酸度维持稳定,而且Sn(II)浓度和Sn(II)占总锡(S(T))比例保持在较高水平。相较于甲酚磺酸,没食子酸更有利于提高电解液稳定性。甲酚磺酸显著阻滞Sn(II)的沉积,增强阴极极化,阴极锡致密平整,甲酚磺酸平整效果好。然而,没食子酸对Sn(II)沉积动力学影响小,其阴极锡平整度、致密度低于甲酚磺酸体系的,添加高浓度没食子酸甚至会导致锡枝晶产生。木质素磺酸钠作为一种整平剂,与没食子酸复合添加可以显著改善阴极锡的平整度和致密度,两者组成的复合添加剂有望取代甲酚磺酸成为新型锡电解精炼电解液绿色添加剂。
关键词:锡电解精炼;甲酚磺酸;没食子酸;木质素磺酸钠;稳定性;形貌
文章编号:1004-0609(2019)-05-1065-08 中图分类号:TF814 文献标志码:A
锡电解精炼过程适于处理铋和贵金属含量较高的粗锡[1-3]。锡电解可在碱性和酸性两种体系中进行[4],相较碱性电解体系,酸性电解体系具有生产费用较低、电耗较低、产品纯度高等优点。因此,锡冶炼厂通常选择酸性电解体系[5]。
目前,锡电解精炼一般采用硫酸-硫酸亚锡电解 液[6]。在电解过程中,粗锡主要以Sn(II)溶出。当粗锡表面氧化膜达到一定厚度,阳极电位上升,粗锡阳极上将进行析氧副反应。析氧反应产生的氧气/中间产物以及电解液中的溶解氧会促进Sn(II)氧化成Sn(IV)[7-8]。在酸性电解体系,Sn(IV)容易发生水解,形成锡胶(SnO2·2H2O)。一方面,锡胶的生成使Sn(II)浓度的降低,阴极极化增大,导致析氢副反应进行;另一方面,锡胶颗粒附着在阴极,恶化阴极锡的形貌和质量[9]。为了提高溶液稳定性,抑制锡胶的生成,传统锡电解精炼电解液中需要添加10~20 g/L的酚磺酸,如苯酚磺酸、甲酚磺酸等,我国炼锡厂通常添加甲酚磺酸[6, 10]。
通常认为,甲酚磺酸既具有稳定Sn(II)离子的作用,又具有阴极整平作用。然而,甲酚磺酸电解体系电流效率较低[11],甲酚磺酸气味重,对人体有毒有害,锡电解车间工作环境较恶劣[12]。随着环境执法力度增大,寻求新型环保添加剂替代甲酚磺酸势在必然。XIAO等[10]指出,酒石酸可以抑制Sn(II)的氧化;亚苄基丙酮、辛基酚聚氧乙烯醚均阻滞析氢反应并增大Sn(II)阴极还原极化;甲醛小幅增加阴极极化,并起光亮剂的作用。然而,上述添加剂很难同时起到稳定Sn(II)和平整阴极形貌的作用。
本文从分子结构出发,提出一种与甲酚结构相近的没食子酸作为甲酚磺酸的替代物。没食子酸具有三个酚羟基,理论上可以还原Sn(IV),起到稳定电解液的作用。此外,没食子酸作为广泛使用的食品添加剂,无色、无味,环保、安全,可以大幅改善车间工作环境。本文对比研究了甲酚磺酸和没食子酸的电化学还原性,通过测试含甲酚磺酸/没食子酸电解液中的阴极极化曲线、沉积动力学、电解液稳定性、电流效率和阴极形貌,对比分析了甲酚磺酸和没食子酸对电解液稳定性和阴极沉积行为的影响。
1 实验
1.1 试剂
基础电解液组成为40 g/L SnSO4 (22.1 g/L Sn)、90 g/L H2SO4、0.2 g/L β-萘酚、1 g/L明胶,上述试剂均为分析纯。甲酚磺酸由混合甲酚和浓硫酸在90 ℃下磺化2 h制成,甲酚磺酸直接以磺化后液加入,没食子酸以C7H6O5·H2O加入。为表述方便,基础电解液记为BE,添加有甲酚磺酸(Cresol sulfonic acid)和没食子酸(Gallic acid)的电解液分别记为BE-CSA和BE- GA,加入木质素磺酸钠(Sodium ligninsulfonate)-没食子酸复合添加剂的电解液记为BE-GA-SL。如无特殊说明,CSA、GA添加量为5 g/L,SL添加量为2 g/L。
1.2 测试方法
所有电化学测试均在上海辰华电化学工作站(CHI660E)上进行,电解液温度恒定在35 ℃,测试采用三电极体系,参比为Hg/Hg2SO4/sat. K2SO4,文中如无特殊说明,所有电位均相对于该参比电极。采用线性扫描方法分析甲酚磺酸和没食子酸的电化学还原性,工作电极和对电极均为Pt片(10 mm×10 mm),电位扫描范围为-0.410~1.700 V,扫描速度5 mV/s。采用线性扫描(LSV)分析甲酚磺酸和没食子酸对阴极沉积行为的影响,工作电极为99.99 %锡薄片(20 mm× 20 mm),对电极为石墨电极(40 mm×40 mm),电位扫描范围为-0.880~-1.100 V,扫描速度10 mV/s。采用Tafel测试分析不同电解液中Sn(II)的沉积动力学,电位扫描范围为-0.780~-1.020 V,扫描速度0.166 mV/s。
电解实验采用双电极体系,阳极为江西自立环保科技有限公司提供的粗锡(20 mm×20 mm),阴极为99.99 %精锡(20 mm×20 mm),电流密度为100 A/m2,电解时间为24 h,电解液温度恒定在35 ℃,极距为50 mm。电解后,立即取出阴极,去离子水冲洗干净后,在80 ℃下烘干8 h后送扫描电子显微镜(SEM)观察阴极锡的形貌。采用滴定法分析电解前、后电解液中的二价锡浓度(ρSn(II))、总锡浓度(ρSn(T))和H+浓度(c(H+))。ρSn(II)采用碘量滴定法测得;测量ρSn(T)时首先用Al片将沸腾溶液中Sn(IV)还原为Sn(II),溶液冷却后,然后用碘量滴定法测得ρSn(T);c(H+)采用NaOH滴定法获得。电解前、后对阴极称量,差重法获得电解过程中沉积锡质量,然后计算电流效率。
2 结果与讨论
2.1 没食子酸和甲酚磺酸的还原性
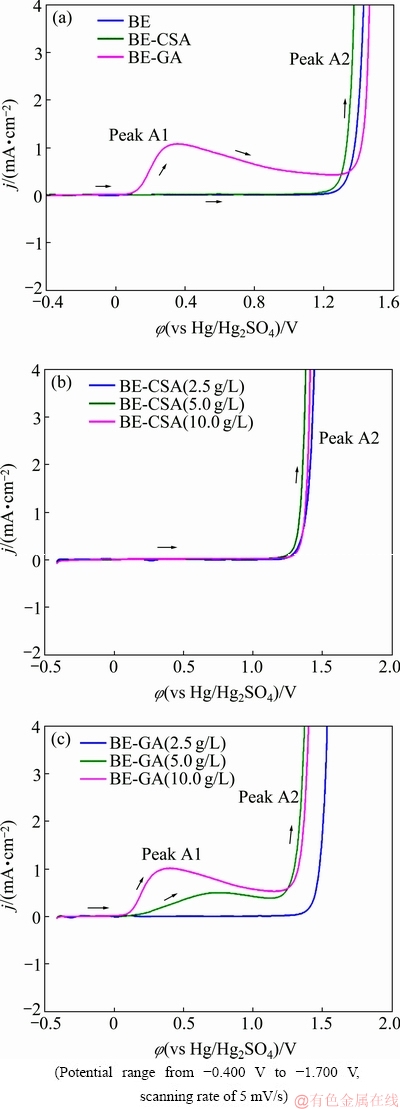
图1 Pt电极在不同电解液中的阳极极化曲线
Fig. 1 Anodic polarization curves of Pt electrode in different electrolytes
采用线性扫描技术对比分析没食子酸和甲酚磺酸的电化学还原性。如图1(a)所示,在-0.400~1.160 V电位区间,BE和BE-CSA溶液中的LSV曲线呈水平直线,未见明显电化学氧化反应。电位高于1.160 V后,电流开始呈指数增长,形成氧化枝A2,对应于Pt电极上的析氧反应。在BE-GA溶液中,电位高于0.080 V时电流开始增大,0.090~1.250 V出现氧化峰A1,随后出现氧化枝A2。图1(b)和(c)给出了Pt电极在含不同浓度甲酚磺酸和没食子酸的电解液中的LSV曲线。如图1(b)所示,甲酚磺酸浓度从2.5 g/L升高到10.0 g/L,LSV曲线基本重合,只出现析氧反应对应的氧化枝A2。说明在低于10 g/L的浓度范围内,未检测到甲酚磺酸在Pt电极上的氧化反应。在含没食子酸电解液中,当没食子酸浓度为2.5 g/L时,未见明显的A1峰;而没食子酸浓度为5.0 g/L和10.0 g/L时,出现明显A1峰。随着没食子酸浓度增大,氧化峰负移,峰值电流增加,证实A1峰对应于没食子酸的氧化反应。上述分析表明,相较于甲酚磺酸,没食子酸电化学还原性更强,这可能是因为没食子酸具有三个酚羟基,而甲酚磺酸上只有一个酚羟基。
2.2 阴极沉积过程
为研究没食子酸和甲酚磺酸对阴极沉积过程的影响,采用线性扫描获得了Sn电极在不同电解液中的阴极极化曲线,如图2所示。在BE溶液中,从开路电位(-0.885 V)负扫,电流立即增大,Sn(II)开始阴极沉积,说明Sn(II)沉积动力学快,沉积所需极化小。随后出现还原峰C1,峰值电位约为-1.020 V,峰值电流密度约为-32 mA/cm2。电位继续负扫,出现阴极还原枝C2,锡沉积和析氢反应同时进行[13-14]。在BE-CSA电解液中,LSV曲线同样出现还原峰C1。相较BE电解液,C1峰峰值电流显著减小,约为-24 mA/cm2,说明甲酚磺酸的加入显著阻滞了Sn(II)的沉积。电位低于-1.025 V后,析氢反应开始进行,还原枝电流增长缓慢,说明甲酚磺酸对析氢具有一定的抑制作用。在BE-GA电解液中,Sn(II)的还原峰C1与BE电解液中的基本重合,说明GA对Sn(II)的沉积速率影响不大。值得注意的是,在扫描电位区间内,未看到明显的还原枝C2,可以推测,GA的加入显著抑制析氢反应。

图2 Sn电极在不同电解液中的阴极极化曲线
Fig. 2 Cathodic polarization curves of Sn electrode in different electrolytes
为进一步研究添加剂浓度对阴极过程的影响规律,在含有不同浓度添加剂的电解液中进行线性扫描,如图2(b)所示。在BE-CSA(2.5 g/L)和BE-CSA(5 g/L)电解液中,阴极极化曲线形状相近,相较BE-CSA(2.5 g/L)溶液,BE-CSA(5 g/L)电解液中锡沉积电流略有减小。当甲酚磺酸添加量提高到10 g/L,锡沉积电流显著减小。证实了甲酚磺酸对锡电积的阻滞作用。如图2(c)所示,没食子酸添加量由2.5 g/L提高到10 g/L时,阴极极化曲线变化不明显,Sn(II)沉积峰值电位略向负移动,说明GA对锡沉积过程的影响不明显。
采用Tafel测试分析了甲酚磺酸和没食子酸对Sn(II)沉积动力学的影响,如图3所示。Tafel测试电位扫描方向为负向扫描,测试前通过辰华CHI660E的IR-compensation模块获得溶液阻抗Ru,图3所示曲线的电位已按φeff=φappl–iRu修正,其中φappl为扫描过程施加的电位,i为测试电流。Tafel曲线采用Orgin软件进行线性拟合,获得不同电解液中Sn(II)沉积的平衡电位和交换电流密度,如图3内的嵌表所示。从拟合数据可以看出,甲酚磺酸和没食子酸的添加均使平衡电位略微正移。比较不同电解液中Sn(II)沉积交换电流密度可以看出,甲酚磺酸的添加使锡沉积交换电流密度减小,沉积反应极化增大,与线性扫描分析结果一致,证实甲酚磺酸对锡沉积的阻滞作用。没食子酸的添加同样小幅降低交换电流密度,然而其对锡沉积的阻滞效果差于甲酚磺酸。

图3 Sn电极在不同电解液中的Tafel曲线
Fig. 3 Tafel plots of Sn electrode in different electrolytes
2.3 电解液稳定性
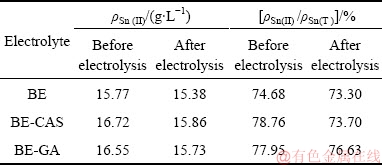
为评估不同添加剂对电解液稳定性的影响,在24 h电解前后,分析了电解液的二价锡Sn(II)浓度、Sn(II)在总锡Sn(T)中的占比和H+的浓度,分别列于表1和表2。如表1所列,在BE电解液中,电解前、后Sn(II)浓度降低了0.4 g/L左右,Sn(II)占总锡的比例由74.68%降低到73.30%。在BE-CSA电解液中,电解前、后Sn(II)的浓度降低了0.86 g/L,尽管其浓度降低幅度高于BE溶液的,但是电解前、后Sn(II)的浓度高于BE溶液体系。此外,电解24 h后,其cSn(II)/cSn(T)也稍高于BE溶液的。说明甲酚磺酸的添加可以起到一定的稳定溶液作用。在BE-GA电解液中,电解前、后Sn(II)浓度降低了0.82 g/L,电解前、后Sn(II)的浓度与BE-CSA电解液中的相当。值得注意的是,电解24 h后BE-GA溶液中的Sn(II)占比明显高于BE和BE- CSA溶液中的。因此,没食子酸在稳定溶液Sn(II)浓度和Sn(II)在总锡中的占比方面具有明显的作用,效果优于甲酚磺酸。这可能与没食子酸还原性更强有关。在电解过程中电解液中的溶解氧及Sn(IV)可与没食子酸优先反应,减少Sn(II)的氧化,甚至可能促进Sn(IV)还原为Sn(II),从而使电解液中Sn(II)的浓度保持在较高水平。
表1 24 h电解前、后溶液中Sn(II)浓度及Sn(II)/Sn(T)变化
Table 1 Sn(II) concentration and Sn(II)/Sn(T) concentration ratio of electrolytes before and after 24 h electrolysis
在电解过程中,除了Sn(II)浓度对电解过程有影响,电解液的酸度对阴极产品质量、电流效率、Sn(II)的稳定性都有影响。因此,分析了电解前、后电解液中H+的浓度。由于甲酚磺酸和没食子酸都是酸类,会电离出H+。因此,讨论酸的绝对浓度意义不大,然而,酸浓度的变化值可以作为评估电解液稳定性的一个指标。如表2所示,BE溶液中,电解前后H+浓度降低了0.084 mol/L。在BE-CAS电解液中,H+浓度降低了0.045 mol/L,酸度降低幅度约为BE电解液的一半。而在BE-GA电解液中,电解前、后酸度几乎未发生变化,酸度保持稳定。这与LSV阴极极化曲线分析是一致,没食子酸抑制析氢的作用明显,在BE-GA电解液中,H+基本上不会参与析氢反应。
表2 24 h电解前、后电解液中H+浓度变化
Table 2 Concentration variation of H+ in electrolytes before and after 24 h electrolysis

结合甲酚磺酸和没食子酸对电解液中Sn(II)浓度、Sn(II)占总锡比例和酸度的影响,可以得出结论,相较于甲酚磺酸,没食子酸的添加更有利于稳定电解液的酸度,而且Sn(II)浓度和Sn(II)占总锡的比例也可以保持在较高水平。因此,没食子酸替代甲酚磺酸可以提高电解液稳定性,有利于电解作业的稳定运行。
2.4 阴极形貌与电流效率
在硫酸电解体系中,锡阴极沉积所需极化小,沉积动力学快,易生长枝晶。因此,电解液中需要加入β-萘酚、乳胶等添加剂[15]。本研究使用的BE电解液中已经添加有0.2 g/L β-萘酚、1 g/L明胶。在BE电解液中(见图4(a)和(b)),阴极锡表面致密,表面呈明显的晶体颗粒堆积形貌,大部分晶体颗粒呈扁长立方体。当电解液中添加甲酚磺酸,阴极锡表面致密而且平整(见图4(c)和(d)),无明显晶体颗粒状。高倍数下(见图4(d))也未见明显晶体颗粒堆积形貌。因此,甲酚磺酸可以大幅改善阴极的平整度。根据阴极极化曲线和Tafel曲线的分析结果,在含甲酚磺酸电解液中,甲酚磺酸阻滞Sn(II)的结晶生长,增大阴极极化,有利于得到细小的晶体颗粒。然而,图4(c)和(d)形貌图显示,含甲酚磺酸电解液中,阴极锡表面无明显晶体颗粒形貌,表面非常平整。可以推测,甲酚磺酸不仅仅阻滞Sn(II)的结晶生长,甲酚磺酸还可能在阴极表面特殊吸附,从而影响Sn(II)的沉积路径,起到整平剂的效果。甲酚磺酸对阴极锡表面的吸附行为和对Sn(II)沉积机理的影响有待于进一步深入研究。

图4 不同电解液中电解24 h(35 ℃,100 A/m2)后阴极锡的形貌
Fig. 4 Morphologies of cathodic Sn after 24 h electrolysis in different electrolytes (35 ℃, 100 A/m2)
在含没食子酸的电解液(见图4(e)和(f))中,阴极锡表面平整度低于BE溶液,出现晶体颗粒堆积形成的大角度接触角。晶体颗粒呈不规则立方体,粒度稍小于BE溶液,阴极锡中存在晶体颗粒堆积产生的空隙,致密度较低。此外,在BE-GA(10 g/L)电解液中,阴极锡的边缘出现大量的细长枝晶,图4(e)中间细长锥形晶粒即为枝晶。
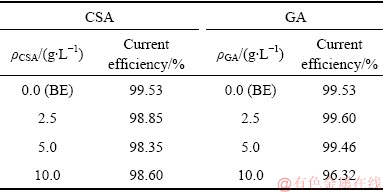
表3列出了不同电解液中阴极电流效率。在BE电解液中,电流效率可达99.53%。在BE-CAS电解液中,阴极电流效率有所降低。随着甲酚磺酸浓度增大,电流效率变化不大,基本维持在98.5%左右。值得注意的是,在酸性体系下,析氢是阴极最常见的副反应。但是在BE-CAS溶液中电解前后H+浓度降低幅度小于BE溶液,说明在含甲酚磺酸电解液中电流效率降低不完全由析氢副反应所致。在BE-GA电极液中,低浓度(2.5~5 g/L)没食子酸加入对电流效率影响不大,电流效率与BE溶液相当。然而,当没食子酸浓度增加到10 g/L,电流效率明显降低。这可能是因为没食子酸添加量大时,阴极表面出现细长枝晶,这些枝晶容易使阳极与阴极短路,从而导致电流密度降低。因此,没食子酸的浓度需要控制在10 g/L以下。
表3 添加剂对锡电解精炼阴极电流效率的影响
Table 3 Influence of additives on cathodic current efficiency during tin electrorefining
2.5 复合添加剂对阴极形貌的影响
由上文可知,在添加有没食子酸电解液中,阴极锡平整度、致密度低于BE和BE-CAS电解液。单独添加没食子酸无法满足工业锡电解精炼作业要求。因此,挑选了几种硫酸电解体系常用整平剂与没食子酸组成复合添加剂,观察了不同复合添加剂电解液中阴极锡的形貌。实验发现,木质素磺酸钠(Sodium ligninsulfonate, 记为SL)与没食子酸组成的复合添加剂可以明显改善阴极锡形貌。
图5所示为BE-GA-SL溶液中电解24 h获得的阴极锡的形貌。由图5(a)和(b)可见,在木质素磺酸钠和没食子酸复合添加剂体系,阴极锡表面未见明显的晶粒及空隙,阴极锡表面平整度高。相较于BE和BE-GA体系,SL-GA复合添加可以显著改善阴极锡平整度和致密度,克服GA单独添加导致大量枝晶生成的问题。相较于BE-CSA体系,BE-GA-SL体系阴极锡的形貌特征与BE-CSA相近,尽管平整度略低于BE-CSA体系,但可以完全满足工业锡电解精炼的要求。因此,木质素磺酸钠和没食子酸复合添加剂有望替代甲酚磺酸,成为锡电解精炼工业电解液绿色添加剂。

图5 BE-GA-SL电解液中电解24 h(35 ℃,100 A/m2)后阴极锡的形貌
Fig. 5 Morphology of cathodic Sn after 24 h electrolysis in BE-GA-SL electrolyte (35 ℃, 100 A/m2)
3 结论
1) 没食子酸还原性强于甲酚磺酸,而且抑制析氢副反应进行。添加没食子酸可以使电解液酸度维持稳定,使电解液中Sn(II)浓度和Sn(II)占总锡的比例保持在较高水平。相较甲酚磺酸,没食子酸更有利于提高电解液稳定性。
2) 甲酚磺酸显著阻滞Sn(II)的沉积,增加阴极极化,阴极锡致密平整,平整效果好;没食子酸对Sn(II)沉积动力学影响较小,阴极锡平整度、致密度降低,添加高浓度没食子酸甚至导致锡枝晶生成。
3) 没食子酸和木质素磺酸钠无毒无异味、绿色环保,两者复合添加,可以明显改善阴极锡的平整度和致密度。该复合添加剂有望替代气味重、有毒有害的甲酚磺酸及其他酚磺酸类锡电解液添加剂。
REFERENCES
[1] 彭天照, 徐非凡. 粗锡精炼现状及前景展望[J]. 有色冶金设计与研究, 2016, 37(5): 30-32.
PENG Tian-zhao, XU Fei-fan. Present situation and prospect of crude tin refining[J]. Nonferrous Metals Engineering & Research, 2016, 37(5): 30-32.
[2] HARANGI Z, KULCSAR T, KEKESI T. Hydrometallurgical processing of anode slimes obtained from the electrolytic refining of soldering scrap[J]. Materials Science and Engineering, 2015, 40(1): 64-74.
[3] KULCSAR T, TOTH G B, KEKESI T. Complex evaluation and development of electrolytic tin refining in acidic chloride media for processing tin-based scrap from lead-free soldering[J]. Mineral Processing and Extractive Metallurgy, 2016, 125(4): 228-237.
[4] SABA A E, AFIFI S E, EL SHERIEF A E. Developments in alkaline tin electrorefining[J]. Journal of the Minerals, Metals and Materials Society, 1988, 40(8): 40-43.
[5] DOBO Z, KULCSAR T, KEKESI T. Electrorefining of tin in pure acid solutions by mechanically controlled cathode deposition and solar power utilization[J]. Materials Science and Engineering, 2012, 37(2): 19-26.
[6] 于海燕, 梁成浩, 王 兵. 甲基磺酸盐镀液体系可焊性合金镀层的工艺[J]. 中国有色金属学报, 2001, 11(s1): 202-205.
YU Hai-yan, LIANG Cheng-hao, WANG Bing. Electroplating processes of solderable coatings from methane surfonate bath[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(s1): 202-205.
[7] BRUBAKER C H Jr. The hydrolysis of tin (IV) in sulfuric acid[J]. Journal of the American Chemical Society, 1955, 77(20): 5265-5268.
[8] LAITINEN T, SALMI K, SUNDHOLM G, VIINIKKA P, YLI-PENTTI A. The anodic behaviour of tin in sulphuric acid solutions[J]. Electrochimica Acta, 1992, 37(10): 1797-1803.
[9] KEKESI T. Electrorefining in aqueous chloride media for recovering tin from waste materials[J]. Acta Metallurgica Slovaca, 2013, 19(3): 196-205.
[10] XIAO F, SHEN X, REN F, REN F, VOLINSKY A. Additive effects on tin electrodepositing in acid sulfate electrolytes[J]. International Journal of Minerals, Metallurgy, and Materials, 2013, 20(5): 472-478.
[11] LEI J, YANG J. Electrochemical mechanism of tin membrane electrodeposition in chloride solutions[J]. Journal of Chemical Technology and Biotechnology, 2017, 92(4): 861-867.
[12] SON S H, PARK S C, KIM J H, KIM Y H, LEE M S, AHN J. Study on the electro-refining of tin in acid solution from electronic waste[J]. Archives of Metallurgy and Materials, 2015, 60(2): 1217-1220.
[13] TOTH G B, UCHIKOSHI M, KEKESI T. Polarization characteristics of tin electrorefining in chloride solutions[J]. Materials Science and Engineering, 2014, 39(2): 103-113.
[14] RIMASZEKI G, KULCSAR T, KEKESI T. Investigation and optimization of tin electrorefining in hydrochloric acid solutions[J]. Journal of Applied Electrochemistry, 2012, 42(8): 573-584.
[15] GHOSH S, ROY S. Characterization of tin films synthesized from ethaline deep eutectic solvent[J]. Materials Science and Engineering B, 2014, 190: 104-110.
Influence of gallic acid on tin electrorefining process
XU Zhi-feng1, LI Zhu1, LU Yong-suo2, NING Jian-ping2, ZHONG Xiao-cong1, LI Jin-hui1, ZHAN You-bei2
(1. School of Metallurgical Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China;
2. Technology Center, Jiangxi Self-Independence Environment Protection Science and Technology Ltd., Fuzhou 344133, China)
Abstract: Traditional tin electrorefining proceeds in electrolyte containing H2SO4, SnSO4 and cresol sulfonic acid (CSA). It is urgent to search novel environmental electrolyte additive to replace CSA due to its stench and toxicity. Influences of CSA and gallic acid (GA) on electrolyte stability and Sn(II) electrodeposit behavior were comparatively investigated through linear scanning voltammetry, Tafel test, titration analysis and SEM. The results show that GA presents stronger reducibility than that CSA does, and remarkably inhibits hydrogen evolution side reaction. Addition of GA stabilizes electrolyte acidity, and enhances Sn(II) concentration and Sn(II)/Sn(T) ratio. Compared with CSA, GA is more suitable to enhance electrolyte stability. Addition of CSA apparently inhibits Sn(II) electrodeposition and increases cathodic polarization. Therefore, CSA presents excellent flattening effect. However, GA shows smaller influence on Sn(II) electrodeposition dynamic, and decreases the flatness and compactness of cathodic tin. Moreover, addition of GA in high concentration results in the appearance of tin dendrites. Sodium ligninsulfonate (SL), as a leveling agent, is selected and combined with GA. Composite additive of SL and GA is demonstrated to improve compactness and flatness of cathodic tin. Consequently, SL-GA composite additive is a potential alternative to CAS. It could be a novel environmental-friendly additive for tin electrorefining.
Key words: tin electrorefining; cresol sulfonic acid; gallic acid; sodium ligninsulfonate; stability; morphology
Foundation item: Project(51704130) supported by the National Natural Science Foundation of China; Project (jxxjbs16026) supported by the Doctoral Scientific Research Foundation of Jiangxi University of Science and Technology, China; Project(2017-3607-09-000002) supported by Jiangxi Self-Independence Environment Protection Science and Technology Ltd., China
Received date: 2017-12-10; Accepted date: 2018-11-21
Corresponding author: ZHONG Xiao-cong; Tel: +86-797-8312204; E-mail: jxustxczhong@163.com
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(51704130); 江西理工大学博士启动基金资助项目(jxxjbs16026); 江西自立环保科技有限公司横向项目(2017- 3607-09-000002)
收稿日期:2017-12-10;修订日期:2018-11-21
通信作者:钟晓聪, 讲师, 博士; 电话: 0797-8312204; E-mail: jxustxczhong@163.com