磷酸铁锂在不同醇溶液中的溶剂热合成及其电化学性能
瞿毅1,唐新村1, 2,李连兴1,陈亮1,王志敏1
(1. 中南大学 化学化工学院,湖南 长沙,410083;
2. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘要:分别以乙醇、乙二醇以及丙三醇/水为溶剂,采用溶剂热法合成橄榄石结构的磷酸亚铁锂(LiFePO4)。运用XRD,SEM和FTIR等手段,对产物晶体结构、颗粒形貌和表面微观结构进行表征,探讨溶剂热合成LiFePO4时不同溶剂对产物形貌和结构的影响,同时运用恒流充放电测试和循环伏安方法对所得产物的电化学性能进行研究。研究结果表明:以乙二醇为溶剂合成的LiFePO4呈均匀片状结构,具有粒度小、厚度薄的特点,这种结构缩短了锂离子的扩散距离,有利于电化学性能的提高,其0.1C倍率放电比容量达到161.7 mA·h/g,1C倍率放电时容量仍保持132.6 mA·h/g;在0.1C倍率下,50次循环后容量保持率为98.02%。
关键词:溶剂热;磷酸铁锂;正极材料
中图分类号:TM912 文献标志码:A 文章编号:1672-7207(2012)02-0450-05
Solvothermal systhesis and electrochemical properties of LiFePO4 using different solvents
QU Yi1, TANG Xin-cun1, 2, LI Lian-xing1, CHEN Liang1, WANG Zhi-min1
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. State Key Laboratory of Power Metallurgy, Central South University, Changsha 410083, China)
Abstract: The olivine lithium ion phosphate(LiFePO4) was prepared via solvothermal reaction using ethanol, ethylene glycol(EG) and glycerol–water as solvents, respectively. The crystalline structure, particle morphology and surface microstructure of products were characterized by high-energy synchrotron X-ray diffraction (XRD), scanning electron microscopy (SEM) and Fourier transform infrared (FTIR) spectroscopy, respectively. The effects of different solvents on the morphologies and structures were investigated, and the electrochemical properties of the products were investigated by charge/discharge test and cyclic voltammetry(CV). The results show that LiFePO4 nanosheet obtained by using EG as solvent has small size and thin features, which reduces the lithium ion diffusion distance and favors the improvement of electrochemical performance, it can deliver an initial discharge capacities of 161.7 mA·h·g-1 at 0.1C, 132.6 mA·h·g-1 at 1C and the cycling capacity retention rate reaches 98.02% over 50 cycles at 0.1C.
Key words: solvothermal; LiFePO4; cathode materials
橄榄石型LiFePO4作为一种新型的锂离子正极材料,具有可逆容量高(170 mA·h·g-1)、充放电平台高、原材料来源广、无毒、结构稳定等优点,因而被认为是未来电动汽车和混合动力车的理想电源[1]。但LiFePO4由于受其固有结构限制,其锂离子扩散系数(DLi+)为10-14~10-16 m2·S-1[2-3],电子电导率为10-9~10-10 S/cm[4]。为了改善其性能,目前多数研究主要围绕以下2个方面进行:(1) 对LiFePO4颗粒表面包覆导电剂[5-7],或者采用适当的金属离子和粒子对LiFePO4进行掺杂,提高电子导电性[8-10];(2) 控制合成条件制备形貌规则、粒径较小的LiFePO4颗粒,缩短锂离子的扩散距离,从而改善扩散性能[11],这可以通过采用溶胶凝胶法[12]、水热法[13]或溶剂热法[14]等软化学方法实现。与传统的高温固相法相比,采用溶剂热法可制备形貌规则、分散性较好和粒度较小的材料,并且还具有耗能低、溶剂选择多样性的特点,因而受到广泛关注。目前的文献报道中,针对不同溶剂在溶剂热制备磷酸铁锂过程中如何影响产物结构和性能方面的研究较少,为此,本文作者以3种不同溶剂采用溶剂热法合成橄榄石结构的磷酸铁锂,制备3种具有不同形貌和结构的产物,研究溶剂对产物结构组成和形貌的影响,并对其电化学性能进行系统研究。
1 实验
1.1 材料的制备
将LiH2PO4, FeC2O4和葡萄糖以质量比1.0:1.0:0.5分别加入到乙醇、乙二醇、丙三醇/水中(丙三醇由于黏度较大,所以采用体积比4:1的丙三醇/水溶液作为溶剂),充分混合后转移到聚四氟乙烯反应釜中,密封,于250 ℃下反应16 h;静置冷却后过滤,用水和乙醇反复冲洗多次,于80 ℃下干燥10 h。将粉末置于管式炉中,在Ar气氛下于550 ℃焙烧6 h,然后冷却至室温,得到产物并依次分别标记为S1,S2和S3。
1.2 样品形貌﹑结构表征
采用NICOLET380傅里叶变换红外光谱仪进行红外光谱(FT-IR)分析;用日本理学MAX2550型X线衍射分析仪对结构进行表征,其中,石墨单色器(Cu靶,Kα单色光谱,管电压40 kV)扫描范围为10°~85°;用日本电子株式会社生产的JSM-5600型扫描电子显微镜观察粒子的粒径和形貌。
1.3 电化学性能测试
将LiFePO4、乙炔黑、PVDF按质量比75:15:10混合均匀,充分混合干燥后压制在面积为0.8 cm2左右的不锈钢网上,制成正极片,于120 ℃真空干燥6 h。以金属锂片为负极,1 mol·L-1 LiPF6/EC+DMC(质量比为1:1)为电解液,在手套箱中组装成双电极电池。采用LAND2001CT电池测试系统测试电池在2.5~4.2 V范围内的充放电性能。在电化学工作站上进行循环伏安测试,采用两电极体系进行循环伏安测试,扫描速率为0.1~1 mV/s, 电压扫描范围2.7~4.2 V。
2 结果与讨论
2.1 XRD分析
图1所示为各样品的XRD谱图。将图谱中的衍射峰位置与 JCPDS卡对照可看出:在3种不同溶剂下合成的物质均为LiFePO4;以乙醇为溶剂合成的样品的衍射图上出现了少量Li3PO4杂质峰;除了杂质峰外,其余的衍射峰与标准谱图的衍射峰吻合,样品峰峰强不高,这是由于样品中所含的少量杂质掩盖了峰的强度。而以乙二醇和丙三醇/水为溶剂时,衍射图谱与标准图谱衍射峰吻合且谱峰尖锐,样品比较纯,结晶度较高。乙醇由于具有比较低的临界温度(243 ℃),因而在反应温度下达到了超临界状态。在超临界状态下制备磷酸铁锂时,容易导致少量Li3PO4杂质产 生[15]。乙二醇和丙三醇/水溶液具有较高的临界温度,在250 ℃反应温度下达不到超临界状态,因而可以避免杂质的生成。

图1 不同溶剂得到样品的X线衍射图
Fig.1 XRD patterns of samples prepared by different solvents
2.2 红外测试
图2所示为不同样品的前驱体样品的红外测试图谱。从图2可看出:3个样品的红外图谱基本一致,在947 cm-1和970 cm-1处的峰为PO43-的对称伸缩振动峰;在1 071,1 107 cm-1处的峰为PO43-四面体的不对称伸缩振动峰;在546,585,632和649 cm-1处的峰为PO43-四面体的不对称弯曲振动峰,在499 cm-1和465 cm-1处的吸收带是锂离子的传输引起的。这都表明:磷酸铁锂晶体在溶剂热反应之后已经形成,后续的烧结是为了提高其结晶度。除了上述橄榄石结构的红外吸收峰外,3个样品都还存在位于1 637 cm-1的C=C吸收峰和1 380 cm-1处的C—O基团吸收峰,这些都表明产物上面还残留着少数有机物[16],这部分有机物在后续的热处理中被碳化,能够分散在产物的颗粒表面和颗粒空隙之间,可以提高材料的整体导电性,这对提高样品的电化学性能具有重要意义。
2.3 SEM分析
在不同溶剂下制得的样品SEM照片如图3所示。对比图3中3个样品的形貌可发现:以3种不同溶剂制备的产物中均存在片状结构,这是加入的有机碳源和溶剂共同作用产生的。葡萄糖的加入除了能够在反应过程中起还原作用外,还具有阻止晶体生长的作用,在反应过程中,它们吸附在晶体的晶面上,阻止特定晶面的生长,从而导致其各向异性生长成为片状结构。同时,不同溶剂的体系黏度等物化性质上的差异(3种溶剂的黏度由小到大依次为乙醇、乙二醇和丙三醇/水),会影响反应过程中反应物粒子的扩散速率和成核速率,因而导致三者形貌之间存在较大的区别。乙醇具有较小的黏度,因而反应粒子扩散速度较快,导致晶体生长速度较快。在这种情况下,有机分子对晶体成长的抑制作用减弱,因而除了存在片状结构外,还存在许多形貌不规则的产物。S2和S3样形貌规则,且粒度均匀,由于两者的溶剂体系黏度较大,晶体生长速度受到限制,吸附在特定晶面的有机分子对晶体生长抑制作用显得更为突出,因而两者的产物均为均匀片状结构。其中S2样片状粒度为300 nm左右,S3样片状粒度为3 μm左右。S2样粒径更小,并且片状厚度仅为几十纳米。这是由于溶剂的黏度越大,能维持晶体生长到更大程度,并使晶体更趋向于各向同性生长[17],因而S3样所得到的产物在尺寸增大的同时,厚度也有所增大。

图2 不同样品前驱体的红外图谱
Fig.2 FTIR spectras of as-prepared LiFePO4 samples

图3 在不同溶剂下制得的样品SEM图
Fig.3 SEM images of LiFePO4 samples prepared by different solvents
2.4 电化学性能分析
为了研究3个样品的电化学性能,将它们组装成实验电池,并对其性能进行测试,结果见图4。
从图4可以看出:3个样品以0.1C倍率充放电时的初始放电容量分别为67.6,161.7和141.6 mA·h·g-1,并且平台电压在3.4 V左右。S1样中Li3PO4杂质的含量虽少,但是它的存在不仅破坏材料的整体导电结构,而且对电极材料与电解液的接触有极大影响,这就导致S1样的容量比较低,仅为67.6 mA·h·g-1。去除这类杂质有利于提高材料的电化学性能,S2和S3样品的电化学性能得到了明显改善,并且S2样品的容量较高,几乎达到理论容量(170 mA·h·g-1)。图5进一步比较了S2和S3样品在不同倍率下的放电容量。从图5可见:S2样品在1C放电时容量仍保持132.6 mA·h·g-1,而S3样品在以较大倍率放电时,容量衰减较大,1C放电时容量为91.6 mA·h·g-1。可以看出:虽然S2和S3样品的产物纯度较高,并都具有规则的形貌和均匀的尺寸,但是,电化学性能依然存在着差异。这种性能上的差异是两者颗粒尺寸不同造成的,并且在较大的电流密度下,活性物质的颗粒粒径对充放电性能的影响更加显著。S2样品呈纳米级的薄片状结构,这种结构能够使活性物质与电解液充分接触,有利于锂离子的嵌入和脱出,使活性物质的利用率更高,从而具有较高的容量,并且锂离子嵌入和脱出的深度小,缩短了锂离子的扩散距离,提高了离子扩散率,因而,在大电流下充放电时容量衰减不大[18]。S3样品与S2样品相比,粒度更大,片状结构更厚,造成性能有所下降。

图4 不同样品的首次充放电曲线
Fig.4 Initial charge/discharge curves of different samples
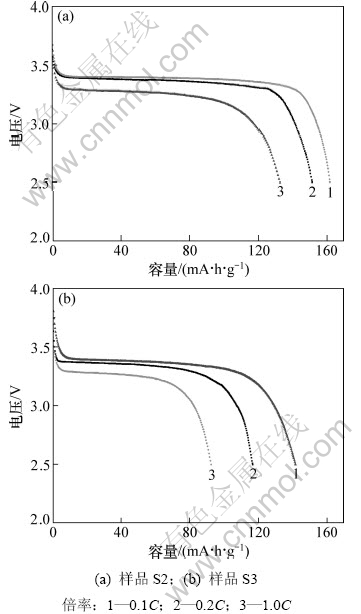
图5 LiFePO4样品在不同倍率下的放电曲线
Fig.5 Discharge curves of LiFePO4 samples at different rates
图6所示为样品在0.1C倍率下放电比容量与循环次数的关系。从图6可以看出:S2样品经过50次循环后容量衰减仅为1.98%,而S3样品容量衰减为3.03%,S1样品的衰减量达到10.6%。颗粒粒度越小,锂离子在扩散过程中的阻力越小,越有利于锂离子的嵌入和脱出,活性物质的利用率越高,并且在锂离子嵌入和脱出时发生的体积变化更小,从而结构更稳定,容量的衰减越小。因此,尺寸为纳米级的S2样品表现出良好的循环性能。杂质的产生对锂离子的扩散通道产生不利影响,随着充放电的进行,会造成可嵌入和脱出的锂离子数量不断减少,因而S1样品的衰减量较大。
图7所示为不同溶剂下合成的LiFePO4样品的循环伏安图。从图7可见:峰面积越大,氧化峰和还原峰之间的电压差越小,电极的极化越小;另外,根据Randles- Sevcik公式Ip=2.69×105A0n3/2C0D1/2V1/2可知:峰电流越大,对应扩散系数也越大,从而锂离子在电极中的扩散动力学性能越好,有利于提高电池的容量性能。从图7可以看出:3个样品的循环伏安曲线均在3.34 V左右出现还原峰,在3.58 V左右出现氧化峰,并且氧化峰和还原峰面积几乎相等,说明所合成的LiFePO4正极材料具有很好的可逆性。从图7还可以看出:S1,S3和S2样品的峰面积和峰电流依次增大,氧化峰和还原峰之间的电压差依次减小,说明三者中S2样具有最好的循环性能,这也与图5中放电容量循环性能测试结果相吻合。

图6 不同样品的循环放电图
Fig.6 Cycle performance of samples
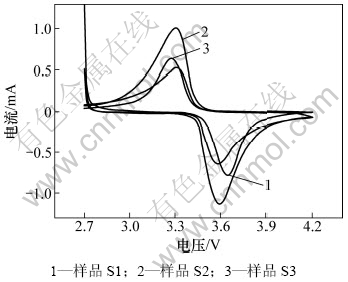
图7 不同LiFePO4样品的循环伏安图
Fig.7 Cyclic voltammograms of as-fabricated LiFePO4 cathode samples
3 结论
(1) 通过采用3种不同的溶剂作为反应介质得到了不同形貌结构和性能的磷酸铁锂产物。
(2) 采用溶剂热合成LiFePO4正极材料时,溶剂不仅起到了提供反应环境的作用,而且由于溶剂本身黏度等性质不同,导致产物在成分和形貌结构上存在差异,进而导致其性能存在差异。其中,当采用乙二醇为溶剂时,由于其具有特有的黏度,制备得到的LiFePO4呈纳米级薄片状结构,形貌均匀,因而具有优良的电化学性能,在0.1C倍率放电时容量为161.7 mA·h/g,1C倍率放电时容量仍保持在132.6 mA·h/g,0.1C倍率放电和50次循环后容量保持率为98.02%。
参考文献:
[1] Yang S F, Song Y N, Ngala K, et al. Performance of LiFePO4 as lithium battery cathode and comparison with manganese andvanadium oxides[J]. Journal of Power Sources, 2003(119/120/121): 239-246.
[2] Prosini P P, Marida L, Zane D, et al. Determination of the chemical diffusion coefficient of lithium in LiFePO4[J]. 2002, 148(1/2): 45-51.
[3] Churikov A V, Ivanishchev A V, Ivanishcheva I A, et al. Determination of lithium diffusion coefficient in LiFePO4 electrode by galvanostatic and potentiostatic intermittent titration techniques[J]. Electrochimica Acta, 2010, 55(8): 2939-2950.
[4] Chung S Y, Bloking J T, Chiang Y-M.Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nature Materials, 2002, 1(2): 123-128.
[5] Doeff M M, Wilcox J D, Kostecki R, et al. Optimization of carbon coatings on LiFePO4[J]. Journal of Power Sources, 2006, 163(1): 180-184.
[6] Wang G X, Yang L, Bewlay S L, et al. Electrochemical properties of carbon coated LiFePO4 cathode materials[J]. Journal of Power Sources, 2005, 146(1/2): 521-524.
[7] Shin H C, Cho W I, Jang H. Electrochemical properties of the carbon-coated LiFePO4 as a cathode material for lithium-ion secondary batteries[J]. Journal of Power Sources, 2006, 159(2): 1383-1388.
[8] Wang G X, Bewlay S, Needham S A. Synthesis and characterization of LiFePO4 and LiTi0.01Fe0.99PO4 cathode materials[J]. Journal of the Electrochemical Society, 2006, 153(1): A25-A31.
[9] Islam M S, Driscoll D J, Fisher C A J. Atomic-scale Investigation of defects,dopants,and lithium transport in the LiFePO4 olivin-type battery material[J]. Chemistry of Materials, 2005, 17(20): 5085-5092.
[10] 张宝, 李新海, 罗文斌, 等. LiFe(1-x)MgxPO4 锂离子电池正极材料的电化学性能[J]. 中南大学学报: 自然科学版, 2006, 37(6): 1094-1097.
ZHANG Bao, LI Xin-hai, LUO Wen-bin, et al. Electrochemical properties of LiFe1-xMgxPO4 for cathode materials of lithium ion batteries[J]. Journal of Central South University: Science and Technology, 2006, 37(6): 1094-1097.
[11] Singhal A, Skandan G, Amatucci G, et al. Nanostructured electrodes for next generation rechargeable electrochemical devices[J]. Journal of Power Sources, 2004, 129(1): 38-44.
[12] Hu Y Q, Doeff M M, Kostecki R, et al. Electrochemical performance of Sol-Gel synthesized LiFePO4 in lithium batteries[J]. Journal of the Electrochemical Society, 2004, 151(8): A1279-A1285.
[13] Chen J J, Wang S J, Whittingham S M. Hydrothermal synthesis of cathode materials[J]. Journal of Power Sources, 2007, 174(2): 442-448.
[14] Saravanan K, Reddy M V, Balaya P. Storage performance of LiFePO4 nanoplates.Journal of material chemistry[J]. Journal of Materials Chemistry, 2009, 19(5): 553-668.
[15] Aimable A, Aymes D, Bernard F, et al. Characteristics of LiFePO4 obtained through a one step continuous hydrothermal synthesis process working in supercritical water[J]. Solid State Ionics, 2009, 180(11/12/13): 861-866.
[16] Rangappaa D, Ichihara M, Kudo T, et al. Surface modified LiFePO4/C nanocrystals synthesis by organic molecules assisted supercritical water process[J]. Journal of Power Sources, 2009, 194(2): 1036-1042.
[17] Zhao L J, Zhang H J, Xing Y, et al.Morphology-controlled synthesis of magnetites with nanoporous structures and excellent magnetic properties[J]. Chemistry of Materials, 2008, 20(1): 198-204.
[18] Andersson A S, Thomas J O. The source of first-cycle capacity loss in LiFePO4[J]. Journal of Power Sources, 2001, 97/98: 498-502.
(编辑 陈灿华)
收稿日期:2011-03-10;修回日期:2011-05-28
基金项目:国家自然科学基金资助项目(20876178);中南大学粉末冶金国家重点实验室开放课题(107102138)
通信作者:唐新村(1972-),男,湖南郴州人,副教授,从事电化学、固相反应和材料化学研究;电话:13469431444;E-mail:tangxincun@163.com