愈创木酚与复合碳源共降解对黄孢原毛平革菌产酶的影响
冯冲凌,曾光明,黄丹莲,胡霜,苏峰峰,赵美花,赖萃
(湖南大学 环境科学与工程学院,湖南 长沙,410082)
摘 要:通过正交实验法,研究愈创木酚与复合碳源共降解对黄孢原毛平革菌产酶的影响,同时探讨不同分子结构对酶催化机制的影响。实验结果表明:同时添加愈创木酚及不同结构的碳源对该菌产酶有显著影响,高浓度的愈创木酚对产酶有明显的促进作用;在培养基中添加愈创木酚2 mmol/L、葡萄糖 2.5 g/L和糊精 5 g/L,可以显著提高黄孢原毛平革菌的综合产酶能力;黄孢原毛平革菌可以分泌纤维素酶和木聚糖酶,而且二者之间有较好的线性正相关关系。
关键词:愈创木酚;复合碳源;黄孢原毛平革菌
中图分类号:X172 文献标志码:A 文章编号:1672-7207(2010)04-1628-05
Influence of guaiacol and compounded carbon sources on enzymes of Phanerochaete chrysosporium
FENG Chong-ling, ZENG Guang-ming, HUANG Dan-lian, HU Shuang,
SU Feng-feng, ZHAO Mei-hua, LAI Cui
(College of Environmental Science and Engineering, Hunan University, Changsha 410082, China)
Abstract: The influence of guaiacol and compounded carbons sources co-degradation on enzymes of white-rot fungi was studied through the orthogonal experiment. The results show that carbons with different structures and guaiacol have remarkable effects on enzymes secreting by Phanerochaete chrysosporium. High concentration of guaiacol can enhance enzymes production. After optimumization of various factors, the addition of guaiacol 2 mmol/L, glucose 2.5 g/L, dextrine 5 g/L in culture medium can significantly promote enzymes production. CMCase and xylanase produced by Phanerochaete chrysosporium are little affected by exterior environment. According to the correlativity between the CMCase and the xylanase analyzed using linear regression, a positive correlation the CMCase and the xylanase is found.
Key words: guaiacol; compounded carbons; Phanerochaete chrysosporium
生物制浆是一种环境友好型技术,其实质是利用木素腐朽菌来分解植物组织中的大部分木素和部分半纤维素,使它们与植物组织中的纤维素彼此分离而形成纸浆的过程[1]。利用木素腐朽菌可以减少造纸废液中木质素及半纤维素含量,从而降低造纸废液的处理难度。木质素是被公认的难降解的高分子化合物,通常自然界中的木质素与纤维素、半纤维素相伴生,因此,在处理木质素过程中需要一个综合的产酶体系对其进行有效作用。Viilari等[2-3]在研究中指出,在生物制浆过程中,半纤维素酶可以除去纸浆在蒸煮过程中再次沉淀在纤维素表面的短链木聚糖,增加纤维的 可渗透性而将木素从纤维中提出;同时,半纤维素酶的酶解作用可以使木素-碳水合物复合体(LCC)在一定程度上水解,从而起到辅助脱除木素的作用。因此,为了高效高质量的制浆并缓解制浆的二次污染,在采用生物技术制浆时应尽可能选择木质素、半纤维素降解酶产率高而纤维素降解酶产率低的微生物。白腐菌可以选择性降解木质素,这种选择性真菌使木质素、纤维素和半纤维素腐烂的速度存在巨大的差异。正是由于该菌具有这样的特性,使得它在处理含木质素废液和废料中有广阔的应用前景[4-6]。将在液态培养条件下的白腐菌培养液作为粗酶液应用到处理含木质素废液或含木质素固体废料中既可以有效提高物料中生物酶的浓度,又可以避免菌体生长所带来的大量不确定因素。为此,本文作者在借鉴已有的液态培养产酶条件的基础上,进一步研究在液态培养条件下愈创木酚与复合碳源共降解对该菌产酶的影响,以期得到在此试验条件下的最优产酶条件。为了能在较少的实验次数内得到较多的信息,采用L8(4×24)的混合水平正交实验,通过对数据进行合理的统计分析,并结合各种新的添加物的自身特性,对其酶作用机理进行探讨和推断。
1 材料与方法
1.1 菌种来源
实验选用的菌种为白腐菌的典型种黄孢原毛平革菌(BKMF-1767),购于武汉大学中国典型培养物中心(CCTCC)。
1.2 菌种驯化
菌种接种在马铃薯培养基(PDA)上,于生化温度为35 ℃的培养箱中培养5 d用于后续实验。
1.3 培养基
培养基基础溶液成分为:KH2PO4 2.0 g/L, MgSO4?7H2O 0.5 g/L, 微量元素液70 mL。pH为自然值。微量元素成分为:NaCl 1.0 g/L,CoCl2?6H2O 0.18 g/L,Na2MoO4?2H2O 0.01 g/L,ZnSO4?7H2O 0.1 g/L,CaCl2 0.1 g/L,CuSO4?5H2O 0.01 g/L,MnSO4?H2O 0.5 g/L,FeSO4?7H2O 0.1 g/L,AlK(SO4)2?12H2O 0.01 g/L,MgSO4?7H2O 3.0 g/L,HBO3 0.01 g/L,NTA 1.5 g/L。在此基础上,添加愈创木酚的浓度为0~2.0 mmol/L,葡萄糖的质量浓度为2.5和5.0 g/L,糊精的质量浓度为2.5和5.0 g/L,酒石酸氨的质量浓度为15.4和30.8 mg/L。
1.4 产酶研究
按L8(4×24)的正交表分配法进行实验。选择有利于黄孢原毛平革菌产酶的结构简单和结构较为复杂的营养源,以质量浓度为2.5和5.0 g/L的葡萄糖和糊精进行任意组合,得到3种不同复合碳源的质量浓度梯度分别为5.0,7.5和10.0 g/L;愈创木酚的添加主要是针LiP酶和MnP酶自身特性来选择的。尽管酚类物质对这2种酶有独特的作用,但人们对此方面系统的研究报道很少。本实验针对此问题,选择了0.2,1.0和2.0 mmol/L这3种不同的浓度梯度,并以不添加愈创木酚的实验样做空白样。采用500 mL锥形瓶,分别装入200 mL培养基,灭菌后,每瓶接种约8.0×106个孢子悬液,于32 ℃暗箱震荡培养,每2 d取样测酶活。做3组平行样,酶活取平行样的平均值。
1.4.1 粗酶液的制备
在无菌条件下,取样4 mL,以6 000 r/min离心15 min,上清液即为粗酶液。
1.4.2 木素过氧化物酶(LiP)测定
取0.2 mL 藜芦醇溶液(10 mmol/L)、0.4 mL 酒石酸缓冲液(250 mmol/L,pH=3.0)与0.4 mL 粗酶液混匀,即得1 mL 反应液。在30 ℃下,于反应液中加20 μL H2O2溶液(20 mmol/L)启动酶促反应,以未加H2O2启动因子的反应液为参比,用紫外分光光度计(UV-2550)测定310 nm处2 min前后反应液吸光度的变化[7]。1个酶活力单位(U)定义为每分钟转化1 μmol底物所需的酶量。
1.4.3 锰过氧化物酶(MnP)测定
将0.211 3 g MnSO4溶解于1 L酒石酸缓冲液(50 mmol/L,pH=4.5)中,取0.8 mL该溶液与0.2 mL 粗酶液混匀,即得1 mL 反应液。在30 ℃,于反应液中加20 μL H2O2溶液(20 mmol/L)启动酶促反应,以未加H2O2启动因子的反应液为参比,用紫外分光光度计(UV-2550)测定290 nm处2 min前后反应液吸光度的变化[8]。
1.4.4 木聚糖酶(xylanase)和纤维素酶(CMCase)测定
用木聚糖和pH=4.8的醋酸缓冲液配成1%的木聚糖溶液。用羟甲基纤维素钠和pH=4.8的醋酸缓冲液配成1%的羟甲基纤维素纳溶液。按文献[9-10]中的测定方法测定木聚糖酶和纤维素酶。
2 结果
2.1 4种因素的最佳正交综合培养条件
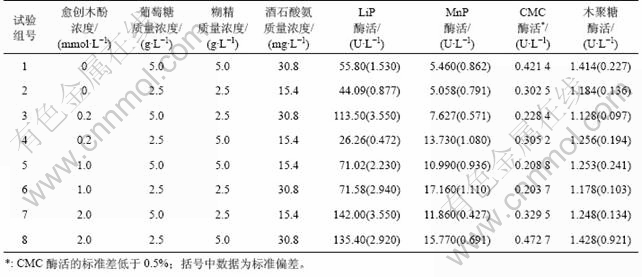
实验方案及实验结果见表1。从表1可以看出:在以愈创木酚与复合碳源共降解的条件下,该菌种的优化培养条件是:愈创木酚浓度为2 mmol/L,葡萄糖质量浓度为2.5 g/L,糊精质量浓度为5 g/L。
表1 正交试验各因素水平及试验结果
Table 1 Design and results of orthogonal test
2.2 复合碳源对产酶的影响
复合碳源对该菌产的4种酶的影响各不相同,对LiP酶,高浓度的葡萄糖和低浓度的糊精更有利于酶活的提高,此时,该酶最高活性可达到142.0 U/L;而对MnP酶、CMC酶及木聚糖酶,低浓度的葡萄糖和高浓度的糊精则更有利于相应各酶酶活的提高,最高酶活分别为13.73,0.472 4和1.428 U/L(表1)。
2.3 愈创木酚对产酶的影响
有研究表明:芳香化合物藜芦醇的存在可以有效提高白腐菌产酶[11],但藜芦醇价格昂贵,不宜大规模使用。故本实验以具有木素结构基本单元的愈创木酚作为诱导剂,结果如表2所示。可见:愈创木酚对该菌的产酶有着显著的影响,尤其对木素降解酶的产量影响最大。以未添加愈创木酚的实验组与添加过愈创木酚的实验组(表1)相对比发现:未添加实验组LiP酶与MnP酶的最高酶活分别为55.800 U/L和5.460 U/L,而添加了愈创木酚的实验组最高酶活分别可达到 142.000 U/L和17.160 U/L,分别提高了1.54倍和3.13倍。
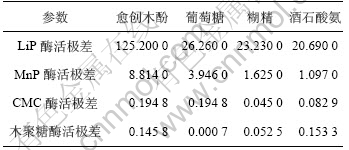
表2 各因素影响酶活的极差分析
Table 2 Range analysis of activities of enzymes with various factors
2.4 CMC酶与木聚糖酶的相互影响
黄孢原毛平革菌在其代谢过程中,不仅可以分泌有效降解木质素的氧化酶,同时也可以分泌可降解纤维素与半纤维素的CMC酶与木聚糖酶,但国内外关于这方面的研究报道很少。从表1可看出:与木素降解酶相比,愈创木酚及碳源浓度的变化对这2种酶的影响不是很明显,且这2种酶随愈创木酚及碳源浓度的变化也是有升有降,所表现出的规律性不强。对其进行极差分析(表2)可知,愈创木酚依然是对这2种酶影响最大的因素;同时,仅针对这2种酶而言,CMC酶的含量始终随木聚糖酶含量的改变而呈现近似线性改变。对实验结果进行回归分析(图1),发现2种水解酶呈较好的线性关系,得到木聚糖酶与CMC酶线性关系为:y=0.041 7x+1.073 6(相关系数R2=0.888 4)。

图1 木聚糖酶线性回归分析图
Fig.1 Regression analysis of aylanase and CMCase
3 讨论
以复合碳源作为该菌的营养源,在实验范围内,并非复合碳源浓度越高就越有利于产酶。单独针对糊精而言,LiP,MnP,CMC和木聚糖这4种酶均是在高浓度的糊精条件下活性较强,这可能与糊精的特殊结构有关,这与李越中等[12]在研究中得到的结论相似。β-糊精是由7个D-吡喃葡萄糖单元通过α-1和4-糖苷键连接形成富电性“锥筒”状空腔,它与客体分子复合时能改变客体分子的电性环境[13]。大量的研究表明[14]:环状糊精可以结合金属离子形成桥联环糊精,这2个相邻的环糊精空腔有可能协同参与对形状和尺寸适合的客体分子的包结配位作用,从而可以扩展分子键合能力,进而提高反应过程中的酶活性。LiP酶与MnP酶是典型的以金属离子为辅酶的氧化酶,因此,可能是由于部分酶分子中的辅酶与β-糊精形成桥联糊精后,酶分子在2个环糊精空腔中包结配位形成稳定性强的超分子配合物,由此导致酶分子与底物的结合活性和催化活性发生改变,进而提高酶的活性。此外,糊精可水解产生葡萄糖,而水解后所产生的葡萄糖又可以作为新的简单碳源被该菌有效利用,这可能是MnP酶、CMC酶及木聚糖酶即使在低浓度葡萄糖条件下也有较高酶活性的原因。故该菌可能利用低浓度的葡萄糖作为该菌产酶的启动碳源,此后葡萄糖与糊精可同时被利用,以此促进产酶。
木质素是由类苯丙烷单元结构组成的具有三维空间结构的芳香类化合物,它包围着纤维素,十分稳定,不易降解。因此,木质素降解既是地球上碳素循环的限速过程,也是植物纤维素材料被有效利用的关 键[14]。有研究指出[15-16]:对于一些难生物降解的芳香化合物,可以通过建立适当的代谢系统对其降解。加入与降解底物相似结构的化合物,这些化合物可以作为诱导底物,代谢底物之间可能发生相互作用,如电子传递等,从而促进底物的降解。Young等[17]指出:LiP酶在H2O2作用下被氧化成失去双电子的化合物,这种化合物可以通过酚型或其他培养基的2个单电子氧化作用回到原始状态。在培养基中添加芳香结构化合物愈创木酚,由于其具有酚型结构,可以作为LiP酶的电子授体,为LiP酶的酶促反应提供了很好的条件,这可能是添加愈创木酚可以提高该菌产酶的原因。添加愈创木酚同时对MnP酶也有很大的促进作用,这可能是因为MnP酶可以将酚环氧化成苯氧基自由基,这种化合物是很强的氧化剂,它还可以氧化非酚型芳香族化合物[18-19]。因此,当在培养基中添加愈创木酚时,增大了MnP酶将酚环氧化成苯氧基自由基的概率,也使得该酶的活性增强。在本实验中,除了实验组3和4外,愈创木酚对LiP酶与MnP酶的影响基本同步,都是随着愈创木酚浓度的增加,2种酶的活性也随之增加。对于实验组3和4出现的与其他实验组有很大差别的实验现象,这可能是因为愈创木酚的添加量为0.2 mmol/L是影响LiP酶与MnP酶分子的状态发生改变的阀值,在此条件下酶分子处于极不稳定的状态,因此,所测得的酶活性与其他情况下所测得的酶活性有显著差异,出现较大的波动。
在很多工业生产应用尤其是生物制浆过程中,最敏感的问题就是在脱木素工艺中伴随出现的纤维素降解现象[20]。此外,造纸工业中产生的造纸黑液常常因为含有大量的半纤维素使得废液黏度大,这也是造纸工业长期需要解决的难题之一[21]。
由表1和图1可以看出:黄孢原毛平革菌产半纤维素酶的能力远强于其产纤维素的能力,且二者之间存在着近似线性的关系。该结果若用于生物制浆的工艺控制,则可以通过控制纤维素酶的量得到一个既可以合理、有效地保存原料中纤维素的含量,又可以有效降解半纤维素的最优值。同时,由于黄孢原毛平革菌自身对木质素具有独特的强降解能力,因此,它在工业应用方面更具优势。
4 结论
(1) 实验选取的多种影响因素均对黄孢原毛平革菌产酶有不同影响。在实验所研究的因素范围内,愈创木酚与糊精浓度越高越有利于产酶。高浓度葡萄糖有利于LiP酶的酶活的提高,而低浓度葡萄糖有利于其他3种酶的酶活的提高。考虑到综合产酶能力及经济效应,选择低浓度的葡萄糖较佳。
(2) β-糊精与愈创木酚的特殊结构是影响黄孢原毛平革菌产酶的重要因素。
(3) 综合考虑实验因素得到最佳产酶条件为:愈创木酚2 mmol/L,葡萄糖 2.5 g/L,糊精 5 g/L。
(4) 黄孢原毛平革菌所产CMC酶与木聚糖酶受外界条件变化的影响不大,并且二者之间存在较好的线性关系。
参考文献:
[1] Gold M H, Alic M. Molecular biology of the lignin-degrading basidiomycete Phanerochaete chrysosporium[J]. Microbiol Rev, 1993, 57(3): 605-622.
[2] Viilari L, Sundquist J, Kettunen J. Xylanases enzymes promote pulp bleaching[J]. Paperri ja Puu-Paper and Timber, 1991, 73(5): 384-389.
[3] Vallet C, Lemaire G, Monties B, et al. Cell wall fractionation of alfalfa stem in relation to internode development: Biochemistry aspect[J]. Agricultural and Food Chemistry, 1998, 46(9): 3458-3467.
[4] Tatarko M, Bumpus J A. Further studies on the inactivation by sodium azide of lignin peroxidase from Phanerochaete chrysosporium[J]. Archives of Biochemistry and Biophysics, 1997, 339(1): 200-209.
[5] Macarena S, Fernando L L, Mónica V, et al. Incomplete processing of peroxidase transcripts in the lignin degrading fungus Phanerochaete chrysospoium[J]. FEMS Microbiology Letters, 2005, 242(1): 37-41.
[6] Martinez A T. Molecular biology and structure- function of lignin-degrading heme peroxidases[J]. Enzyme and Microbal Technology, 2002, 30(4): 425-444.
[7] Tien M, Kirk T K. Lignin peroxidase of Phanerochaete chrysosporium[J]. Methods in Enzyology, 1988, 161(2): 238-249.
[8] Hofrichter M, Frische W. Depolymerization of low-rank coal by extracelluar fungal enzyme systems: the ligninolytic enzymes of the coal-humic-acid-depolumerizing fungus Nematoloma frowardii b19[J]. Applied Microbiology Biotechnology, 1997, 47(4): 419-424.
[9] Adriane M F, Milagres R M, Sales E. Evaluating the basidiomycetes Poriamedula-pani and Wolfiporia cocos for xylanase production[J]. Enzyme and Microbial Technology, 2001, 28(6): 522-526.
[10] Machuca A, Ferraz A. Hydrolytic and oxidative enzymes produced by white- and brown-rot fungi during Eucalyptus grandis decay in solid medium[J]. Enzyme and Microbial Technology, 2001, 29(6): 386-391.
[11] Greg R J, Sutherland A K, Steven D A. The effect of veratryl alcohol on manganese oxidation by lignin peroxidases[J]. Archives of Biochemistry and Biophysics, 1996, 327(1): 20-26
[12] 李越中, 高培基, 王祖农. 黄孢原毛平革菌合成木素过氧化物酶的营养调控[J]. 微生物学报, 1994, 34(1): 29-36.
LI Yue-zhong, GAO Pei-ji, WANG Zu-nong. Nutritional regulation of synthesis of lignin peroxidase by Phaneroochate Chrysosporium ME-446[J]. Acta Microbiologica Sinica, 1994, 34(1): 29-36.
[13] 赵明刚, 郝爱友. 环糊精在有机合成中的立体控制性能[J]. 化学通报, 2006, 69(1): 1-8.
ZHAO Ming-gang, HAO Ai-you. Stereoselective ability of cyclodextrin in organic synthesis[J]. Chemistry, 2006, 69(1): 1-8.
[14] Schlatter A, Kunda M K, Woggon W D. Enantioselective reduction of aromatic and aliphatic ketones catalyzed by ruthenium complexes attached to beta-cyclodextrin[J]. Angewandte Chemie International Edition, 2004, 43: 6731-6734.
[15] 马登波, 刘紫鹃, 高培基, 等. 木素生物降解的研究进展[J]. 纤维素科学与技术, 1996, 4(1): 1-12.
MA Deng-bo, LIU Zi-juan, GAO Pei-ji, et al. Advance in the research of lignin biodegradation[J]. Journal of Cellulose Science and Technology, 1996, 4(1): 1-12.
[16] Fara F, Gioia D D, Marchetti L. Characterization of pigment produced by pseudeamonas fluorencens during 3-Chlorobenzoate cometabolism[J]. Chemosphere, 1993, 26(8): 1424-1429.
[17] Young R A, Akntar M. Environmentally friendly technologies for the pulp paper industry[M]. New York: John Wiley and Sons, 1998: 142-143.
[18] Hofrichter M, Scheibner K, Schneega I, et al. Enzymatic combustion of aromatic and aliphatic compounds by manganese peroxidase from Nematoloma frowardii[J]. Applied and Enviromental Biotechnology, 1998, 64(2): 399-404.
[19] Jensen Jr K A, Bao W, Kawai S, et al. Manganese dependent cleavage of nonphenolic lignin structures by Ceriporsis subvermispora in the absence of lignin peroxidase[J]. Applied and Environmental Microbiology, 1996, 62(10): 3679-3686.
[20] 王彩华, 余惠生, 付时雨. 贝壳状革耳菌和黄孢平革菌固体培养酶系比较[J]. 微生物学报, 1999, 39(2): 127-131.
WANG Cai-hua, YU Hui-sheng, FU Shi-yu. Comparison of lignocellulolyic enzyme profiles secreted by Panus Conchatus and Phaneroochate Chrysosporium during solid state cultures[J]. Acta microbiologica sinica, 1999, 39(2): 127-131.
[21] Sun J X, Xu F, Sun X F, et al. Physico-chemical and thermal characterization of cellulose from barley straw[J]. Polymer Degradation and Stability, 2005, 88(3): 521-531.
收稿日期:2009-09-06;修回日期:2009-12-26
基金项目:国家重点基础研究发展规划(“973”计划)项目(2005CB724203);国家杰出青年科学基金资助项目(50425927);国家教育部长江学者和创新团队发展计划项目(IRT 0719);国家自然科学基金青年科学基金资助项目(50808073);湖南省环境保护科技项目(2007185)
通信作者:曾光明(1962-),男,湖南华容人,教授,博士研究生导师,从事堆肥中微生物技术研究;电话:0731-88822754;E-mail: zgming@hnu.cn
(编辑 赵俊)