钌盐提纯和高纯钌粉制取的理论与实验研究
来源期刊:稀有金属2016年第8期
论文作者:章德玉 唐晓亮
文章页码:796 - 805
关键词:钌盐酸溶液;氧化;真空蒸馏;硫化钌;高纯钌粉;
摘 要:钌的精炼过程分为钌盐的精制和高纯钌的制取两个步骤。本文以氧化还原标准电极电位作为选择性氧化分离锇、钌的判据,从理论上分析了采用二段分步氧化蒸馏分离锇、钌的必要性和可行性。研究了氧化-真空蒸馏方法从一次钌盐酸吸收液中,一段氧化加入H2O2选择性氧化-真空蒸馏分离锇,使钌盐酸溶液中的锇被选择氧化而以OsO4气体单独蒸馏出来并被NaOH溶液吸收,而未氧化的钌则留在蒸馏余液中;之后在分离锇后的一次钌盐酸蒸馏余液中,二段氧化加入H2SO4+NaClO3进行氧化-真空蒸馏分离钌和残留的锇。氧化蒸馏出的RuO4经HCl吸收并还原得到精制的二次钌盐酸溶液,进一步经硫化钠结晶沉淀提纯制得高纯硫化钌盐,并对沉钌过程做了初步的理论分析。所得精制硫化钌沉淀物在氢气氛围下煅烧还原制得高纯海绵钌,海绵钌经王水与氢氟酸混合酸煮洗后水洗,在氢气氛围下干燥后制得的钌粉经辉光放电质谱法(GDMS)分析,纯度达到4N5(99.995%)以上,可直接用于溅射靶材。本研究为靶材用5N(99.999%)高纯钌粉的制备及其工业化生产提供了理论和实验依据。
网络首发时间: 2015-04-23 15:59
稀有金属 2016,40(08),796-805 DOI:10.13373/j.cnki.cjrm.2016.08.009
章德玉 唐晓亮
天水师范学院化学工程与技术学院
兰州大学化学化工学院
钌的精炼过程分为钌盐的精制和高纯钌的制取两个步骤。本文以氧化还原标准电极电位作为选择性氧化分离锇、钌的判据,从理论上分析了采用二段分步氧化蒸馏分离锇、钌的必要性和可行性。研究了氧化-真空蒸馏方法从一次钌盐酸吸收液中,一段氧化加入H2O2选择性氧化-真空蒸馏分离锇,使钌盐酸溶液中的锇被选择氧化而以OsO4气体单独蒸馏出来并被NaOH溶液吸收,而未氧化的钌则留在蒸馏余液中;之后在分离锇后的一次钌盐酸蒸馏余液中,二段氧化加入H2SO4+NaClO3进行氧化-真空蒸馏分离钌和残留的锇。氧化蒸馏出的RuO4经HCl吸收并还原得到精制的二次钌盐酸溶液,进一步经硫化钠结晶沉淀提纯制得高纯硫化钌盐,并对沉钌过程做了初步的理论分析。所得精制硫化钌沉淀物在氢气氛围下煅烧还原制得高纯海绵钌,海绵钌经王水与氢氟酸混合酸煮洗后水洗,在氢气氛围下干燥后制得的钌粉经辉光放电质谱法(GDMS)分析,纯度达到4N5(99.995%)以上,可直接用于溅射靶材。本研究为靶材用5N(99.999%)高纯钌粉的制备及其工业化生产提供了理论和实验依据。
中图分类号: TF838
作者简介:章德玉(1969-),男,甘肃张掖市人,博士,副教授,研究方向:化学冶金、过程强化技术;电话:0938-8367717;E-mail:zhangdeyudeyu@163.com;
收稿日期:2015-03-17
基金:国家自然科学基金项目(21371083)资助;
Zhang Deyu Tang Xiaoliang
College of Chemical Engineering and Technology,Tianshui Normal University
College of Chemistry and Chemical Engineering,Lanzhou University
Abstract:
Ruthenium refining process could be pided into two steps which were purification of ruthenium salt and preparation of high-purity ruthenium powder. In this paper,the necessity and feasibility of separation osmium and ruthenium from each other by selective oxidation and vacuum distillation pided into two steps were analyzed theoretically,based on the redox standard electrode potential as a criterion of the selective oxidation separation for osmium and ruthenium. The first step was separating osmium oxidized from ruthenium hydrochloric acid absorption liquid by H2O2 selective oxidation and vacuum distillation,in which ruthenium was not oxidized and still in ruthenium hydrochloric acid distillation-residue. Osmium tetroxide( OsO4),which formed in the process of oxidation and vacuum distillation,was absorbed in sodium hydroxide solution. And the second step,which was separating ruthenium oxidized and residual osmium oxidized from the first step's residue by oxidation and vacuum distillation with the addition of H2SO4 and NaClO3,were studied. Ruthenium tetroxide( RuO4),which formed in the process of the second step,was absorbed in hydrochloric acid solution and purified ruthenium hydrochloric acid absorption liquid was gotten. Pure ruthenium sulfide crystals could be obtained by crystallizing and precipitating the purified ruthenium hydrochloric acid absorption liquid with sodium sulfide,and all kinds of phenomena in the process were explained in theory. Sponge ruthenium powder was prepared by sintering the resultant ruthenium salt under the optimum operation condition of the sinter and reduction in hydrogen atmosphere. The sponge ruthenium powder was washed first by a mixed solution of aqua regia and hydrofluoric acid,and further washed by water before drying. The purity of prepared ruthenium powder was at least99. 995% excluding the gaseous ingredient elements analyzed by glow discharge mass spectrometry( GDMS),and could be used for preparing high-purity ruthenium sputtering target. This study provides the theoretical and experimental basis for industrialized production of high-purity ruthenium powder with purity of 5N( 99. 999%).
Keyword:
ruthenium hydrochloric acid solution; oxidation; vacuum distillation; ruthenium sulfide; high-purity ruthenium powder;
Received: 2015-03-17
钌的盐酸溶液是一种化工中间体原料,同时也是制备粗钌粉和高纯钌的原料
相对Os,Ru而言,目前主要用氯化铵沉淀法分离贵贱金属,对其研究和应用较多,而用硫化物沉淀法(如Na2S,H2S,(NH4)2S沉淀法等)分离贵贱金属的理论基础研究和应用很少
由于钌盐的精制和高纯钌粉的研究刚刚起步,国内目前只有少量关于钌吸收液提纯(钌盐进行精制)
为此,本研究目的是针对钌吸收液的提纯、钌盐精制和高纯钌制取技术存在的不足,对拟采用的方法和措施,通过理论分析和实验研究,克服现有技术的不足,制备出靶材用的纯度不低于4N5(99.995%)的高纯钌粉。
1 理论分析
以氧化还原标准电极电位作为选择性氧化分离锇、钌的判据,对拟采用的二段分步氧化蒸馏分离锇、钌及其钌与其他铂族金属以及贱金属,进行初步理论分析,含钌盐酸溶液的精制二段分步氧化蒸馏技术是指:第一段选择性氧化蒸馏分离锇,使钌溶液中的锇被选择氧化而单独蒸馏出来,而钌不被氧化则留在蒸馏余液中,选择性氧化剂选用H2O2;第二段在蒸馏余液中加入强氧化剂氧化蒸馏钌和残留的锇,选用H2SO4+Na Cl O3作为强氧化剂氧化钌,使锇、钌分离更彻底,同时实现钌与其他铂族金属以及贱金属分离,最终制得高纯的钌盐酸吸收液。
要达到选择性氧化蒸馏分离锇、钌的目的,必须具备以下3个条件:(1)在不同的氧化剂的条件下氧化蒸馏时,盐酸溶液中的锇、钌的氧化反应性能有差别;(2)生成的四氧化物的快慢有区别,即具有选择性;(3)生成的四氧化物在酸、碱吸收液中的氧化还原反应有差别。
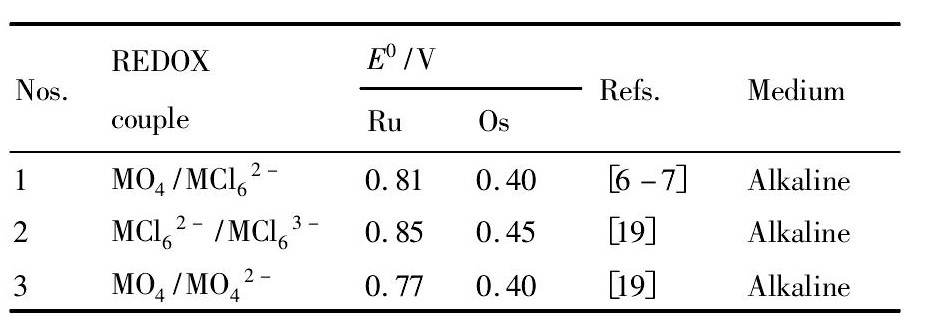
锇、钌的重要的氧化还原电对的标准电极电位值如表1所示,锇、钌四氧化物的标准生成自由焓如表2所示,Na Cl O3和H2O2氧化还原电对的标准电极电位如表3所示。
从表1看出,所有标准氧化还原电对的电位值E0均为正值,根据ΔG0=-n FE0,其中:ΔG0为吉布斯标准自由能,k J·mol-1;n为转移电荷的物质的量,mol;F为法拉第常数,大小为96486.70C·mol-1,E0为标准电极电位,V。这些反应的正向反应均能自发进行,而且存在一定规律:
表1 锇、钌氧化还原电对的标准电极电位E0值Table 1Standard electrode potential E0value of osmium and ruthenium REDOX couple* 下载原图
*:M standing for Os,Ru
表1 锇、钌氧化还原电对的标准电极电位E0值Table 1Standard electrode potential E0value of osmium and ruthenium REDOX couple*
表2 锇、钌四氧化物的标准生成自由焓ΔG0Table 2Standard formation free enthalpy of Ru O4and Os O4 下载原图

表2 锇、钌四氧化物的标准生成自由焓ΔG0Table 2Standard formation free enthalpy of Ru O4and Os O4
表3 Na Cl O3和H2O2氧化还原电对的标准电极电位E0Table 3Standard electrode potential value E0of Na Cl O3and H2O2REDOX couple 下载原图
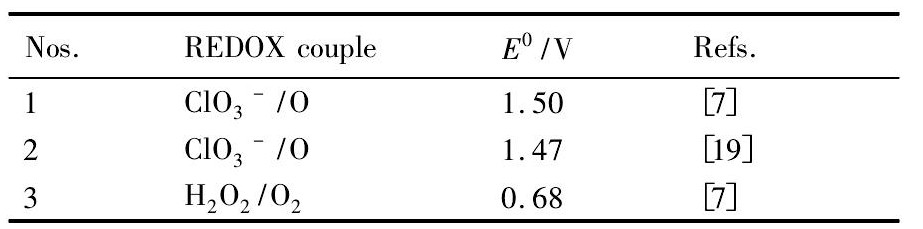
表3 Na Cl O3和H2O2氧化还原电对的标准电极电位E0Table 3Standard electrode potential value E0of Na Cl O3and H2O2REDOX couple
(1)逆向反应,E0取负值,则逆反应ΔG0>0,即氧化反应不能自发进行,必须有相当强的氧化剂参与才能发生。如3号样品中Os的MO4/MO42-氧化还原电对的值比Ru的小得多,意味着Os的MO4/MO42-更易被氧化;
(2)从表1进一步得出:在酸性溶液中,要使Os O4挥发,关键是利用Os O4/Os Cl62-的平衡关系,该电对的标准氧化还原电位为0.40 V,只要用氧化电位高于0.40 V的氧化剂即可使Os(Ⅵ)氧化为Os(Ⅷ)。热力学计算认为,只要两个氧化还原的标准电极电位高于0.3 V,即可使氧化反应进行完全。因此选择氧化电位高于0.7 V的氧化剂,即可使Os O42-完全氧化为Os O4。要使Ru O4挥发,也需利用Ru O4/Ru Cl62-的平衡关系,该电对的标准氧化还原电位为0.81 V,只要用氧化电位高于1.1V的氧化剂即可使Ru O42-完全氧化为Ru O4挥发。
从表2看出,锇、钌四氧化物的标准生成自由焓ΔG0相差较大,固体Ru O4的ΔG0值几乎是固体Os O4的一倍,固体Os O4的ΔG0与气体Os O4的ΔG0几乎相等,可以猜测固体Ru O4的ΔG0与气体Ru O4的ΔG0也相当。且ΔG0<0,过程能自发进行,说明Os O4更易生成。
从表3中可以看出,H2O2/O2电对的标准氧化还原电位E0值为0.68 V,Cl O3-/O电对的标准氧化还原电位E0值为1.47 V。把它们与Ru,Os的MO4/MCl62-电对的标准氧化还原电位E0值相比较,有如下的数据关系式:0.40 V<0.68 V≈0.7V<0.8 V<1.1 V<1.47 V,相应有如下对应的关系不等式:
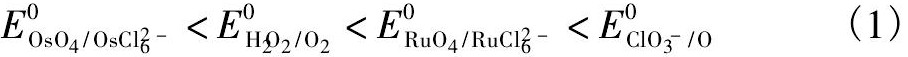
从关系式(1)进一步说明H2O2作为选择性氧化剂,只能使Os(Ⅳ)氧化为Os(Ⅷ),而Ru(Ⅳ)不被氧化;Na Cl O3作为氧化剂,不仅Ru(Ⅳ)氧化为Ru(Ⅷ),而且残余的Os(Ⅳ)彻底被氧化为Os(Ⅷ)而挥发出来。
综上所述,Os要比Ru更容易被氧化为四氧化物。依据其特性可以采用二段氧化蒸馏方法,达到Os,Ru的相互分离、Ru与其他铂族金属及其贱金属的分离。
2 实验
2.1 原料、试剂及仪器
原料:贵金属矿经氧化蒸馏分离锇、钌所得的一次钌盐酸吸收液(盐酸浓度为3 mol·L-1),经电感耦合等离子体原子发射光谱法(ICP-MS)和电感耦合等离子体质谱仪(ICP-AES)对溶液分析,其成分见表4所示。
实验试剂:AR双氧水、AR氯酸钠、AR硫酸、AR氢氧化钠、GR盐酸、GR无水乙醇、MOS硫化钠、MOS盐酸、二次蒸馏水、MOS硝酸、MOS氢氟酸、AR硫脲、5N高纯氮气、5N高纯氢气。
实验设备:SH-3A双显加热磁力搅拌器、PXD-2通用离子计、SHZ-ⅢB防腐循环水真空泵、自制氧化真空蒸馏装置一套、CH-2015超级恒温槽、1000 mlφ47/50 mm不锈钢杯式过滤器、ZDF-1真空干燥箱、SK2-6-12管式电阻炉。
测试仪器:ICP-MS X 7分析仪、ICP-AESⅡ分析仪,OH-900分析仪,VG-9000辉光放电质谱(GDMS)分析仪,JSM-6300扫描电子显微镜(SEM)。
2.2 实验方法
钌盐的提纯和高纯钌粉制取工艺流程见图1所示。
2.2.1 钌盐酸溶液的提纯方法
每批以一次钌盐酸吸收液为原料,体积取6 L,在自制的蒸馏瓶氧化-真空蒸馏装置中进行一段氧化真空蒸馏赶锇、二段氧化真空蒸馏提钌过程,氧化-真空蒸馏反应器实验装置如图2所示。由于原料为贵金属,原则上正交试验的次数尽可能减少。分析影响一段氧化-真空蒸馏赶锇试验的主要因素和水平分别为:反应温度T(℃)(60,75,90)、真空度Δp(k Pa)(20,40,60),30%H2O2反应当量倍数ω(1.0,1.2,1.5)(假设Ru全部以Ru(Ⅲ)存在),在反应时间为40 min的条件下,不考虑交互作用的情况下选用L9(34)正交设计表安排一段氧化真空蒸馏赶锇实验;以赶锇后的一次钌盐酸蒸馏余液为原料,分析影响二段氧化-真空蒸馏提钌试验的主要因素和水平分别为:反应温度T(℃)(60,70,80,90)、真空度Δp(k Pa)(20,30,40,50)、35%NaCl O3反应当量倍数ω1(1.0,1.2,1.5,2.0)、9mol·L-1H2SO4的反应当量倍数ω2(1.0,1.2,1.5,2.0),在反应时间以硫脲棉球在测气管路中检测不显色为准的条件下,不考虑交互作用的情况下选用L16(45)正交设计表安排二段氧化真空蒸馏提钌实验;在氧化-真空蒸馏过程中,逸出的气体进入三级HCl(3 mol·L-1HCl+0.5%C2H5OH)吸收瓶吸收挥发出来的Ru O4气体,再经过二级Na OH(20%Na OH+0.5%C2H5OH)溶液吸收瓶吸收微量的挥发出来的Os O4气体。以正交试验所得的最佳操作条件,经一段氧化-真空蒸馏赶锇、二段氧化-真空蒸馏提钌过程。用ICP分析仪对一段氧化蒸馏赶锇后的含钌余液和二段氧化蒸馏分离钌后所得的二次钌盐酸吸收液的成分进行分析,并计算赶锇率εOs和提钌率εRu。蒸馏率ε:
表4 不同钌盐溶液的成分ICP分析Table 4 Compositions of different ruthenium salt solution liquids by ICP 下载原图

*:M'/Ru being ratio of impurities content and Ru content,respectively
表4 不同钌盐溶液的成分ICP分析Table 4 Compositions of different ruthenium salt solution liquids by ICP

式中,M'为吸收液中Ru或Os的浓度,M'0为原液中Ru或Os的浓度,mg·L-1;V'为吸收液体积,V'0为原液体积,L。
一段氧化-真空蒸馏赶锇过程中的主要反应式有:
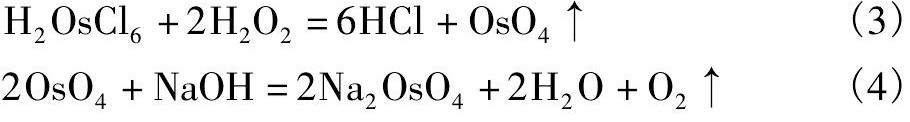
一段氧化-真空蒸馏赶锇过程中发生的副反应有:
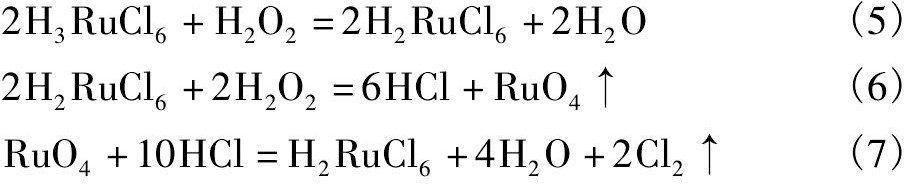
二段氧化-真空蒸馏提钌过程中的主要反应式有:
图1 钌盐的提纯和高纯钌粉制取工艺流程图Fig.1Technological process of purification of ruthenium salt and production of high-purity ruthenium
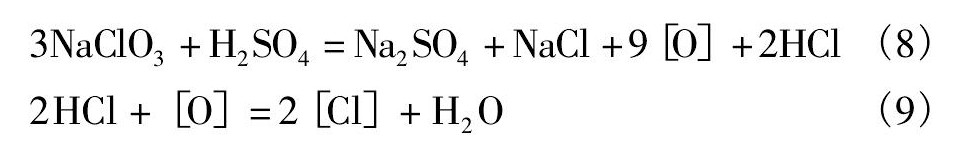
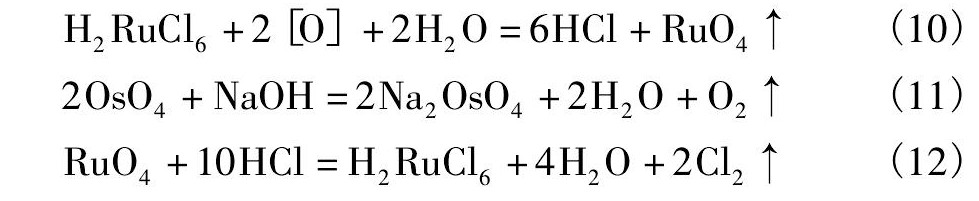
二段氧化-真空蒸馏提钌过程中的主要反应式有:
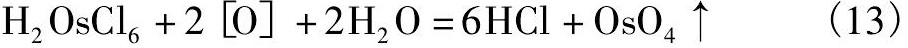
2.2.2 高纯硫化钌盐的精制方法
每批以二段氧化-真空蒸馏提钌后的一定浓度的纯钌盐酸吸收液100 ml和10%硫化钠为原料,加入不同量的Na2S在结晶反应器中对一定浓度和定量的纯钌盐酸吸收液进行结晶沉钌实验,得到不同p H值的反应体系。用PXD-2型通用离子计测定p H值(精确度为0.01 p H)后,在磁力加热搅拌器中加热煮沸30 min,停止加热,自然降温并继续搅拌10 min,放置3~4 h,析出褐黑色沉淀。之后补加一定量的二次蒸馏水回复溶液原有体积,再次测定p H,滤出沉淀。将所得的褐黑色硫化钌结晶沉淀物先后用热的6 mol·L-1HCl溶液和二次蒸馏水各洗涤一次,沉淀过滤后在100~150℃下烘干,用20 ml高纯H2SO4使之浆化,之后加入二次蒸馏水稀释至体积100 ml,放置1 h后,用ICP分析仪对配置含钌硫酸溶液中的Ru及其杂质元素含量进行分析,并计算沉钌率η。

式(14)中,M为硫化钌硫酸水溶液中Ru的浓度,M0为钌盐酸溶液中Ru的浓度,mg·L-1;V为相应溶液体积,V0为相应溶液体积,L。
硫化钠结晶沉钌、酸洗过程的主要反应有:
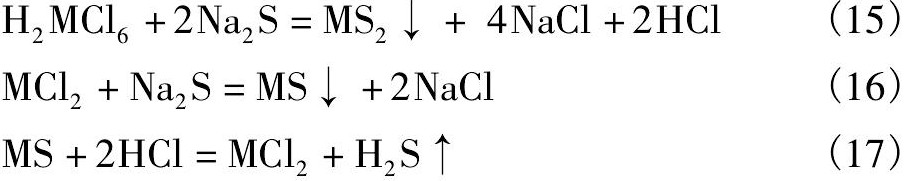
其中:反应(15),(16)分别为贵金属、贱金属与硫化钠的沉淀反应;反应(17)为贱金属硫化物与盐酸的溶解反应。
2.2.3 海绵钌的提纯和高纯钌粉的制取方法
将所得每批次褐黑色的硫化钌经烘干后装入石英舟中,放入管式炉内在不同的煅烧、还原条件下通氮煅烧、通氢还原,得到银灰色的高纯海绵钌。
实验所得最佳煅烧、还原条件为:将烘干的褐黑色的硫化钌粉末,装入石英舟中,放入管式炉内在1 h内均匀升温至200℃,然后在此温度下保温1 h,再在通氮氛围下于2 h内升温至800℃,并保温1 h。之后在通氢气氛围下于1 h内缓慢升温至800~1100℃,通氢氛围下保温1 h,继续通氢氛围下停止加热降温至600℃,最后在通氮氛围下自然降温至常温。
将煅烧还原得到的高纯海绵钌,针对超标杂质元素含量,依据金属溶解方法原理,用合适的方法去除,经烘干得到最终产品高纯钌粉。用SEM照片分析产品的形貌和粒度,用GDMS分析钌粉的纯度。
图2 氧化-真空蒸馏反应器实验装置图Fig.2 Experimental device of oxidation-vacuum distillation reactor
1-Oil bath heaters;2-Quartz distillation bottle;3,4-Constant pressure drop funnel;5,9,12-Triple-valve;6,7,8-Hydrochloric acid absorption bottle;10,11-Alkali absorption bottle;13-Buffer vacuum bottle;14-Two-way valve;15-Vacuum pump
硫化钌煅烧还原过程中主要的反应式有:
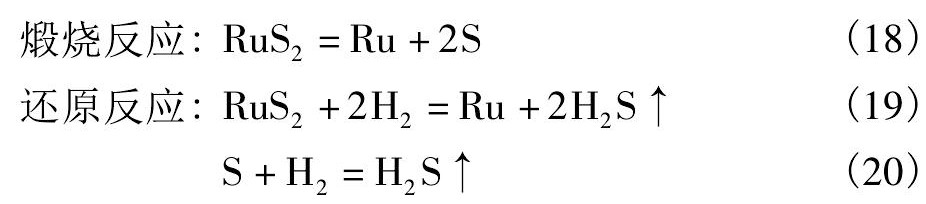
3 结果与讨论
3.1 钌盐酸溶液的提纯
正交及优化试验得出最佳工艺条件。一段氧化-真空蒸馏赶锇的最佳操作条件为:反应温度T=90℃,H2O2反应当量倍数为1.2倍、真空度为60 k Pa、反应时间为40 min的条件下赶锇,用ICP分析仪对赶锇后的含钌余液的锇进行分析,并计算赶锇率εOs可达80%以上;二段氧化-真空蒸馏提钌的最佳操作条件为:反应温度T=80℃,Na Cl O3反应当量倍数为1.5倍、H2SO4反应当量倍数为1.2倍,真空度为40 k Pa下提钌,氧化蒸馏操作时间10 h后,检测几乎无Ru O4气体溢出,反应结束。之后对所得总体积为6 L(三级吸收液合并)的二次钌盐酸吸收液的成分进行分析,并计算提钌率εRu和总赶锇率εOs,分析结果如表4所示。
由表4可以看出,采用二段氧化-真空蒸馏锇、钌,分步蒸馏的反应温和、安全,达到Os,Ru的较彻底的分离和Ru与其他铂族金属及其贱金属的有效分离。所得二次钌盐酸吸收液具有显著的提纯效果,必控杂质元素含量除Na外都有不同幅度地降低。说明该技术理论分析合理,实际应用可行。但由于氧化蒸馏耗时长效率低而导致提钌率较低,提钌率达97%左右。总赶锇率高达92%左右。
3.2 高纯硫化钌盐的精制
硫化钠结晶沉钌实验结果见表5所示。
硫化钠沉钌实验现象:溶液开始变蓝,并有褐黑色的沉淀析出,反应速度很慢,有H2S气体放出。
由表5 Na2S沉钌实验结果可以看出:反应体系的p H值随着Na2S加入量的增大而非线性增大;同时,沉钌率随着Na2S加入量的增大而出现先增大后逐渐减小的变化规律,沉钌率出现最大值。具体是:当加入Na2S后,p H≤7时,几乎不产生沉淀或产生少量的沉淀;当加入Na2S后,8<p H<9时,Ru S2沉淀完全,并且沉淀率可达99%左右;当加入Na2S后,p H>9.5时,沉钌率又下降,在p H=9.8时,沉钌率仅为13.51%,在p H=10.6时,几乎不沉淀。硫化钠结晶沉钌的最优工艺条件如下:当加入Na2S后,控制p H值在8.5左右时,沉钌彻底,且沉钌率可达99%以上。
表5 硫化钠沉钌实验结果Table 5Experimental results of ruthenium sulfide obtained with sodium sulfide crystals precipitation method 下载原图
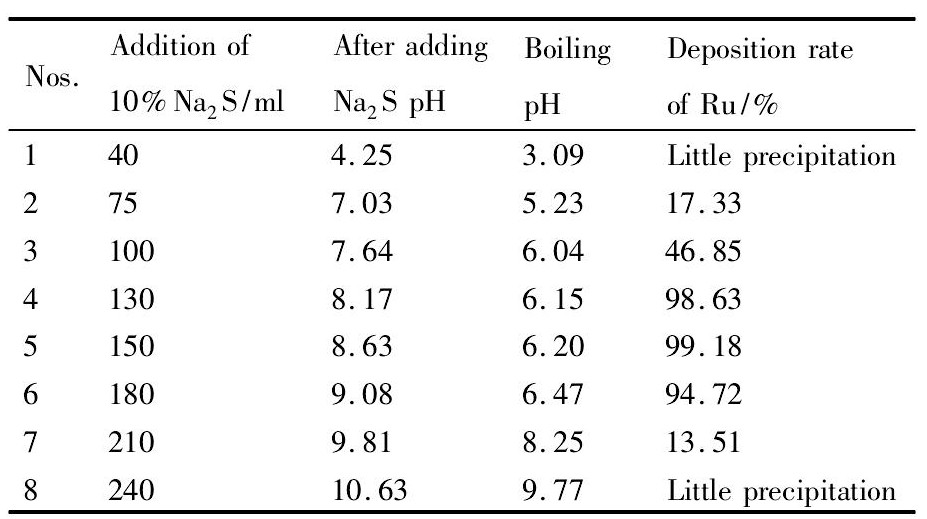
表5 硫化钠沉钌实验结果Table 5Experimental results of ruthenium sulfide obtained with sodium sulfide crystals precipitation method
由表5可以看出,在Na2S加入的过程和反应的过程中,体系的p H值发生一种特殊变化。最初p H值随Na2S的加入而升高。如控制Na2S用量至体系p H值在不超过7时,则溶液在放置中轻微浑浊,析出微量的硫化物沉淀,p H值下降到5左右;如控制Na2S用量至体系p H值在7~8时,则溶液在放置中逐渐浑浊,析出少量的硫化物沉淀,p H值下降到6左右;如控制Na2S用量至体系p H值在8~9时,则溶液在放置中逐渐浑浊,析出大量的硫化物沉淀,p H值大幅下降到6.2左右。整个过程都出现“p H值回降”现象。当Na2S加至体系p H值超过10时,则溶液变得透明,不再有沉淀析出,p H值略微下降。
这说明Na2S与铂族金属离子的反应,不能用现有的硫化物沉淀理论来解释。对于硫化物与铂族金属离子反应机制的解释不多。产生这种现象的理论解释还有待于进一步研究。
产生这种显现的理论解释如下:
Na2S与铂族金属离子的反应,不能用现有的硫化物沉淀理论来解释。
Na2S与Ru配离子的硫化沉淀反应,可以归类为八面体配离子与硫化物反应的范畴,但目前较少有这方面的实质性研究文献。
[Ru Cl6]2-为d4电子组态的正八面体构型,6个配体将金属离子团团围住。根据价键理论,Ru(Ⅳ)还留有4个d电子,填充到dxy,dyz和dzx,余下的两个空d轨道同s轨道和p轨道组成d2sp3杂化,并为六个配体Cl-所占用,这种构型的配离子比较稳定。
Na2S极易水解,水解产生的SH-参与反应,反应式为:
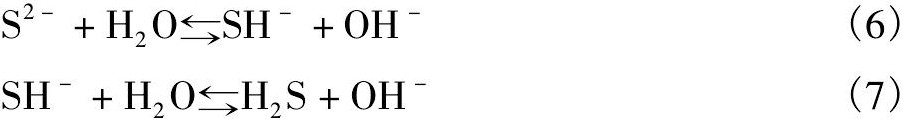
当Na2S水解产生的SH-与Cl-发生交换反应时,随着Na2S用量的不同,可以有1个、2个,以至6个SH-进入配离子内界,然后释放出H+,析出硫化物沉淀或形成硫化钌盐,因而出现了复杂的反应现象。
由于部分Ru(Ⅳ)被Na2S还原成Ru(Ⅲ),出现溶液变蓝现象。
由于SH-不能与正八面体配阴离子的中心离子直接接触,必须待配离子的一个配体Cl-脱开后发生交换,因此反应速度缓慢,一部分SH-将与体系中的H+结合,放出H2S。同时,由于H+的消耗及从Na2S溶液中带入OH-,体系的p H值将不断上升。
当Na2S的加入量较少时,进入[Ru Cl6]2-配离子内界的SH-数量不多,产生的混合配位基配离子不稳定,从内界缓慢放出H+,析出Ru S2沉淀,这就出现了“p H值回降”现象,其反应式可推测为:

当Na2S的加入量较多,体系的p H>10后,[Ru Cl6]2-中的Cl-可全部被SH-取代,生成六琉基配离子,此时溶液已呈碱性,这种配离子将放出H2S,生成可溶性的硫代盐配合物,导致沉钌率下降。推测过程反应式如下:
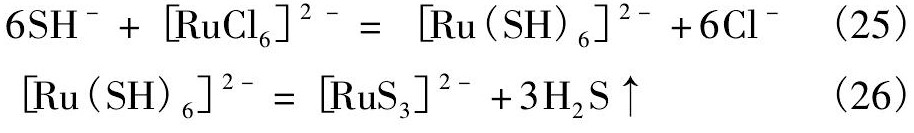
经硫化钠结晶沉淀生成的Ru S2结晶沉淀按前述的2.2.2节中洗涤方法洗涤和配置含钌硫酸溶液,分析溶液的Ru含量和必控杂质元素含量,分析结果如表6所示。
由表6可以看出,对Ru S2沉淀物的主元素Ru及其试液超标杂质元素含量分析,经Na2S沉钌后的Ru S2沉淀物先用热的6 mol·L-1高纯HCl溶液煮洗一次,再用二次蒸馏水洗涤一次过滤后,原超标杂质元素含量都有不同幅度的降低,所得Ru S2纯度更高,可直接用于高纯钌粉的制备。但超标杂质元素仍为Fe,Si,尤其Si很难去除;部分碱金属杂质离子如Na离子超标。其原因分析如下:由于在硫化钠沉钌过程中,Na2S与溶浓中的铂族金属及某些贱金属一起生成硫化物沉淀,与钌形成共沉淀,贱金属沉淀完全,而铂族金属形成硫化物的倾向却是有区别的,沉淀的条件差别很大,Pd,Os,Ru较易沉淀,而Pt,Rh,Ir不易沉淀。之后用盐酸煮洗把沉淀中的贱金属硫化物溶解,从而实现贵、贱金属的分离;Si超标主要是由钌原料本身含Si以及石英玻璃容器被酸性气体腐蚀带入所致;Na等碱金属超标是由于Na2S沉淀剂容易带入更多的Na等其他碱金属杂质离子到反应液中,导致Ru S2沉淀物中碱金属杂质离子偏高,增加水洗次数可以很好地脱除钠等碱金属,但又导致钌的流失。
表6 海绵钌和高纯钌粉GDMS分析结果Table 6 Composition of sponge ruthenium and high-purity ruthenium analyzed by GDMS(1×10-6) 下载原图
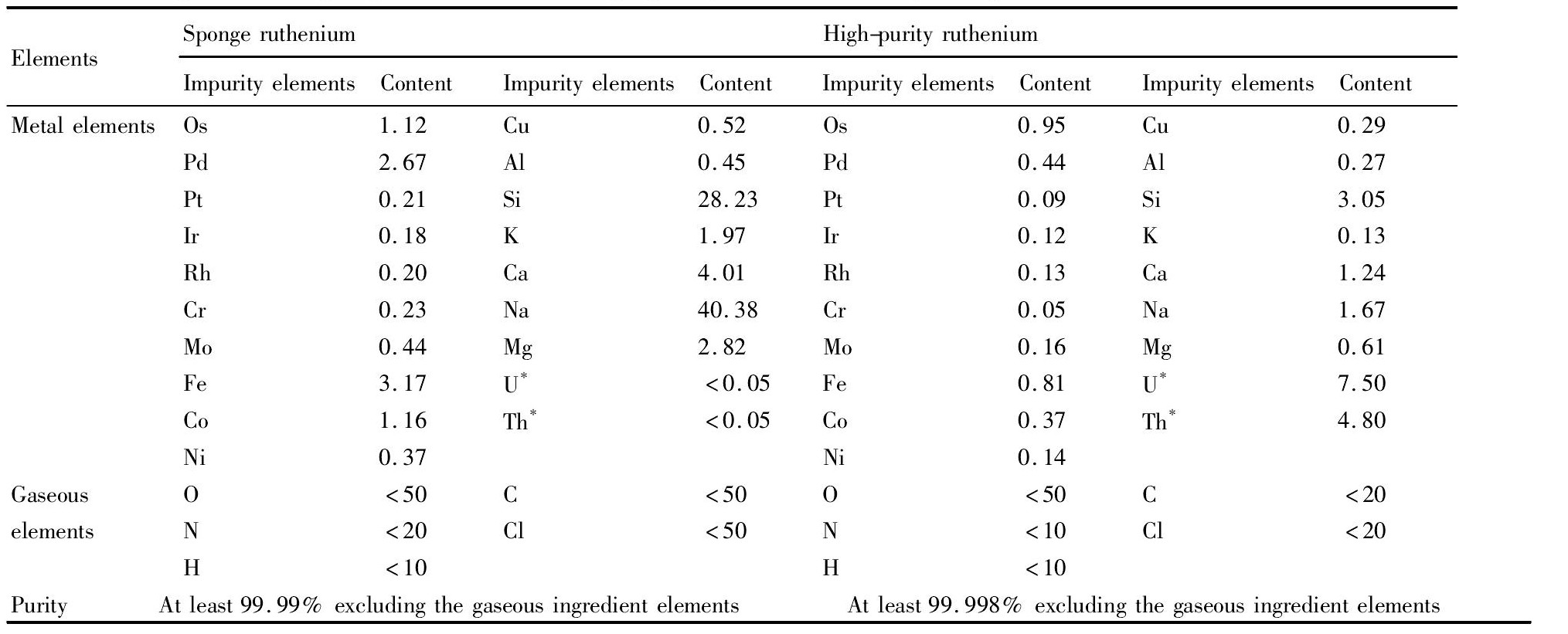
*:unit of U and Th being 1×10-9
表6 海绵钌和高纯钌粉GDMS分析结果Table 6 Composition of sponge ruthenium and high-purity ruthenium analyzed by GDMS(1×10-6)
3.3 海绵钌的制取及提纯和高纯钌粉的制备
将一批次所得的硫化钌在实验基础上得出的以2.2.3节所述的最佳煅烧还原条件下,制得的海绵钌的电镜照片如图3(a)所示,GDMS成分分析结果如表6所示。
从图3(a)可以看出,SEM照片很好地反映了产品的形貌。海绵钌粉颗粒较大且呈现出不规则的形状,并且分散性不好,易团聚。原因分析:正如朱军等
从表6可以看出,硫化钌经煅烧还原制得的海绵钌纯度不低于4N(99.99%),但不能满足靶材对钌粉纯度的要求。超标杂质元素主要有:Pd,Fe,Si,Na,Ca,Mg。依据金属溶解方法原理,对铂族金属而言,王水能对Pt,Pd溶解,而对Os,Ru,Rh,Ir不溶;同时,王水几乎能溶其他杂质离子如Fe,Al,Co,Mg,Cu,Cr,Th等,尤其对难以去除的Fe杂质离子有很好的溶解去除效果;对于Si而言,由于Si的化学性质不活泼,不与任何酸作用,但能溶于HF和HNO3(作为氧化剂)的混合酸中,生成可溶性的氟硅酸(H2Si F6),且反应十分彻底
图3 海绵钌粉及高纯钌粉SEM照片Fig.3 SEM images of sponge ruthenium powder(a)and high-purity ruthenium powder(b)
从图3(b)SEM照片可以看出,产品高纯钌粉颗粒较小且大小均匀,且呈现出较规则的球形,并且分散性好,不易团聚,颗粒直径在20~40μm之间,粒度分布范围较窄。原因分析:用王水与氢氟酸混合酸煮洗,使得海绵钌颗粒间易于分散开来,使得颗粒变小和呈现出球形小颗粒的规整形状,但在250℃的氛围下烘2 h,也不可避免地发生轻微烧结现象。
从表6可以看出,海绵钌经酸煮条件下深度除杂可制得纯度大于4N8(99.998%)的用于溅射靶材的高纯钌粉,满足0.35μm线宽工艺所需靶材用的化学纯度在4N5(99.995%)以上的指标要求。钌的直收率在94%左右。表明混合酸(HCl+HNO3+HF)对海绵钌中的金属杂质离子起到了进一步深度除杂的效果,尤其对Fe,Si难于去除杂质去除效果很好。产品中只有Si,Na,Ca离子微量超标,其他杂质元素含量符合指标要求。Si,Na,Ca离子微量超标的主要原因:用硫化钠沉钌,硫化钌中带入的碱金属杂质较多,酸煮、水洗彻底脱钠难度较大,不可避免地会导致碱金属含量微量超标;Si微量超标主要是由钌原料液中本身含有较高的Si和实验用的石英玻璃容器被酸性气体腐蚀带入所致。进一步精细化操作过程或继续重复1次二段氧化蒸馏提钌过程,可制备出纯度不低于5N(99.999%)的能满足0.25μm线宽工艺所需靶材用的高纯钌粉。
4 结论
1.以氧化还原标准电极电位作为选择性氧化分离锇、钌的判据,提出采用二段分步氧化蒸馏分离锇、钌及其钌与其他铂族金属以及贱金属的有效分离,并进行初步理论分析和实验研究,实现含钌盐酸溶液的精制。
2.采用二段氧化-真空蒸馏技术,从钌盐酸溶液中赶锇、提钌,锇、钌分步蒸馏反应温和、安全,选择性氧化效果明显,但蒸馏效率低,耗时长,工业化提纯受到一定限制。寻求一种更有效的利于工业化生产的氧化蒸馏技术,势在必行。
3.本文采用硫化钠沉钌法,进行了精制硫化钌盐实验研究。首次获得详细相关数据和对过程中产生的各种现象进行初步理论解释。实现钌盐酸溶液的贵金属与贱金属杂质离子的进一步分离,获得了精制的硫化钌盐,为高纯钌粉的制取提供合格的钌盐原料。
4.针对硫化钌经煅烧、还原得到的海绵钌中超标金属杂质的特性,依据金属溶解方法原理,提出采用王水与氢氟酸混合酸进一步煮洗海绵钌深度除杂的方法,符合靶材用的纯度不低于4N5(99.995%)的高纯钌粉,钌的直收率在94%左右。继续重复1次二段氧化蒸馏提钌过程,制备的高纯钌粉纯度不低于5N(99.999%)。
参考文献
[13] Yuichiro S,Tsuneo S.Process for producing high-purity ruthenium[P].US Patent:6036741,2000.
[14] James E,Len D.Method for purifying ruthenium and related processes[P].US Patent:6458183,2002.

