文章编号:1004-0609(2013)12-3440-08
富氧硫酸体系中硫化锌精矿的常压直接浸出动力学
徐志峰1,朱 辉1,王成彦2
(1. 江西理工大学 冶金与化学工程学院,赣州341000;
2. 北京矿冶研究总院 冶金研究设计所,北京100160)
摘 要:采用常压浸出与加压浸出相结合的方法,研究硫化锌精矿在富氧硫酸体系中的常压直接浸出动力学。结果表明:锌浸出受界面化学反应控制,浸出反应表观活化能为(44.28±4.28) kJ/mol。浸出槽底部锌的浸出速率远高于浸出槽上部锌的浸出速率,且随槽底矿浆压力的增大,锌的浸出速率明显提高。进一步基于收缩核模型,通过二次回归方法,建立浸出槽底部锌的浸出动力学方程。在硫化锌精矿常压富氧直接浸出中,对于位于浸出槽底部的锌浸出,温度的影响明显大于矿浆压力的影响。
关键词:硫化锌精矿;硫酸;常压直接浸出;富氧;动力学
中图分类号:TF813;TF111.31 文献标志码:A
Atmospheric direct leaching kinetics of zinc sulfide concentrate in oxygen-rich sulfuric acid system
XU Zhi-feng1, ZHU Hui1, WANG Cheng-yan2
(1. School of Metallurgical and Chemical Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China;
2. Institute of Metallurgy, Beijing General Research Institute of Mining and Metallurgy, Beijing 100160, China)
Abstract: The atmospheric direct leaching (ADL) kinetics of zinc sulfide concentrate in oxygen-rich sulfuric acid system was studied by the integration of atmospheric leaching and pressure leaching. The results show that the extraction of zinc is controlled by interface chemical reaction and the apparent activation energy of leaching reaction is calculated as (44.28±4.28) kJ/mol. The leaching rate of zinc at the bottom of ADL tank is much higher than that at the top of ADL tank and it is improved greatly with the increase of the slurry pressure at the bottom of ADL tank. The kinetic equation for zinc leaching at the bottom of ADL tank was further established by quadratic regression on the basis of shrinking core model. The influence of temperature on the extraction of zinc at the bottom of ADL tank is greater than that of slurry pressure.
Key words: zinc sulfide concentrate; sulfuric acid; atmospheric direct leaching; oxygen-rich; kinetics
焙烧-浸出-电积(Roast-leach-electrowinning,RLE)工艺是目前锌生产的主流工艺,世界上约85%以上的锌经RLE工艺产出[1]。焙烧工序将产出SO2气体,而SO2外泄以及制酸后低浓度SO2尾气引起的环境污染问题是RLE工艺面临的重大挑战[2]。加压浸出(Zinc pressure leach,ZPL)是湿法炼锌新工艺,在ZPL工艺中,硫以单质形式回收,这从根本上回避了SO2污染问题。与RLE工艺相比,ZPL工艺虽然过程强化,锌和硫的回收率高[3-5],但存在高压釜初始投资大、设备材质要求严格及操作安全要求高等缺点。ZPL工艺有向低温低压方向发展的趋势[6-7]。在这一背景下,锌精矿常压直接浸出技术[8-9](Atmospheric direct leaching,ADL)应运而生,ADL实际上是常压富氧浸出。芬兰奥托昆普冶炼厂ADL工艺通过提高矿浆高度以增大浸出压力,在常压富氧搅拌浸出设备中取得低温加压浸出(T=373 K,ptotal=20 kPa)的效果[10],并分别于1998年、2004年在芬兰科科拉(Kokkola,Finland)和挪威奥达(Odda,Norway)实现了工业化[11-12]。奥托昆普ADL工艺也于2008年在国内实现工业应用[13]。与ZPL工艺相比,虽然ADL工艺浸出条件温和,是目前最经济的湿法炼锌工艺,但其浸出速率缓慢,耗时10~20 h才取得95%以上的锌浸出率。如何克服浸出动力学受限的问题是ADL工艺进一步发展的方向。
在常压条件下,硫化锌矿的浸出速率受浸出体系的影响明显。相对而言,虽然闪锌矿在硫酸体系中的浸出动力学规律与在酸性氯盐体系中的浸出动力学规律近似,但在硫酸体系中,锌的浸出速率慢很多[14]。而现有的ADL工艺一般采用硫酸体系。因此,基于硫酸体系开展硫化锌精矿常压富氧直接浸出动力学研究,这符合ADL工艺发展的需要。目前,对于闪锌矿常压浸出动力学已进行了大量研究,其中,收缩核模型(Shrinking core model,SCM)应用最为广泛(见表1),但就硫酸体系而言,浸出动力学研究还有待进一步深入,因为不仅现有研究所得出的锌浸出反应表观活化能计算值波动较大,而且对浸出过程控制性环节认定也存在明显分歧。为此,本文作者以闪锌矿为主要矿物的锌精矿为研究对象,通过常压浸出与加压浸出相结合的方法,应用SCM模型研究常压富氧浸出槽中锌精矿的浸出动力学。
1 实验
1.1 实验原料
硫化锌精矿原料中粒度小于74 μm的占86.88% (质量分数),主要元素含量见表2。由XRD谱(见图1)可知,除主要矿物闪锌矿外,锌精矿中还含有少量黄铁矿、磁黄铁矿和方铅矿等硫化矿以及一定量的石英、滑石和石膏等非金属矿物。其中,石英和滑石是矿石中原有的脉石矿物,而石膏由锌精矿浮选过程中添加引入。
表1 ZnS常压浸出动力学数据
Table 1 Kinetics parameters for atmospheric leaching of ZnS
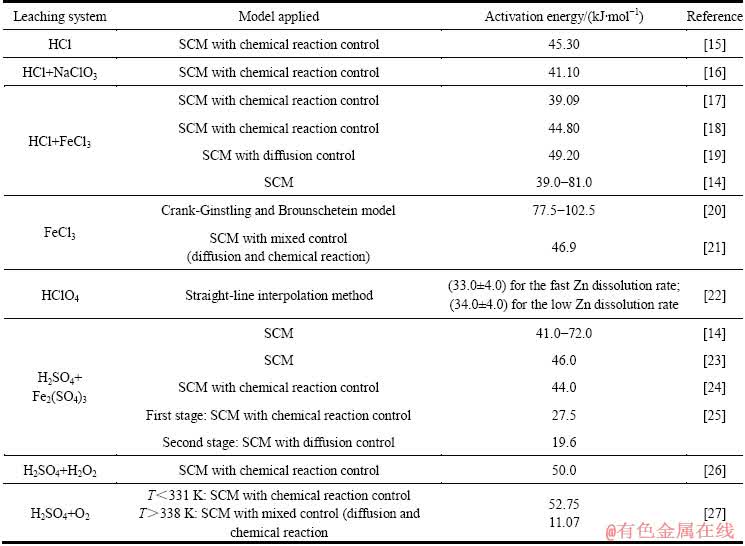
表2 硫化锌精矿的主要化学成分
Table 2 Main chemical composition of zinc sulfide concentrate (mass fraction, %)

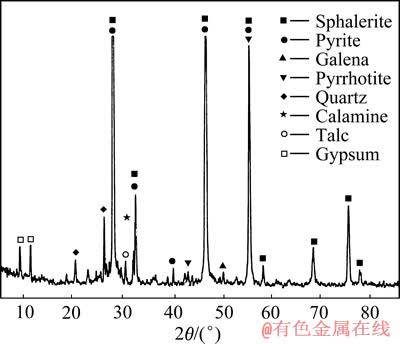
图1 硫化锌精矿的XRD谱
Fig. 1 XRD spectrum of zinc sulfide concentrate
1.2 实验方法
硫化锌精矿常压富氧直接浸出借助浆液高度以增大矿浆压力,在常压浸出设备中形成加压浸出条件,进而实现锌精矿直接浸出。如图2所示,位于浸出槽上部(如A点位置)的锌精矿浸出属常压浸出,而位于浸出槽底部(如B点位置)的锌精矿浸出则属加压浸出。
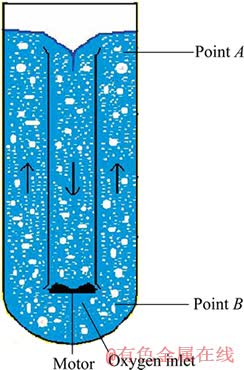
图2 硫化锌精矿常压富氧浸出示意图
Fig. 2 Schematic diagram of atmospheric oxygen-rich direct leaching of zinc sulfide concentrate
为综合比较A、B两点的浸出动力学,硫化锌精矿常压浸出及加压浸出实验均采用相同的初始硫酸浓度及液固比。为使浸出过程中反应物(即硫酸)浓度保持相对恒定,初始硫酸浓度选取1.25 mol/L,液固比(mL/g)为30/1。
鉴于常压浸出温度低于373 K,因此,在研究浸出槽A点位置的锌精矿的浸出动力学时,温度范围选择348~368 K,浸出过程中不断通入空气。此时,矿浆压力(不含大气压力)可视为0 MPa。
本研究采用1.0 L高压釜模拟浸出槽B点位置锌精矿浸出,考察矿浆压力分别为0.3、0.4和0.5 MPa条件下锌精矿的浸出动力学,温度范围选择358~378 K。鉴于浸出槽B点位置矿浆处于强烈搅拌的流态化状态,而基于大量实验可知,当1.0 L高压釜内搅拌转速不低于500 r/min时,即可保证釜内气、液、固三相充分混合与传质,故在各次实验中控制搅拌转速恒定为500 r/min。此外,为保证实验结果具有可比性,控制每次浸出实验时高压釜升温速率及降温速率相同。
浸出结束后,分别将浸出液和浸出渣送样分析。锌浸出率计算按渣计。
2 结果与讨论
2.1 矿浆压力对锌浸出速率的影响
当矿浆压力为0 MPa(即位于浸出槽A点位置)时,在348~368 K温度范围内,锌浸出结果如图3所示。由图3可见,虽在60~360 min范围内,锌浸出率(xZn)与浸出时间呈良好的线性关系,但随时间的进一步延长,锌浸出率未见明显增加。即使浸出温度升高至368 K,保温时间延长至360 min,锌浸出率也仅为13.60%,锌浸出速率偏低。此外,随浸出温度由348 K升高至368 K,锌浸出速率由0.015 min-1仅增大至0.033 min-1。
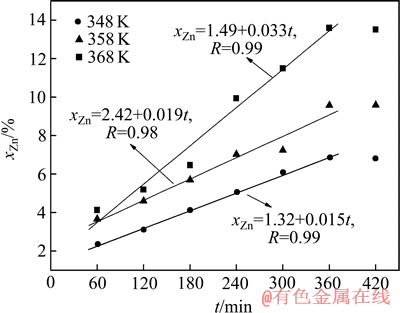
图3 硫化锌精矿的常压浸出结果
Fig. 3 Atmospheric leaching results of zinc sulfide concentrate
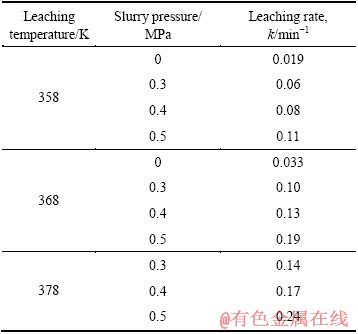
当矿浆压力分别为0.3、0.4和0.5 MPa时,在358~378 K温度范围内,锌浸出结果如图4所示。由图4可见,在60~420 min范围内,锌浸出率与浸出时间也呈良好的线性关系,即使时间延长至420 min,锌浸出也未达平衡。进一步由图4可见,在各浸出温度及保温时间条件下,随矿浆压力升高,锌浸出率总体上呈增大趋势,而且如表3所示,锌浸出速率也呈增大趋势。进一步由表3可知,在常压富氧浸出槽底部(图2中B点位置)的锌浸出速率远远高于浸出槽上部(图2中A点位置)锌浸出速率,而且随着B点位置的矿浆压力增大,锌浸出速率明显提高。

图4 不同温度条件下矿浆压力对锌浸出的影响
Fig. 4 Effect of slurry pressure on zinc extraction at different temperatures
表3 不同温度及矿浆压力条件下锌的浸出速率
Table 3 Leaching rate of zinc under different temperatures and slurry pressures
2.2 锌浸出过程的控制性环节
硫化锌精矿(ZnS)在硫酸介质中氧化浸出时将有单质硫固体产物生成,其总反应方程式如式(1)所示:
ZnS(s)+H2SO4(aq)+1/2O2 → ZnSO4(aq)+S0(s) +H2O(aq) (1)
假设硫酸浓度及矿物颗粒粒径保持恒定,式(1)可用有固相产物生成的SCM模型来描述。
当浸出速率受界面化学反应控制时,速率方程可以表示如下:
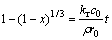 (2)
(2)
式中:x为锌浸出率;kr为界面化学反应速率常数;r0为硫化锌矿物颗粒的初始粒径; c0为初始硫酸浓度;ρ为硫化锌矿物密度;t为浸出时间。
当浸出速率取决于固体产物层的扩散速率时,速率方程表达式为
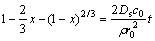 (3)
(3)
式中:Ds为硫酸分子通过单质硫层的有效扩散系数。
将不同矿浆压力条件下所得锌浸出率分别代入式(2)和(3),结果发现,只有界面化学反应控制的动力学曲线才具有良好的线性回归关系(见图5)。

图5 不同矿浆压力条件下锌的浸出动力学曲线
Fig. 5 Plots of zinc leaching kinetics at different slurry pressures
由不同矿浆压力条件下锌的浸出速率常数k以 ln k对1/T作图(见图6)。由图6可见,ln k与1/T之间呈良好的线性关系,对应矿浆压力0、0.3、0.4和0.5 MPa的直线斜率分别为-5 029.92、-5 742.28、-5 112.25和-5 423.14。进一步根据阿累尼乌斯(Arrhenius)公式求解浸出反应的表观活化能可得,锌浸出反应表观活化能分别为41.8、47.7、42.5和45.1 kJ/mol。按95%置信水平,活化能计算值置信区间为(44.28±4.28) kJ/mol,介于40~300 kJ/mol范围内。由此可知,在硫化锌精矿常压富氧浸出中,无论是浸出槽上部还是底部,锌浸出过程均受界面化学反应控制。
对浸出渣在显微镜下进行观察可知,浸出渣中残存的闪锌矿边界呈锯齿状,虽浸蚀现象明显,但多以单体形态存在,与氧化产物单质硫相对分离。进一步对浸出渣中残存的闪锌矿进行扫描电镜微区分析,其背散射电子像及元素面分布见图7。如图7所示,闪锌矿虽吸附少量细粒硫珠,但其表面未形成致密硫环。由此可知,在浸出过程中,绝大部分闪锌矿表面暴露于浸出剂中,不存在反应物H3O+或产物Zn2+通过富硫表面层的扩散,因此,锌浸出过程不应为扩散所控制,而是受界面化学反应控制,这与动力学分析结果是一致的。

图6 不同矿浆压力条件下锌浸出ln k—1/T关系
Fig. 6 Plots of ln k—1/T for zinc leaching at different slurry pressures
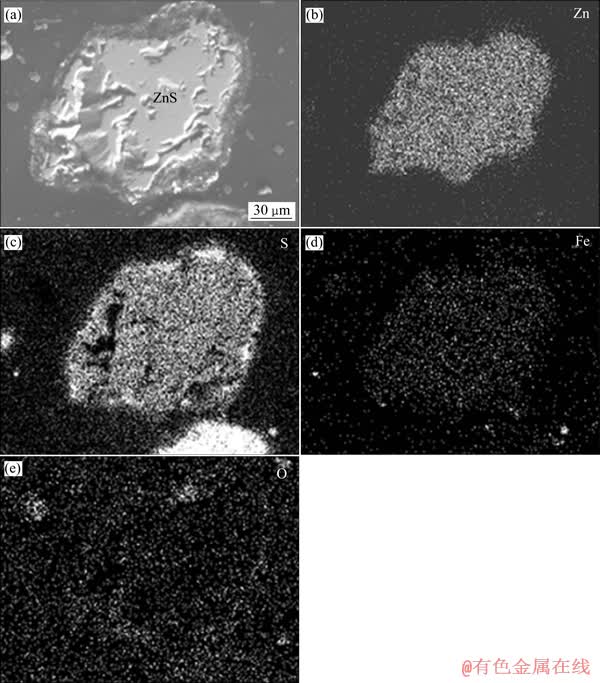
图7 浸出渣中闪锌矿背散射电子像及元素面分布
Fig. 7 Backscattered electron image(a) and elemental surface distribution((b)-(e)) of sphalerite in leaching residue
2.3 锌的浸出动力学方程
基于2.2节分析结果可知,在硫化锌精矿常压富氧直接浸出过程中,锌浸出遵循界面化学反应控制的SCM模型。为综合考察浸出槽底部(图2中B点位置)矿浆压力与温度对锌浸出的影响,可假设锌浸出动力学方程形式如下:
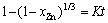 (4)
(4)
 (5)
(5)
式中:xZn为锌浸出率(%);K为表观速率常数;k0为反应速率常数;T为浸出温度(K);p为矿浆压力(MPa);指数a为相对温度条件的反应级数;指数b为相对矿浆压力条件的反应级数;E为浸出反应表观活化能(J/mol);t为浸出时间(min)。
对式(5)取对数并移项可得:
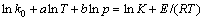 (6)
(6)
令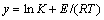 ,
,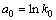 ,
,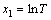 ,
,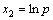 ,并代入式(6)可得:
,并代入式(6)可得:
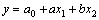 (7)
(7)
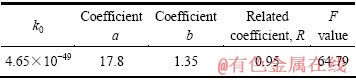
鉴于不同矿浆压力条件下活化能计算值差别不大,为简化回归计算过程,现对矿浆压力0.3、0.4和0.5 MPa条件下活化能计算值取平均值(45.1 kJ/mol)处理,进而基于自主开发的回归软件对浸出槽B点位置的锌浸出动力学数据进行二次回归分析,回归分析结果见表4。
表4 锌浸出动力学数据的二次线性回归结果
Table 4 Quadratic regression results of zinc leaching dynamic data
进一步对回归分析结果进行F检验:
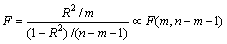 (8)
(8)
在显著水平取值a=0.005的条件下,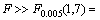 0.66 ,由此说明,回归效果显著。因此,在锌精矿常压富氧浸出中,浸出槽B点位置的锌浸出动力学方程可归纳如下:
0.66 ,由此说明,回归效果显著。因此,在锌精矿常压富氧浸出中,浸出槽B点位置的锌浸出动力学方程可归纳如下:
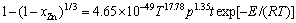
(E=45.1 kJ/mol) (9)
浸出温度及矿浆压力对锌浸出反应级数分别为17.78和1.35。经比较可知,在锌精矿常压富氧浸出 中,位于浸出槽B点位置,温度对锌浸出的影响明显大于矿浆压力对锌浸出的影响,即在相同矿浆压力条件下提高温度比相同温度条件下提高矿浆压力能获得更好的锌浸出效果。
3 结论
1) 对于硫化锌精矿常压富氧浸出,无论位于浸出槽上部还是底部,锌浸出率与浸出时间均呈良好的线性关系,且锌浸出率随浸出时间的延长而不断增大。在浸出槽上部,不仅锌浸出有限,而且浸出速率低;浸出槽底部的锌浸出速率则远远大于浸出槽上部的锌浸出速率,且随槽底的矿浆压力增大,锌浸出速率明显提高。
2) 在硫化锌精矿常压富氧浸出中,无论是浸出槽上部还是底部,锌浸出过程均受界面化学反应控制,浸出动力学方程遵循未反应收缩核模型。经二次回 归,得到了位于浸出槽底部的锌浸出速率方程。
3) 在硫化锌精矿常压富氧浸出中,对于位于浸出槽底部的锌浸出,温度的影响明显大于矿浆压力的影响,即在相同矿浆压力条件下提高温度将比在相同温度条件下提高矿浆压力能获得更好的锌浸出效果。
REFERENCES
[1] SOUZA A D, PINA P S,  V A. Bioleaching and chemical leaching as an integrated process in the zinc industry[J]. Minerals Engineering, 2007, 20(6): 591-599.
V A. Bioleaching and chemical leaching as an integrated process in the zinc industry[J]. Minerals Engineering, 2007, 20(6): 591-599.
[2] DELLER G. World zinc supply and demand-heading for a late decade price spike[C]// UMETSU Y. Proceedings of Lead & Zinc’05. Kyoto: The Minerals, Metals & Materials Society, 2005: 17-25.
[3] BUBAN K R, COLLINS M J, MASTERS I M, TRYTTEN L C. Comparison of direct pressure leaching with atmospheric leaching of zinc concentrates[C]// DUTRIZAC J E. Proceedings of Lead-Zinc 2000. Pittsburg: The Minerals, Metals & Materials Society, 2000: 727-738.
[4] BEREZOWSKY R M G S, COLLINS M J, KERFOOT D G E, TORRES N. The commercial status of pressure leaching technology[J]. JOM, 1991, 43(2): 9-15.
[5] 邱定蕃. 加压湿法冶金过程化学与工业实践[J]. 矿冶, 1994, 3(4): 55-67.
QIU Ding-fan. Process chemistry and industrial practice of pressure hydrometallurgy[J]. Mining & Metallurgy, 1994, 3(4): 55-67.
[6] 石 伟, 涂桃枝, 杨寒林, 夏光祥. 催化氧化酸浸法处理锌精矿的研究[J]. 有色金属: 冶炼部分, 1999(1): 8-10.
SHI Wei, TU Tao-zhi, YANG Han-lin, XIA Guang-xiang. Catalytic oxidative acidic leaching of zinc concentrate[J]. Nonferrous Metals: Extractive Metallurgy, 1999(1): 8-10.
[7] 蒋开喜, 林江顺, 王海北, 刘大星, 王 春, 李 岚, 王玉芳, 江培海. 一种从含锌硫化矿物提取锌的方法: 中国, CN01140484.1[P]. 2002-07-24.
JIANG Kai-xi, LIN Jiang-shun, WANG Hai-bei, LIU Da-xing, WANG Chun, LI Lan, WANG Yu-fang, JIANG Pei-hai. A method of zinc extraction from sulfide ores containing zinc: China, CN01140484.1[P]. 2002-07-24.
[8] van PUT J W, TERWINGHE F M I G, de NYS T S A. Process for the extraction of zinc from sulphide concentrates: US, 5858315[P]. 1999-01-12.
[9] FUGLEBERG S,  A. Method for leaching zinc concentrate in atmospheric conditions: Finland, WO/1998/006879[P]. 1998-02-19.
A. Method for leaching zinc concentrate in atmospheric conditions: Finland, WO/1998/006879[P]. 1998-02-19.
[10] FILIPPOU D. Innovative hydrometallurgical processes for the primary processing of zinc[J]. Mineral Processing & Extractive Metallurgy Review, 2004, 25(3): 205-252.
[11] SVENS K, KERSTIEN B, RUNKEL M. Recent experiences with modern zinc processing technology[J]. Erzmetall, 2003, 56: 94-103.
[12] TAKALA H. Leaching of zinc concentrates at Outokumpu Kokkola Plant[J]. Erzmetall, 1999, 52: 37-42.
[13] HAAKANA T,  B, LEHTINEN L, TAKALA H, LAHTINEN M, SEVENS K, RUONALA M, GONGMING X. OUTOTEC direct leaching application in China[J]. Journal of the South African Institute of Mining and Metallurgy, 2008, 108(5): 245-251.
B, LEHTINEN L, TAKALA H, LAHTINEN M, SEVENS K, RUONALA M, GONGMING X. OUTOTEC direct leaching application in China[J]. Journal of the South African Institute of Mining and Metallurgy, 2008, 108(5): 245-251.
[14] PEREZ I P, DUTRIZAC J E. The effect of the iron content of sphalerite on its rate of dissolution in ferric sulphate and ferric chloride media[J]. Hydrometallurgy, 1991, 26(2): 211-232.
[15] BABA A A, ADEKOLA F A. Hydrometallurgical processing of a Nigerian sphalerite in hydrochloric acid characterization and dissolution kinetics[J]. Hydrometallurgy, 2010, 101(1/2): 69-75.
[16] UCAR G. Kinetics of sphalerite dissolution by sodium chlorate in hydrochloric acid[J]. Hydrometallurgy, 2009, 95(1/2): 39-43.
[17] AYDOGAN S, ARAS A, CANBAZOGLU M. Dissolution kinetics of sphalerite in acidic ferric chloride leaching[J]. Chemical Engineering Journal, 2005, 114(1/3): 67-72.
[18] MOHAMMAD A H, KINGMAN S. The influence of microwaves on the leaching of sphalerite in ferric chloride[J]. Chemical Engineering and Processing, 2007, 46(10): 883-888.
[19] DEHGHAN R, NOAPARAST M, KOLAHDOOZAN M. Leaching and kinetic modeling of low-grade calcareous sphalerite in acidic ferric chloride solution[J]. Hydrometallurgy, 2009, 96(4): 275-282.
[20] RATH P C, PARAMGURU R K, JENA P K. Kinetics of dissolution of zinc sulphide in aqueous ferric chloride solution[J]. Hydrometallury, 1981, 6(3/4): 219-225.
[21] BOBECK G E, SU H. The kinetics of dissolution of sphalerite in ferric chloride solution[J]. Metallurgical and Materials Transactions B, 1985, 16(3): 413-424.
[22] WEISENER C G, SMART R St C, GERSON A R. Kinetics and mechanisms of the leaching of low Fe sphalerite[J]. Geochimica et Cosmochimica Acta, 2003, 67(5): 823-830.
[23] CRUNDWELL F K. Kinetics and mechanism of the oxidative dissolution of a zinc sulphide concentrate in ferric sulphate solutions[J]. Hydrometallurgy, 1987, 19(2): 227-242.
[24] DUTRIZAC J E. The kinetics of sphalerite dissolution in ferric sulphate-sulphuric acid media[C]// UMETSU Y. Proceedings of Lead & Zinc’05. Kyoto: The Minerals, Metals & Materials Society, 2005: 833-851.
[25] SOUZA A D, PINA P S,  V A, SILVA C A, SIQUEIRA P E. The leaching kinetics of a zinc sulphide concentrate in acid ferric sulphate[J]. Hydrometallurgy, 2007, 89(1/2): 72-81.
V A, SILVA C A, SIQUEIRA P E. The leaching kinetics of a zinc sulphide concentrate in acid ferric sulphate[J]. Hydrometallurgy, 2007, 89(1/2): 72-81.
[26] PECINA T, FRANCO T, CASTILLO P, ORRANTIA E. Leaching of a zinc concentrate in H2SO4 solutions containing H2O2 and complexing agents[J]. Minerals Engineering, 2008, 21(1): 23-30.
[27] 肖 纯, 杨声海. 硫化锌精矿空气氧化硫酸浸出的动力学研究[J]. 有色金属: 冶炼部分, 2008(1): 7-10.
XIAO Chun, YANG Sheng-hai. Leaching kinetics of zinc sulfide concentrate with air-oxidation and sulfuric acid[J]. Nonferrous Metals: Extractive Metallurgy, 2008(1): 7-10.
(编辑 陈卫萍)
基金项目:国家自然科学基金资助项目(50964004);江西省第四批青年科学家培养对象资助项目(赣科发计字[2010]209号文)
收稿日期:2013-01-08;修订日期:2013-10-12
通信作者:王成彦,教授,博士;电话:010-88399551;E-mail: wchy3207@sina.com