文章编号:1004-0609(2015)-03-0824-10
细菌化学诱变育种对富钾砂页岩生物浸矿提钾的影响
周德志1,陈 晔1,2,曹 飞1,2,孙德四1
(1. 九江学院 化学与环境工程学院,九江 332005;
2. 九江学院 生命科学学院,九江 332005)
摘 要:以多黏芽孢杆菌P.Polymyxa (PA)和根瘤农杆菌A.tumefaciens (AT)为出发菌株,采用硫酸二乙酯(DES)对其进行诱变育种与浸矿研究。结果表明:分别通过30和 40 mg/L 的DES处理出发菌株PA 和 AT,致死率分别为87%和85%,正突变率分别为10% 和 16%;筛选获得的两株突变菌PAM 和 ATM 达到生长稳定期的时间分别比对应的出发菌株缩短了48和24 h,且具有更大的菌体密度以及产酸和产蛋白质与多糖的能力;浸出15 d,诱变菌株PAM 和 ATM 从富钾砂页岩中释放的K2O量分别比对应的出发菌株提高了29.00% 和21.28%,且达到浸出终点的时间分别提前了5和3 d;混合诱变菌株浸出的K2O的量比单一诱变菌株PAM和ATM浸出的K2O的量分别提高了22.78% 和67.55% ,且达到浸出终点的时间比出发菌株的提前了6 d;SEM和XRD分析结果表明:混合诱变菌株对富钾砂页岩的破坏作用最为明显;在富钾页岩混合菌浸矿过程中,P·Polymyxa为浸矿优势菌种,诱变前后混合菌浸出15 d后,P.Polymyxa和A.tumefaciens的菌落个数比由最初的1:1分别变为7:1和18:1。
关键词:“钾”细菌;诱变;硫酸二乙酯;细菌浸出; 提钾;富钾砂页岩
中图分类号:TD925.5;Q939.97 文献标志码:A
Effects of chemical mutation on bacterial extracting potassium from potassium-rich sandshale
ZHOU De-zhi1, CHEN Ye1,2, CAO Fei1,2, SUN De-si1
(1. School of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China;
2. School of Life Science, Jiujiang Universitiy, Jiujiang 332005, China)
Abstract: The P.Polymyxa (PA) and A.tumefaciens (AT) were used as original strains, and the mutagenesis and bioleaching induced by diethylsulfate (DES) were studied. The results show that the lethal rates of the original strains PA and AT are 87% and 85%, and the positive mutant rates are 10% and 16% after being treated by 30 and 40 mg/L DES, respectively. The two mutants of P.Polymyxa (PAM) and A.tumefaciens (ATM) screened from positive mutant strains reach stationary stages 48 h and 24 h, respectively, ahead of the corresponding original strains. PAM and ATM have higher bacterial concentrations and higher producing ability of organic acids, polysaccharides and proteins, than those of the original strains. After a 15 d leaching, the K2O concentrations in supernatants of the mutant stains PAM and ATM are improved by 29.00% and 21.28%. And the mutant strains PAM and ATM can shorten the leaching time by 5 d and 3 d, respectively, than those of the two corresponding original strains. After bioleaching for 15 d with the mixture of the two mutant strains PAM and ATM, the K2O concentration of the supernatant is 22.78% and 67.55% higher than that with the single mutant strain PAM or ATM, respectively, and the mixture can shorten leaching time by 6 d in comparison with the original strains. The SEM and XRD analyses of potassium-rich shale surfaces before and after leaching show that the mixture of PAM and ATM has the greatest corrosion and decomposition ability on shale. P.Polymyxa is the dominant culture in bacterial community during bioleaching of potassium-rich shale. After bioleaching for 15 d, the proportion of cell density in the supernatants of P.Polymyxa and A.tumefaciens before and after DES-induced mutagenesis is changed from 1:1 to about 7:1 and 18:1, respectively.
Key words: potassium bacteria; mutation; DES; bioleaching; potassium extraction; potassium-rich sandshale
速效与可交换性钾素能显著促进农作物生长,并对其产量与品质产生重要影响。耕层土壤蕴藏着丰富的钾资源,但绝大部分(>90%)赋存于含钾硅酸盐矿物中,是水难溶性的或不溶性的,不能直接被植物吸收利用[1-2]。目前,我国钾肥生产量只占世界生产总量的 0.34%,而消耗量占世界消耗总量的14.7%。近年来,我国农作物的复种指数提高及高产耗钾品种的推广等导致我国钾肥供需矛盾日益尖锐。至今,国内外主要采用高能耗、高污染的物理化学方法从含钾矿物中提取钾。有关使用微生物技术从钾矿物中提取钾的实验研究或工业应用的相关报道很少。与传统的湿法冶金工艺相比,生物浸出具有工艺简单、成本低、环境友好等优点[3-6]。因此,开发环境友好的含钾矿物的生物提钾技术对发展生态与经济农业具有十分重要的意义。对比已报道的含钾硅酸盐矿物微生物风化的实验结果可知,有较好的矿物风化分解能力且对 K、Si、Al 具有一定溶出效果的微生物均为异养菌(主要是细菌及真菌)。细菌中的多黏芽孢杆菌 Paenibacillus polymyxa (P.Polymyxa)、胶质芽孢杆菌 Bacillus mucilaginosus(B.Mucilaginousus)、环状芽孢杆菌 Bacillus circulans(B.circulans)与农杆菌 Argrobacterium tumefaciens(A.tumefaciens)对硅酸盐矿物的分解能力较强,因此,这类细菌又称为“钾”细菌或“硅酸盐”细菌;真菌中的菌根真菌岩生真菌等对矿物中的不溶性元素(K、Si 等)具有较好的溶出作用 [7-11]。以上微生物主要被用来制备微生物菌肥。目前,已有大量有关硅酸盐矿物微生物风化机理研究报道,如:不同来源异养菌之所以对矿物的分解能力不同,是它们的生长代谢差异所致,特定的硅酸盐矿物可以刺激与促进“硅酸盐类”细菌或真菌的生长代谢能力,如在含钾矿物培养基中,“钾”细菌产多糖、蛋白质及小分子有机酸量明显较在纯培养基中的高[12-14];微生物主要通过有机酸的质子交换、胞外聚合物的络解、生物膜及氧化还原等多种因素的协同作用方式溶蚀硅酸盐矿物[15-16];菌种代谢产酸、产胞外聚合物及氧化还原酶(蛋白质)的能力是影响其对矿物分解效果的关键因素[14,17-19];在多种矿物同时存在的情况下,微生物对不同结构矿物的溶蚀作用具有一定的选择 性[20]。此外,硅酸盐矿物的风化过程包含微生物的直接粘附作用(主要指菌种生长所产生的机械破坏作用与大分子胞外聚合物的络解作用)和微生物产生的小分子代谢物溶蚀的间接作用两部分,矿物中 K、Fe、Si 的溶出主要受间接作用机制的影响,Al 的溶出主要受直接作用机制的影响[21]。以上机理研究结果表明,“钾”细菌代谢产有机酸、胞外多糖与蛋白质的能力对其释放钾矿物中钾的能力有重要的影响。目前,所有有关钾矿物微生物浸出提钾技术仍处于理论与实验室研究阶段,制约其工业化应用的主要原因有:菌种繁殖速度缓慢,生物浸矿周期长;不同环境筛选所得菌种产有机酸、产胞外多糖与蛋白质的能力不同;菌种浸矿性能不稳定,多次传代培养后溶蚀矿物的能力会显著降低。这些缺陷急需在生物浸矿过程中得到解决。
微生物诱变育种是一种提高其生长繁殖速度与代谢产物产量的有效手段。在生物湿法冶金领域,国内外有关浸矿菌种的诱变育种技术主要集中于铜矿、硫铁矿、稀土等重金属与贵金属的生物浸出,很少有关用于浸出钾的“钾”细菌诱变育种方面的报道[22-24]。硫酸二乙酯(DES)是一种典型的烷化剂类化学诱变剂,因其对微生物中 DNA 具有较好的致突变性而已广泛应用于微生物药物与食品工业[25]。DES 诱变剂具有活泼的烷基化基团,与水反应先形成碳正离子,然后攻击 DNA 碱基中鸟嘌呤的 N-7 位、鸟嘌呤的 N-3 位和腺嘌呤的 N-3 位,导致相应部位的烷基化,破坏微生物的正常生物学功能,从而影响其遗传特性。
本文作者选用多黏芽孢杆菌 P.Polymyxa 和根瘤农杆菌 A.tumefaciens 作为出发菌株,采用硫酸二乙酯(DES) 对出发菌株进行诱变育种,通过对诱变菌株的初筛与复筛及遗传稳定性培养,筛选出两株正突变菌P.Polymyxa(PAM)和A.tumefaciens(ATM),并以出发菌株作为对照,分别采用单一菌种和混合菌种对富钾页岩进行浸矿分解及提钾实验研究。通过对比分析诱变前后菌株的产酸、多糖与蛋白质及释钾能力的差异、细菌作用后富钾砂页岩矿物表面结构的变化以及混合菌浸矿过程中群落结构的动态演替规律,为揭示“钾”细菌浸出钾矿物的作用过程和机制提供一些有用的信息。
1 实验
1.1 实验矿样
实验用富钾砂页岩样品购自浙江大学地质标本厂,样品产地为安徽寿县,呈浅褐色,条纹状结构。根据X射线衍射分析,其主要矿物组成为:66.12%钾长石;12.25%伊利石;8.26%石英;5.28%白云母(质量分数)。样品的化学组成分析结果见表1所列。
1.2 出发菌株的培养与驯化
本实验中所用的出发菌株多黏芽孢杆菌
表1 富钾砂页岩的主要化学成分(质量分数,%)
Table 1 Main chemical components in potassium-rich sandshale (mass fraction, %)

P.polymyxa(PA)和根瘤农杆菌 A.tumefaciens(AT)购自中国普通微生物菌种保藏管理中心(CGMCC)。PA 菌种的活化基础培养基为营养肉汁琼脂培养基(蛋白胨10.0 g/L,牛肉提取物 3.0 g/L,琼脂 15.0 g/L,NaCl 5.0 g/L,pH 7.0),AT 菌种的活化基础培养基为牛肉膏蛋白胨培养基(牛肉膏 5.0 g/L,酵母提取物 1.0 g/L,蛋白胨 5.0 g/L,琼脂 15.0 g/L,1 mol/L MgSO4·7H2O 2.0 mL/L,pH 7.0)。两株出发菌种活化后,均在改性的“钾”细菌专性培养基[12](蔗糖5.0g/L,Na2HPO4 2.0g/L,MgSO4·7H2O 0.5g/L, NaCl 0.1g/L, Na2CO3 0.1g/L, pH 7)中进行发酵培养,并在含0.5 g/L钾矿物的相应“钾”细菌培养基中进行进一步驯化。
发酵培养条件实验表明:PA 菌的最佳生长温度为30 ℃,最佳初始pH值为7.0;AT 菌的最适生长温度28 ℃,初始pH值为 7.0。在装有90 mL“钾”细菌培养基的250 mL的锥型瓶中,加入粒径小于75 μm的富钾页岩矿样5 g,分别接入5 mL的PA与AT菌(菌体密度约为1.00×107个/mL),在温度 28~30 ℃,摇床转速 150~200 r/min的条件下浸矿培养7 d,浸出液中K2O的浓度可分别达到30与20 mg/L,表明两株出发菌种均具有一定分解富钾页岩的能力,并能释放其中的钾。
1.3 细菌诱变与筛选
出发菌株在“钾”细菌改性培养基中扩大培养至对数生长期,将菌液在5000 r/min 条件下离心分离20 min,去上清液,收集菌体,然后用无菌水制备成菌悬浮液,菌体密度控制在107~108个/mL。
硫酸二乙酯(DES)诱变:取已制备好的出发菌株菌悬浮液 10 mL,分别加入装有90 mL 含不同DES浓度(0、5、10、20、30、40、50 mg/L)的 “钾”细菌培养基的 250 mL 锥型瓶中,在(28~30 ℃,200 r/min)条件下处理 60 min。然后取各诱变菌液1 mL,加入 0.5 mL25% 的 Na2S2O3 溶液终止反应,适当稀释后,涂布于分离培养基平板上,在28~30 ℃ 下培养 48 h 后进行菌落计数,确定最佳诱变剂量并挑取该诱变剂量下的菌落进行初筛与复筛。菌株的正突变率由传代时间、生长稳定期和在发酵培养液中产酸与产胞外多糖与蛋白质的量共同决定。在装有90 mL “钾”细菌培养基和2 g 富钾页岩的 250 mL 锥型瓶中进行培养测定菌株的代谢能力,实验条件同1.2节。在培养过程中,每隔1 d 测定发酵液中的pH 值、多糖浓度与蛋白质浓度;在装有不含钾矿样的纯发酵液体培养基的锥型瓶中,在以上同样条件下对细菌进行培养测定菌株的生长稳定期。正突变菌株的遗传稳定性测定如下:将筛选出的相对较高代谢活性的正突变菌株在含富钾页岩的液体培养基中连续传代培养7次,并于第7代测定培养液中的pH值、多糖浓度与蛋白质浓度,考察诱变菌株代谢活性的稳定性。
1.4 富钾页岩细菌浸矿实验
在250 mL锥型瓶中装入90 mL的“钾”细菌发酵培养基,接入对数生长期菌液(细菌初始浓度1.1×107个/mL),矿浆质量浓度45 g/L(矿石粒度小于0.074 μm),在(30 ℃,初始pH 7,200 r/min)条件下连续培养15d,定期测定上清液中K2O的浓度。设计7组试验浸矿体系,每组做3个平行实验如下所示:1) 接种诱变前的出发菌株PA;2) 接种诱变菌株PAM;3) 接种诱变前的出发菌株AT;4) 接种诱变菌株ATM;5) 接种诱变前的混合出发菌株AT+PA(数量比为1:1);6) 接种诱变混合菌株PAM+ATM(数量比为1:1);7) 对照组CK(不接菌)。
1.5 测试分析方法
浸出液中的钾采用 ICP-AES(仪器型号为JY38S)测定,并以 K2O 进行计量;采用 UV-2102 紫外可见分光光度计,通过苯酚-硫酸法测定发酵液中多糖浓度;采用 UV-2102 紫外可见分光光度计,通过考马斯亮蓝 G250 染色法测定发酵液中蛋白质浓度;采用 PHS-3C 型 pH 计(上海雷磁仪器厂生产)测定pH 值;采用XS-212 生物显微镜(南京江南永新光学仪器生产)通过平板计数法测定培养液及浸矿上清液中的细菌数量;采用SEM(TESCAN公司生产,型号为VEGIILSU)与XRD(日本Rigaku生产,D/Max-2500型)观察细菌浸出前后矿样的表面微观形态及矿物结构变化。
1.6 混合菌浸矿过程中细菌群落结构的动态演替分析
在混合菌浸矿过程中,取不同时期的浸出液样品,采用上海生工生物技术有限公司的细菌 DNA 提取试剂盒提取混合“钾”细菌的总DNA。采用上游引物 27f(5’AGAGTTTGATCCTGGCTCAG 3’)和下游引物为1492r(5’ GGTTACCTTGTTACGACTT 3’) 扩增16S rRNA 基因片断。通过琼脂糖凝胶电泳观察 PCR 结果,使用UNIQ-10 柱式试剂盒回收目的片断。将转化后重组的细菌涂布于琼脂平板上,在温度为30 ℃条件下,培养 48 h,随后在 LB 琼脂平板中加入5-Bromo-4-chloro-3-indolyl β-D-galactopyranoside ,根据菌落颜色,随机筛选出60个目的菌落,通过载体引物7f (5'-CAGAGTTTGATCCTGGCT-3') 和1540r(1522) (5'-AGGAGGTGATCCAGCCGCA-3'),将携带重组质粒的细胞破壁,对目的菌落进行 PCR 扩增。16S rRNA 的 PCR 扩增产物用 HindI 和 MspI 试剂盒在30 ℃进行酶切过夜,1.5% 琼脂糖凝胶电泳分离后,在紫外光下观察 ARDRA 结果,与实验出发菌株的16S rRNA 限制性酶切片段进行比较分析。
2 结果与讨论
2.1 出发菌株DES诱变结果
2.1.1 PA的DES诱变结果
采用不同剂量的 DES 对 PA 进行诱变处理,以诱变菌株在稳定期具有比出发菌株更大的菌体密度与更短的传代时间为正突变指标,所得致死率与正突变率结果如图1(a)所示。由图1(a)可知,出发菌株的致死率与 DES 的质量浓度成正相关。诱变剂量大时致死率高(90%~100%),在单位存活的细胞中负突变菌株较多,正突变菌株较少,但在不多的正突变株中可能筛选得到产量提高幅度较大的理想的正突变菌株;对于致死率为40%~80%的小剂量诱变处理,在单位存活的细胞中正突变株较多,然而筛选得到大幅度提高产量的诱变菌株的可能性较小。因此,选择 DES质量浓度30 mg/L为最佳诱变剂量(致死率为87%,正突变率为10%)。从正突变菌株中选取传代时间比出发菌株更短且到达生长稳定期时菌体密度更大的变株用于发酵培养及生物浸出探索实验,并经过7次传代培养后筛选出一株 PA 诱变菌株(PAM)用于富钾页岩生物浸出实验。
出发菌株 PA 和诱变菌株 PAM 的生长曲线如图1(b)所示。由图1(b)可见,诱变后正突变菌株达到生长稳定期的时间为5 d,比出发菌株提前了2 d,菌体密度也由原来的108 个/mL 左右上升到109 个/mL左右。
2.1.2 AT的DES 诱变结果
AT在不同剂量的DES 处理下的致死率与正突变率如图2(a)所示。从图2(a)可以看出,AT的致死率同样与DES的质量浓度成正相关。当DES质量浓度为 40 mg/L时为最佳诱变剂量(致死率为85%,正突变率为16%)。同样从中筛选出数株正突变菌株,通过发酵培养与浸矿探索实验,并经7次传代培养,挑选出代谢产酸、产蛋白质与多糖能力最强、释钾效果最好的一株正突变菌株(ATM)用于富钾页岩生物浸出实验。

图1 DES 诱变对PA菌的影响及其诱变前后的生长曲线
Fig. 1 Effect of DES-induced mutagenesis on PA (a) and growth curves of PA before and after mutagenesis (b)
AT和ATM菌株的生长曲线如图2(b)所示。由图2(b)可以看出,诱变后正突变菌株ATM达到生长稳定期的时间为6 d,比出发菌株AT提前了1 d,菌体密度由诱变前的108 个/mL 左右上升到109 个/mL左右。
2.2 诱变菌株的遗传稳定性测定结果
出发菌株经DES诱变处理破坏了其 DNA 结构的稳定性,DNA结构中的突变位点可能处于亚稳定状态,增大了回复突变或抑制基因突变的概率。为保证突变菌株的遗传稳定性,一般需对筛选出的正突变菌株反复传代7次,通过测定其正突变指标来判断其遗传性状稳定性。钾硅酸盐矿物的微生物风化破坏程度与细菌代谢产酸、产胞外多聚物(主要为蛋白质与多糖)等的能力密切相关[11-13]。为此,以细菌代谢产酸与产胞外聚合物为诱变菌株的重要正突变指标,对经过7次传代培养后所挑选出来的诱变菌株 PAM、ATM 与出发菌株在各菌株的最佳生理生化条件下进行培养,定时测定培养体系中的pH 值、多糖与蛋白质含量,进一步考察诱变菌株的遗传稳定性,测定结果见图3所示。
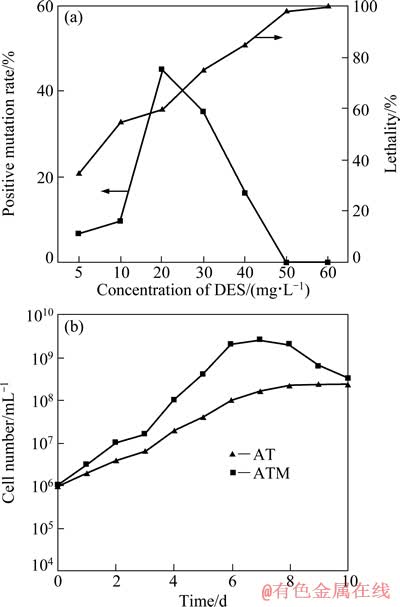
图2 DES 诱变对AT菌的影响及其诱变前后的生长曲线
Fig. 2 Effect of DES-induced mutagenesis on AT (a) and growth curves of AT before and after mutagenesis (b)
从图3可以看出,诱变菌株 PAM 和 ATM的代谢产酸与产大分子胞外聚合物的能力明显要比各自诱变前菌株的代谢能力强,且达到最大量的发酵时间更短。在含 PA、AT、PAM和ATM 的培养液中,分别发酵培养 8、9、7和7 d 后,发酵液的 pH 值达到各自的最低值,分别为4.7、4.7、4.0和4.3,且随着发酵时间的延长,各发酵液中的酸度均有小幅下降(见图3(a));从图3(b)和(c)可以看出,发酵培养6 d后,含诱变菌株 PAM和ATM 的发酵液中的蛋白质与多糖浓度达到最大值,蛋白质浓度分别为 6.48和3.96 mg/L,多糖浓度分别为7.57和3.26 g/L;而含出发菌株 PA和AT 的发酵液中蛋白质与多糖浓度到达最大值的时间均延迟了2 d,且明显要比各自的诱变菌株代谢产生的蛋白质与多糖浓度低,蛋白质浓度分别为 5.45和3.1 mg/L,多糖浓度分别为6.15和2.6 g/L。随后,各发酵液中的蛋白质与多糖浓度均会随发酵时间的延长而小幅下降,导致这一现象的原因是因为在发酵培养后期,培养液处于贫营养状态,细菌又会利用自身产生的代谢物来维持其生命活动。由以上结果可以进一步推断,出发菌株经 DES 诱变后引起了遗传变异,筛选所得到的突变菌株产酸与产胞外聚合物的能力较出发菌株的有了较大的提高,其中诱变菌株 PAM 产酸与产胞外聚合物的能力最强。

图3 在不同菌种发酵液中pH值、蛋白质浓度与多糖浓度随浸出时间的变化曲线
Fig. 3 Changing curves of pH values versus leaching time (a), concentrations of proteins versus leaching time (b) and concentrations of polysaccharides versus leaching time (c) in different cultures
2.3 富钾页岩细菌浸出释钾实验
以无菌培养液作为对照(CK),采用单一菌种和组合菌种的形式,选用出发菌株PA 和AT及诱变菌株PAM和ATM浸出富钾砂页岩中的钾,结果如图4所示。由图4可知,在浸出15 d后,在有菌的6个浸出体系的浸出液中,K2O质量浓度的变化规律一致,大致可以分为快速上升、平缓上升与停滞期3个阶段;在不同的浸出体系中,K2O质量浓度的增加幅度与时间跨度存在明显差异。
在接种了出发菌株 PA和AT的浸出体系中,浸出液中K2O质量浓度随浸出时间的变化规律一致。在0~10 d时,浸出液中K2O质量浓度持续快速增加,从0 mg/L 分别增加至40.54 mg/L 与32.08 mg/L;在10~15 d时,K2O质量浓度平缓增加至42.07与32.78 mg/L;在实验中发现,在15 d 后,菌种对富钾页岩中的钾仍有极微弱的浸出作用,但根据浸出效率可以认为已经达到浸出终点。
在接种了诱变菌株ATM的浸出体系中,浸出液中K2O质量浓度的快速上升期、平缓上升期与停滞期3个阶段分别为0~10 d,10~12 d 和12~15 d。当浸出到第12 d 时,浸出液中K2O质量浓度为39.72 mg/L,此后随浸出时间的继续延长,K2O质量浓度增加极其微弱,达到浸出终点。
在接种了诱变菌株PAM的浸出体系中,对应的3个浸出阶段分别为0~8 d、8~10 d 和10~15 d。在浸出10 d 后,浸出液中K2O质量浓度随浸出时间的延长而增加十分微弱,按照浸矿效率评判,可以认为浸出到第10 d 时已经达到浸出终点,浸出液中K2O质量浓度为54.25 mg/L。
在接种了诱变前的PA 与AT(数量比为1:1)的混合菌浸出体系中,对应的3个浸出阶段与诱变前单一菌株浸矿体系的一致,达到浸出终点时(15 d),浸出液中K2O质量浓度为51.3 mg/L。结果表明,混合菌种的浸矿释钾效果要比单一菌种的要好。
在接种了诱变菌株PAM与ATM(数量比为1:1)的混合菌浸出体系中,对应的3个浸出阶段分别为0~8 d、8~9 d和10~15 d。根据浸出液中K2O质量浓度随浸出时间的变化幅度,可以认为在浸出9 d 时,浸出体系已经达到浸出终点,此时浸出液中K2O质量浓度为66.55 mg/L。
从以上实验结果可以看出:出发菌株PA的浸矿释钾效果要好于出发菌株AT的浸矿释钾效果。而诱变菌株PAM和ATM对富钾砂页岩的释钾效率明显比对应的出发菌株要高,浸出液中K2O质量浓度分别提高了29.0%和21.28%,且达到浸出终点的时间分别提前了5和3 d,表明出发菌株经DES诱变后,提高了出发菌株对富钾砂页岩的浸矿效率。结合它们产酸与产胞外聚合物的能力(见图3),分析可知,代谢能力是影响细菌对矿物溶蚀与分解的关键因素之一。混合菌浸矿释钾效率明显高于单一菌的浸矿释钾效率,其中,在接种了诱变菌株PAM和ATM的混合菌浸出体系中,达到浸出终点的时间比出发菌株提前了6 d,比浸矿效果较好的诱变菌株PAM提前了1 d,浸出液中的K2O质量浓度分别比单一诱变菌株ATM和PAM提高了67.55% 和22.78%,表明P·Polymyxa 和A·tumefaciens两株菌种在浸矿过程中具有协同效应,可以促进它们各自对矿物的溶蚀能力。

图4 不同细菌浸出体系中从富钾砂页岩提取的K2O质量浓度随浸出时间的变化曲线
Fig. 4 Changing curves of K2O concentrations extracted from potassium-rich sandshale versus leaching time in different culture systems
2.4 浸渣表面分析
对富钾砂页岩原矿样及被不同浸出体系浸出15 d 后的各浸渣样进行SEM分析,结果如图5所示。从图5 可以看出,与未经细菌作用的富钾页岩对照样相比(见图5(a)),各浸出体系中富钾砂页岩浸渣表面均有明显的变化,且不同浸出体系对富钾砂页岩的溶蚀程度存在明显的差异。未经细菌作用的富钾砂页岩表面较为光滑平整,晶体结构较为完整。经出发菌株AT与PA作用后的富钾砂页岩浸渣表面形貌,表面均变得粗糙不平,凹凸不平状更显著,出现了大量溶蚀坑与裂缝。与AT菌相比,PA菌对富钾砂页岩的溶蚀作用更强,溶蚀的面积更大(见图5(b)和(c))。与出发菌株相比,诱变菌株对富钾砂页岩的溶蚀作用更为显著,其中诱变菌株ATM对富钾砂页岩的溶蚀作用与出发菌株PA对富钾砂页岩的溶蚀作用基本一致,但明显比对应的出发菌株AT的强;而经诱变菌株PAM 作用后的富钾砂页岩表面结构基本被破坏,原矿样中大的凸起部分被分裂成许多细小颗粒,矿物颗粒表面的溶蚀坑与裂缝较对应出发菌株PA作用后富钾砂页岩表面的更大、更深与更宽(见图5(d)和(e))。与诱变前后单一菌对富钾砂页岩的溶蚀作用相比,诱变后混合菌PAM+ATM 对富钾砂页岩的溶蚀作用最强,矿物表面结构被整体破坏,非晶态物资显著增多,大量的细小颗粒基本呈絮状相互粘连在一起(见图5(f))。

图5 浸出15 d 后不同浸出体系中富钾砂页岩浸渣表面的SEM像
Fig. 5 SEM images of potassium-rich sandshale surfaces after leaching for 15 d in different bioleaching systems
为进一步验证诱变前后实验菌株对富钾砂页岩矿物结构的破坏程度差异,以及混合菌在浸矿过程中的协同效应,选取释钾效果较好的PA为研究对象,对含出发菌株PA 、诱变菌株PAM 与混合菌株ATM+PAM的浸矿体系中的浸渣进行XRD 分析,结果如图6所示。结果表明,与不含细菌浸出体系中的富钾砂页岩对照样(CK)相比,在有菌的3组浸出体系中,XRD谱中代表富钾页岩中各矿物(钾长石、石英、伊利石、白云母)晶体结构的特征峰均有不同程度的降低或消失。单一诱变菌株PAM比单一出发菌株PA 对富钾砂页岩中各矿物的破坏作用要强,其XRD谱中代表钾长石、石英、伊利石、白云母各矿物晶体结构的特征锐锋下降幅度更为明显,其中代表白云母的特征峰基本消失,代表伊利石的特征峰大部分消失,且出现了代表水铝石晶体结构的新特征峰。而经混合菌ATM+PAM作用后,XRD谱中代表白云母与伊利石的特征峰均基本消失,代表新生矿物水铝石的特征峰有显著增强。
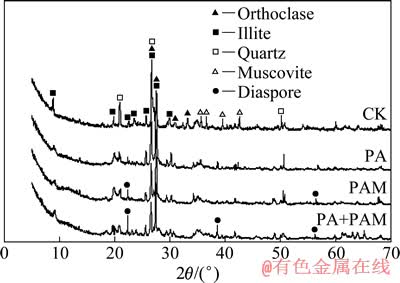
图6 浸出15 d 后不同浸出体系中富钾砂页岩浸渣的XRD 谱
Fig. 6 XRD patterns of potassium-rich sandshale residues after leaching for 15 d in different bioleaching systems
上述分析结果表明:PA与AT经DES 诱变后,显著提高了它们对富钾砂页岩的溶蚀与破坏作用能力;在混合菌浸矿过程中,AT 可以协助PA 的浸矿作用,增强其对矿物的破坏程度;在多种矿物同时存在的情况下,细菌对各矿物的破坏作用具有一定的选择性,具层状结构的白云母与伊利石较具架状结构的钾长石更易首先被细菌溶蚀分解,这与周跃飞[21]及孙德四等[11]前期研究结果一致。在单一诱变菌PAM与PAM+ATM混合菌的作用下,富钾砂页岩部分转化成了新生矿物水铝石,表明细菌的溶蚀作用使钾矿物的晶体结构受到破坏的同时,一种矿物会被转变成另一种或多种矿物,形成次生矿物模块。
2.5 浸出过程中浸出液内生物群落结构的动态演替
分别在诱变前(PA + AT) 与诱变后(PAM + ATM)混合菌浸矿浸出3、6、9、12和15 d 的浸出液中取样,提取细菌的总DNA,通过PCR 扩增、连接、转化,采用ARDRA分析各样品中P.Polymyxa 与A.tumefaciens 所占比例,结果如图7所示。从图7可以看出,在接种了诱变前混合菌与诱变后混合菌的两种浸矿体系中,随着浸出时间的延长,诱变前后的P.Polymyxa在各自的浸出体系中所占比例逐步增加,而A.tumefaciens 的比例逐步下降。在接种了诱变前混合菌浸出体系中,在3 d和6 d的样品中,PA 与AT 的数量比在1.5:1以内,而当浸出到9 d 及以后,PA 菌的比例大幅上升;到15 d浸出结束时,浸出液中PA菌所占比例为87%,AT 菌所占比例为13%。在相同条件下,接种了诱变后混合菌的浸矿体系中,在3 d的样品中,PAM 与ATM 的数量比为1.5:1,在6 d 及以后的样品中,PAM 菌的比例显著上升,ATM菌的比例显著下降,在15 d 浸出液样品中,PAM 菌所占比例为94.6%,ATM菌所占比例只有5.4%。上述对比分析结果表明,A.tumefaciens 不是浸矿过程中的优势菌种,只占混合菌群落结构的小部分,协助P.Polymyxa起浸矿作用。因此,在以后的钾矿物微生物浸矿提钾实验过程中应更多考虑有利于P.Polymyxa 的浸矿条件,并在浸出体系中接种少量的A.tumefaciens,以提高其浸矿效率。

图7 P.Polymyxa 与A·tumefaciens诱变前与诱变后在不同浸出时间时所占比例
Fig. 7 Percentages of P.Polymyxa and A·tumefacien before (a) and after (b) mutagenesis for different leaching time
3 结论
1) 硫酸二乙酯(DES)诱变P.Polymyxa 与A.tumefaciens 的最佳剂量分别为30和40 mg/L,致死率分别为87%和85%,正突变率分别为10%和16%。诱变后筛选所得的诱变菌株PAM和ATM达到生长稳定期的时间分别比对应的出发菌株缩短了48和24 h,且有更大的细菌浓度;诱变菌株产酸与产胞外多糖及蛋白质的能力较出发菌株有了较大的提高,其中诱变菌株PAM产酸与产胞外聚合物的能力最强。
2) 诱变菌株PAM和ATM对富钾砂页岩的溶蚀分解能力比对应的出发菌株要强。浸出液中K2O质量浓度分别比出发菌株提高了29.00% 和21.28%,且达到浸出终点的时间分别提前了5和3 d;混合诱变菌株优于单独出发菌株、单独诱变菌株和混合出发菌株对富钾页岩的溶钾效果,浸出体系达到浸出终点的时间比出发菌株提前了6 d,比浸矿效果较好的诱变菌株PAM提前了1 d;浸出液中K2O质量分数分别比单一诱变菌株PAM和ATM的提高了22.78% 和67.55%。
3) 在富钾砂页岩混合菌浸矿过程中,P.Polymyxa 与A.tumefaciens相比,P.Polymyxa 为浸矿过程中的优势菌,随着浸出时间的延长,P.Polymyxa数量逐步增加,而A.tumefaciens数量逐步下降。在浸出15 d后,出发菌株 PA与AT的数量比由1:1变为7:1左右;而诱变菌株PAM与ATM的数量比由1:1变为18:1左右。
REFERENCES
[1] COLPAN E, ZENGIN M,  ZBAHCE A. The effects of potassium on yield and fruit quality components of stick tomato[J]. Horticultural Environmental Biotechnology, 2013, 54(1): 20-28.
ZBAHCE A. The effects of potassium on yield and fruit quality components of stick tomato[J]. Horticultural Environmental Biotechnology, 2013, 54(1): 20-28.
[2] PARMAR P, SINDHU S S. Potassium solubilization by rhizosphere bacteria: Influence of nutritional and environmental conditions[J]. Journal of Microbiology Research, 2013(3): 25-31.
[3] BOCHAMIKOVA E A, LOGINOV S V, MATYCHENKOV V V, STOROZHENKO P A. Silicon fertilizer efficiency[J]. Russian Agricultural Sciences, 2010, 36(6): 446-448.
[4] MA J F, YAMAJI N. Silicon uptake and accumulation in higher plants[J]. Trends Plant Sciences, 2006, 11: 392-397.
[5] ANJUMN F, SHAHID F, AKCIL A. Biohydrometallurgy techniques of low grade ores: A review on black shale[J]. Hydrometallurgy, 2012, 117/118: 1-12.
[6] BRIERLY C L. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 216-221.
[7] DOPSON M, LOVGREN L, BOSTROM D. Silicate mineral dissolution in the presence of acidophilic microorganisms: Implications for heap bioleaching[J]. Hydrometallurgy, 2009, 96(4): 325-329.
[8] MOCKOVCIAKOVA A, IVETA S, JIRI S. Characterization of changes of low and high defect kaolinite after bioleaching[J]. Applied Clay Sciences, 2008, 39(3/4): 451-455.
[9] PHILIPS-LANDER C M, FOWLE D A, TAUTON A, HERNANDEZ W, MORA M, MOORE D, SHINOGLE H, ROBERTS J A. Silicate dissolution in Las Pailas thermal field: Implication for microbial weathering in acidic volcanic hydrothermal spring systems[J]. Geomicrobiology Journal, 2014, 31: 23-41.
[10] HUTCHENS E, VALSAMI J E, MCELDOWNEY S, GAZE W, MCLEAN J. The role of heterotrophic bacteria in feldspar dis-solution-An experimental approach[J]. Mineralogical Magazine, 2003, 67: 1157-1170.
[11] 孙德四, 陈 晔, 曹 飞. 细菌-矿物接触方式对铝土矿降解的影响[J]. 中国矿业大学学报, 2013, 42(1): 122-127.
SUN De-si, CHEN Ye, CAO Fei. Influence of microbe-mineral contact model on decomposition of bauxite[J]. Journal of China University of Mining & Technology, 2013, 42(1): 122-127.
[12] 孙德四, 陈 晔, 曹 飞. 矿物环境对硅酸盐细菌的铝土矿浸矿脱硅作用的影响[J]. 化工进展, 2012, 21(10): 2341-2348.
SUN De-si, CHEN Ye, CAO Fei. Effects of mineral environments on desilicon from bauxite by silicate bacteria[J]. Chemical Industry and Engineering Progress, 2012, 21(10): 2341-2348.
[13] XIAO B, LIAN B, SHAO W. Do bacterial secreted proteins play a role in the weathering of potassium-bearing rock powder?[J]. Geomicrobiology Journal, 2012, 29: 497-505.
[14] 满李阳, 曹晓燕, 孙德四. 钾细菌-矿物接触模式对富钾页岩分解行为的影响[J]. 中国有色金属学报, 2014, 24(4): 1099-1109.
MAN Li-yang, CAO Xiao-yan, SUN De-si. Effect pf potassium-solubilizing bacteria-mineral contact mode on decomposition behavior of potassium-rich shale[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(4): 1099-1109.
[15] 孙德四, 尹健美, 陈 晔, 曹 飞. 钾矿物晶体结构对黑曲霉生长代谢及钾与硅的溶出影响[J]. 中国农业科学, 2014, 47(3): 503-513.
SUN De-si, YIN Jian-mei, CHEN Ye, CAO Fei. Effect of crystal structures of potassium-bearing minerals on Aspergillus niger growth metabolism and potassium and silicon release[J]. Scientia Agricultura Sinca, 2014, 24(4): 503-513.
[16] ZHOU Y F, WANG R C, LU X C. Anorthite dissolution promoted by bacterial adhesion: Direct evidence from dialytic experiment[J]. Earth Sciences Science China, 2011, 54(2): 204-211.
[17] GHORBANI Y, OLIAZADEH M, SHAHVEDI A, ROOHI R, PIRAYEHGAR A. Use of some isolated fungi in biological leaching of aluminum from low grade bauxite[J]. African Journal of Biotechnology, 2007, 6(11): 1284-1288.
[18] LIU W X, XU X S, WU X H, YANG Q Y, LUO Y M. Decomposition of silicate minerals by Bacillus mucilaginosus in liquid culture[J]. Environmental Geochemistry and Health, 2006, 28: 133-140.
[19]  . Rock weathering by indigenous heterotrophic bacteria of Bacillus spp. at different temperature: a laboratory experiment[J]. Mineral Petrology, 2012, 105: 135-144.
. Rock weathering by indigenous heterotrophic bacteria of Bacillus spp. at different temperature: a laboratory experiment[J]. Mineral Petrology, 2012, 105: 135-144.
[20] 钟婵娟, 肖国光, 曹 飞, 孙德四. 铝土矿脱硅微生物的定向筛选及脱硅性能[J]. 高效地质学报, 2013, 19(4): 692-699.
ZHONG Chan-juan, XIAO Guo-guang, CAO Fei, SUN De-si. Orientation screening and desilicon abilities of silicon-releasing microorganisms from bauxite[J]. Geological Journal of China Universities, 2013, 19(4): 692-699.
[21] 周跃飞, 王汝成, 陆现彩. 微生物-矿物接触模式影响矿物溶解机制的实验研究[J]. 高校地质学报, 2007, 12, 13(4): 658-662.
ZHOU Yue-fei, WANG Ru-cheng, LU Xian-cai. Influence of microbe-mineral contact model on mineral dissolution: a primary study on microperthite dissolution by Paenibacillus polymyxa[J]. Geological Journal of China Universities, 2007, 12, 13(4): 658-662.
[22] 周 丹, 曾宪鹏, 李盛钰, 赵玉娟, 张 雪, 谢达平, 杨贞耐. 植物乳杆菌荚膜缺陷型菌株的诱变选育[J]. 微生物学报, 2010, 11, 37(11): 1666-1671.
ZHOU Dan, ZHENG Xian-peng, LI Sheng-yu, ZHAO Yu-juan, XIE Da-ping, YANG Zhen-nai. Mutagenesis and breeding of capsule-deficient lactobacillus plantarum[J]. Microbiology China, 2010, 11, 37(11): 1666-1671.
[23] DONG Y B, LIN H, WANG H. Effects of ultraviolet irradiation on bacteria mutation and bioleaching of low-grade copper tailings[J]. Minerals Engineering, 2011, 24(8): 870-875.
[24] XU A L, XIA J L, ZHANG S. Bioleaching of chalcopyrite by UV-induced mutagenized Acidiphilium cryptum and Acidithiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China, 2010, 20: 315-321.
[25] 程 明, 崔承彬, 李长伟, 田从魁, 杜智敏. 化学诱变技术在微生物育种研究中的应用[J]. 国际药学研究杂志, 2009, 36(12): 412-417.
CHEN Ming, CUI Cheng-bin, LI Chang-wei, TIAN Cong-kui, DU Zhi-min. Chemical mutation technique applied microorganism breeding[J]. Journal of International Pharmaceutical Research, 2009, 36(12): 412-417.
(编辑 王 超)
基金项目:国家自然科学基金资助项目(51264014,31360064);江西省教育厅科技项目(GJJ14736)
收稿日期:2014-07-13;修订日期:2014-11-17
通信作者:陈 晔,教授;电话:15170295286;E-mail:chenyesds@126.com