反硝化聚磷菌的SBR反应器中微生物种群与浓度变化
周康群,刘 晖,孙彦富,王宝娥,周遗品
(仲恺农业技术学院 环境科学与工程系,广东 广州,510225)
摘 要:依据DPB原理,以SBR反应器富集反硝化聚磷菌,进行各阶段的泥水混合液中微生物浓度与种群变化的研究。研究结果表明:聚磷菌\反硝化聚磷菌的浓度分别增加为原来的94和75倍。第2段运行后,常规聚磷菌和部分放线菌被淘汰,污泥沉降比(SV)的变化为反应器细菌变化提供了指示作用。好氧段中硝化菌、亚硝化菌浓度明显比厌氧段的高。好氧段中亚硝化菌下降为原来的0.63倍,但硝化菌的浓度增加为最初的19.3倍。反硝化菌、聚磷菌的浓度比反硝化聚磷菌多。反硝化菌的浓度先上升后下降,第2段淘汰了常规的反硝化菌。反应器中有一定量的发酵菌和产乙酸菌,但无产甲烷菌。富集后聚磷菌的种类减少且集中,反硝化聚磷菌以假单胞菌属、棒状杆菌属为主,肠杆菌科和葡萄球菌属次之。
关键词:硝酸盐;反硝化聚磷菌;微生物浓度;微生物种群
中图分类号:X172 文献标识码:A 文章编号:1672-7207(2008)04-0705-07
Change of microorganism amount and species in
SBR reactor enriching denitrifying phosphate bacteria
ZHOU Kang-qun, LIU Hui, SUN Yan-fu, LIU WANG Bao-e, ZHOU Yi-pin
(Department of Environment Science and Engineering, Zhongkai Agrotechnical College, Guangzhou 510225, China)
Abstract: Based on the DPB(denitrifying phosphorus removal bacteria) principal, the SBR(sequencing batch reactor) reactor was used to enrich DPB. The change of microorganism amount and species during different phases were studied. The result shows that the amounts of PAO(phosphate accumulation organism) and DPB increase 94 and 75 times, respectively. After the second phase, the routine PAO and partial actinomyces are eliminated. The change of SV(sludge setting ratio) provided the indication of the bacteria change. The amount of nitrate and nitrite bacteria during the aerobic phase is larger than that of anaerobic phase. The amount of nitrite bacteria decreases 0.63 times but the nitrate bacteria increases 19.3 times. The amount of denitrifying bacteria and PAO is more than that of DPB. The amount of denitrifying bacteria rises first but then drops. The routine denitrifying bacteria are eliminated during the second phase. The reactor has some zymogen and acetogen, but no methanogen bacteria. After enrichment the species of PAO are reduced and concentrated. DPB includes Pseudomonas spp/ Corynebacterium spp /Enterobacteriaceae spp and Staphylococcus spp.
Key words: nitrate; denitrifying phosphate bacteria; microorganism amount; microorganism species
生物反硝化聚磷技术是国内外污水处理研究领域的重点和热点,其原理是依据DPB(Denitrifying phosphorus removal bacteria)理论,即反硝化聚磷菌在厌氧条件下吸收有机物同是合成为细胞内储备营养物PHB(聚β-羟基丁酸)并释放正磷酸盐,而在缺氧环境下利用硝酸盐作为电子受体,进行反硝化作用的同时超量聚磷,使得聚磷反硝化脱氮这2个生物过程在缺氧环境下由同一类微生物一并完成。其结果表明,聚磷和脱氧过程的结合不仅降低了脱氮对碳源的需亲,而且缺氧条件下完成聚磷,可节省好氧聚磷所需能源和池容。此外,产生的剩余污泥量大大降低[1-2]。同时解决了碳源双重消耗问题,提商了脱氮聚磷效率[3-4]。国内依据此原理开发了一系列的同步反硝化聚磷工艺和设备,但目前国内外对反硝化生物聚磷工艺中微生物的变化情况研究很少,此方面研究远远落后于对工艺过程的研究。仅罗宁等[5]对新型生物反硝化除磷脱氮系统处于稳定运行时微生物的组成进行了初步探讨。迄今为止,未见反硝化聚磷工艺在富集DPB菌过程体系中,微生生的浓度、种类与种群变化全面、系统的研究报道。在此,本文作者采用SBR反应器富集以硝酸盐为电子受体的反硝化聚磷菌,以3个处理阶段的泥水混合液为研究对象,进行微生物浓度、种类与种群变化的跟踪与研究。
1 材料与方法
1.1 动态SBR反应器
采用动态SBR反应器有效容积35 L,内设黏砂曝气头,采用鼓风曝气,反应器中同时设有搅拌器在厌氧和缺氧环境下使泥水均匀混合,实验系统见图1。
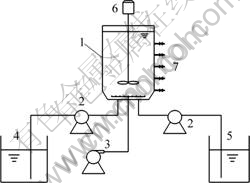
1—动态反应器;2—泵;3—风机;4—人工合成模拟废水;
5—不含COD的人工模拟废水;6—搅拌器;7—排水取样口
图1 动态SBR反应器
Fig.1 Dynamic SBR reactor
1.2 SBR反应器工艺流程
SBR反应器工艺流程见图2。
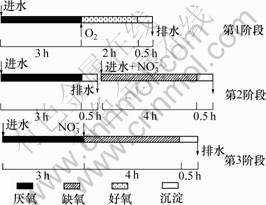
图2 SBR反应器工艺流程
Fig.2 Technology flow of SBR
1.3 试验材料
1.3.1 试验废水
试验废水采用仲恺农业技术学院生活区污水,其主要成分见表1。
表1 试验主要废水成分
Table 1 Composition of waste water used during experimental period

1.3.2 SBR反应器供试活性污泥
取自运行良好的污水处理厂A2/O工艺厌氧段污泥。
1.3.3 细菌计数及聚磷菌种群变化供试活性污泥
将所取污泥与表1中的试验废水混合(混合液质量浓度为3.5~4.0 g/L)。利用图1所示的动态SBR反应器的装置和图2所示的SBR反应器工艺流程分3个阶段,以NO-3作为电子受体对反硝化聚磷菌(DPB)进行选择和富集,装置共运行了168周期。其中:第1阶段以厌氧/好氧工艺运行20周期,得到具有高效的好氧除磷污泥;第2阶段厌氧/沉淀/排水/缺氧/沉淀工艺运行103周期(厌氧释磷和沉淀排水之后加不含COD,其他成分同表1的人工合成废水),其目的是淘汰常规的反硝化菌,而对反硝化聚磷菌进行选择和富集(缺氧段系统氮磷按n(NO3--N)?n(po43--P)=2?1流 加[6]);第3阶段采用厌氧/缺氧/沉淀工艺运行45周期,目的是稳定第2阶段选择和富集的反硝化聚磷菌和系统抗冲击负荷能力。
在反硝化聚磷菌的富集过程中,细菌计数和聚磷菌种群变化供试种泥,取自SBR反应器中各阶段去除率每出现一个明显的上升值时该周期的泥水混合液。
1.3.4 供试培养基
a. 硝化菌培养基、反硝化菌培养基配方和制作按文献[7]中所述方法进行。
b. 肉膏蛋白胨培养基、高氏合成1号培养基、真菌培养基、发酵菌培养基、产乙酸菌培养基、产甲烷菌培养基配方和制作按文献[7]中所述方法进行。
c. 聚磷菌培养基配方和制作按文献[8]中所述方法进行。
1.4 试验方法
1.4.1 细菌总数测定方法
将1.3.3节中制得的种泥分别接种到1.3.4节中的培养基上。每种培养基每个稀释浓度下接3个平行样,采用稀释平板法和MPN法相结合,分别进行好氧培养或厌氧培养后细菌计数[7]。
1.4.2 聚磷菌分离与纯化
将1.4.1节中培养出的单一菌落用划线、稀释分离方法,并经3~4次转移平板纯化得纯菌株并转入矿物油斜面保存。
1.4.3 聚磷菌属鉴定[9]
将1.4.2节中分离、纯化后的菌株进行了革兰氏染色、运动性(半固体琼脂穿刺法)、氧化酶试纸检测、反硝化试验、吲哚、葡萄糖氧化发酵、产氨试验、硝酸盐还原、亚硝酸盐还原、异染粒等试验,以常用细菌鉴定手册鉴定归属。
1.4.5 指标分析方法
氧化还原电位采用SUNTEX TS-2手提式氧化还原电位仪测定;NO-3-N采用麝香草酚分光光度测定;COD采用5B-1型快速测定仪测定;磷酸盐采用钼锑抗分光光度法测定;混合液浓度采用滤纸重量法测定;pH值采用98127型手持式pH计测定。
2 结果与讨论
2.1 聚磷菌的浓度变化
采用稀释平板法测定第1阶段好氧聚磷菌和第2阶段反硝化聚磷菌的浓度,结果见表2和表3。
表2 第1阶段典型周期好氧聚磷菌(PAO)总数及COD、磷酸盐去除率的变化
Table 2 Change of PAO/COD and phosphate removal efficiency during the first typical cycle
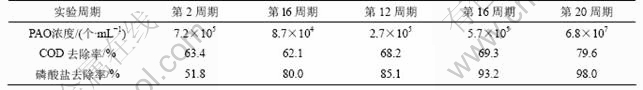
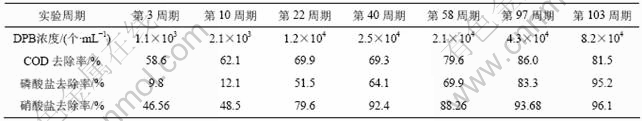
表3 第2阶段典型周期反硝化聚磷菌(DPB)总数及COD、硝酸盐、磷酸盐去除率的变化
Table 3 Change of DPB/COD /nitrate/phosphate removal efficiency during the second typical cycle
由表2可知,经第1段活化后,好氧聚磷菌的浓度均有明显的增加,由7.2×105 个/mL上升为6.8×107 个/mL,其浓度增长93倍,与此同时PO3-4-P和COD去除率同步逐渐升高,分别由63.4%和51.8%上升至79.6%和98.0%。
由表3可知,反硝化聚磷菌的浓度也有一定增加,由1.1×103 个/mL上升至8.2×104 个/mL,其浓度增长74倍,与此同时,PO3-4-P,NO-3-N和COD去除率同步逐渐升高,分别由9.8%,46.56%和58.6%上升至95.2%、96.1%和81.5%。其原因是:污水中的有机物在厌氧发酵产酸菌的作用下转化为乙酸苷,而污泥中的好氧聚磷菌和反硝化聚磷菌在厌氧的不利状态下,因呼吸链作用被抑制,分解体内积聚的磷产生能量,能量中一部分供聚磷菌生存,另一部分能量供细菌主动吸收乙酸苷转化为聚β-羟基丁酸(PHB)储藏于体内,同时消除糖酵解过程所形成的H+维持正常能量平衡。而进入好氧或缺氧状态后的聚磷菌,除了吸收、利用污水中残剩的可生物降解有机物外,主要是以氧气或硝酸盐为电子受体,分解消耗内部贮存的PHB和外源基质释放能量摄取环境中的溶磷,产生质子运动力,质子运动力的一个作用是运输体系中磷酸盐,另一作用在三磷酸腺苷酶的位置形成ATP,继而形成聚磷酸盐成为细胞生长的磷库,即在去除有机物、聚磷酸盐和硝酸盐的同时,使细菌获取能量得以生存和增值[10]。
但值得注意的是,表2和表3中数据显示,聚磷菌的浓度由第1段末的6.8×107 个/mL减少到第2段初的2.4×105 个/mL,其原因是实验体系运行由第1段的厌氧/好氧方式进入到第2段的厌氧/缺氧方式运行后,一部分仅能利用氧气不能利用硝酸盐为电子受体的常规的聚磷菌被淘汰,进一步说明体系的生态环境(缺氧段的氧化还原电位VOR为-100~+50 mV,厌氧段的氧化还原电位VOR为-100~ -180 mV)不利于常规好氧聚磷菌生存。
2.2 第2阶段富集过程污泥沉降比的变化与放线菌、真菌和反硝化聚磷菌(DPB)浓度的关系
采用稀释平板计数法测定出反应器第1段不同周期的放线菌、真菌的浓度,并同时测量污泥沉降比(SV),结果见表4。从表4可看出,前10周污泥沉降比明显下降(由15%降为7%),与此同时,由于放线菌大多是好氧的,必须有足够的氧气才能生存,因此,放线菌的浓度也有明显下降,说明污泥沉降比的下降与常规好氧聚磷菌、部分放线菌被淘汰有关。第10~ 103周期污泥沉降比逐步上升(由7%上升到18%),这与表3中反硝化聚磷菌(DPB)总数在10~103周期呈逐渐增加趋势相符合,而放线菌的浓度变化并不大。因此,在试验过程中,可通过污泥沉降比变化情况,既简单又及时地间接了解到反应器中反硝化聚磷菌的富集情况,为整个反应器的运行提供了指示作用。
表4 第2阶段典型周期污泥沉降比与放线菌、真菌浓度的变化
Table 4 Change of SV/actinomyces and fungi during the second typical cycle
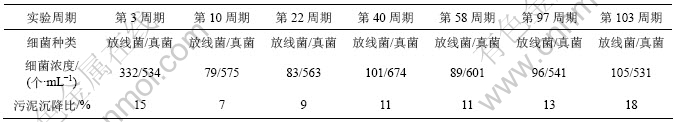
真菌浓度较放线菌浓度大,但不同周期浓度变化不大,说明真菌受温度、进水水质等因素的影响不大,这与周康群等[11]在反硝化聚磷一体化设备中微生物浓度变化的研究的报道相一致,建议对反应器后续周期的真菌的浓度变化不再进行跟踪研究。
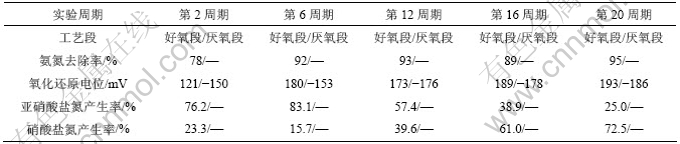
2.3 硝化菌、亚硝化菌的浓度及变化
反应器在第1段好氧条件下不同运行周期的硝化菌、亚硝化菌的浓度变化见5。与此同时监测进出水的氨氮去除率和亚硝酸盐氮、硝酸盐氮产生率的变化,其结果见表6。从表5可以看出,好氧段中亚硝化菌的浓度在103~104个/mL之间变化,硝化菌的浓度在102~104 个/mL之间变化,并且好氧段亚硝化菌的浓度逐步降低为最初的0.63倍,而硝化菌的浓度逐步升高为最初的19.3倍。结合表6中氨氮去除率及亚硝酸盐氮、硝酸盐氮产生率数据,即氨氮去除率在试验整个过程都高达78%~95%,亚硝酸盐氮产生率由初期的76.2%降为后来的25%,而硝酸盐氮产生率则逐步增加,由初期的23.3%升至后来的72.5%。硝化菌、亚硝化菌的浓度化趋势与氨氮去除率、亚硝酸盐氮和硝酸盐氮产生率间表现出良好的同步关系。分析其原因,是亚硝化菌优先在反应器中生长繁殖,而硝化菌则因适应能力比前者弱,生长较慢[12],前者硝化能力相应小于后者,因而造成亚硝酸盐氮的初期积累。随着运行时间的增加,硝化菌逐步适应和增值,出水硝酸盐氮浓度开始上升,亚硝酸盐氮逐渐下降,致使硝酸盐氮产生率和硝化菌浓度逐步升高而亚硝酸盐氮产生率和亚硝菌浓度逐步降低。该观点与王志盈等[12]在内循环生物流化床硝化过程的选择特性研究中的观点一致,可见,在溶解氧充足(氧化还原电位为121~ 193 mV)、环境适宜的条件下,生物膜上硝酸菌和亚硝酸菌的浓度及硝化能力最终会达到平衡,完成NH4+-N到NO3--N的转化。
表5 第1阶段典型周期硝化菌和亚硝化菌的浓度
Table 5 Change of nitrate/nitrite bacteria during the first typical cycle

表6 第1阶段典型周期氨氮去除率及亚硝酸盐氮、硝酸盐氮产生率变化
Table 6 Change of ammonia/nitrite and nitrate removal efficiency during the first typical cycle
对比表5厌氧段中硝化菌与亚硝化菌浓度变化,硝化菌和亚硝化菌浓度明显比好氧段的少。但亚硝化菌浓度较硝化菌浓度多,并且亚硝化菌浓度增值为最初的2倍,而硝化菌浓度下降了近50%,这说明:一方面,硝化菌、亚硝化菌因氧化还原电位降低,其强烈好氧性受限而使浓度降低;另一方面,亚硝酸菌对有限溶解氧的竞争力强于硝化菌,致使亚硝化菌浓度增值速度比硝化菌高。说明低溶氧状态下亚硝化菌能够继续增值,而硝化菌则由于对溶解氧的竞争能力小于前者,其正常的繁殖过程受到了严重的抑制,且由于长期缺氧而在内源呼吸中死亡,浓度降低。该观点与王志盈等人观点一致[12]。
2.4 反硝化菌浓度变化
由表7可知,反硝化菌的浓度在前10周期略有上升(由1.9×105 个/mL上升为3.6×105 个/mL),而磷酸盐去除率在前10周期都较低(仅由最初的9.86%上升为12.1%),此时,硝酸盐的去除率却很高(46.5%~ 50.1%),说明反应器在0~10周期内反硝化菌占主导。但反应器在10~103周期中,随着培养周期不断增长反硝化菌的浓度逐步减少,至103周期时浓度仅为开始的51%(由1.9×105个/mL降为9.6×104 个/mL),而反应器从10周期至103周期,磷酸盐和硝酸盐的去除率分别由12.1%,48.5%上升至95.2%和96.1%。再结合表3中反硝化聚磷菌浓度也同期由2.1×103个/mL上升至8.2×104 个/mL,这表明常规的反硝化菌(即只具有反硝化脱氮功能而没有聚磷功能的细菌)被淘汰,说明反硝化聚磷菌通过适应后浓度在不断增加。这与第2阶段采用厌氧/沉淀/排水/缺氧的运行方式,并在厌氧释磷、沉淀和排水之后加不含COD的人工合成废水,限制反硝化菌的生长的富集条件吻合。
表7 第2阶段典型周期反硝化菌总数及硝酸盐、磷酸盐去除率的变化
Table 7 Change of amount of denitrifying bacteria/nitrate and phosphate removal efficiency during the second typical cycle
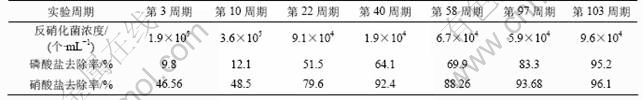
通过比较表3和表7,需注意反应器第2段反硝化菌的浓度变化(范围为104~105 个/mL)。反硝化菌浓度较反硝化聚磷菌浓度(103~104个/mL)多,再对比表2和表3中的好氧聚磷菌浓度与反硝化聚磷菌浓度,发现好氧聚磷菌浓度(105~107个/mL)也明显高于反硝化聚磷菌浓度(104~105个/mL)。分析其原因,一方面,由于硝酸盐还原和超量聚磷是2种并不冲突的细菌生化特性,某些细菌既可以单独拥有其中一种生化特性,也可以同时拥有2种生化特性,反硝化菌和聚磷菌之间并无严格区分,可互相交叉,其交叉点是反硝化聚磷菌[13];另一方面,Hu等[14]分别以NO-3-N和O2不同电子受体对厌氧/缺氧条件下驯化的污泥进行了反硝化聚磷研究,其结果表明,可利用NO3--N为电子受体的聚磷菌,同时也可利用O2为电子受体,这类菌称为反硝化聚磷菌。Wachtmeister等[15-16]设计了一个批量试验装置来研究全部聚磷菌中反硝化聚磷菌的浓度,认为缺氧聚磷和好氧聚磷速率的比值反映了反硝化聚磷菌和全部聚磷菌的比值。由此说明反硝化菌中包含了反硝化聚磷菌,而聚磷菌中也包含一部分反硝化聚磷菌。试验中可根据反硝化菌、反硝化聚磷菌和聚磷菌的浓度变化及时调整反应器的条件,富集出所需要的目标种群。
2.5 厌氧菌的浓度变化
采用厌氧菌的培养方法,测定第2阶段厌氧段中厌氧菌的浓度,结果见表8。试验结果表明,反应器中存在一定浓度的发酵菌和产乙酸菌,其浓度经过103周期的运行有一定的增加。这是因为反应器厌氧段中氧化还原电位控制在-180 mV左右,并且有一定量的有机物,发酵菌产生的胞外酶分解至小分子的有机酸、醇,而乙酸菌将简单的有机酸、醇进一步转化为乙酸,从而发酵菌、乙酸菌得到生长和繁殖,这与表3中COD有一定去除率相吻合。而聚磷菌利用发酵菌、乙酸菌转化的乙酸苷作为能量,能量中一部分供聚磷菌生存,另一部分能量供细菌主动吸收乙酸苷转化为聚β-羟基丁酸(PHB)储藏于体内。因此,发酵菌和产乙酸菌的存在为聚磷菌生长创造了条件。而产甲烷菌的浓度在反应器中均未检出,这说明反应器中控制的环境氧化还原电位不适宜于严格厌氧菌的生长。
表8 第2阶段典型周期厌氧菌总数的变化
Table 8 Change of amount of anaerobic bacteria during the second typical cycle

2.6 反应器中种群的变化
由于聚磷菌在第1阶段(聚磷菌活化)和第2阶段(富集反硝化聚磷菌)生长的条件不同。而第2和第3阶段是反硝化聚磷菌富集和稳定阶段,其生长的条件一致,此时,第2阶段磷酸盐和硝酸盐去除率分别由开始的9.8%,46.56%上升为第103周期的95.2%和96.1%,第3阶段45周期内磷酸盐和硝酸盐去除率稳定在95%和97%。为了解反应器中聚磷菌种群的变化,利用微生物分离和纯化的方法,分别在第1、第2和第3阶段分离出单菌株为24株、26株和31菌株,通过革兰氏染色和菌落特征的观察,合并为14株、9株和11株。经细菌的主要生理生化指标测定,利用常用细菌鉴定手册[9]为依据鉴定归属结果见表9。从表中各段细菌的组成可以看出,通过第3阶段的富集,聚磷菌的种类在减少,由第1阶段的5个种类到第2阶段的4个种类和第3阶段的3个种类,第2阶段和第3阶段主要的反硝化聚磷菌的种类为假单胞菌属、棒状菌属,其次是肠杆菌科和葡萄球菌属,假白喉棒杆菌属最少并且为国内首次报道,但第3阶段未分离到假白喉棒杆菌属,可能是由第2阶段转第3阶段时富集条件发生了变化所致,有待于进一步研究。该结果与Fuhs和Chen等提出废水生物除磷完全是由不动杆菌属组成的观点不一致[10],但与罗宁等[5]在新型双泥生物反硝化除磷脱氮系统中所分离到的种群的观点有部分是一致的。在污水生物脱氮除磷过程中,活性污泥混合液内微生物组成和浓度的差异,是因所采用的处理工艺的类型、进水水质和运行条件等不同所致。说明掌握反应器中微生物种群组成和变化,对于更好地控制生物除磷体系的运行、取得良好的除磷效果很重要。
表9 反应器不同阶段活性污泥中主要的聚磷菌
Table 9 Main PAO of activated sludge in reactor during different phases

3 结 论
a. 第1段中好氧聚磷菌的浓度分别增加为原来的94倍。第2段中反硝化聚磷菌的浓度增加为原来的75倍,反硝化聚磷菌浓度的增加与PO43---P,NO3--N和COD去除率升高呈同步关系。由第1段进入第2段方式运行后,常规的聚磷菌被淘汰,致使聚磷菌的浓度减少。
b. 第2阶段前10周由于常规好氧聚磷菌、部分放线菌被淘汰,污泥沉降比由15%降为7%。在第10~103周期,污泥沉降比由7%上升到18%,与反硝化聚磷菌浓度增加有关而与放线菌的浓度变化无关。通过测定污泥沉降比的变化,简单、及时了解到反应器中反硝化聚磷菌的富集情况,为整个反应器的运行提供了指示作用。真菌较放线菌浓度多,但浓度变化不大。
c. 好氧段中硝化菌、亚硝化菌浓度明显比厌氧段高。好氧段中亚硝化菌的浓度降为最初的0.63倍硝化菌的浓度升为最初的19.3倍。但厌氧段中亚硝化菌浓度增加为最初的2倍,而硝化菌浓度下降为最初的0.5倍。好氧段中硝化菌、亚硝化菌的浓度变化与氨氮去除率、亚硝酸盐氮和硝酸盐氮产生率趋势表现出良好的同步关系。
d. 反硝化菌浓度和好氧聚磷菌浓度较反硝化聚磷菌浓度多。反硝化菌的浓度前10个周期略有上升,说明反应器在第0~10个周期内反硝化菌占主导。但到了第103个周期反硝化菌的浓度仅为开始的51%,在第2段中淘汰了常规的反硝化菌。
e. 反应器中存在一定浓度的发酵菌和产乙酸菌,而产甲烷菌的浓度在反应器中均未检出,这说明反应器中控制的环境的氧化还原电位不适宜于严格厌氧菌的生长。
f. 通过3阶段的富集,聚磷菌的种类减少并且集中,反硝化聚磷菌的种类为假单胞菌属、棒状杆菌属,其次是肠杆菌科和葡萄球菌属,假白喉棒杆菌属最少且为反硝化聚磷菌。
参考文献:
[1] Meinhold J, Filipe C D M, Dagger G T, et al. Characterization of the denitrifying fraction of phosphate accumulating organisms in brological phosphate removal process[J]. Wat Sci-Tech, 1999, 39(1): 31-42.
[2] Kuba T, van Loosdrencht M C M, Brand F A, et al. Occurrence of denitrifying phosphorus removing bacteria in modified UCT type wastewater treatment plants[J]. Wat Res, 1997, 31(4): 777-786.
[3] Kuba T, van Loosdrecht M C M, Heijnen J J. Phosphorus and nitrogen removal with minimal COD requirement by integration of denitrifying dephosphatation and nitrification in a two-sludge system[J]. Water Research, l996, 30(7): l702-l710.
[4] Alan J, Daidou T, Tsuneda S, et al. Metabolic behavior of denitrifyng phosphate-accumulating organisms under nitrate and nitrite electron accepter conditions[J]. Journal of Bioscience and Bioengineering, 200l, 92(5): 442-446.
[5] 罗 宁, 罗固源, 吉方英, 等. 新型双泥生物反硝化除磷脱氮系统中微生物的组成[J]. 给水排水, 2003, 29(8): 33-35.
LUO Ning, LUO Gu-yuan, JI Fang-ying, et al. Microbial buildup on new two-sludge system for nitrogen and phosphorus removal[J]. Water & Wastewater Engineering, 2003, 29(8): 33-35.
[6] 李智勇, 王淑滢, 吴凡松, 等. 强化生物除磷体系中反硝化聚磷菌的选择与富集[J]. 环境科学学报, 2004, 24(1): 45-49.
LI Zhi-yong, WANG Shu-ying, WU Fan-song, et a1. Selection and enrichment of denitrifying phosphate accumulating bacteria in biologically enhanced phosphate removal process[J]. Acta Scientiae Circumstantiae, 2004, 24(1): 45-49.
[7] 马 放, 任南琪, 杨基先. 污染控制微生物学实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2002: 17-84.
MA Fang, REN Nan-qi, YANG Ji-xian. Pollute control microbial experimentation[M]. Harbin: Harbin Institute of Technology Press, 2002: 17-84.
[8] Kirsten S J, Anneli S L P. Polyphosphae accumulation among denitrifying bacteria in activated sludge[J]. Anaerobe, 1995(1): 161-168.
[9] 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
DONG Xiu-zhu. Familiar bacilli system identify enchiridion[M]. Beijing: Science Press, 2001.
[10] 李 军, 杨秀山, 彭永臻. 微生物与水处理工程[M]. 北京: 化学工业出版社, 2003: 360-361.
LI Jun, YANG Xiu-san, PENG Yong-zhen. Microbiology and water treatment engineering[M]. Beijing: Chemical Industry Press, 2003: 360-361.
[11] 周康群, 杜 林, 黄小丹, 等. 反硝化聚磷一体化设备中微生物浓度变化的研究[J]. 仲恺农业技术学院学报, 2001, 14(3): 18-22.
ZHOU Kang-qun, DU Ling, HUANG Xiao-dan, et al. Study on microorganisms change in denitrification and phosphorus removing integration equipment[J]. Journal of Zhongkai Agrotechnical College, 2001, 14(3): 18-22.
[12] 王志盈, 袁林江, 彭党聪, 等. 内循环生物流化床硝化过程的选择特性研究[J]. 中国给水排水, 2000, 16(4): 1-4.
WANG Zhi-ying, YUAN Lin-jiang, PENG Dang-cong, et al. Experimental study oil the selection characteristic of nitrification in down-flow biological fluidized bed(DBFB)[J]. China Water & Wastewater, 2000, 16(4): 1-4.
[13] 罗 宁, 罗固源, 许晓毅. 从细菌的生化特性看生物脱氮与生物除磷的关系[J]. 重庆环境科学, 2003, 25(5): 33-36.
LUO Ning, LUO Gu-yuan, XU Xiao-yi. Study on the relation between bio-denitrification and bio-dephosphatation by bacterial metabolism[J]. Chongqing Environmental Sciences, 2003, 25(5): 33-36.
[14] Hu J Y, Ong S L, Ng W J, et al. A new method for characterizing denitrifying phosphorus removal bacteria by using three different types of electron acceptors[J]. Wat Res, 2003, 37(14): 3463-3471.
[15] Wachtmeister A, Kuba T, van Loosdrecht M C M, et al. A sludge characterization for aerobic and denitrifying phosphoru removing sludge[J]. Wat Res, 1997, 31(3): 471-478.
[16] Meinhold J, Filipe C D M, Dagger G T, et a1. Characterization of the denitrifying fraction of phosphate accumulating organisms in biological phosphate removal process[J]. Wat Sci Tech, 1999, 39(1): 31-42.
收稿日期:2007-12-09;修回日期:2008-02-27
基金项目:广东省自然科学科学基金资助项目(04009663)
通信作者:周康群(1963-),女,江苏南京人,副教授,从事污水生物处理新技术新工艺研究;电话:020-89003191;E-mail: gzzkq@126.com