文章编号:1004-0609(2013)12-3462-08
铝酸钠溶液中S2-对低合金钢腐蚀行为的影响
谢巧玲,陈文汨
(中南大学 冶金与环境学院,长沙 410083)
摘 要:采用钢弹群釜溶出装置进行高温腐蚀实验,结合SEM和XRD等分析技术,研究S2-对低合金钢在高温铝酸钠溶液中腐蚀行为的影响。采用极化曲线法分析S2-加速低合金钢腐蚀的原因。结果表明:在高温条件下,随着S2-和碱浓度的升高,低合金钢具有很高的腐蚀速率,而随着氧化铝浓度的升高,腐蚀速率减小。表面腐蚀产物主要成分为Fe3O4,其结构疏松,在搅拌条件下易于从表面脱落。低温极化研究表明,S2-加速腐蚀原因是在金属表面形成结构不稳定的铁硫化物,当该硫化物被氧化成具有较稳定结构的氧化物时,铁的腐蚀得到抑制。
关键词:低合金钢;S2-;铝酸钠溶液;高温腐蚀;极化曲线
中图分类号:TF821 文献标志码:A
Effect of S2- on corrosion behavior of low alloy steel in sodium aluminate solution
XIE Qiao-ling, CHEN Wen-mi
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: The effect of S2- on the corrosion behaviors of low alloy steel in high temperature sodium aluminate was investigated by high temperature corrosion test conducted in steel bombs and analysis technologies of SEM and XRD. Polarization curve method was used to examine the origins of the corrosion acceleration. The results indicate that low alloy steel exhibits high corrosion rate as the concentrations of sulfide and hydroxide increase at high temperature, but the corrosion rate of low allay steel decreases with an increase in the concentration of alumina. The corrosion product mainly consists of Fe3O4, with a porous structure, which tends to fall off the surface easily when the solution is stirred. Polarization studies at lower temperature show that, accelerated corrosion is attributed to the formation of unstable iron sulfide with unprotected structure on the surface of metal, and when the sulfide is oxidized to oxide with stable structure, the corrosion of iron is inhibited.
Key words: low alloy steel; S2- ; sodium aluminate solution; high temperature corrosion; polarization curve
近几年来,随着高品位铝土矿逐渐开采殆尽致使资源面临枯竭,我国氧化铝工业开始大量使用高硫铝土矿生产氧化铝。矿石中的硫主要以黄铁矿(FeS2)形态存在,并在拜耳法溶出过程与苛性碱反应主要生成硫化钠(Na2S)及少量的Na2S2O3、Na2SO3和Na2SO4等,从而使硫大量转入工业铝酸钠溶液中[1-4]。硫化钠在碱性溶液中主要以HS-和S2-形式存在,两者比例取决于溶液pH值,pH值越高,S2-含量越高。当c(NaOH)>8 mol/L,即ρ(Na2Ok)>248 g/L时,溶液中Na2S主要以S2-形式存在[5]。铝酸钠溶液为高pH值的强碱性溶液,溶液中的Na2S主要以S2-形式存在。应用于高温溶出设备(240~260 ℃)、后加矿溶出设备(160~220 ℃)、沉降槽(约90 ℃)、晶种分解槽(约75 ℃)以及分解母液的蒸发浓缩设备(约100 ℃)等的低合金钢材料频繁暴露于含S2-浓度较高的铝酸钠溶液中,造成严重的腐蚀。碱性溶液中S2-对钢制设备的腐蚀研究起源于20世纪初,在造纸工业硫酸盐法制浆过程的腐蚀研究报道较多[6]。HAZLEWOOD[7]、CROWE等[8]通过失重法研究了硫化钠和氢氧化钠对低碳钢腐蚀速率的影响,发现溶液的腐蚀性取决于硫化钠和碱浓度。HALEEM等[9]、TROMANS等[10]、BHATTACHARYA等[11]和BETOVA等[12]采用极化曲线法研究了硫化钠对不锈钢和低碳钢的腐蚀,认为硫化钠是腐蚀活化剂,破坏钢的钝化行为,使钝化延迟。CROWE[13]将极化曲线和循环伏安法相结合研究了碳钢在硫化钠溶液中的高温电化学行为,发现提高温度和硫化钠浓度,会加剧钢的溶解和膜的形成。SINGH等[14]的进一步研究表明提高温度、碱浓度或硫化钠浓度使双相不锈钢的自腐蚀电位下降,加速钢的腐蚀溶解。HAZLEWOOD[7]在另一研究中发现在170 ℃下,当碱浓度不变时,碳钢的平均腐蚀速率随着硫化钠浓度的升高而增大,然而在硫化钠浓度固定不变的情况下,碱浓度提高使平均腐蚀速率减小。
普遍认为硫化钠的腐蚀机理是S2-在金属表面与Fe反应形成不具保护性的FeS膜,使已形成的Fe3O4存在缺陷,对金属表面不具有保护性。而当腐蚀产物中S2-被氧化成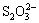 、铁的硫化物被氧化成具有较稳定结构的氧化物时,表面开始发生钝化。但最近几年对拜耳法溶出过程S2-的行为研究发现,在较高温度下,铝酸钠溶液中S2-与Fe作用生成溶解度较大的羟基硫代铁酸钠(Na2[FeS2(OH)2]·2H2O)[15],该物质的生成也会加速钢的腐蚀溶解。硫化钠腐蚀的严重后果是材料表面发生均匀腐蚀变薄或成块脱落,使材料的使用寿命大大低于设计寿命,造成巨大的经济损失。
、铁的硫化物被氧化成具有较稳定结构的氧化物时,表面开始发生钝化。但最近几年对拜耳法溶出过程S2-的行为研究发现,在较高温度下,铝酸钠溶液中S2-与Fe作用生成溶解度较大的羟基硫代铁酸钠(Na2[FeS2(OH)2]·2H2O)[15],该物质的生成也会加速钢的腐蚀溶解。硫化钠腐蚀的严重后果是材料表面发生均匀腐蚀变薄或成块脱落,使材料的使用寿命大大低于设计寿命,造成巨大的经济损失。
铝酸钠溶液中硫化物对设备腐蚀的研究最早在苏联进行。由于苏联在20世纪七八十年代大量使用高硫铝土矿,因而最早发现硫对钢制设备的腐蚀并进行研究。在苏联拉乌尔铝厂所用的铝土矿中含硫化铁达2.2%,拜耳溶出后溶液含320 g/L Na2OT(全碱)、298 g/L Na2Ok(苛性碱)、145 g/L Al2O3、0.9 g/L S2-、1.90 g/L 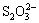 ;0.56 g/L
;0.56 g/L 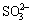 和1.85 g/L
和1.85 g/L 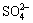 ,因而严重腐蚀蒸发设备。最初采用CT20碳钢管(直径57 mm,厚度3.5 mm),使用寿命只有4~6 h,后改用含镍和高合金镍钢管,效果也差。研究发现采用15×25T高铬钢管(直径57 mm,厚度3.5 mm)对含硫的碱性铝酸钠溶液有耐蚀作用。报道指出,1984年乌拉尔铝厂4台蒸发设备使用15×25T高铬钢管,可节省经费90万卢布,折合人民币约19万元[16]。到20世纪90年代前苏联解体后,尚未见到有关这方面的详细报道,但苏联的研究为以后处理高硫铝土矿设备材料的选择具有重要指导意义。
,因而严重腐蚀蒸发设备。最初采用CT20碳钢管(直径57 mm,厚度3.5 mm),使用寿命只有4~6 h,后改用含镍和高合金镍钢管,效果也差。研究发现采用15×25T高铬钢管(直径57 mm,厚度3.5 mm)对含硫的碱性铝酸钠溶液有耐蚀作用。报道指出,1984年乌拉尔铝厂4台蒸发设备使用15×25T高铬钢管,可节省经费90万卢布,折合人民币约19万元[16]。到20世纪90年代前苏联解体后,尚未见到有关这方面的详细报道,但苏联的研究为以后处理高硫铝土矿设备材料的选择具有重要指导意义。
我国近几年才开始大量使用高硫铝土矿,因而关于铝酸钠溶液中硫对设备腐蚀的研究尚未见报道。目前氧化铝厂处理高硫铝土矿仍采用原有设备,其材料多为含碳钢,低合金钢和不锈钢类[17],经常发生管道或设备泄漏事故,严重影响正常生产,所造成的经济损失不可忽视。因此,有必要研究铝酸钠溶液中硫化钠对钢制设备腐蚀的影响,探索导致设备腐蚀的主要原因,以便及时采取科学、经济、可靠的防护措施。
本文作者通过高温浸泡腐蚀实验、结合XRD和SEM等分析手段,研究低合金钢(以Fe表示)在含硫铝酸钠溶液(特指含S2-的铝酸钠溶液,下同)中的腐蚀行为。通过阳极极化曲线法进一步探讨S2-对Fe腐蚀行为的影响及腐蚀机理。
1 实验
1.1 实验材料与溶液
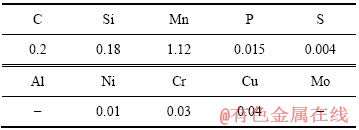
实验材料为16Mn低合金钢(Q345B),化学成分见表1。
表1 16Mn低合金钢的化学成分
Table 1 Chemical composition of 16Mn low alloy steel (mass fraction, %)
实验用拜耳液通过NaOH(工业)、Al(OH)3(分析 纯)和去离子水在10 L高压釜,160 ℃的条件下溶解获得。拜耳液中的Na2Ok包括与氧化铝反应生成铝酸钠的NaOH和以NaOH形态存在的游离的Na2O。Al2O3代表溶解的Al(OH)3浓度。含硫铝酸钠溶液中S2-是在每次实验之前加入分析纯Na2S·9H2O获得。
1.2 高温腐蚀实验方法
高温腐蚀实验(160~260 ℃)在钢弹群釜溶出装置中进行。钢弹有效容积为120 mL,材质为316L不锈钢。实验溶液为含硫铝酸钠溶液,体积为100 mL,搅拌速率为40 r/min,实验时间为8 h。腐蚀试片尺寸为25 mm×16 mm×2 mm,总表面积为9.64 cm2。实验前试片用400、600和1000号金相砂纸逐级打磨光亮,酒精脱脂,去离子水冲洗,冷风干燥,记录试片的质量和表面积,实验后将表面腐蚀产物清洗干净,室温烘干后称取质量。每个实验需重复两次以上,使腐蚀速率相差在10%以内。腐蚀速率计算如式(1)所示:
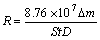 (1)
(1)
式中:R为腐蚀速率,mm/a;△m为试样的质量损失,g;S为试样总面积,cm2;t为实验时间,h;D为材料的密度,kg/m3。
1.3 电化学实验方法
采用CHI600B电化学分析仪(上海辰华仪器公司生产)进行低温电化学实验(25~90 ℃)。采用传统三电极体系,在带螺纹盖的聚四氟乙烯槽内进行,如图1所示。聚四氟乙烯槽置于恒温水浴锅中,控温精度为±1 ℃。以低合金钢为研究电极,并制成柱状,工作面积为0.3 cm2,非工作部分用环氧树脂密封。辅助电极采用大面积块状石墨,而饱和甘汞电极(SCE)为参比电极,置于聚四氟乙烯槽外部25 ℃条件下。在本研究中,电极电位均为相对于饱和甘汞电极电位。鲁金毛细管与工作电极距离为1 mm,通过饱和KCl盐桥与参比电极相连接。由盐桥内浓度效应及热梯度产生的微小电位差异在本实验中没有进行校正。测定阳极极化曲线的扫描速度为1 mV/s。所有工作电极进行阳极极化之前均通氮气1 h,待体系稳定后,测开路电位后阳极极化扫描从低于所测开路电位300 mV处开始。
2 结果与讨论
2.1 高温腐蚀速率及影响因素
2.1.1 溶液成分的影响
图2所示为铝酸钠溶液中S2-浓度对Fe试样平均腐蚀速率的影响。从图2中可以看出,当S2-浓度低于2 g/L时,Fe试样的平均腐蚀速率低于在纯铝酸钠溶液中的数值,且表面腐蚀程度较轻,可看到未腐蚀的表面,表明S2-在低浓度下可抑制Fe的腐蚀。随着S2-浓度的升高,平均腐蚀速率逐渐变大,当S2-浓度高于3 g/L时,平均腐蚀速率急剧增大,超过100 mm/a,表面腐蚀产物呈疏松的砂状,为亮黑色。同时在溶液中发现黑色块状,为试片腐蚀脱落产物。
S2-在低浓度下的抑制作用是由于与OH-发生竞争吸附,当S2-浓度较低时,Fe表面主要被OH-占据,容易形成结构致密的钝化膜,阻止腐蚀的发生[18]。
图3所示为不同Na2Ok浓度对Fe试样在含硫铝酸钠中平均腐蚀速率的影响。从图3中可以看出,随着Na2Ok浓度的升高,平均腐蚀速率变大,当Na2Ok浓度为260 g/L时,腐蚀速率高达200 mm/a。根据φ—pH图可知,高pH值有利于Fe的活性溶解,产生大量的可溶性铁离子。因此,Na2Ok浓度越高,腐蚀程度越严重[19]。
图4所示为不同Al2O3浓度对Fe试样在含硫铝酸钠中平均腐蚀速率的影响。从图4可以看出,随Al2O3浓度的升高,平均腐蚀速率变小,当Al2O3浓度升高至170 g/L时,腐蚀速率降低至5.30 mm/a,对Fe的腐蚀产生抑制作用,与S2-和Na2Ok的促进作用不同。Al2O3的作用主要是与Na2Ok反应生成NaAlO2,随着Al2O3浓度的升高,Na2Ok 的消耗量增大,以游离形式存在的Na2Ok量减少,腐蚀程度减轻。Al2O3对硫化钠腐蚀的抑制作用对拜耳法处理高硫铝土矿具有重要的指导意义。
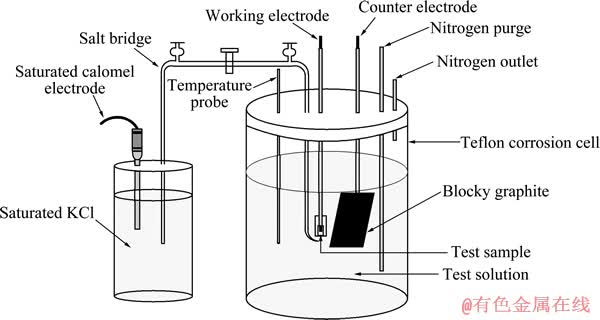
图1 电化学极化实验的工作电极、参比电极和辅助电极示意图
Fig. 1 Schematic diagram of electrochemical polarization cell with working, reference and counter electrodes
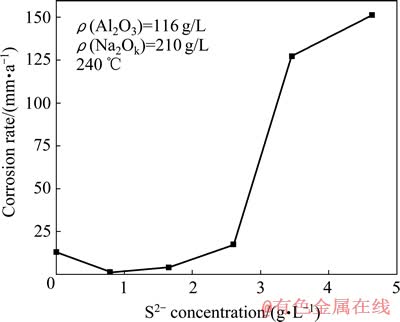
图2 S2-浓度对Fe试样腐蚀速率的影响
Fig. 2 Effect of S2- concentration on corrosion rate of Fe sample
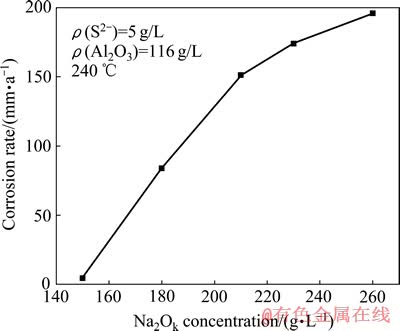
图3 Na2Ok浓度对Fe试样腐蚀速率的影响
Fig. 3 Effect of Na2Ok concentration on corrosion rate of Fe sample
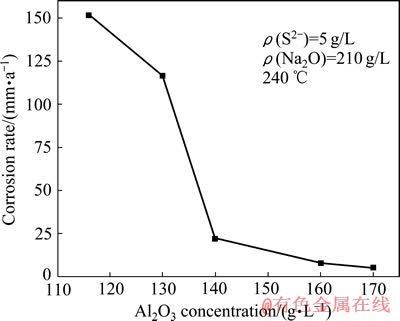
图4 Al2O3浓度对Fe试样腐蚀速率的影响
Fig. 4 Effect of Al2O3 concentration on corrosion rate of Fe sample
2.1.2 温度的影响
温度对Fe试样平均腐蚀速率的影响如图5所示。由图5可见,Fe试样的平均腐蚀速率随温度的升高先增大后减小。通过阿累尼乌斯方程可解释平均腐蚀速率升高的原因,见式(2)[6]。由式(2)可知,腐蚀速率的自然对数与温度成正比,即温度越高,腐蚀速率越大。
 (2)
(2)
式中:Rc为腐蚀速率,mm/a;A为阿累尼乌斯常数的自然对数;Ea为活化能,J/mol;R为摩尔气体常数,8.314 J/(mol·K)。
根据图5中数据绘制腐蚀速率的自然对数对温度倒数的曲线,式(2)变为
 ,
,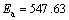 J/mol。
J/mol。
可见,温度越高,腐蚀速率越大。然而,当温度高于240 ℃时,平均腐蚀速率反而降低。其原因是在较高温度下,大部分S2-被氧化成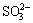 ,而非低温条件下氧化成
,而非低温条件下氧化成 [20],使溶液中S2-浓度大幅降低。腐蚀前后溶液成分变化见表2。发生如下反应,见式(3):
[20],使溶液中S2-浓度大幅降低。腐蚀前后溶液成分变化见表2。发生如下反应,见式(3):
S2-+6OH-
 +3H2O+6e (3)
+3H2O+6e (3)
式(3)为失电子反应,根据阴极和阳极反应的得失电子平衡可知,在阴极析氢得电子反应一定的条件下,S2-氧化成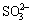 释放电子的反应,将抑制Fe释放电子的阳极反应,使Fe的腐蚀变慢。
释放电子的反应,将抑制Fe释放电子的阳极反应,使Fe的腐蚀变慢。
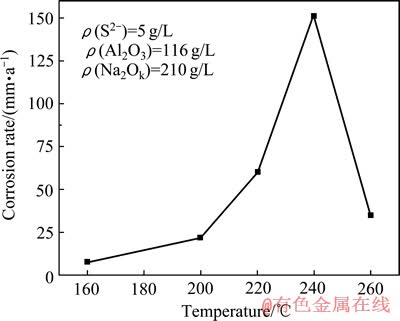
图5 不同温度下Fe试样的腐蚀速率
Fig. 5 Corrosion rate of Fe sample at different temperatures
表2 腐蚀前后溶液中低价含硫阴离子成分
Table 2 Low value anion ion concentrations of solution before and after corrosion

2.1.3 搅拌的影响
高温腐蚀实验的钢弹群釜溶出装置只有一种搅拌速度,40 r/min。由于实验条件的限制,本文作者仅通过静态(不搅拌)和动态(搅拌)两种实验条件来研究流体流动状态对Fe试样平均腐蚀速率的影响,结果如表3所列。从表3中可以看出,Fe试样在两种溶液处于静止状态下的平均腐蚀速率均很小,而在搅拌情况下,平均腐蚀速率都显著增大,其中在含硫铝酸钠溶液中的平均腐蚀速率为静止状态下的5倍以上,表明搅拌能显著加速Fe试样的腐蚀溶解。这可能是因为一方面搅拌促进溶液传质,加速腐蚀反应,另一方面在搅拌过程中钢片表面腐蚀产物容易脱落,使腐蚀钝化层出现缺陷,进而在此处继续发生腐蚀。
表3 两种溶液中搅拌状态对Fe试样腐蚀速率的影响
Table 3 Effect of stirring on corrosion rate of Fe sample in two kinds of solution

2.2 高温腐蚀产物分析
图6(a)所示为Fe试样在240 ℃铝酸钠溶液中浸泡8 h后的表面腐蚀形貌。由图6(a)可知,腐蚀前由金相砂纸处理的残留刮痕尚存在,表明Fe试样在纯铝酸钠溶液中的腐蚀程度较轻。
图6(b)所示为Fe试样在240 ℃含硫铝酸钠溶液中浸泡8 h后的表面腐蚀形貌。由图6(b)可见,表面腐蚀产物不均匀,试样右表面的腐蚀产物已经脱落,露出粗糙的表面,中间区域有一块结构疏松的腐蚀产物。与图6(a)相比,图6(b)中S2-的存在严重地破坏了表面钝化膜的完整性,导致钝化膜的保护性变差,从而降低Fe试样的抗腐蚀性能。图6(b)进一步证明了搅拌使表面腐蚀产物易于脱落,加速Fe的腐蚀。
为了深入研究S2-对腐蚀产物膜的影响,对图6(b)对应腐蚀产物进行物相分析,分析结果如图7所示。由图7可以看出,Fe试样在240 ℃含硫铝酸钠溶液中形成的腐蚀产物主要由Fe3O4组成,因为在高温、强碱性溶液中能稳定存在的物相主要为Fe3O4。此外,在高温条件下S2-会与铁氧化物反应形成溶解度较大的羟基硫代铁酸钠,使在Fe表面所形成Fe3O4结构不稳定,易于从表面脱落。

图6 腐蚀产物表面形貌的SEM像
Fig. 6 SEM images of corrosion product film
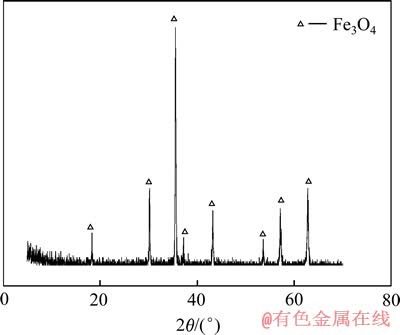
图7 硫化钠腐蚀产物的XRD谱
Fig. 7 XRD pattern of sulfide corrosion product
2.3 低温阳极极化
低温条件下,含硫铝酸钠溶液对Fe试样的腐蚀程度较轻,在有限的时间内难以通过质量损失法求出试样的平均腐蚀速率。因此,本文作者选160~260 ℃为高温质量损失实验温度,反映在拜耳法生产氧化铝过程中的高温苛刻条件下S2-对Fe试样的腐蚀情况。根据阿累尼乌斯方程可知,温度升高在动力学上可加速Fe试样的腐蚀,而电化学方法主要研究腐蚀机理,即在热力学上可能发生的反应,在不同温度下具有类似的腐蚀机理。此外,在实验条件下难以进行高于100 ℃ 以上的电化学实验。因此,选25~90 ℃为电化学实验温度,其中75 ℃代表拜耳液的晶种分解温度,90 ℃代表稀释矿浆的沉降温度。
2.3.1 S2-对极化行为的影响
图8所示为S2-浓度对Fe电极在含硫铝酸钠溶液中的阳极极化行为的影响。由图8可以看出,随着S2-浓度的升高,阳极电流密度增大。在铝酸钠溶液中的自腐蚀电流密度为0.46 mA/cm2,当S2-浓度从1 g/L提高到5 g/L时,自腐蚀电流密度从0.21 mA/cm2增加至0.63 mA/cm2,表明腐蚀速率随着S2-浓度的升高而增大。Fe在S2-浓度为1 g/L溶液中的腐蚀电流密度低于在铝酸钠溶液中的腐蚀电流密度,腐蚀后电极表面为一薄层暗黑色膜,而在S2-浓度高于1 g/L溶液中极化后表面呈棕黄色,进一步表明低浓度的S2-对腐蚀产生抑制作用。
在强碱性铝酸钠溶液中,硫化钠的腐蚀作用是由于Na2S水解成S2-,S2-强烈吸附在电极表面[12],且随着S2-浓度的增加,吸附作用更强烈。在表面腐蚀产物的晶格结构内形成FeS或不具有保护性膜的Fe3O4-xSx[13],改变具有较稳定结构的Fe3O4的电导性,使表面结构变得不稳定,阻止金属的进一步钝化,加速Fe的腐蚀溶解。在电化学研究方法的高电位下,S2-会被氧化成高价态的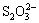 ,减少晶格中S2-含量,使Fe3O4结构变得更稳定,电极表面发生钝化[6]。当S2-浓度较低时,在金属表面的吸附受到OH-抑制,形成结构致密而稳定的Fe3O4,使电极表面发生钝化,与高温腐蚀实验结果一致。
,减少晶格中S2-含量,使Fe3O4结构变得更稳定,电极表面发生钝化[6]。当S2-浓度较低时,在金属表面的吸附受到OH-抑制,形成结构致密而稳定的Fe3O4,使电极表面发生钝化,与高温腐蚀实验结果一致。
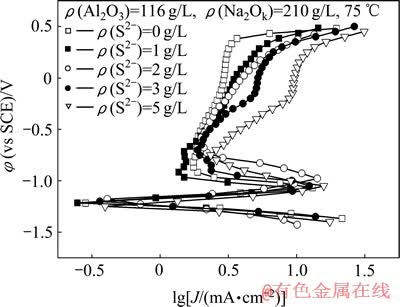
图8 S2-浓度对Fe电极极化行为的影响
Fig. 8 Effect of S2- concentration on anodic polarization behavior of Fe electrode
2.3.2 温度对极化行为的影响
图9所示为温度对Fe电极在含硫铝酸钠溶液中的阳极极化行为的影响。由图9可以看出,温度越高,阳极电流密度越高,自腐蚀电流密度从25 ℃的0.16 mA/cm2提高到90 ℃的0.66 mA/cm2,表明腐蚀程度变得严重。这是因为提高温度改善了可溶性反应物在电极表面的扩散,使Fe的腐蚀加快。在25 ℃低温条件下,阳极电流密度很低,存在一个较宽的钝化区间,与在纯铝酸钠溶液中的极化曲线类似,表明表面腐蚀程度较轻。
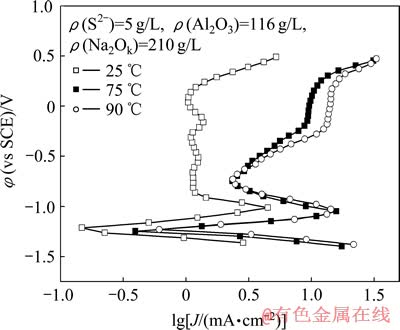
图9 温度对Fe电极极化行为的影响
Fig. 9 Effect of temperature on anodic polarization behavior of Fe electrode

图10 Fe在铝酸钠和含硫铝酸钠溶液中的阳极极化行为
Fig. 10 Anodic polarization behavior of Fe in sodium aluminate solution and sulfide-containing aluminate solution
2.3.3 腐蚀机理分析
图10所示为Fe电极在75 ℃纯铝酸钠与含硫铝酸钠两种溶液中的极化曲线。从图10中可以看出,在两种情况下,Fe的自腐蚀电位(φcorr)接近-1.22 V,处于活化状态并经历一个活化-钝化过渡区;当电位高于0.35 V时,电流密度急剧变大,发生析氧反应,见式(4);在低于自腐蚀电位时,极化曲线接近线性,为析氢反应,见式(5)。然而,溶液中含有S2-使腐蚀电流密度增加,破坏电极表面的稳定性,使钝化延迟。
O2+2H2O+4e 4OH-
4OH-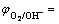 1.367-0.069pH (4)
1.367-0.069pH (4)
2H2O+2e→2OH-+H2↑ (5)
在铝酸钠溶液中Fe的自腐蚀电位为-1.22 V,根据Fe-H2O系φ—pH图[19],在pH值为15.21时铝酸钠溶液中Fe的自腐蚀电位在 平衡电位区间内。高于自腐蚀电位时,Fe的阳极电流密度急剧增大,并经历一个活化-钝化过渡区间,随后进入钝化区间。
平衡电位区间内。高于自腐蚀电位时,Fe的阳极电流密度急剧增大,并经历一个活化-钝化过渡区间,随后进入钝化区间。
当高于自腐蚀电位之上电流密度的增大为Fe的活性溶解形成可溶性铁离子(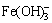 ),见式(6)。
),见式(6)。

 Fe+3H2O
Fe+3H2O
 0.553-0.103 5pH+0.034 5
0.553-0.103 5pH+0.034 5 (6)
(6)
在活化-钝化过渡区为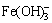 氧化,形成Fe3O4,见式(7),同时在电极表面形成一层黑色薄膜。Fe3O4的形成使Fe表面发生钝化[21]。
氧化,形成Fe3O4,见式(7),同时在电极表面形成一层黑色薄膜。Fe3O4的形成使Fe表面发生钝化[21]。
Fe3O4+5H2O+2e  3
3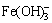 +H+
+H+
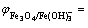 -1.982+0.034 5pH-0.103 5
-1.982+0.034 5pH-0.103 5 (7)
(7)
随着电位的升高,电极表面由黑色逐渐变为黑色偏棕黄色,表明部分Fe3O4氧化成结构更稳定的棕黄色的FeOOH,见式(8)。FeOOH的形成使电极表面进一步发生钝化。与BHATTACHARYA等[11]、CROWE[13]和SINGH等[14]所得出在高电位下Fe3O4氧化成Fe2O3的实验结果不一致。Fe3O4之所以被氧化成棕黄色的FeOOH而非Fe2O3,是因为强碱性铝酸钠溶液的pH值较高,约为15.21,根据Fe-H2O系φ—pH图及高温腐蚀产物成分可知,高pH值条件下,稳定存在物相为FeOOH而非Fe2O3。
3FeOOH+H++e Fe3O4+2H2O
Fe3O4+2H2O
 0.297-0.069pH (8)
0.297-0.069pH (8)
式(6)~(7)中 浓度根据流过电极电量Q来估算,取从自腐蚀电位到电流密度最强峰电位的时间内在电极上流过总电量,由
浓度根据流过电极电量Q来估算,取从自腐蚀电位到电流密度最强峰电位的时间内在电极上流过总电量,由 =Q/(FnV)求出其浓度。铝酸钠溶液pH值由pH计直接测得,为15.21。因此估算得
=Q/(FnV)求出其浓度。铝酸钠溶液pH值由pH计直接测得,为15.21。因此估算得 -1.441 V,
-1.441 V, -1.090 V,
-1.090 V, -0.994 V,
-0.994 V,  0.08 V。
0.08 V。
由于测阳极极化曲线时,未对由浓度效应和盐桥内热梯度引起小的电位差异进行校正,因而以上各反应式的平衡电位与图中曲线对应电位存在差异。
当铝酸钠溶液中含有S2-时,Fe的自腐蚀电位为-1.25 V。根据Fe-S-H2O系的φ—pH图[13]可知,Fe的自腐蚀电位在S2-/FeS平衡电位区间。在自腐蚀电位区间能稳定存在的离子为S2-和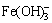 。高于自腐蚀电位上Fe的阳极电流密度先增大随后减小,对应于Fe的开始氧化,形成可溶性
。高于自腐蚀电位上Fe的阳极电流密度先增大随后减小,对应于Fe的开始氧化,形成可溶性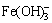 (式(6)),随后由于浓度梯度的影响,金属表面局部
(式(6)),随后由于浓度梯度的影响,金属表面局部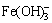 浓度升高,当高于1.0×10-5.34 mol/L时[13],
浓度升高,当高于1.0×10-5.34 mol/L时[13],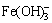 与S2-反应形成FeS,见式(9)。
与S2-反应形成FeS,见式(9)。
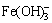 + S2-+3H+
+ S2-+3H+ FeS↓+3H2O (9)
FeS↓+3H2O (9)
由于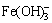 的扩散速度很慢,FeS在电极表面形成,此时在电极表面可看到一层结构疏松的黑色产物。FeS结构疏松,粘附力弱,使生成的Fe3O4结构不稳定,易重新溶解于溶液中,对钢片不具有保护作用,使钝化发生延迟。但随着电位的升高,FeS被氧化成结构较致密的FeOOH后(式(10)),使钝化膜结构变稳定,从而抑制Fe的腐蚀溶解,FeS完全转化成FeOOH后电极表面由黑色变为棕黄色。
的扩散速度很慢,FeS在电极表面形成,此时在电极表面可看到一层结构疏松的黑色产物。FeS结构疏松,粘附力弱,使生成的Fe3O4结构不稳定,易重新溶解于溶液中,对钢片不具有保护作用,使钝化发生延迟。但随着电位的升高,FeS被氧化成结构较致密的FeOOH后(式(10)),使钝化膜结构变稳定,从而抑制Fe的腐蚀溶解,FeS完全转化成FeOOH后电极表面由黑色变为棕黄色。
2FeOOH+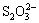 +12H++10e
+12H++10e  2FeS+7 H2O
2FeS+7 H2O
 0.408-0.082 8pH+0.006 9
0.408-0.082 8pH+0.006 9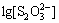 (10)
(10)
在电位升高的过程中,FeS可能与S2-进一步反应形成可溶性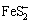 :
:
FeS+ S2-→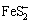 + H2O+e (11)
+ H2O+e (11)
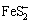 不稳定,在低温下会以NaFeS2形式析出,实验后未取下工作电极,放置一段时间后在溶液底部发现胶状沉淀可能为NaFeS2。随着电位继续升高,S2-被氧化成较高价态的
不稳定,在低温下会以NaFeS2形式析出,实验后未取下工作电极,放置一段时间后在溶液底部发现胶状沉淀可能为NaFeS2。随着电位继续升高,S2-被氧化成较高价态的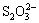 ,并释放出电子,使电流密度变大,见式(12)[6, 10],
,并释放出电子,使电流密度变大,见式(12)[6, 10],
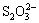 +6H++8e→2S2-+3H2O
+6H++8e→2S2-+3H2O
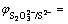 0.224+0.051 8pH+0.008 6
0.224+0.051 8pH+0.008 6 (12)
(12)
在电位升高过程中,S2-可能被氧化成其他高价含硫阴离子,其中氧化成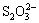 的速度最快[22]。产物层中S2-全部被氧化成
的速度最快[22]。产物层中S2-全部被氧化成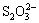 后,无铁的硫化物,膜结构变得更稳定,促使电极表面发生钝化。实验结束后电极表面的棕黄色产物可被擦掉,露出薄层的暗色表面,为结构致密的Fe3O4。
后,无铁的硫化物,膜结构变得更稳定,促使电极表面发生钝化。实验结束后电极表面的棕黄色产物可被擦掉,露出薄层的暗色表面,为结构致密的Fe3O4。
3 结论
1) S2-浓度、苛性碱浓度、溶液温度和搅拌均对低合金钢的腐蚀具有促进作用,而氧化铝浓度的升高显著抑制S2-对低合金钢的腐蚀。
2) 低合金钢在高温含硫铝酸钠溶液中表面主要生成Fe3O4,其结构疏松,对基体不具有保护作用。
3) 低合金钢在铝酸钠溶液中具有较宽的钝化区,表面能形成稳定的钝化膜,而在含硫铝酸钠溶液中,S2-通过在金属表面形成结构疏松的铁硫化物,阻止稳定钝化膜的形成,钝化延迟,并随着S2-浓度及温度的升高,这种作用更明显。因此,在含硫铝酸钠溶液中的腐蚀机理类似于活性溶解,导致材料的大量损耗。
REFERENCES
[1] HU Xiao-lian, CHEN Wen-mi, XIE Qiao-ling. Sulfur phase and sulfur removal in high sulfur-containing bauxite[J]. Transaction of Nonferrous Metals Society of China, 2011, 21(7): 1641-1647.
[2] 胡小莲, 陈文汨.采用湿式氧化法脱除铝酸钠溶液中硫的研究[J].中南大学学报: 自然科学版,2011, 42(10):2911-2916.
HU Xiao lian,CHEN Wen mi.Desulfurization from sodium aluminate solution by wet oxidation[J].Journalof CentralSouth University:Scienceand Technology,2011, 42(10):2911-2916.
[3] 宋 超, 彭志宏, 魏欣欣, 齐天贵. 黄铁矿在拜耳法溶出过程中的反应行为研究[J]. 有色金属科学与工程, 2011, 1(5): 2-5.
SONGChao,PENG Zhi hong,WEI Xin xin,QI Tian gui.The reaction behaviorofpyrite in process of Bayer digestion [J].Nonferrous Metals ScienceandEngineering, 2011, 1(5): 1-5.
[4] 李小斌, 李重洋, 齐天贵, 周秋生, 刘桂华, 彭志宏. 拜耳法高温溶出条件下黄铁矿的反应行为[J]. 中国有色金属学报, 2013, 23(3): 829-835.
LIXiao bin, LI Chong yang, QITian gui, ZHOU Qiu sheng, LIU Gui hua, PENG Zhi hong. Reaction behavior ofpyrite during Bayer digestion at high temperature[J]. TheChinese Journal of Nonferrous Metals, 2013, 23(3): 829-835.
[5] COTTON F A, WILKINSON G. 基础无机化学[M]. 北京: 科学出版社,1984: 241-242.
COTTON F A, WILKINSON G. Basic inorganic chemistry[M]. Beijing: Science Press, 1984: 241-242.
[6] HAZLEWOOD P E. Factors affecting the corrosivity of pulping liquors[D]. Atlanta: Georgia Institute of Technology, 2006: 63-97.
[7] HAZLEWOOD P E, SINGH P M, HSIEH J S. Corrosion behavior of carbon steels in sulfide-containing caustic solutions[J]. Ind Eng Chem Res, 2006, 45(23): 7789-7794.
[8] CROWE D C, YESKE R A. Kraft white liquor compositionand long termcorrosionbehavior[C]// Corrosion 88. Houston: NACE, 1988: 435-447.
[9] ABD HALEEM S M, ABD EL AAL E E. Electrochemical behaviour of iron in alkaline sulphide solutions[J]. Corrosion Engineering, Science and Technology, 2008, 43(2): 173-178.
[10] TROMANS D,ELECTROCHEM J. Anodic polarization behavior of mild steel in hot alkaline sulfide solutions[J]. Journal of the Electrochemical Society,1980,127(6): 1253-1256.
[11] BHATTACHARYA A, SINGH P M. Electrochemical behaviour of duplex stainless steels in caustic environment[J]. Corrosion Science, 2011, 53(1): 71-81.
[12] BETOVA I, BOJINOV M. Effect of sulphide on the corrosion behaviour of AISI 316L stainless steel and its constituent elements in simulated Kraft digester conditions[J]. Corrosion Science, 2010, 52(4): 1499-1507.
[13] CROWE D C. The high temperature electrochemical behavior of carbon steel in alkaline sulfide solutions[D]. Vancouver: The University of British Columbia, 1985: 119-172.
[14] SINGH P M, IGE O, MAHMOOD J. Stress corrosion cracking of type 304L stainless steel in sodium sulfide-containing caustic solutions[J]. Corrosion, 2003, 59(10): 843-850.
[15] 李桂兰, 林 齐, 方建川. 高硫高有机物型黑灰铝土矿溶出特性研究[J]. 轻金属, 2010(8): 9-11.
LI Gui-lan, LIN Qi, FANG Jian-chuan. The study of the digesting characteristic of black-grey bauxite with high sulphur and TOC[J]. Light Metal, 2010(8): 9-11.
[16] САМОИЛЕНКО В М. Alumina plant evaporator using anti-corrosion steel tubes[J]. Nonferrous Metals, 1989, 2(1): 27-29.
[17] 冯文洁, 陈巧英, 候丙毅. 氧化铝生产流程中氯离子的行为[J]. 甘肃冶金, 2004, 26(3): 20-25.
FENG Wen-jie, CHEN Qiao-ying, HOU Bing-yi. On chlorine ion behaviors in alumina production process[J]. Gansu Metallurgy, 2004, 26(3): 20-25.
[18] ABD HALEEM S M, ABD EL AAL E E. Effect of sulphide ions on corrosion behavior of iron in alkaline solutions[J]. Corrosion Engineering, Science and Technology, 2008, 43(3): 225-230.
[19] ASHWORTH V, BODEN P J. Potential—pH diagrams at elevated temperatures[J]. Corrosion Science, 1970, 10(10): 709-718.
[20]  Interactions of sulphur anions and stainless steels at kraft pulp digesting temperature[J]. Materials and Corrosion, 2001, 52: 531-539.
Interactions of sulphur anions and stainless steels at kraft pulp digesting temperature[J]. Materials and Corrosion, 2001, 52: 531-539.
[21] WENSLEY D A, CHARLTON R S. Corrosionstudies in kraft white liquor[J]. Corrosion, 1980, 36(8): 385-389.
[22] MUELLER W A. Reduction and oxidation reactions in kraft liquor recovery: Sources, effects and preventions[J]. Pulp and Paper Magazine of Canada, 1973, 74(4): 69-76.
(编辑 陈卫萍)
基金项目:广东省教育部产学研重大项目(2009B090200053)
收稿日期:2013-01-20;修订日期:2013-07-30
通信作者:陈文汩,教授,博士;电话:0731-88876531;E-mail: chenwenmi@sina.com