DOI: 10.11817/j.ysxb.1004.0609.2021-39626
含磷废水中稀土除磷及沉淀剂再生
车键勇,张文娟,马保中,王成彦
(北京科技大学 冶金与生态工程学院,北京 100083)
摘 要:基于已有热力学数据,对稀土除磷过程及沉淀产物的再生过程分别进行了热力学计算,绘制了25 ℃下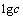 -pH图,为含磷废水中磷的资源化利用和无害化处置提供理论支撑。结果表明:采用稀土处理含磷废水时在pH 2.70~8.66范围内沉淀,可生成稳定的LaPO4(和CePO4)沉淀,实现磷的去除;再生过程pH在14.5~16.0范围内,LaPO4(和CePO4)可转变为La(OH)3(和Ce(OH)3)实现沉淀剂的再生与磷的回收。采用La(OH)3和Ce(OH)3处理30 mg/L的含磷溶液,磷沉淀率分别为99.72%和96.33%;采用4 mol/L的NaOH溶液分解沉淀产物,反应3 h后La(OH)3和Ce(OH)3的再生率分别为30.38%和63.38%。
-pH图,为含磷废水中磷的资源化利用和无害化处置提供理论支撑。结果表明:采用稀土处理含磷废水时在pH 2.70~8.66范围内沉淀,可生成稳定的LaPO4(和CePO4)沉淀,实现磷的去除;再生过程pH在14.5~16.0范围内,LaPO4(和CePO4)可转变为La(OH)3(和Ce(OH)3)实现沉淀剂的再生与磷的回收。采用La(OH)3和Ce(OH)3处理30 mg/L的含磷溶液,磷沉淀率分别为99.72%和96.33%;采用4 mol/L的NaOH溶液分解沉淀产物,反应3 h后La(OH)3和Ce(OH)3的再生率分别为30.38%和63.38%。
关键词:稀土;除磷;热力学;废水处理
文章编号:1004-0609(2021)-01-0114-11 中图分类号:X703 文献标志码:A
引文格式:车键勇, 张文娟, 马保中, 等. 含磷废水中稀土除磷及沉淀剂再生[J]. 中国有色金属学报, 2021, 31(1): 114-124. DOI: 10.11817/j.ysxb.1004.0609.2020-39626
CHE Jian-yong, ZHANG Wen-juan, MA Bao-zhong, et al. Removal of phosphate and precipitant regeneration from phosphorus-containing wastewater by rare earth[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(1): 114-124. DOI: 10.11817/j.ysxb.1004.0609.2020-39626
磷是一种动植物生长的必要元素,对区域生态平衡起重要的作用。磷的过量排放会导致水体富营养化,进而破坏该区域生态环境[1]。冶金工业作为能源资源消耗和污染物排放的重点行业,从选矿到冶炼均会产生大量的含磷溶液,如高磷赤铁矿选矿产生的酸性废水,铅锌冶炼产生的含磷、砷、氟废水,钨钼冶炼产生的含磷浸出液等。诸如此类含磷废液,若未经处理直接排放,将会导致严重的水体污染。
此外,磷矿是一种不可再生的战略矿产资源,研究报道[2-3],全球磷资源将在50~100年面临枯竭消耗殆尽。因此,对含磷废水进行资源化和无害化处理,具有重大的现实意义和环境效益。
目前,国内外常用的除磷技术有化学沉淀法、吸附法、离子交换法、电化学法、生物除磷法等[4-9]。化学沉淀法污泥产量大,且沉淀剂不能重复使用[10];吸附法需定期更换吸附剂,处理费用较高[11-13];生物除磷法对处理环境条件要求高,处理效果受水质变化的影响较大,不适于处理重金属离子较多的含磷废水[14-16]。结晶法是一种被广泛研究的方法,具有较高的回收率和可观的经济效益。化学结晶法是一种资源化处理磷的方式,在处理过程中,将溶液中磷以难溶性晶体的形式析出,实现磷的回收利用。目前,结晶主要有Ca-P和MgNH4PO4·6H2O-MAP两种方式,除磷效果好,工艺成熟。
轻稀土元素由于价格较低,且其原生矿物多为稀土元素与磷酸结合的稀土磷酸盐,与磷酸根有着较强的结合能力。在轻稀土矿物中,独居石是一种主要由LaPO4和CePO4构成,具有较强的热稳定性及化学稳定性的矿物[17-18]。在较宽pH范围内可稳定存在[19]。故利用La(OH)3 (或Ce(OH)3)作为沉淀剂,可使溶液中的磷转化为LaPO4和CePO4析出,从而实现废水中磷的脱除;基于独居石的碱分解过程,又可实现沉淀物中磷的回收及稀土的再生,工艺过程如图1所示。
考虑到除磷及再生的过程并不涉及电子得失即氧化还原反应,φ-pH图提供的信息对沉淀过程只能粗略的提供LaPO4和CePO4存在的pH值范围,而采用沉淀体系的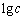 图[20-21],可以清楚地表示溶液中离子组成及其浓度随pH值变化的趋势,更适用于分析溶液中磷的沉淀及沉淀产物的分解过程。本文作者结合文献中所给数据,绘制出了含磷废水沉淀过程及沉淀剂再生过程的
图[20-21],可以清楚地表示溶液中离子组成及其浓度随pH值变化的趋势,更适用于分析溶液中磷的沉淀及沉淀产物的分解过程。本文作者结合文献中所给数据,绘制出了含磷废水沉淀过程及沉淀剂再生过程的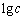 图,并对其进行了热力学分析和实验验证。
图,并对其进行了热力学分析和实验验证。
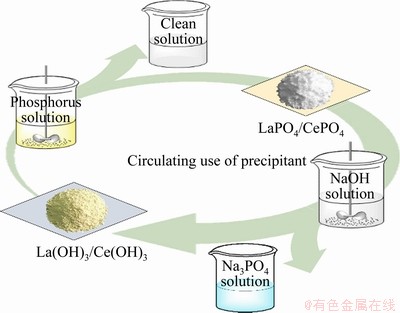
图1 稀土除磷及回收的工艺过程
Fig. 1 Process of rare earth dephosphorization and regeneration of precipitant
1 热力学数据及计算方法
本研究的目的在于对氢化稀土的沉磷过程及沉淀剂的再生过程进行分析,以确定稀土磷酸盐沉淀的最佳工作窗口,溶液中主要离子的存在形态,沉淀物的组成及沉淀剂再生的转化条件。通过热力学计算,获得25 ℃下La-P-H2O系和Ce-P-H2O系的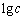 -pH图。
-pH图。
根据已有文献[19, 21],溶液中可能存在的游离组分有H+、OH-、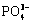 、
、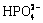 、
、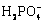 、H3PO4、La3+、LaOH2+、
、H3PO4、La3+、LaOH2+、 、La(OH)3、
、La(OH)3、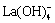 、
、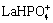 、
、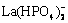 、
、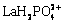 、LaPO4、
、LaPO4、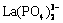 、Ce3+、CeOH2+、
、Ce3+、CeOH2+、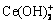 、Ce(OH)3、
、Ce(OH)3、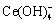 、
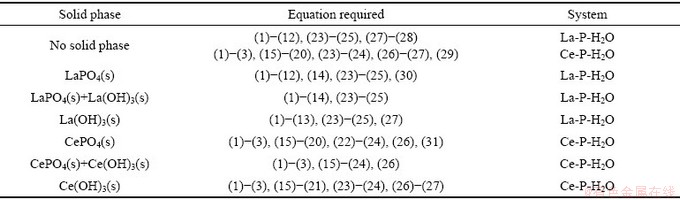
、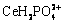 、CePO4;可能存在的固相组分有LaPO4、La(OH)3、CePO4、Ce(OH)3。这些组分可能存在的化学反应及平衡常数如表1所示。根据各组分间的平衡关系,各游离组分的平衡浓度可以被计算出来。
、CePO4;可能存在的固相组分有LaPO4、La(OH)3、CePO4、Ce(OH)3。这些组分可能存在的化学反应及平衡常数如表1所示。根据各组分间的平衡关系,各游离组分的平衡浓度可以被计算出来。
根据质量平衡定理,平衡时溶液中总磷[P]T、总镧[La]T、总铈[Ce]T浓度满足表2中式(24)~(26)。随着pH的变化,溶液体系中稳定固相不断变化,因此它们的溶解平衡需要分别被考虑。当溶液中出现不同固相时,各组分的成分关系如表3所示。根据各组分间平衡关系及质量守恒定理,即可计算出各固相稳定存在的pH区间及各组分的平衡浓度。对于复杂溶液体系,由于缺乏离子的活度系数,且体系沉淀过程中游离离子浓度较低,故而在实际计算过程中采用离子浓度代替活度。
表1 溶液体系可能发生的化学反应方程及其在25 ℃下的平衡常数
Table 1 Chemical reaction equations of solution systems and equilibrium constants at 25 ℃

续表1

表2 沉淀过程中溶液体系的质量守恒方程
Table 2 Mass balance equations of solution system in precipitation process

表3 溶液体系处于固体稳定区的平衡方程
Table 3 Solution systems of equations depending on nature of solid phase(s)
2 结果与讨论
2.1 稀土沉淀除磷
由于选矿和冶金过程产生的含磷废水的酸碱度变化较大,且pH值对沉淀过程中的固相组成和液相组成影响较大。因此,在冶金过程中对溶液中的固相组成进行分析,以期获得磷酸盐沉淀生成的最佳操作区间。
2.1.1 La-P-H2O系
图2所示为La-P-H2O系相关组分的分布图,其中初始浓度[P]Ti和[La]Ti分别为0.001和0.002 mol/L。结合图2(a)和(b)可以看出,随着pH的增大,溶液中稳定存在的固相依次为LaPO4(s)、LaPO4(s)和La(OH)3(s)、La(OH)3(s)。当溶液0≤pH<1.75时,溶液中无固体生成;在pH=1.75处LaPO4(s)开始沉淀,在1.75≤pH<9.0区间内LaPO4(s)为溶液中存在的单一固相;当pH=9.0时La(OH)3(s)开始生成,当9.0≤pH<14.5时,LaPO4(s)和La(OH)3(s)两相共存。随着pH的增大,溶液中总磷[P]T逐渐增加,沉淀中LaPO4(s)含量逐渐降低,La(OH)3(s)含量逐渐升高;当pH=14.5时LaPO4(s)完全消失;当14.5≤pH<15.0时,La(OH)3(s)成为溶液中单一固相;当15.0≤pH<16.0时,溶液中总磷[P]T和总镧[La]T等于初始浓度,各组分以离子的形式存在,无固相存在。
从图2(c)中还可以看出,pH的变化导致溶液中La的存在形式改变。pH越大,配位的OH-越多,溶液中La3+逐渐向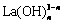 (n≥1)转变。在图2(d)中,1.75≤pH<9.0为LaPO4(s)单一固相稳定区间;9.0≤pH<14.5为LaPO4(s)和La(OH)3(s)两相共存区,且两者的比例较为稳定;14.5≤pH<15.0为La(OH)3(s)的单一固相稳定区。
(n≥1)转变。在图2(d)中,1.75≤pH<9.0为LaPO4(s)单一固相稳定区间;9.0≤pH<14.5为LaPO4(s)和La(OH)3(s)两相共存区,且两者的比例较为稳定;14.5≤pH<15.0为La(OH)3(s)的单一固相稳定区。
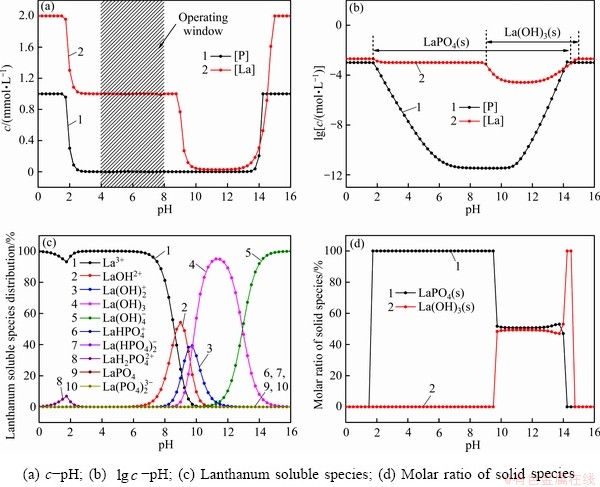
图2 La-P-H2O系相关组分的分布图
Fig. 2 Distribution of La-P-H2O system
综上可以看出,pH值对LaPO4(s)沉淀过程是一个非常重要的影响因素。当pH值从1.75增大到2.00,磷的沉淀率从4.28% 增加到69.87%。在2.70≤pH<8.66范围之间,磷的沉淀率可维持在99.80%附近,在此范围内,原溶液中残留的总磷[P]T基本维持在1.9×10-8 mol/L左右。
2.1.2 Ce-P-H2O系
图3所示为Ce-P-H2O系相关组分的分布图,其中初始浓度[P]Ti和 [Ce]Ti 分别为0.001和0.002 mol/L。从图3可以看出,随着pH的增大溶液中稳定存在的固相依次为CePO4(s)、CePO4(s)和Ce(OH)3(s)、Ce(OH)3(s)。当溶液0≤pH<1.75时,溶液中无固体生成;在pH=1.75处CePO4(s)开始沉淀;在1.75≤pH<9.0 区间内CePO4(s)为溶液中存在的单一固相;当pH=9.0时Ce(OH)3(s)开始生成,当9.0≤pH<14.0时,CePO4(s)和Ce(OH)3(s)两相共存,随着pH的增大,溶液中总磷[P]T逐渐增加,沉淀中CePO4(s)含量逐渐降低,Ce(OH)3(s)含量逐渐升高;当pH=14.0时CePO4(s)和Ce(OH)3(s)同时消失,在14.0≤pH<16.0区间内,溶液中总磷[P]T和总铈[Ce]T等于初始浓度,各组分以离子的形式存在。
同样,从图3(b)中还可以看出,相比于La(OH)3除磷,Ce(OH)3除磷效果较差,但仍能将溶液中磷含量降至3.31×10-5。图3(c)表明,pH的变化同样会导致溶液中Ce的存在形式的改变。pH越大,配位的OH—越多,溶液中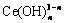 (n≥1)含量升高。在图3(d)中,1.75≤pH<9.0为CePO4(s)单一固相稳定区间;9.0≤pH<14.0为CePO4(s)和Ce(OH)3(s)两相共存区。
(n≥1)含量升高。在图3(d)中,1.75≤pH<9.0为CePO4(s)单一固相稳定区间;9.0≤pH<14.0为CePO4(s)和Ce(OH)3(s)两相共存区。
综上可以看出,pH值对CePO4(s)沉淀过程是一个非常重要的影响因素。当pH值从1.75增大到2.00,磷的沉淀率从62.78%增加到87.61%。在2.70≤pH<8.66范围内,磷的沉淀率可维持在96.7%附近,在此范围内原溶液中残留的总磷[P]T基本维持在3.31×10-5 mol/L左右。
2.1.3 La(Ce)用量对除磷效果的影响
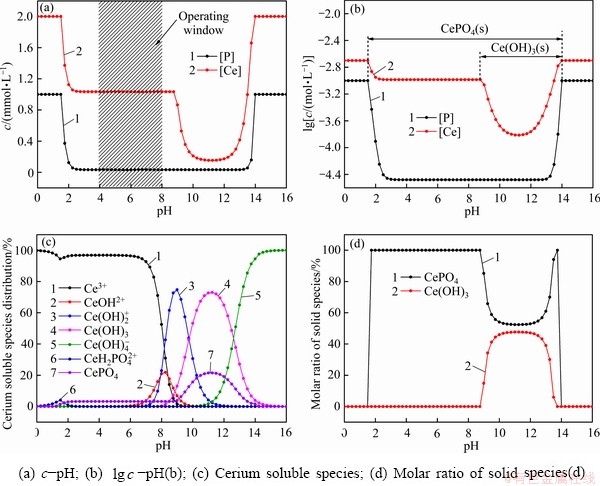
图3 Ce-P-H2O系相关组分的分布图
Fig. 3 Distribution of Ce-P-H2O system
实际操作中,影响沉淀效果的因素往往有很多,如反应温度、沉淀剂加入量、反应时间、pH值等。在此结合热力学分析,本文通过绘制一定沉淀剂加入量下时各游离组份的浓度变化,来分析沉淀剂用量对磷沉淀效果的影响。图4所示为初始总磷[P]Ti=0.001 mol/L时不同初始总镧[La]Ti(见图4(a))和总铈[Ce]Ti(见图4(b))下的沉淀率曲线。由图4可知,pH=1.75时,镧和铈的初始浓度为0.002 mol/L的沉淀率分别为4.28%和62.78%,当浓度升高至0.008 mol/L时,沉淀率分别为65.71%和89.14%,由此可看出,初始浓度越高,更易于与磷结合形成沉淀,沉淀率越高;在同一浓度下,如在0.002 mol/L时,随着pH的升高,镧与磷的沉淀率由4.28%升高至99.99%,铈与磷的沉淀率由62.78%升高至96.69%,沉淀率随pH的增加而增大。相对于镧的99.99%的沉淀率而言,铈的沉淀率较低,仅为96.69%,除磷效果略有降低。结合图2、图3可知,采用1:1的La(OH)3(s)(或Ce(OH)3(s))在2.70~8.66的pH区间,适当增大pH可实现磷的高效脱除。
2.2 沉淀剂的再生
通过分析上述该过程已生成的LaPO4和CePO4沉淀在水溶液中的溶解平衡,获得LaPO4和CePO4分解的最佳理论条件。
2.2.1 La(OH)3的再生
图5所示为25 ℃下溶液中总磷[P]T、总镧[La]T的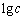 -pH图(见图5(a))以及镧在溶液中的赋存状态(见图5(b))。从图5(a)可以看出,当0≤pH<2.8时,溶液中总磷[P]T和总镧[La]T含量高于LaPO4(s)在水中的溶解度,可以认定此时LaPO4(s)已经溶解;当2.8≤pH<14.3,溶液中总磷[P]T和总镧[La]T含量变化一致,此区间为LaPO4(s)的稳定存在区;随着pH值的增大,在区间14.3≤pH<16.0,LaPO4(s)逐渐溶解,溶液中总磷[P]T和总镧[La]T含量升高,当溶液中OH-含量上升到一定程度,镧主要以La(OH)3(s)沉淀的形式存在。
-pH图(见图5(a))以及镧在溶液中的赋存状态(见图5(b))。从图5(a)可以看出,当0≤pH<2.8时,溶液中总磷[P]T和总镧[La]T含量高于LaPO4(s)在水中的溶解度,可以认定此时LaPO4(s)已经溶解;当2.8≤pH<14.3,溶液中总磷[P]T和总镧[La]T含量变化一致,此区间为LaPO4(s)的稳定存在区;随着pH值的增大,在区间14.3≤pH<16.0,LaPO4(s)逐渐溶解,溶液中总磷[P]T和总镧[La]T含量升高,当溶液中OH-含量上升到一定程度,镧主要以La(OH)3(s)沉淀的形式存在。
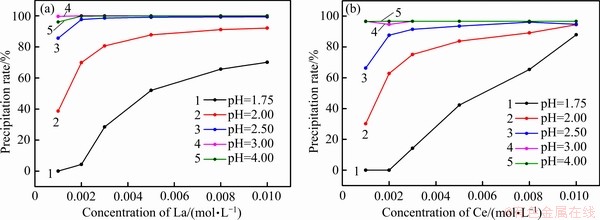
图4 不同初始La浓度和Ce浓度下的沉淀率曲线
Fig. 4 Precipitation rate curves at different initial La(a) and Ce(b) concentrations ([P]Ti=0.001 mol/L)
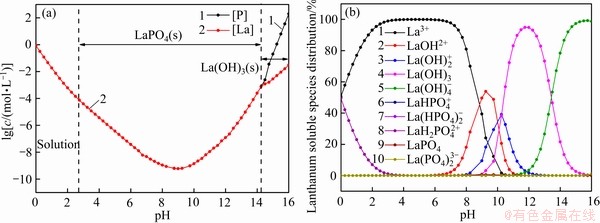
图5 [La]Ti=0.001 mol/L,[P]Ti=0.001 mol/L下的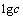 -pH和溶液组分分布图
-pH和溶液组分分布图
Fig. 5 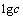 -pH diagram(a), lanthanum soluble species distribution(b) under conditions of [La]Ti=0.001 mol/L and [P]Ti= 0.001 mol/L
-pH diagram(a), lanthanum soluble species distribution(b) under conditions of [La]Ti=0.001 mol/L and [P]Ti= 0.001 mol/L
由图5(b)可以看出,在区间0≤pH<2.8,溶液中镧主要以La3+和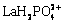 的形式存在,随着pH值的增大,溶液中的磷更多地以
的形式存在,随着pH值的增大,溶液中的磷更多地以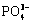 形式存在,而非
形式存在,而非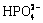 、
、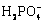 和H3PO4,且LaPO4(s)的溶度积一定,故而溶液中La3+逐渐升高;随着pH值的持续增大,总磷[P]T和总镧[La]T逐渐升高,溶液中的镧更多以
和H3PO4,且LaPO4(s)的溶度积一定,故而溶液中La3+逐渐升高;随着pH值的持续增大,总磷[P]T和总镧[La]T逐渐升高,溶液中的镧更多以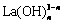 (n>1)的形式存在。
(n>1)的形式存在。
2.2.2 Ce(OH)3的再生
图6所示为25 ℃下溶液中总磷[P]T、总铈[Ce]T的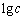 -pH图(见图6(a))以及铈在溶液中的赋存状态(见图6(b))。从图6(a)可以看出,当0≤pH<1.5时,溶液中总磷[P]T和总铈[Ce]T高于CePO4(s)在水中的溶解度,可以认定此时CePO4(s)已经溶解;当1.5≤pH<14.5,溶液中总磷[P]T和总铈[Ce]T变化一致,此区间为CePO4(s)的稳定存在区;随着pH值的增大,在区间14.5≤pH<16.0,CePO4(s)逐渐溶解,溶液中总磷[P]T和总铈[Ce]T升高,随着溶液中OH-浓度不断上升,铈最终以Ce(OH)3(s)沉淀的形式存在。
-pH图(见图6(a))以及铈在溶液中的赋存状态(见图6(b))。从图6(a)可以看出,当0≤pH<1.5时,溶液中总磷[P]T和总铈[Ce]T高于CePO4(s)在水中的溶解度,可以认定此时CePO4(s)已经溶解;当1.5≤pH<14.5,溶液中总磷[P]T和总铈[Ce]T变化一致,此区间为CePO4(s)的稳定存在区;随着pH值的增大,在区间14.5≤pH<16.0,CePO4(s)逐渐溶解,溶液中总磷[P]T和总铈[Ce]T升高,随着溶液中OH-浓度不断上升,铈最终以Ce(OH)3(s)沉淀的形式存在。
由图6(b)可以看出,在区间0≤pH<1.5,溶液中铈主要以Ce3+和CeH2PO42+的形式存在,随着pH值的增大,溶液中的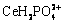 逐渐解离,故而溶液中Ce3+逐渐升高;在1.5≤pH<5.0间,pH值的增大导致溶液中
逐渐解离,故而溶液中Ce3+逐渐升高;在1.5≤pH<5.0间,pH值的增大导致溶液中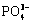 逐渐增多,且由于CePO4(s)的溶度积一定,故而溶液中Ce3+逐渐减少,更多的以CePO4的形式存在;当溶液中OH-达到一定浓度时,会转化为Ce(OH)3和
逐渐增多,且由于CePO4(s)的溶度积一定,故而溶液中Ce3+逐渐减少,更多的以CePO4的形式存在;当溶液中OH-达到一定浓度时,会转化为Ce(OH)3和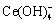 ,最终完全转化为
,最终完全转化为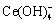 。
。
综上所述,经热力学分析可知,在14.5≤pH< 16.0范围内,La(OH)3(s)和Ce(OH)3(s)能够稳定存在,沉淀产物LaPO4(s)和CePO4(s)均可以在此区间内转化为La(OH)3(s)和Ce(OH)3(s),实现沉淀剂的再生。
2.3 实验验证
为了验证以上热力学计算结果,明确镧和铈对磷的沉淀效果及其沉淀后沉淀剂的再生效果,采用镧和铈的沉淀剂分别进行了沉淀实验和反应后沉淀剂的再生实验。
1) 沉淀实验
将四个装有1 L含磷溶液的烧杯分为两组,控制反应温度为30 ℃,分别加入沉淀剂La(OH)3 和Ce(OH)3。在单个实验组内,调节pH分别为1.40和6.00,恒温搅拌30 min后,过滤取上清液,采用ICP测定上清液中磷的含量,并根据实验结果计算出磷的沉淀率,其结果如表4所示。
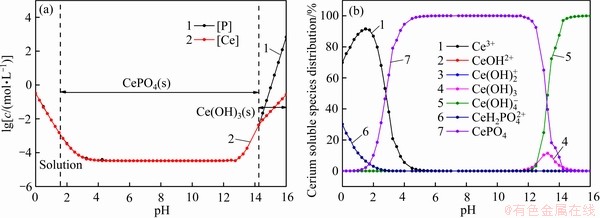
图6 [Ce]=0.001 mol/L, [P]=0.001 mol/L下的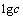 -pH和溶液组分分布图
-pH和溶液组分分布图
Fig. 6 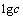 -pH diagram(a), lanthanum soluble species distribution(b) under condition of [Ce]=0.001 mol/L and [P]=0.001 mol/L
-pH diagram(a), lanthanum soluble species distribution(b) under condition of [Ce]=0.001 mol/L and [P]=0.001 mol/L
表4 不同沉淀剂和不同pH值下的除磷效果
Table 4 Removal effects of phosphorus with different precipitants and different pH values
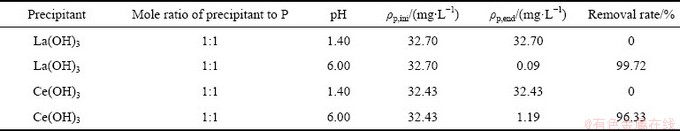
由表4可见,在pH=1.40时,溶液体系无沉淀生成,磷的去除率为0;当调节pH为6.00时,溶液中磷浓度大幅度下降,磷的去除率在99%左右。沉淀的FTIR图如图7所示,对比实验产物与标准图谱可知[22-23],540、614、1052 cm-1为LaPO4的特征峰,538、615、1055 cm-1为CePO4的特征峰。沉淀实验最终产物分别为LaPO4和CePO4。比较两种沉淀剂发现,La(OH)3具有更好的除磷效果,终点磷浓度<0.1 mg/L。实验结果与理论计算相符,进一步验证了理论计算的准确性。
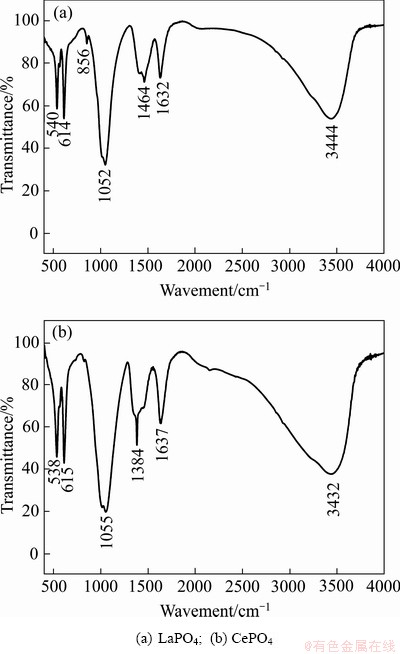
图7 沉淀实验产物的FTIR图
Fig. 7 FTIR spectra of precipitation products
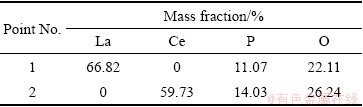
图8所示为沉淀过程的SEM像。如图8所示,沉淀产物的颗粒较大,具有良好的过滤性能,这一点对于工业生产较为重要。相比于LaPO4沉淀,CePO4沉淀表面较为平整,结晶度较好。沉淀产物的EDS数据如表5所示,沉淀中各元素质量占比基本符合LaPO4和CePO4中元素占比,可进一步确定沉淀为LaPO4和CePO4。

图8 沉淀过程的SEM像
Fig. 8 SEM images of precipitation process
表5 沉淀产物的EDS数据
Table 5 EDS data of different points in precipitation process
2) 沉淀产物的再生实验
分别取0.5 g上述两种沉淀,置于30 ℃下4 mol/L的NaOH溶液中,反应3 h。反应过程中,在特定时间点(0.5、1.0、1.5、2.0、3.0 h)分别取样分析。采用ICP测定溶液中磷的浓度,然后计算出沉淀剂的再生率,其结果如图9所示。从图9可以看出,随着反应时间的延长,溶液中磷的浓度逐渐升高,沉淀开始转化,且转化率逐渐增大。对比两种沉淀的转化率曲线可以发现,CePO4更易向Ce(OH)3转化,反应3 h后,转化率可达60%以上,这一实验与理论计算相符。
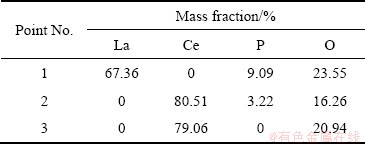
图10所示为再生过程的SEM像。从图10中可以看出,再生实验后物相形貌变化较大,且两种沉淀转化方式也有不同。在LaPO4的转化中,原有颗粒的表面出现了许多细小的、绒毛状的颗粒,为由外到内的逐层分解的形式;CePO4颗粒则是大颗粒分解为小颗粒,分解后进一步向Ce(OH)3转化,转化过程沉淀中元素比例如表6所示。对比表5可知,LaPO4沉淀转化较少,CePO4沉淀转化率较高,这可能是由于LaPO4沉淀在转化过程被新生成的La(OH)3包裹,受动力学因素控制,转化较慢。
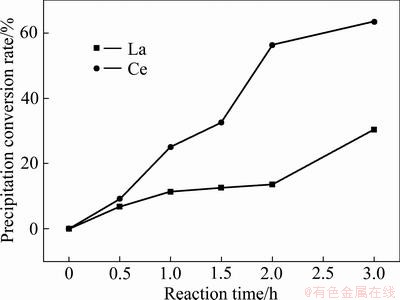
图9 不同反应时间下沉淀的转化率
Fig. 9 Conversion rates of precipitation at different reaction time

图10 再生过程的SEM像
Fig.10 SEM images of regeneration process
表6 沉淀再生产物的EDS分析结果
Table 6 EDS analysis results of different points in regeneration process
3 结论
1) 理论计算结果表明,采用La(OH)3或Ce(OH)3均可在2.70≤pH<8.66范围内形成稳定的LaPO4和CePO4沉淀,实现磷的高效脱除。在计算的含磷浓度条件下,磷的理论沉淀率分别为99.9%和96.7%。随着沉淀剂用量增加,磷的沉淀率逐渐升高,沉淀区间逐渐增大。
2) 除磷过程生成的LaPO4和CePO4沉淀在14.5≤pH<16.0范围内可转化为La(OH)3和Ce(OH)3,故在此区间可实现沉淀剂的再生且提高碱浓度可增加转化程度。
3) 基于理论计算,采用La(OH)3和Ce(OH)3处理30 mg/L的含磷溶液,磷的沉淀率分别为99.72%和96.33%;针对形成的磷酸稀土沉淀,用4 mol/L的NaOH溶液中进行再生,LaPO4和CePO4的转化率分别为30.38%和63.38%。
REFERENCES
[1] WANG H J, LIANG X M, JIANG P H, et al. TN:TP ratio and planktivorous fish do not affect nutrient-chlorophyll relationships in shallow lakes[J]. Freshwater Biology, 2008, 53(5): 935-944.
[2] NESME T, METSON G S, BENNETT E M. Global phosphorus flows through agricultural trade[J]. Global Environmental Change, 2018. 50: 133-141.
[3] 杨晓松, 邵立南, 刘峰彪, 等. 高浓度泥浆法处理矿山酸性废水机理[J]. 中国有色金属学报, 2012, 22(4): 1177-1183.
YANG Xiao-song, SHAO Li-nan, LIU Feng-biao, et al. Mechanism of mine acidic waste water treated by high density sludge[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(4): 1177-1183.
[4] 张保华, 雷岗星. 含磷废水处理技术的研究进展[J]. 石油石化节能与减排, 2013, 3(4): 37-40.
ZHANG Bao-hua, LEI Gang-xing. Progress of phosphorus wastewater treatment technology[J]. Energy Conservation and Emission Reduction in Petroleum and Petrochemical Industry, 2013, 3(4): 37-40.
[5] ZHANG J, BLIGH M W, LIANG P, et al. Phosphorus removal by in situ generated Fe(Ⅱ): Efficacy, kinetics and mechanism[J]. Water Research, 2018, 136: 120-130.
[6] 李 芳, 刘柏林. PFS和PAM化学沉淀法处理高磷废水的实验研究[J]. 广州化工, 2020, 48(14): 85-87.
LI Fang, LIU Bo-lin. Experimental study on treatment of high phosphorus wastewater by PFS and PAM chemical precipitation[J]. Guangzhou Chemical Industry, 2020, 48(14): 85-87.
[7] 夏世斌, 张 义, 鲁双月, 等. 改性脱磷剂对高磷赤铁矿选矿废水的除磷性能[J]. 中国有色金属学报, 2010, 20(4): 772-776.
XIA Shi-bing, ZHANG Yi, LU Shuang-yue, et al. Experimental study on treatment of acidic wastewater from high-phosphorus hematite ores processing[J]. Environmental Science & Technology, 2010, 33(8): 132-134.
[8] 王 松, 谢洪勇. 鸟粪石结晶法回收高浓度酸性含磷废水中磷的研究[J]. 江苏农业科学, 2020, 48(4): 282-285.
WANG Song, XIE Hong-yong. Study on the recovery of phosphorus in waste water containing high concentration acid by guano crystal crystallization method[J]. Jiangsu Agricultural Sciences, 2020, 48(4): 282-285.
[9] 王 刚, 徐晓军, 杨津津, 等. 电解-强化微电解耦合法处理含铜废水[J]. 中国有色金属学报, 2013, 23(10): 2936-2941.
WANG Gang, XU Xiao-jun, YANG Jin-jin, et al. Treatment of cupric wastewater by electrolysis-enhanced micro electrolysis coupled method[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2936-2941.
[10] 郭朝晖, 姜智超, 刘亚男, 等. 混凝沉淀法处理钨多金属矿选矿废水[J]. 中国有色金属学报, 2014, 24(9): 2393-2399.
GUO Zhao-hui, JIANG Zhi-chao, LIU Ya-nan, et al. Coagulation and sedimentation treating wastewater from W containing multi-metal ore dressing process[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(9): 2393-2399.
[11] MENG S L, LI Y D, ZHANG T, et al. Influences of environmental factors on lanthanum/aluminum-modified zeolite adsorbent (La/Al-ZA) for phosphorus adsorption from wastewater[J]. Water, Air, & Soil Pollution, 2013, 224(6): 1556-1563.
[12] 孟 锋, 柴易达, 张洛红, 等. 硫酸亚铁结合电化学絮凝处理中水氨氮与总磷的研究[J]. 环境保护科学, 2020, 46(2): 39-43.
MENG Feng, CHAI Yi-da, ZHANG Luo-hong, et al. Treatment of ammonia nitrogen and total phosphorus in reclaimed water by combining ferrous sulfate with electrochemical flocculation[J]. Environmental Protection Science, 2020, 46(2): 39-43.
[13] 纪鹏华. 钙/铝改性钢渣陶粒的制备及其除磷性能的研 究[D]. 保定: 河北大学, 2017.
JI Peng-hua. Study of the preparation and performance of Ca/Al-modified steel slag ceramisite for phosphate removal[D]. Baoding: Hebei University, 2017.
[14] 王燕燕. MAP法在生物工程制药废水脱氮除磷中应用探讨[J]. 环境与发展, 2020, 32(5): 128, 130.
WANG Yan-yan. Application of MAP in nitrogen and phosphorus removal from bioengineering pharmaceutical wastewater[J]. Environment and Development, 2020, 32(5): 128, 130.
[15] ZHANG X Y, LIU C, NEPAL S, et al. A hybrid approach for scalable sub-tree anonymization over big data using MapReduce on cloud[J]. Journal of Computer and System Sciences, 2014, 80(5): 1008-1020.
[16] 郑晓英, 李 楠, 邱丽佳, 等. 羟基铁对污水厂二级处理出水中低浓度磷的深度处理性能[J]. 净水技术, 2019, 38(3): 70-75, 112.
ZHENG Xiao-ying, LI Nan, QIU Li-jia, et al. Advanced phosphorus removal from low phosphorus concentration water by iron hydroxyl[J]. Water Purification Technology, 2019, 38(3): 70-75, 112.
[17] WU S X, ZHAO L S, WANG L S, et al. Dissolution behaviors of rare earth elements in phosphoric acid solutions[J]. Transactions of Nonferrous Metals Society of China, 2018, 8(11): 2375-2382.
[18] 佘海东, 范宏瑞, 胡芳芳, 等. 稀土元素在热液中的迁移与沉淀[J]. 岩石学报, 2018, 34(12): 3567-3581.
SHE Hai-dong, FAN Hong-rui, HU Fang-fang, et al. Migration and precipitation of rare earth elements in the hydrothermal fluids[J]. Acta Petrologica Sinica, 2018, 34(12): 3567-3581.
[19] KIM E, OSSEO-ASARE K. Aqueous stability of thorium and rare earth metals in monazite hydrometallurgy: Eh-pH diagrams for the systems Th-, Ce-, La-, Nd- (PO4)-(SO4)-H2O at 25 ℃[J]. Hydrometallurgy, 2012, 113/114: 67-78.
[20] 杨 亮, 赵中伟, 何利华, 等. 钼酸铵溶液镁盐沉淀法除砷的热力学分析[J]. 中南大学学报(自然科学版), 2012, 43(5): 1610-1615.
YANG Liang, ZHAO Zhong-wei, HE Li-hua, et al. Thermodynamics analysis on removal of arsenic from ammonium molybdate solution by chemical precipitation with magnesium salt[J]. Journal of Central South University (Science and Technology), 2012, 43(5): 1610-1615.
[21] 张文娟, 马保中, 王成彦. 基于磷酸盐沉淀分离电镀污泥中铬铁的热力学研究[J]. 稀有金属, 2018, 42(10): 1084-1092.
ZHANG Wen-juan, MA Bao-zhong, WANG Chen-gyan. Thermodynamic study on selective separation of chromium and iron from electroplating sludge based on phosphate precipitation[J]. Chinese Journal of Rare Metals, 2018, 42(10): 1084-1092.
[22] LI J Z, XU X W, FAN Y, et al. Controllable synthesis and photoluminescence of LaPO4:Eu3+ nanomaterials[J]. Materials Chemistry and Physics, 2010, 124(2/3): 1172-1176.
[23] ZHU Z Q, ZHANG K, ZHAO H Y, et al. UV-light driven photocatalytic performance of hydrothermally-synthesized hexagonal CePO4 nanorods[J]. Solid State Sciences, 2017, 72: 28-32.
Removal of phosphate and precipitant regeneration from phosphorus-containing wastewater by rare earth
CHE Jian-yong, ZHANG Wen-juan, MA Bao-zhong, WANG Cheng-yan
(School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083, China)
Abstract: Based on the available thermodynamic data, the thermodynamic calculation of the phosphorus removal process with rare earth and the regeneration process of precipitation products were carried out, respectively. And the  -pH diagram at 25 ℃ was drawn to provide theoretical support for the resource utilization and harmless disposal of phosphorus in phosphorus-containing wastewater. The analysis shows that stable LaPO4 (and CePO4) precipitation can be generated within the pH range of 2.70-8.66 to remove phosphorus. During the regeneration process, LaPO4 (and CePO4) can be transformed into La(OH)3 (and Ce(OH)3) in the pH range of 14.5-16.0 to achieve precipitation regeneration and phosphorus recovery. The results show that when La(OH)3 and Ce(OH)3 were used to treat 30mg/L phosphorous solution, the phosphorus precipitation rates are 99.72% and 96.33%, respectively. After 3h reaction, the regeneration rates of La(OH)3 and Ce(OH)3 are 30.38% and 63.38%, respectively.
-pH diagram at 25 ℃ was drawn to provide theoretical support for the resource utilization and harmless disposal of phosphorus in phosphorus-containing wastewater. The analysis shows that stable LaPO4 (and CePO4) precipitation can be generated within the pH range of 2.70-8.66 to remove phosphorus. During the regeneration process, LaPO4 (and CePO4) can be transformed into La(OH)3 (and Ce(OH)3) in the pH range of 14.5-16.0 to achieve precipitation regeneration and phosphorus recovery. The results show that when La(OH)3 and Ce(OH)3 were used to treat 30mg/L phosphorous solution, the phosphorus precipitation rates are 99.72% and 96.33%, respectively. After 3h reaction, the regeneration rates of La(OH)3 and Ce(OH)3 are 30.38% and 63.38%, respectively.
Key words: rare earth; phosphorus removal; thermodynamics; waste water treatment
Foundation item: Project(2018YFC1900404) supported by the National Basic Research Development Program of China; Project(51804029) supported by the National Natural Science Foundation of China
Received date: 2020-01-03; Accepted date: 2020-05-10
Corresponding author: WANG Cheng-yan; Tel: +86-10-62333170; E-mail: chywang@yeah.net
(编辑 龙怀中)
基金项目:国家重点研发计划资助项目(2018YFC1900404);国家自然科学基金资助项目(51804029)
收稿日期:2020-01-03;修订日期:2020-05-10
通信作者:王成彦,教授,博士;电话:010-62333170;E-mail:chywang@yeah.net