DOI: 10.11817/j.issn.1672-7207.2015.08.010
层状-尖晶石复合正极材料LiNi0.25Mn0.75O2.25的制备与性能
高彦涌,刘云建,郭长庆,窦爱春
(江苏大学 材料科学与工程学院,江苏 镇江,212013)
摘要:以共沉淀法制备Ni0.25Mn0.75(OH)2,并以Ni0.25Mn0.75O2.25(OH)2为前驱体,在不同温度下与Li2CO3烧结制备LiNi0.25Mn0.75O2.25。利用X线衍射(XRD)、扫描电镜(SEM)和透射电镜(TEM)对不同温度下制备材料的结构和形貌进行表征。研究结果表明:制备的材料LiNi0.25Mn0.75O2.25均具备层状和尖晶石型结构。800 ℃下制备的样品具有最好的电化学性能。在2.0~4.8 V电压范围内,该样品在0.1C倍率下的首次放电比容量达到250 mA·h/g,首次库仑效率为90.9%,循环50次后的容量保持率达到95.9%,10C放电比容量达到69 mA·h/g。800 ℃下制备的样品具有最小的电荷转移阻抗。
关键字:锂离子电池;层状-尖晶石复合正极材料;库仑效率;电化学性能
中图分类号:TM912 文献标志码:A 文章编号:1672-7207(2015)08-2831-06
Synthesis and electrochemical performance of layered-spinel composite cathode mateials LiNi0.25Mn0.75O2.25
GAO Yanyong, LIU Yunjian, GUO Changqing, DOU Aichun
(School of Material Science and Engineering Jiangsu University, Zhenjiang 212013, China)
Abstract: Ni0.25Mn0.75(OH)2 precursors were synthesized by co-precipitation method. The composite cathode material LiNi0.25Mn0.75O2.25 was prepared by heat-treating of Ni0.25Mn0.75(OH)2 and Li2CO3 at different temperatures. The prepared samples were characterized by X-ray powder diffractometry(XRD), scanning electron microscopy(SEM), transmission electron microscope(TEM) and electrochemical tests. The results show that the spinel and layered phases are integrated in the LiNi0.25Mn0.75O2.25 electrode effectively. LiNi0.25Mn0.75O2.25 synthesized at 800 ℃ shows the best electrochemical performance. The initial discharge capacity is 250 mA·h/g and the initial coulomb efficiency is 90.9% at 0.1C between 2.0-4.8 V. The capacity remains 95.9% after 50 cycles. And the discharge capacity at 10C is still 69 mA·h/g. The charge transfer resistance of LiNi0.25Mn0.75O2.25 synthesized at 800 ℃ is the lowest.
Key words: Li-ion battery; layered-spinel composite cathode; coulomb efficiency; electrochemical performance
信息技术的发展和新型电子仪器设备的进步使得锂离子二次电池迅速被人们所接受,并得到了飞速的发展。LiCoO2作为目前最广泛应用于商业化的正极材料, 具有工作电压高、放电平稳、循环性能好等优点, 但钴资源稀少、价格高, 而且对环境有一定污染[1]。尖晶石结构的LiMn2O4具有较高的工作电压、价格低廉、环境友好等特点, 但是较低的可逆循环容量和高温下容量的快速衰减是阻碍其商业化应用的关键因素之一[2]。价格相对低廉的LiFePO4 电子电导率较差, 而且实际放电比容量较低[3]。层状固溶体材料Li1.5Ni0.25Mn0.75O2.5具有比容量高、能量密度高、循环性能好、安全性好等优点[4-5],但存在着首次库仑效率低、倍率性能差等问题,这严重影响了该材料的实际运用。目前针对上述缺陷,主要的改性方法是表面包覆,例如表面包覆Al2O3[6],MnO2[7],C[8],MgO[9]和AlF3[10]等,但是表面包覆工艺复杂,不利于实际生产,所以有必要采取新的改性方法。尖晶石LiNi0.5Mn1.5O4是人们在对LiMn2O4进行掺杂改性时发现的具有4.7 V充放电平台的新型正极材料[11]。尖晶石LiNi0.5Mn1.5O4所具有的特殊三维扩散通道,使其具有良好的倍率性能和循环性能。基于Li1.5Ni0.25Mn0.75O2.5和LiNi0.5Mn1.5O4具有相同的镍锰原子比、氧堆积方式以及合成方法,由Park等[12]利用尖晶石型LiNi0.5Mn1.5O4对层状固溶体Li1.5Ni0.25Mn0.75O2.5进行改性,并制备出新型层状-尖晶石复合固溶体正极材料Li0.5+xNi0.25Mn0.75O2+x/2(0<x<1)。在层状-尖晶石系列复合材料中,当x=0.5时,层状-尖晶石复合固溶体正极材料LiNi0.25Mn0.75O2.25被发现具有较高的首次库仑效率和倍率性能,被认为有可能成为新一代的电动汽车用锂离子电池正极材料[12]。通过对现有报道的查阅,发现层状-尖晶石复合材料的烧结温度一般都控制在900 ℃,目前尚未发现研究烧结温度对层状-尖晶石复合固溶体正极材料结构与性能的影响报道。本文作者以层状-尖晶石复合材料LiNi0.25Mn0.75O2.25为对象,研究不同温度对正极材料的电化学性能的影响,特别是对首次库仑效率和倍率性能的影响,并对其相关机理进行分析。
1 实验
1.1 材料的制备
将Ni(NO3)2·6H2O和Mn(NO3)2·6H2O按照摩尔比为1:3配成一定浓度的水溶液。然后滴加NaOH溶液,利用NH3·H2O溶液调节pH,充分搅拌,反应完全后,过滤、洗涤、干燥得到Ni0.25Mn0.75(OH)2沉淀。按照化学当量配比(锂过量5%),称取Li2CO3,并将其与Ni0.25Mn0.75(OH)2前驱体混合球磨5 h,使其充分混合均匀。将混合物置于管式炉中,在空气氛围下采用二段烧结法进行烧结。先将混合物加热到500 ℃并保持5 h,然后分别继续升温至750,800,850和900 ℃并保温12 h得到不同的产物。所有的产物都采用液氮进行淬火处理,得到的层状-尖晶石复合正极材料分别标记为样品a,b,c和d。
1.2 材料表征测试
物相分析使用日本理学D/MAX-C型X线衍射仪,加速电压为40 kV,电流为300 mA,衍射靶为Cu Kα,扫描范围为10°~80°。采用JEOL JSM-7001F型高分辨场发射扫描电子显微镜观察材料的表面形貌。用透射电镜(TEM,Tecnai G220 ST 型透射电子显微镜,荷兰)观测颗粒微观组织。
1.3 电极制备与半电池组装
将正极活性物质、乙炔黑和聚偏氟乙烯(PVDF)按质量比8:1:1混合,加入溶剂N-甲基-2-吡咯烷酮(NMP),混合均匀后,刮涂于铝箔上,在烘箱内于120 ℃下干燥,压片后得到正极片,在氩气保护的手套箱中,以金属锂片为负极,以溶解于乙烯碳酸酯(EC)+碳酸二甲酯(DMC)+碳酸甲乙酯(EMC)(体积比为1:1:1)溶液的1 mol/L LiPF6为电解液,以聚丙烯微孔膜(Celgard 2400)为隔膜,组装成CR2025扣式半电池。
1.4 电化学性能测试
采用上述组装的CR2025扣式半电池,以新威尔电池测试仪采用恒流恒压法对电池进行充放电测试,充放电电压为2.0~4.8 V,首次充放电电流为0.1C,循环性能测试电流为0.2C(1C=250 mA·h/g)。
交流阻抗测试采用三电极体系进行,辅助电极和参比电极均采用金属锂片。测试仪器为上海辰华的CHI660D 电化学工作站,交流阻抗的测试频率为0.01~100 000 Hz。
2 结果与讨论
2.1 合成产物的XRD物相分析
图1所示为不同温度下产物的XRD图。从图1可以看出:所有材料都具有层状和尖晶石结构的特征衍射峰。在20°~25°之间出现一组较小的衍射峰, 这是由于Li2MnO3 的过渡金属层按Li和Mn摩尔比n(Li)/n(Mn)=1/2排列,具有超晶格有序性[13]。在34°~50°之间,尖晶石和层状结构同时出现,其中311,222和400峰为明显的尖晶石结构(spinel)衍射峰,并且随着温度升高,衍射峰随之更为尖锐。结果表明,合成的正极材料LiNi0.25Mn0.75O2.25中同时具有层状和尖晶石结构。这与文献[14]报道的结果相似。
2.2 合成产物的SEM和TEM分析
图2所示为在不同温度下合成LiNi0.25Mn0.75O2.25的SEM图。由图2可以看出:不同温度下烧结材料的形貌基本类似,为不规则的细小固体颗粒,一次粒径在0.2 μm左右,并伴有一定量的团聚现象。较小的颗粒粒径缩短了Li + 在正极材料颗粒内部的扩散路径,有利于提高正极材料的电化学性能,特别是倍率性能[15]。
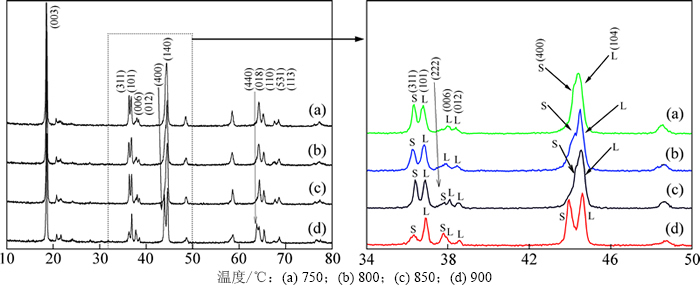
图1 不同温度下产物的XRD图
Fig. 1 XRD patterns of LiNi0.25Mn0.75O2.25 synthesized at different temperatures

图2 不同温度下合成LiNi0.25Mn0.75O2.25的SEM图像
Fig. 2 SEM images of LiNi0.25Mn0.75O2.25 synthesized at different temperatures
图3所示为800℃下合成LiNi0.25Mn0.75O2.25样品的高倍透射电镜图以及局部的快速傅里叶变换图(FFT-Fast Fourier Transform)。从图3可以看出:该材料具有明显的晶界,说明存在2种不同的相结构。图3中区域1的FFT图可以被看作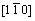 晶向的选区电子衍射,其为典型的Li2MnO3相(111)晶面的晶格结构,所以区域1为层状结构。图3中区域2的FFT图为分别由[110]晶向LiMn2O4和
晶向的选区电子衍射,其为典型的Li2MnO3相(111)晶面的晶格结构,所以区域1为层状结构。图3中区域2的FFT图为分别由[110]晶向LiMn2O4和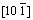 晶向Li2Mn2O4的2种晶格结构叠加而成。所以,区域2可以看作是典型的尖晶石结构[16]。该图直接证实了在LiNi0.25Mn0.75O2.25中层状-尖晶石2种不同结构的存在,并且2种结构还能够紧密复合。通过尖晶石LiNi0.5Mn1.5O4具有的特殊三维扩散通道,锂离子更容易进行脱嵌,从而有效地提高材料倍率性能。
晶向Li2Mn2O4的2种晶格结构叠加而成。所以,区域2可以看作是典型的尖晶石结构[16]。该图直接证实了在LiNi0.25Mn0.75O2.25中层状-尖晶石2种不同结构的存在,并且2种结构还能够紧密复合。通过尖晶石LiNi0.5Mn1.5O4具有的特殊三维扩散通道,锂离子更容易进行脱嵌,从而有效地提高材料倍率性能。
2.3 合成产物的电化学性能测试
图4所示为不同温度下合成LiNi0.25Mn0.75O2.25样品首次放电曲线,充放电区间为2.0~4.8 V,充放电电流为0.1C。由图4可以看出:所有样品的充电曲线中在4.5 V处都出现了1个平台,该平台表征了Li2O从Li2MnO3脱出的反应[14]。在放电过程在4.7 V处存在明显的电压平台。这是由于在放电过程中,固溶体中的LiNi0.5Mn1.5O4其结构发生转变,Ni4+被还原成Ni2+,产生贫锂的固溶体,从而形成4.7 V的电压平台。当继续放电至电压低于3.0 V时又出现放电平台,这是由于发生了Mn4+到Mn3+的还原反应。不同温度下合成的样品a~d首次充电比电容量分别为270,275,300和288 mA·h/g,首次放比电容量分别为217,250,213和200 mA·h/g,库仑效率分别为80.3%,90.9%,71.0%和69.4%。该结果表明:随着合成温度上升,样品的放电比容量和库仑效率都是先增加后减小,在800 ℃下合成的LiNi0.25Mn0.75O2.25放电容量和库仑效率都最高,这可能是因为800 ℃下合成的材料中层状和尖晶石结构发育良好,分散均匀;团聚较少,有利于电解液的浸润和锂离子的脱嵌,当温度继续升高时,锂离子的扩散程度增加,导致阳离子混排严重,进而影响了锂离子的脱嵌,直观地表现为首次放电容量降低。

图3 LiNi0.25Mn0.75O2.25的HRTEM图像及其快速傅里叶变换图
Fig. 3 HRTEM with corresponding indexed FFT image of LiNi0.25Mn0.75O2.25
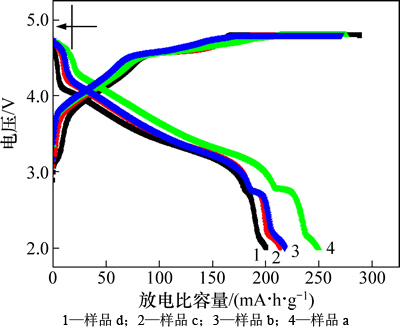
图4 不同温度下合成样品首次充放电曲线
Fig. 4 The first charge and discharge curves of LiNi0.25Mn0.75O2.25 synthesized at different temperatures
图5所示为不同温度下合成LiNi0.25Mn0.75O2.25样品的循环性能,充放电电流为0.2C。由图5可以看出:不同温度下合成LiNi0.25Mn0.75O2.25样品a~d 0.2C的放电容量分别为203,221,190和180 mA·h/g。经过循环50次后样品a~d的容量分别为188,212,174,164 mA·h/g,保持率分别为92.6%,95.9%,91.5%和91.3%。由此可见,随着温度增加,LiNi0.25Mn0.75O2.25样品循环后的容量保持率先增加后减小,800 ℃下合成样品的容量保持率最高。由XRD图谱可以看出:在高于800 ℃烧结时,尖晶石结构发育突出;而LiNi0.5Mn1.5O4在3.0 V下放电时,会发生Jahn-Teller效应而导致循环性能下降;当温度低于800 ℃烧结时,LiNi0.5Mn1.5O4发育衰退,导致层状结构成分升高,而层状结构在Li+脱嵌时,Ni离子会进入Li层,增大了阳离子混排程度,阻碍锂离子的扩散;在800 ℃进行烧结时,层状和尖晶石结构发育良好,使锂离子更容易在层状和三维隧道相互补充下进行脱嵌行为,减少锂离子迁移的阻力和损耗,进而表现出较好的循环性能。
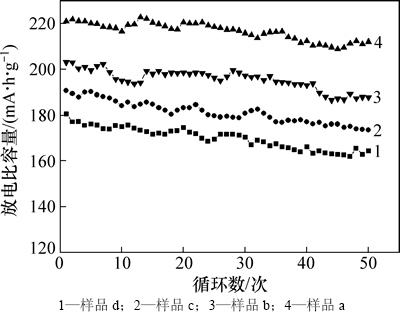
图5 不同温度下合成样品的循环性能
Fig. 5 Cycling performances of LiNi0.25Mn0.75O2.25 synthesized at different temperatures
图6所示为不同温度下制备LiNi0.25Mn0.75O2.25样品的倍率性能。在2.0~4.8 V电压范围内,充电电流均为0.1C,而放电电流分别为0.1,0.2,0.5,1,2,5和10C。从图6可以看出:随着放电倍率的增大,样品的放电比容量均有所降低;在0.1C放电时,放电比容量分别为217,250,213和200 mA·h/g;在1C放电时放电容量为147,161,109和91 mA·h/g,而在10C放电时放电比容量分别为69,96,51和46 mA·h/g。该结果表明:800 ℃下制备的LiNi0.25Mn0.75O2.25具备最佳的倍率放电性能,特别是大倍率下的放电性能。
图7所示为不同温度合成LiNi0.25Mn0.75O2.25样品的交流阻抗图,测试前LiNi0.25Mn0.75O2.25电极的电压稳定在4.3 V左右。LiNi0.25Mn0.75O2.25样品阻抗图谱均由高频区的半圆和低频区的直线组成。高频区的半圆弧代表正极材料表面电荷转移阻抗Rct;低频区的直线代表Li+在固相活性物质中的扩散Warburg阻抗Zw。经过Zview软件模拟得知,750,800,850以及900 ℃下合成样品的电荷转移阻抗分别为51,36,70,83 Ω。由此可见:随着温度的升高,LiNi0.25Mn0.75O2.25样品的电荷转移阻抗先减小后增大,800 ℃时合成LiNi0.25Mn0.75O2.25样品的电荷转移阻抗最小。该结果和LiNi0.25Mn0.75O2.25样品的倍率性能相吻合。较小的电荷转移阻抗将有利于Li+的传递,进而表现出较好的倍率放电性能。
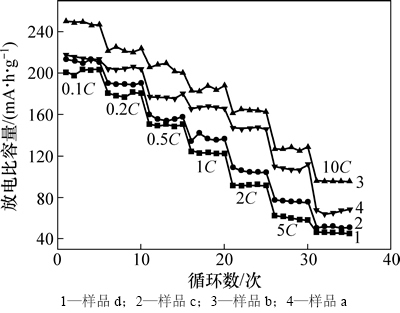
图6 不同温度下合成样品的倍率性能
Fig. 6 Rate capacity of LiNi0.25Mn0.75O2.25 synthesized at different temperatures
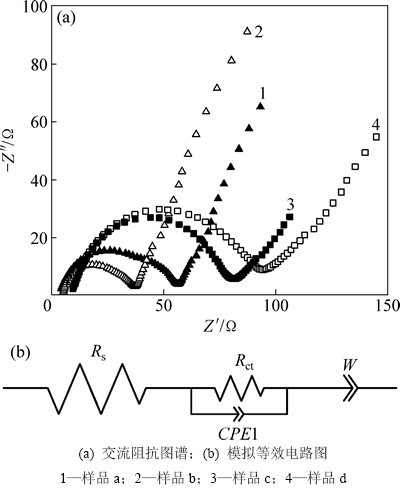
图7 LiNi0.25Mn0.75O2.25样品的交流阻抗图谱和模拟等效电路图
Fig. 7 AC impedance of LiNi0.25Mn0.75O2.25 and equivalent circuit model
3 结论
1) 采用共沉淀法制备Ni0.25Mn0.75(OH)2,并以Ni0.25Mn0.75(OH)2为前驱体,在不同温度下烧结制备复合固溶体正极材料LiNi0.25Mn0.75O2.25。LiNi0.25Mn0.75O2.25由Li1.5Ni0.25Mn0.75O2.5和LiNi0.5Mn1.5O4复合组成,同时具有层状和尖晶石型 结构。
2) 随着温度的升高,LiNi0.25Mn0.75O2.25样品的首次放电容量、库仑效率、循环性能以及倍率性能都是先增加后降低。800 ℃下制备的样品表现出最好的电化学性能,首次放电比容量达到250 mA·h/g,首次库仑效率达到90.9%。10C放电时仍能保持在69 mA·h/g,50次循环容量保持率为95.9%。
3) 800 ℃下制备的样品LiNi0.25Mn0.75O2.25具有最小的电荷转移阻抗。较小的电荷转移阻抗是800 ℃下制备的样品LiNi0.25Mn0.75O2.25具有最佳循环性能和倍率的重要原因。
参考文献:
[1] Goodenough J B, Kim Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587-603.
[2] YUE Hongjun, HUANG Xingkang, LU Dongping, et al. Hydrothermal synthesis of LiMn2O4/C composite as acathode for rechargeable lithium-ion battery with excellent rate capacity[J]. Electrochimica Acta, 2009, 54(23): 5363-5367.
[3] Taniguchi L. Powder properties of partially substituted LiMxMn2-xO4(M=Al, Cr, Fe and Co) synthesized by ultrasonies pray pyrolysis[J]. Materials Chemistry and Physics, 2005, 92(1): 172-175.
[4] LI Xiangqun, WANG Zhixing, LIANG Rufu. Electrochemical properties of high-power lithium ion batteries made from modified spinel LiMn2O4[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(6): 1494-1498.
[5] Armstrong A R, Holzapfei M, Nova’k P, et al. Demonstrating oxygen loss and associated structural reorganization in the lithium battery cathode[J]. Journal of the American Chemical Society, 2006, 128: 8694-8698.
[6] Jung Y S, Cavanagh A S, Yan Yanfa, et al. Effects of atomic layer deposition of Al2O3 on the Li[Li0.20Mn0.54Ni0.13Co0.13]O2 cathode for lithium-ion batteries[J]. Journal of the Electrochemical Society, 2011, 158(12): A1298-A1302.
[7] LIU Yunjian, LIU Sanbing, Wang Yaping, et al. Effect of MnO2 modification on electrochemical performance of LiNi0.2Li0.2Mn0.6O2 layered solid solution cathode[J]. Journal of Power Sources, 2013, 222: 455-460.
[8] 刘云建, 王亚平, 刘三兵, 等. LiNi0.2Li0.2Mn0.6O2 正极材料的合成与碳包覆[J]. 中南大学学报(自然科学版), 2013, 44(2): 482-486.
LIU Yunjian, WANG Yaping, LIU Sanbing, et al. Synthesized and carbon-coating of LiNi0.2Li0.2Mb0.6O2 cathodes[J]. Journal of Central South University (Science and Technology), 2013, 44(2): 482-486.
[9] Shi S J, Tu J P, Tang Y Y, et al. Enhanced cycling stability of Li[Li0.2Mn0.54Ni0.13Co0.13]O2 by surface modification of MgO with melting impregnation method[J]. Electrochimica Acta,2013, 88: 671-679.
[10] Li G R, Feng X, Ding Y, et al. AlF3-coated Li(Li0.17Ni0.25Mn0.58)O2 as cathode material for Li-ion batteries[J]. Electrochimica Acta, 2012, 78: 308-315.
[11] Wu Y, Manthiram A. High Capacity, Surface-modified layered Li[Li(1-x)/3Mn(2-x)/3Cox/3]O2 cathodes with low irreversible capacity Loss[J]. Electrochemica and Solid-State Letter, 2006, 9(5): A221-A224.
[12] Park S H, Kang S H, Johnson C S, et al. Lithium–manganese–nickel-oxide electrodes with integrated layered-spinel structures for lithium batteries[J]. Electrochemisty Communications, 2007, 9(2): 262-268.
[13] Lu Z H, Chen Z H, Dahn J R. Lack of cation clustering in Li[NixLi1/3-2x/3Mn2/3-x/3]O2 (0≤x≤1/2) and Li[CrxLi(1-x)/3Mn(2-2x)/3]O2 (0<x<1) [J]. Chemistry of Materials, 2003, 15(16): 3214-3220.
[14] Lee E S, Huq A, Chang H Y, et al. High-voltage, high-energy layered-spinel composite cathodes with superior cycle life for lithium-ion batteries[J]. Chemistry of Materials, 2013, 24(2): 600-612.
[15] ZHENG Jianming, WU Xuebin, YANG Yong. A comparison of preparation method on the electrochemical performance of cathode material Li[Li0.2Mn0.54Ni0.13Co0.13]O2 for lithium ion battery[J]. Electrochimica Acta, 2011, 56 (8): 3071-3078.
[16] SONG Bohang, LIU Zongwen, LAI Manon et al. Structural evolution and the capacity fade mechanism upon long-term cycling in Li-rich cathode material[J]. Physical Chemistry Chemical Physics, 2012, 14: 12875-12883.
(编辑 赵俊)
收稿日期:2014-08-13;修回日期:2014-11-26
基金项目(Foundation item):国家自然科学基金资助项目(51304081);中国博士后科学基金资助项目(2012M51121)(Project (51304081) supported by the National Natural Science Foundation of China; Project (2012M51121) supported by the National Science Foundation of Post-doctoral Scientists of China)
通信作者:刘云建,博士,副教授,从事新能源材料及电化学研究;E-mail:lyjian122331@163.com