DOI:10.19476/j.ysxb.1004.0609.2019.08.17
废铜包铁针NH3-(NH4)2SO4-H2N(CH2)2NH2 体系隔膜电解回收铜
杨建广,李树超,李陵晨,闫万鹏,丁 龙,南天翔
(中南大学 冶金与环境学院,长沙 410083)
摘 要:以电子加工行业产出的废铜包铁针为阳极,以不锈钢板为阴极,采用单因素试验法优化NH3-(NH4)2SO4-H2N(CH2)2NH2体系隔膜电解回收铜工艺。结果表明:在阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L、Cu(Ⅱ) 30 g/L、乙二胺0.4 mol/L以及阴极电流密度为350 A/m2的条件下隔膜电解12 h后,在阴极可以得到表面光滑平整的阴极铜板,阴极铜纯度99.95%。由于部分阳极铜以+1价溶解于电解液中,使得实际隔膜电解回收废铜包铁针时阴极电流效率达到106%(以+2价铜电化当量计算),而阳极电流效率则为126%,脱铜后得到的铁针品位为99.3%。
关键词:氨性体系;废杂铜处理;隔膜电解;电流效率;溶液循环
文章编号:1004-0609(2019)-08-1721-12 中图分类号:TF811 文献标志码:A
近年来,电子及通讯、汽车、电线电缆等行业发展迅猛,生产过程中产生的镀铜边角废料日益增多。其中,铜包铁针是电子元器件管脚剪切加工行业中一种常见的镀铜废料,每年产生量多达40~50万t。废铜包铁针一般含铜4.0%~6.5%(质量分数)、铁93.5%~ 96.0%(质量分数)。实现其清洁高效回收利用具有可观的经济效益和显著的社会效益[1-2]。
由于此类废铜包铁针铜含量低、铁含量高,难以作为炼铜原料配入现行铜火法冶炼系统回收铜。而若采用现有的酸法路线,则大量的铁将被酸溶解进入溶液,给后续溶液除杂带来负担[3-6]。综合考虑,利用氨可与铜可形成稳定的铜-氨络合物且铁不被溶解的特点[7],采用氨性体系处理该类铜包铁废料应该是合理的选择。
目前,采用的氨性体系回收铜的工艺,如Aribiter工艺[8]等,通常包括浸出-萃取-电积3部分。即首先采用NH3-(NH4)2SO4-H2O/NH3-NH4Cl-H2O等氨性溶液浸出含铜物料得到铜-氨络合物溶液,再采用萃取-反萃技术将铜-氨络合物溶液转为硫酸铜溶液后,通过电积得到阴极铜。但由于现有的碱性萃铜剂存在萃取效率低、反萃后电解液中(NH4)2SO4积累影响铜的回收效率等问题,目前未获得大规模推广应用[9]。
近年来,从氨性体系浸出液直接电沉积铜的研究得到了广泛关注。例如,刘维[10]在处理汤丹低品位氧化铜矿时,探索了从氨性浸出液中直接电积铜的可行性实验。但实验发现由于浸出液中铜浓度过低,阴极产物为海绵铜,阴极电流效率低于80%;于霞等[11]采用氨-硫酸铵体系处理铜精矿焙砂,浸出液直接电积以得到阴极铜,电流效率最高为85%左右;OISHI等[12-16]采用“浸出-净化-电积”流程回收电子废弃物中的铜。首先采用二价铜氨溶液浸出原料得到一价铜氨溶液,之后经萃取除去其中锌等杂质组分,最后经隔膜电积得到阴极铜。但实验发现,萃取阶段约有10%铜(质量分数)损失,且一价铜的配合物Cu(NH3)2+不稳定,需向电解液中充氮气以防止Cu(Ⅰ)氧化为Cu(Ⅱ)。
本文作者课题组开发出一种基于氨性体系隔膜电解处理废铜包铁针的新工艺[10-14]。已开展的试验结果表明,采用NH3-(NH4)2SO4-H2N(CH2)2NH2体系隔膜电解废铜包铁针,可一步回收其中的铜,且阴极电流效率达到97%以上,阴极铜品位99.9%。退铜后得到的铁芯铁含量大于99%,可以作为炼铁原料搭配入炉。该工艺具有流程短、能耗低、无废水排放的优点。本研究主要介绍废铜包铁针氨性隔膜电解工艺条件优化过程,为研究同行提供相关的参考。
1 实验
1.1 实验原料
本实验所用原料废铜包铁针实物图如图1所示,由于堆放时间较长,其表面已有少量的铜锈等。该原料主要金属成分含量分析如表1所列。

图1 实验所用废铜包铁针光学照片
Fig. 1 Scrap copper coated iron needle used in experiments
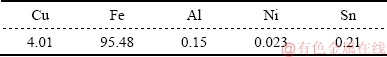
表1 废铜包铁针的主要金属成分含量
Table 1 main metals contents in scrap copper coated iron needle (mass fraction, %)
1.2 工艺流程
将一定量的废铜包铁针放入钛篮中为阳极,以不锈钢板为阴极,在NH3-(NH4)2SO4-H2N(CH2)2NH2-H2O电解液体系中隔膜电解回收铜。电解时,阳极液由蠕动泵运输至阴极室,阴极液溢流至阳极室,构成电解液的循环回路。阳极框内的原料经电加强溶解作用以铜离子形式溶出,循环至阴极表面经放电得到电沉积铜;中间安置阴离子交换膜以阻碍一价铜离子的循环放电副反应。装置示意图如图2所示。
1.3 实验方法及计算公式
1.3.1 实验方法
废铜包铁针NH3-(NH4)2SO4-H2N(CH2)2NH2-H2O体系隔膜电解回收铜实验在如图2所示的隔膜电解槽中进行。阴、阳极室的尺寸分别为9 cm×10 cm×10 cm、6 cm×10 cm×10 cm。实验所用阴极液与阳极液之体积比为3:2。阴极为钛板,尺寸为7 cm×10 cm,其中工作面积为7 cm×5cm,剩余部分用胶带覆盖以防止铜在多余部分沉积;每次试验时将定量的废铜包铁针放入钛篮中为阳极,钛篮中心与阴极板间距离保持在7 cm。

图2 NH3-(NH4)2SO4-H2N(CH2)2NH2-H2O体系隔膜电解回收铜工艺流程示意图
Fig. 2 Schematic diagram of copper recoveryvia membrane electrolysis in NH3-(NH4)2SO4-H2N(CH2)2NH2-H2O system
实验时将阴、阳极电解液分别倒入隔膜电解槽的阴极室和阳极室,放置好阴、阳极后开始隔膜电解。条件优化实验电解时间为8 h,综合条件电解时间为12 h。实验结束后,将阴极板与阳极产物表面用蒸馏水冲洗干净,在干燥箱中干燥30 min。称取质量并记录阴极铜板的形貌,分析其化学成分,随后分别计算阴、阳极实验前后的质量差,并据此计算阴、阳极电流效率。
1.3.2 计算公式
阴、阳极电流效率计算公式如下所示:
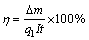 (1)
(1)
其中:△m为隔膜电解前后阴、阳极板的质量差,g;q1为Cu(Ⅱ)的电化学当量,1.186 g/(A·h);I为通过阴阳极板的电流,A;t为隔膜电解时间,h。
2 结果与讨论
2.1 条件优化实验
2.1.1 乙二胺浓度对隔膜电解过程的影响
在温度40 ℃,电流密度300 A/m2,阴极室磁力搅拌速率200 r/min,阴极液组成为NH3·H2O 2 mol/L,(NH4)2SO4 1 mol/L,Cu(Ⅱ)浓度 30 g/L的条件下,改变电解液中乙二胺的摩尔浓度分别为0.2、0.3、0.4、0.5、0.6 mol/L,研究乙二胺浓度对废铜包铁针隔膜电解电流效率及阴极铜形貌的影响规律,其结果如图3所示。图4所示为不同乙二胺浓度下阴极铜的光学图像。
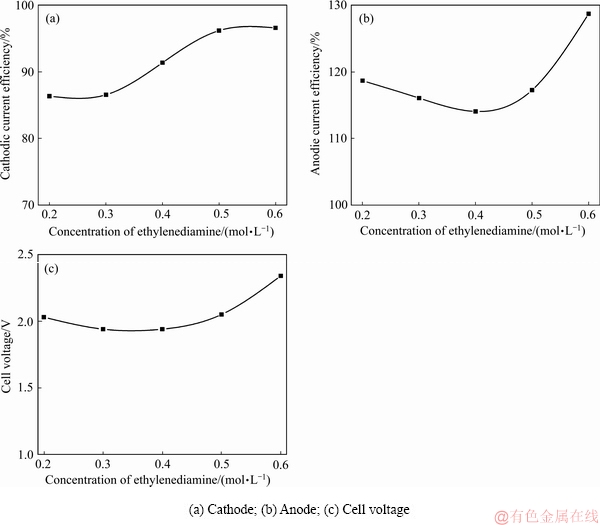
图3 乙二胺浓度对隔膜电解阴、阳极电流效率及槽压的影响
Fig. 3 Effect of ethylenediamine concentration on membrane electrolytic current efficiency and cell voltage

图4 不同乙二胺浓度下的阴极铜的形貌
Fig. 4 Optical morphologies of copper deposit at different ethylenediamine concentrations
实验发现,随着乙二胺浓度由0.2 mol/L增加至0.5 mol/L,阴极电流效率由86.35%迅速升高至96.18%;随着乙二胺浓度继续增大,阴极电流效率则逐渐趋于稳定(见图3(a));而在本研究所述的参数范围内,阳极电溶效率均超过100%,这是由于阳极铜溶解产生的Cu(Ⅱ)可与铜板发生反应生成Cu(Ⅰ),其反应式为Cu(Ⅱ)+Cu(s)=2Cu(Ⅰ)。阳极液中的Cu(Ⅰ)在溶解[O]或阳极氧化作用下被再次氧化为Cu(Ⅱ),新生成的Cu(Ⅱ)促进了上述反应的正向进行。此外,随着乙二胺浓度的增加,槽电压也随之升高,但升高的幅度不大。其原因主要是随着电解液中乙二胺浓度的增加,溶液中Cu(en)i2+浓度升高,而Cu(en)i2+的扩散速率相对较慢,相应电解时槽压也略升高。由不同乙二胺浓度下阴极铜的形貌可知(见图4),当电解液中乙二胺浓度为0.3 mol/L时,电解得到的阴极铜表面光滑平整;随着乙二胺浓度的增加,阴极铜片表面变得粗糙且附着有少量颗粒物。综合考虑,本研究选择乙二胺浓度为0.4 mol/L作为最佳条件进行后续优化实验。
2.1.2 氨水浓度对隔膜电解过程的影响
在温度40 ℃、电流密度300 A/m2、阴极室磁力搅拌速率200 r/min,阴极液组成为 (NH4)2SO4 1 mol/L,Cu(Ⅱ)浓度 30 g/L,乙二胺0.4 mol/L的条件下,改变电解液中氨水的摩尔浓度分别为2.5、3.0、3.5、4.0、4.5 mol/L,研究氨水浓度对废铜包铁针隔膜电解工艺的影响规律,结果如图5所示。图6所示为不同氨水浓度下电解得到的阴极铜板光学照片。
由图5(a)可知,阴极电流效率随电解液中氨水浓度的变化呈现出不同的变化规律。随着氨水浓度由2.0 mol/L增加至3.0 mol/L,阴极电流效率由91.57%降低至78.92%;当氨水浓度继续增加至4.5 mol/L时,阴极电流效率升高至96.18%。由图6可知,随着氨水浓度增加至4.5 mol/L,阴极铜片表面变得平整、致密,出现金属光泽且表面不规则沉积物减少。而随着氨水浓度的增加,阳极电流效率呈上升趋势(见图5(b))。原因主要为溶液中铜离子的主要配体为游离氨,随着氨水浓度增加,溶液的铜溶解能力相应增加。
前期进行的Cu(II)-NH3-(NH4)2SO4-H2N(CH2)2NH2体系热力学计算发现,随着氨水浓度的增加,溶液中Cu(NH3)i2+的占比呈上升趋势,而Cu[H2N(CH2)2- NH2]j2+的占比则呈下降趋势。由此推测电解液中氨水浓度在2.0~3.0 mol/L范围内时,阴极表面的主要放电离子为Cu[H2N(CH2)2NH2]j2+,而随着氨水浓度增加,阴极表面的主要放电离子转变为Cu(NH3)i2+。
图7所示为两种不同组成的电解液经电积得到的阴极铜的扫描电镜图像。[H2N(CH2)2NH2]/[NH3]较高的电解液a中主要铜配合物为Cu[H2N(CH2)2NH2]j2+,而[H2N- (CH2)2NH2]/[NH3]较低的电解液b中为Cu(NH3)i2+。由图7可知,以Cu[H2N(CH2)2NH2]j2+为主的电解液a经电积得到的阴极铜表面为较大粗糙颗粒物,而以Cu(NH3)i2+为主的电解液经电积得到的阴极铜表面则为光滑的球状颗粒物。这是由于Cu(NH3)i2+的空间位阻小于Cu[H2N(CH2)2NH2]j2+,因而,Cu(NH3)i2+具有相对更好的扩散性能,因此,以Cu(NH3)i2+的电解液经电积可得到较光滑的阴极产物。综合考虑,本研究中选取氨水为4.5 mol/L作为最佳条件进行后续优化实验。

图5 氨水浓度对隔膜电解阴、阳极电流效率及槽压的影响规律
Fig. 5 influence of ammonia concentration on current efficiency and cell voltage

图6 不同氨水浓度下的阴极铜形貌
Fig. 6 Morphologies of copper deposit at different ammonia concentrations

图7 不同组成的电解液经电积得到的SEM像
Fig. 7 SEM images of copper deposits by electrowinning from electrolytes with different compositions
2.1.3 搅拌速率对隔膜电解过程的影响
在温度40 ℃,电流密度300 A/m2,阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L,Cu(Ⅱ)浓度 30 g/L、乙二胺0.4 mol/L的条件下,改变阴极室磁力搅拌速率分别为0、100、200、300、400 r/min,研究阴极室磁力搅拌速率对废铜包铁针隔膜电解工艺的影响,其结果如图8所示。
图9所示为不同搅拌速率下电解得到的阴极铜光学照片。实验结果表明,阴极室磁力搅拌速率在较低范围(0~200 r/min)内变化时,阴极电流效率由95.98%
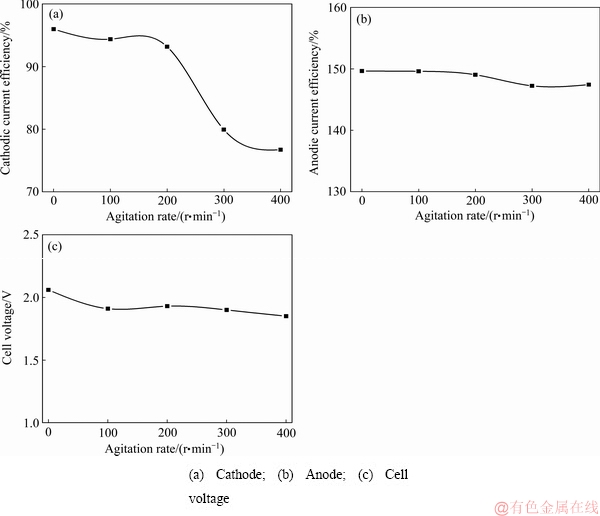
图8 磁力搅拌速率对隔膜电解阴、阳极电流效率及槽压的影响
Fig. 8 influence of agitation rate on current efficiency and cell voltage
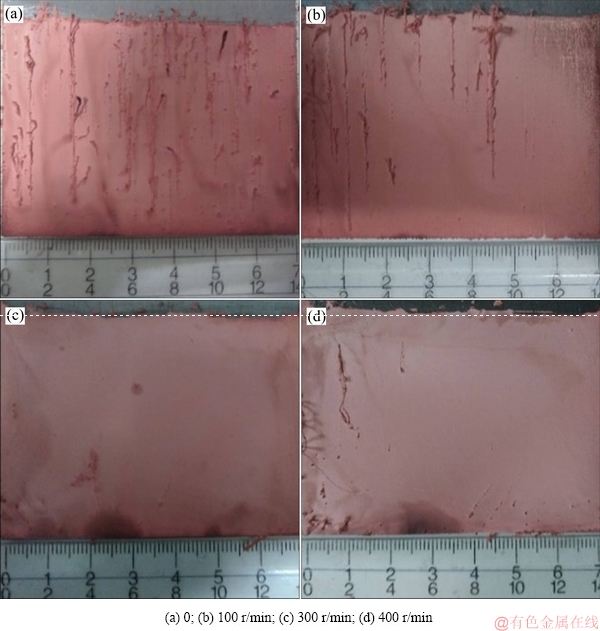
图9 不同搅拌速率下阴极铜的形貌
Fig. 9 Morphologies of copper deposit at different agitation rate
缓慢降低至93.17%;而搅拌速率增加至400 r/min时,阴极电流效率迅速降低至76.71%(见图8(a))。观察不同搅拌速率下阴极铜的形貌可知(见图9),当电解未加搅拌时,阴极产物表面存在条状沉积物;且随着搅拌速率逐渐增加,阴极铜表面条状沉积物逐渐减少。其原因主要为,随着搅拌速度增加,阴极表面的Cu(Ⅱ)浓度分布趋于均匀,有利于产出表面均匀平整的阴极铜。由图8(b)可知,阴极室磁力搅拌速率在0~400 r/min范围内改变时,阳极电流效率几乎没有明显变化。考虑到阴、阳极液间的循环方式(见图2)及能耗成本,本研究选择阴极室搅拌速率为200 r/min为最佳搅拌速度,而阳极室则无需施加额外搅拌。
2.1.4 阴极电流密度对隔膜电解过程的影响
在温度40 ℃,阴极室磁力搅拌速率200 r/min,阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L、Cu(Ⅱ)浓度 30 g/L、乙二胺0.4 mol/L的条件下,改变阴极电流密度分别为200、250、300、350、400 A/m2,研究阴极电流密度对隔膜电解工艺的影响规律,试验结果如图10所示。图11所示为不同阴极电流密度下阴极铜板的光学图像及SEM像。
由图10(a)可知,随着阴极电流密度从200 A/m2增加至250 A/m2,阴极电流效率从88%增加至96%左右。当电流密度继续增加,电流效率无明显变化,稳定在96%~97%,而槽压则由1.5 V缓慢升高至2.5 V左右。由图11阴极铜的形貌可知,电流密度分别为200、250A/m2时得到的阴极铜片表面有不规则沉积物;而电流密度为350 A/m2时,阴极铜的形貌较好,表面致密、平整且有金属光泽。由图11阴极铜的SEM像可知,随着阴极电流密度逐渐增加至350 A/m2,阴极铜表面颗粒物的直径逐渐增大;电流密度达到400 A/m2时,阴极表面颗粒物趋于消失。原因分析为,随着阴极电流密度的增加,阴极表面铜晶核的长大速率变快,倾向于形成晶核较大的晶粒。综合考虑,本研究选择阴极电流密度为350 A/m2作为最佳条件进行后续优化实验。
2.1.5 Cu(Ⅱ)浓度对隔膜电解过程的影响
在温度40 ℃,阴极室磁力搅拌速率200 r/min,阴极电流密度350 A/m2,阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L、乙二胺0.4 mol/L的条件下,分别改变阴极液中Cu(Ⅱ)浓度为20、30、40、50、60 g/L,研究Cu(Ⅱ)浓度对隔膜电解工艺的影响规律,结果如图12所示。图13所示为不同Cu(Ⅱ)浓度下阴极铜板的光学图像。
由图12(a)可知,废铜包铁针隔膜电解阴极电流效率随着阴极液中Cu(Ⅱ)浓度的增加,呈现先增加后又逐渐降低的规律。阴极电流效率在Cu(Ⅱ)为30 g/L时达到最大值,约96%左右。由图12(b)可知,随着阴极液中二价铜离子浓度的增加,阳极电流效率整体上呈增加趋势,槽压则随着Cu(II)浓度增加而略有降低。而由不同Cu(Ⅱ)浓度下的阴极铜的形貌(见图13)可知,在较高Cu(Ⅱ)浓度范围内,Cu(Ⅱ)浓度对隔膜电解阴极铜表面形貌影响不大,只是随着Cu(Ⅱ)浓度的增加,阴极铜表面不规则析出物减少,且Cu(Ⅱ)浓度更高时,阴极铜更为致密。当阴极液中二价铜离子浓度为50 g/L时,阴极铜板光滑致密,无不规则沉积物附着。综合考虑,本研究选择阴极液中二价铜离子浓度为30 g/L为最佳条件。
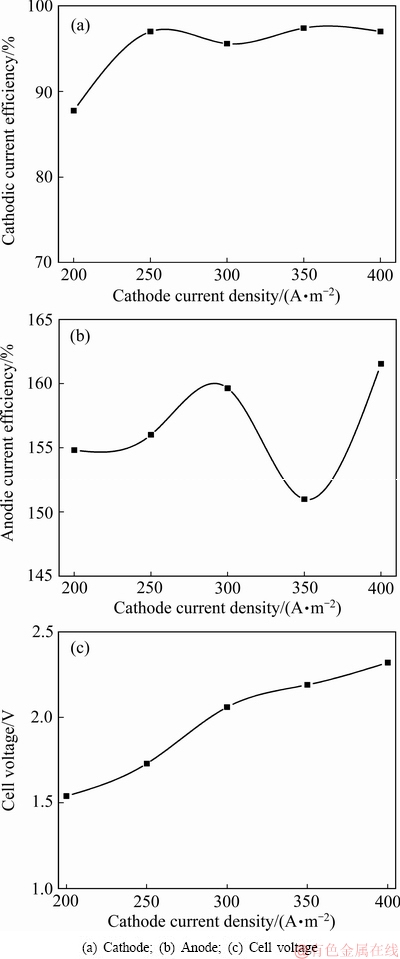
图10 阴极电流密度对隔膜电解阴、阳极电流效率及槽压的影响规律
Fig. 10 influence of cathode current density on current efficiency and cell voltage

图11 不同阴极电流密度下阴极铜的形貌及其扫描电镜图
Fig. 11 Morphologies((a)-(d)) and SEM images((a′)-(d′)) of copper deposits at different cathode current densities

图12 Cu(Ⅱ)浓度对废铜包铁针隔膜电解阴、阳极电流效率及槽压的影响规律
Fig. 12 influence of Cu(Ⅱ) concentration on current efficiency

图13 不同Cu(Ⅱ)浓度下的阴极铜的形貌
Fig. 13 Morphologies of copper deposit at different Cu(Ⅱ) concentrations
2.2 隔膜电解综合条件实验
通过上述条件优化试验,得到了废铜包铁针NH3-(NH4)2SO4-H2N(CH2)2NH2体系隔膜电解回收铜工艺的最佳工艺条件:温度40 ℃,阴极电流密度350 A/m2,阴极室磁力搅拌速率200 r/min,阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L、Cu(Ⅱ)浓度 30 g/L、乙二胺0.4 mol/L。在此优化条件下进行综合条件实验。连续隔膜电解12 h后,所得阴极铜板形貌及XRD谱如图14所示。图15所示为褪除铜之后的铁针光学照片。经分析表明,其中铁含量为99.3%(见表2)。
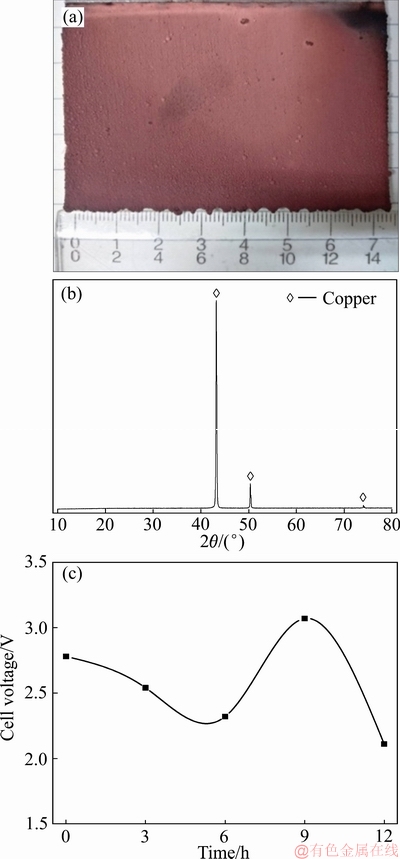
图14 废铜包铁针隔膜电解综合条件实验所得阴极铜片形貌、XRD谱及槽压变化规律
Fig.14 Morphologies of copper deposit(a), XRD pattern of Cu(b) and cell voltage variation of comprehensive condition experiment(c)

图15 隔膜电解12 h后阳极框中脱铜后的铁针
Fig. 15 Iron needle after copper removal in anode frame after 12 h of diaphragm electrolysis
表2 隔膜电解后阳极框中铁针的主要金属成分含量
Table 2 main metals contents of iron needle (mass fraction, %)

由图14可知,综合条件下连续隔膜电解12 h后可得到形貌较为平整的阴极铜。经分析,所得阴极铜的纯度为99.95%。阴极电流效率为106%,这是由于电解液中存在一定量的Cu(Ⅰ),使得阴极电流效率(以铜+2价计算电流效率)超过100%;阳极电流效率经计算为126%。由图14(c)可知,在废铜包铁针隔膜电解过程中槽电压出现一定的波动。这是因为废铜包铁针在表面有一些铜锈、铁锈等在隔膜电解时发生脱落,以及随着阳极电溶解的进行,废铜包铁针间的接触电阻发生一定的变化,因而槽压也随之波动。
3 结论
1) 采用NH3-(NH4)2SO4-H2N(CH2)2NH2体系隔膜电解处理废铜包铁针,可一步实现该物料中铜、铁的分离并高效回收其中的铜。
2) NH3-(NH4)2SO4-H2N(CH2)2NH2体系隔膜电解处理废铜包铁针的优化工艺条件为:阴极电流密度350 A/m2,阴极室磁力搅拌速率200 r/min,阴极液组成为NH3·H2O 4.5 mol/L、(NH4)2SO4 1 mol/L、Cu(Ⅱ)浓度 30 g/L、乙二胺0.4 mol/L。在此工艺条件下隔膜电解废铜包铁针12 h,可以得到表面光滑致密的阴极铜板及纯度为99.3%的铁针,由于溶液中部分Cu(I)的存在,使得以Cu(II)的电化当量计算得到的阴极电流效率为106%,阳极电流效率为126%。
3) 增加乙二胺浓度、阴极电流密度对提高阴极电流效率有明显的促进作用。随着阴极电流密度增加,阴极铜表面晶粒直径逐渐增大并趋于平整。电解液中铜浓度过高或过低时阴极电流效率均有所下降。
4) 随着氨水等配体浓度的增加,阴极表面放电离子由Cu[H2N(CH2)2NH2]j2+转变为Cu(NH3)i2+,且分别以该两种铜络合物为主的电解液经电积得到的阴极铜板的形貌存在明显不同。
REFERENCES
[1] 胡长平. 调结构促转型增效益我国铜铅锌产业供给侧结构性改革成效显著[J]. 有色冶金节能, 2017(6): 59-62.
HU Chang-ping. Adjusting structure, promoting transformation, increasing efficiency, China’s copper, lead and zinc industry supply side structural reforms have achieved remarkable results [J]. Energy Saving of Non-Ferrous Metallurgy, 2017(6): 59-62.
[2] 王赤卫. 中国铜工业发展的机遇与挑战[J]. 有色金属工程, 2013(6): 5-6.
WANG Chi-wei. Opportunities and challenges for the development of China’s copper industry[J]. Nonferrous Metals, 2013(6): 5-6.
[3] HE Wen-zhi, LI Guang-ming, MA Xing-fa, WANG Hua, HUANG Ju-wen, XU Min, HUANG Chun-jie. WEEE recovery strategies and the WEEE treatment status in China[J]. Hazard Material, 2006, 136: 502-512.
[4] KANG H Y, SCHOENUNG J M. Electronic waste recycling: A review of U.S. infrastructure and technology options[J]. Resources, Conservation and Recycling, 2005, 45(4): 368-400.
[5] KIDDEE P, NAIDU R, WONG M H. Electronic waste management approaches: An overview[J]. Waste Manag, 2013, 33(5): 1237-1250.
[6] LU Yan, XU Zhen-ming. Precious metals recovery from waste printed circuit boards: A review for current status and perspective[J]. Resources, Conservation and Recycling, 2016, 113: 28-39.
[7] RADMEHR V, KOLEINI S M J, KHALESI M R, MOHAMMADI M R T. Ammonia leaching: A new approach of copper industry in hydrometallurgical processes[J]. Journal of The Institution of Engineers (India): Series D, 2013, 94(2): 95-104.
[8] PAYNTER J C. A review of copper hydrometallurgy[J]. Journal of the South African Institute of Mining and Metallurgy, 1973, 74(4): 158-172.
[9] SCHLESINGER M E, KING M J, SOLE K C. Extractive metallurgy of copper[M]. Amsterdam: Elsevier, 2011.
[10] 刘 维. MACA体系中处理低品位氧化铜矿的基础理论和工艺研究[D]. 长沙: 中南大学, 2010.
LIU Wei. Theoretical and technological study on treating low grade copper oxide ore in the system of MACA[D]. Changsha: Central South University, 2010.
[11] 于 霞, 甘雪萍, 杨声海, 唐谟堂. Cu(Ⅱ)-NH3- (NH4)2SO4-H2O体系浸出-电积生产铜的工艺研究[J]. 湖南有色金属, 2001(6): 18-20, 48.
YU Xia, GAN Xue-ping, YANG Sheng-hai, TANG Mo-tang. The study on leaching-electrodeposition in NH3-(NH4)2SO4- H2O system[J]. Hunan Nonferrous Metals, 2001(6): 18-20, 48.
[12] ALAM M S, TANAKA M, KOYAMA K,OISHI T, LEE J C. Electrolyte purification in energy-saving monovalent copper electrowinning processes[J]. Hydrometallurgy, 2007, 87(1/2): 36-44.
[13] OISHI T, KOYAMA K, ALAM S, TANAKA M, LEE J C. Recovery of high purity copper cathode from printed circuit boards using ammoniacal sulfate or chloride solutions[J]. Hydrometallurgy, 2007, 89(1/2): 82-88.
[14] OISHI T, KOYAMA K, KONISHI H, TANAKA M, LEE J C. Influence of ammonium salt on electrowinning of copper from ammoniacal alkaline solutions[J]. Electrochimica Acta, 2007, 53(1): 127-132.
[15] OISHI T, YAGUCHI M, KOYAMA K, TANAKA M, LEE J C. Hydrometallurgical process for the recycling of copper using anodic oxidation of cuprous ammine complexes and flow-through electrolysis[J]. Electrochimica Acta, 2008, 53(5): 2585-2592.
[16] OISHI T, YAGUCHI M, KOYAMA K, TANAKA M, LEE J C. Effect of additives on monovalent copper electrodeposition in ammoniacal alkaline solutions[J]. Hydrometallurgy, 2013, 133: 58-63.
Copper recovery from scrap copper coated iron needle via membrane electrolysis in NH3-(NH4)2SO4-H2N(CH2)2NH2 system
YANG Jian-guang, LI Shu-chao, LI Ling-chen, YAN Wan-peng, DING Long, NAN Tian-xiang
(School of Metallurgy and Environmental, Central South University, Changsha 410083, China)
Abstract: Using scrap copper coated iron needle as anode and stainless steel plate as cathode,the membrane electrolytic recovery of copper from scrap copper coated iron needle viaNH3-(NH4)2SO4-H2N(CH2)2NH2 system was optimized by single factor test. The experimental results show that, when the catholyte composition is NH3·H2O 4.5 mol/L,(NH4)2SO4 1mol/L, Cu (Ⅱ) 30 g/L, ethylenediamine 0.4 mol/L, and the cathode current density is 350 A/m2, a smooth cathode copper plate can be obtained at the cathode for 12 h electrowinning, and the grade of resultant cathode copper is 99.95%. The cathode current efficiency is 106% (calculated at +2 valence copper electrification equivalent), while the anode current efficiency is 126%, because some anode copper dissolves in the electrolyte at +1 valence. The grade of iron needle obtained after copper removal is 99.3%.
Key words: ammoniacal system; copper scraps treatment; membrane electrowinning; current efficiency; effluent recycle
Foundation item: Project(51574294) supported by the National Natural Science Foundation of China
Received date: 2018-07-04; Accepted date: 2018-10-16
Corresponding author: YANG Jian-guang; Tel: +86-731-88830470; E-mail: jianguang_y@163.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51574294)
收稿日期:2018-07-04;修订日期:2018-10-16
通信作者:杨建广,教授,博士;电话:0731-88830470;E-mail:jianguang_y@163.com