基于微生物燃料电池技术的生物传感器及其应用进展
来源期刊:中南大学学报(自然科学版)2010年第6期
论文作者:蒋海明 李潇萍 罗生军 许晓晖 郭荣波
文章页码:2451 - 2458
关键词:微生物燃料电池;生物传感器;生化需氧量;毒性;微生物活性
Key words:microbial fuel cell; biosensors; biochemical oxygen demand; toxicity; microbial activity
摘 要:简要介绍微生物燃料电池型生物传感器的工作原理,概述各种基于微生物燃料电池技术开发的生物传感器及其应用领域。分析影响微生物燃料电池型生物传感器性能的因素,讨论提高传感器性能的方法,以期为研究和开发高性能的微生物燃料电池型生物传感器提供参考。
Abstract: The principle of biosensors based on microbial fuel cell(MFC) was briefly described, and the different types of MFC-based biosensors and their application were mainly summarized. Factors that constitute barriers to increase MFC-based biosensor performance were analyzed and solutions to improve the performance of MFC-based biosensors were also discussed. This review will help the development of high performance MFC-based biosensors.
蒋海明1, 2, 3,李潇萍1,罗生军1,许晓晖1,郭荣波1
(1. 中国科学院 青岛生物能源与过程研究所,山东 青岛,266101;
2. 山东大学 威海分校海洋学院,山东 威海,264209;
3. 中国科学院 研究生院,北京,100049)
摘 要:简要介绍微生物燃料电池型生物传感器的工作原理,概述各种基于微生物燃料电池技术开发的生物传感器及其应用领域。分析影响微生物燃料电池型生物传感器性能的因素,讨论提高传感器性能的方法,以期为研究和开发高性能的微生物燃料电池型生物传感器提供参考。
关键词:微生物燃料电池;生物传感器;生化需氧量;毒性;微生物活性
中图分类号:X835 文献标志码:A 文章编号:1672-7207(2010)06-2451-08
JIANG Hai-ming1, 2, 3, LI Xiao-ping1, LUO Sheng-jun1, XU Xiao-hui1, GUO Rong-bo1
(1. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China;
2. Weihai Marine College, Shandong University, Weihai 264209, China;
3. Graduate University, Chinese Academy of Sciences, Beijing 100049, China)
Abstract: The principle of biosensors based on microbial fuel cell(MFC) was briefly described, and the different types of MFC-based biosensors and their application were mainly summarized. Factors that constitute barriers to increase MFC-based biosensor performance were analyzed and solutions to improve the performance of MFC-based biosensors were also discussed. This review will help the development of high performance MFC-based biosensors.
Key words: microbial fuel cell; biosensors; biochemical oxygen demand; toxicity; microbial activity
微生物燃料电池(MFC)是以微生物为催化剂,将化学能直接转化为电能的装置[1-2]。利用微生物产电的最初构想是20世纪初由Potter教授提出的。Potter[3]利用大肠杆菌进行产电试验研究时观察到电流的产生,但这一工作并没有继续。直到Cohen[4]利用串联的微生物燃料电池获得了高达35 V的电压,从此,微生物燃料电池才被广泛地关注。早期的微生物燃料电池是用发酵型的酵母和细菌产电,但其机制并不清楚,初步认为是在微生物发酵过程中产生的还原产物与电极直接作用而产生电流。20世纪80年代后,由于电子传递中间体的广泛应用,微生物燃料电池的输出功率有了较大提高,但由于电子传递中间体对微生物的毒害性,因此,也制约了其发展。而20世纪90年代中期电化学活性细菌的发现是微生物燃料电池发展的里程碑。近年来,由于能源危机的出现及现代科学技术的发展,微生物燃料电池技术在世界范围内掀起了研究的热潮,并在电极微生物、电极材料、催化剂、电池结构及电子传递机理等方面的研究取得了重大进展。同时,微生物燃料电池技术在有机污水处理、产电、环境生物修复、野外电源及传感器等领域的应用研究呈逐年上升趋势,已有研究成果展示了微生物燃料电池技术在传感器领域的巨大应用潜力。自从Karube等[5]应用微生物燃料电池测定生化需氧量以来,微生物燃料电池作为传感器在分析领域的应用研究取得了很大的进展。本文作者对微生物燃料电池技术在传感器领域的应用进行概述,在分析影响微生物燃料电池性能的基础上,讨论提高微生物燃料电池型生物传感器性能的方法。
1 微生物燃料电池型生物传感器的原理
微生物燃料电池是以微生物为催化剂,将化学能转化为电能的装置。典型的微生物燃料电池由阳极室和阴极室构成,2个极室由质子交换膜(PEM)隔开,见图1[2]。阳极室保持厌氧环境,阴极室保持好氧环境,阴阳两极通过外电路连接。在阳极室中,微生物催化氧化有机物的过程中产生电子和质子。产生的电子直接或间接传递至阳极,然后经外电路传递至阴极。同时,质子经质子交换膜迁移至阴极,并与来自外电路的电子和阴极室的氧气反应生成水,并产生电流[6-7]。
许多研究表明:在一定条件下,微生物燃料电池的产电量或电流与阳极室添加的可代谢的底物的浓度或微生物数量成正比;此外,当有毒物质进入阳极室时,会导致微生物燃料电池产生的电流下降,而电流的下降程度与有毒物质的浓度存在一定的相关性。微生物燃料电池的这些性质可被用于构建不同类型的生物传感器。微生物燃料电池工作原理见图2[6]。
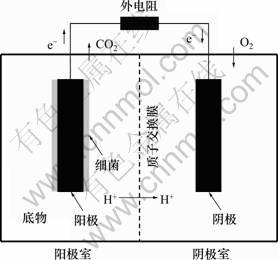
图1 微生物燃料电池结构示意图[2]
Fig.1 Schematic diagram of typical two-chamber microbial fuel cell
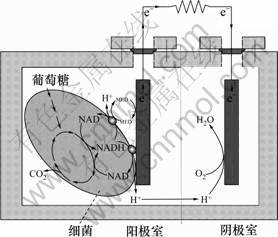
图2 微生物燃料电池工作原理
Fig.2 Working principle of microbial fuel cell
2 微生物燃料电池型生物传感器
2.1 生化需氧量传感器
生化需氧量(BOD)是水质监测的重要指标。现行标准主要采用BOD5测定法,此方法具有适用范围广和对设备要求低等优点。但是,该方法检测过程繁 琐、耗时长及重现性较差,同时不适合用于实时在线检测[8]。为克服传统BOD5测定法的不足,发展了许多BOD快速测定方法,其中微生物电极法目前使用最广泛。虽然微生物电极法可缩短测定时间,其响应信号与BOD之间也具有较好的相关性,但由于微生物膜的污染导致其稳定性较差,同时需要对溶氧电极进行周期性地清洗和替换,在一定程度上限制了微生物电极法的使用。对微生物燃料电池的研究发现:在一定条件下微生物燃料电池的产电量或电流与底物生化需氧量成正比,因而可被用于BOD快速检测。微生物燃料电池方法相对其他方法具有稳定性好和维护要求低等优点[9]。Karube等[5]用凝胶将产氢微生物丁酸梭菌(C. butyricum)固定于铂电极表面,构建了微生物燃料电池型BOD传感器,当生化需氧量<300 mg/L时,电池的稳态电流与生化需氧量成正比。Karube利用该传感器测定了屠宰场、食品厂和酒精厂废水中的BOD,与BOD5法测定结果的相对误差<10%。此后,利用电子传递中间体发展了各种微生物燃料电池型BOD生物传感器[10-13]。虽然在这些传感器中添加电子传递中间体可以增强电子传递,但由于电子传递中间体通常对微生物有毒害作用,因而使传感器难以保持长期稳定运行。同时,由于电子传递中间体流失,使得这些传感器也不能在线检测生化需氧量。近年来,人们从污水和活性淤泥中富集了腐败希瓦氏菌(S. putrefaciens)、铁还原红育菌(R. ferrireducens)及硫还原地杆菌(G. metallireducens)等电化学活性微生物,它们能将电子直接传递至阳极,可用于构建无介体微生物燃料电池。无介体微生物燃料电池有较强的稳定性,更适合作为BOD传感器。
Kim等[14]以污水为燃料,从厌氧活性淤泥中富集电化学活性微生物,并构建了无介体微生物燃料电池型BOD生物传感器,该传感器的产电量与生化需氧量在20~206 mg/L范围内具有很好的线性关系(相关系数R2=0.99)。当生化需氧量为206.4 mg/L时,电池的响应时间约为10 h。Chang等[15]利用活性淤泥富集电化学活性微生物,以富含葡萄糖和谷氨酸的人造废水为燃料,构建了微生物燃料电池型BOD传感器,并实现了对样品生化需氧量的连续检测。当进样流量为0.35 mL/min,且样品中生化需氧量为20~100 mg/L时,电池的输出电流与生化需氧量成正比,相对误差<10%。改变样品质量浓度,在60 min电流可重新达到稳定。Kim等[16]将设计的微生物燃料电池型BOD传感器应用于污水处理厂,以验证其原位、实时、在线检测能力。污水流经澄清池后进入电池阳极,电池的输出电流迅速升高,且产电量与污水生化需氧量成正比(R2=0.97)。传感器可长期保持高灵敏度和操作稳定性,样品测定时间为45 min。
上述大部分无介体微生物燃料电池型BOD传感器主要用于测定高生化需氧量废水,不适合测定低生化需氧量的废水。这是由于阴极反应效率低及阳极的微生物利用阴极扩散过来的氧进行好氧呼吸而消耗燃料的影响。Moon等[9]通过增强阴极反应和降低氧扩散,并富集贫营养微生物的无介体微生物燃料电池来测量BOD小于10 mg/L的样品。在连续操作下,该传感器的BOD的线性范围在2.0~10.0 mg/L之间,对BOD为2 mg/L的样品响应时间为60 min。Kang等[17]用富集了贫营养微生物的无介体微生物燃料电池型BOD传感器,甚至能检测到BOD为0.5 mg/L的样品。这些类型的传感器可用于在线检测地表水或二级出水的BOD。
虽然微生物燃料电池型BOD生物传感器的研究取得很大进展,也已经商品化(如韩国科学技术院研制的HABS-2000和HABS-2001),但仍需提高传感器的稳定性和灵敏度,并降低响应时间。
2.2 乳酸传感器
微生物燃料电池也可以用于检测其他能提供电子的化合物,如乳酸等。Kim等[18]利用腐败希瓦氏菌 (S. putrefaciens)构建了无介体微生物燃料电池,并将其作为检测乳酸的传感器。当乳酸浓度<30 mmol/L时,电流与乳酸浓度成正比;同时,电流的升高速率与乳酸浓度在2~25 mmol/L范围内成正比(R2=0.84)。Tront等[19]利用沙雷菌MR-1(S. oneidensis MR-1)构建了微生物燃料电池乳酸型传感器,当乳酸浓度为0~41 mmol/L时,电流与乳酸浓度成正比(R2=0.9)。由于微生物能代谢许多底物,因而无介体微生物燃料电池可以用来检测不同有机物浓度。例如,利用硫还原地杆菌(G. sulfurreducen)和丁酸梭菌(C. butyricure)构建的微生物燃料电池可以分别用来测定乙酸和甲酸浓 度[20-21]。
2.3 毒性检测传感器
微生物燃料电池可用于开发毒性检测传感器,一旦有毒物质进入电池的阳极,电化学活性微生物的代谢受到有毒物质的抑制,造成传递到阳极的电子减少,导致电池产生的电流骤减,而电流的降低程度与有毒物质的浓度存在一定的关系,据此可检测样品的毒性。Kim等[22]根据有毒物质浓度与电流骤减幅度之间的关系,利用微生物燃料电池构建了有毒物质检测系统。该检测系统能分别检测到0.04 mg/L Cr6+,0.03 mg/L Hg,0.04 mg/L Pb2+及0.04 mg/L苯。Kim等[23]利用微生物燃料电池构建了一个新的毒性检测系统,并用于现场、在线监控水中的有毒物质。当有毒物质如有机磷化合物、Pb及Hg和多氯化联(二)苯等进入到该系统后,电池的电流迅速下降。1 mg/L的这些有毒物质的抑制率分别达到61%,46%,28% 和38%。韩国生物工程系统公司开发的生物毒性监测系统HATOX-2000产品就是基于上述原理制成的。
由于电池电流的下降与有毒物质的浓度之间没有很好的定量关系,因而该类传感器不能用于定量分析有毒物质,但像传统的生物检测方法一样,可成功用于监控样品的综合毒性。此外,该传感器可用于有毒物质的原位、在线检测,并具有快速报警、长期稳定、操作简单等优点[23]。
2.4 微生物数量检测传感器
微生物数量测定是衡量食品、水质和环境污染程度的重要指标之一,对于快速初筛、现场取证及预警具有非常重要的作用。传统的微生物测定方法有平板计数法、显微镜直接观察法及干重法。这些方法除了需要熟练的操作技能和严格的操作规则外,都存在操作繁琐、测定时间长等缺点,且无法满足在线检测的需要。近年来,发展了许多微生物快速检测方法,如阻抗法[24]、放射法[25]及生物发光法[26]等,且有相应的产品上市。相对传统方法而言,这些方法检测微生物的时间显著缩短,但都存在着技术要求高、测量仪器复杂、设备和使用成本高及操作繁琐等不足,因而很难得到实际推广和普遍应用。此外,这些方法也不适合于在线和连续检测微生物数量。基于微生物燃料电池原理的微生物数量测定技术与上述检测方法相比,具有响应快、样品预处理要求低、设备简单、操作方便、制造与使用成本低等优点,适于现场与在线测定,因而引起了人们的广泛兴趣。Matsunaga等[27]利用微生物燃料电池连续测定发酵罐里的细胞数量。当微生物酿酒酵母(S. cerevisiae)的浓度低于4×109 个/mL时,电池电流与微生物浓度成正比。然而,该体系只适用于快速测定高浓度微生物数量。Nishikawa等[28]将微生物预先浓缩在滤膜上,并以2, 6-二氯酚靛酚为电子传递中间体,能在15 min 内测定废水中104~106 个/mL范围内低浓度的细菌数量。以劳氏紫为电子传递中间体,Patchett等[29]设计的传感器能在5 min内快速测定细菌的浓度,其检测下限为105 个/mL。卢智远等[30]研制了一种能快速测定奶乳制品中细菌含量的燃料电池型微生物传感器,该传感器能在10 min内检测出敞开鲜牛奶中滋生的细菌浓度,且测量结果与传统的平板计数法测得的结果相吻合。同时,传感器具有很宽的测量范围,其检测下限为103 个/mL,而检测上限为1012 个/mL。
微生物燃料电池提供了一种快速及连续测定微生物数量的方法。然而,这种方法的精确性受微生物生理条件的影响,这是因为微生物处于不同生长期,其代谢活性存在差异。此外,这种方法在测定混合微生物的数量方面,因为不同微生物的代谢机理和活性存在差异,因此,影响了测定的准确性,需要通过进一步研究提高其测定混合微生物数量的准确性。传感器存在的上述不足制约了该技术的进一步应用。
2.5 细菌活性检测传感器
微生物的代谢活性是所有微生物过程的关键因素,可以使用不同方法对其进行测定,如测定底物降解、氧的消耗、生成的产物及酶活性等[31]。微生物燃料电池也可用于测定微生物的活性。在微生物燃料电池体系中,微生物通过将电子转移给阳极进行呼吸,在其他条件一定的情况下,微生物燃料电池产生的电流与微生物的代谢活性直接相关,因此,电池产生的电流可用于直接、实时测定微生物的活性。Holtmann等[31]基于微生物燃料电池技术在线测定了大肠杆菌TG1(E. coli TG1)、酿酒酵母(S. cerevisiae)及荧光假单胞菌(P. fluorescens)等许多微生物的活性。Tront等[20]以乙酸为电子供体,利用微生物燃料电池现场监控硫还原地杆菌(G. sulfurreducens)的活性。Tront等[19]利用设计的微生物燃料电池型乳酸传感器现场监控生物修复过程中沙雷菌MR-1(S. oneidensis MR-1)代谢乳酸的呼吸速率。由于许多微生物可用作微生物燃料电池阳极的催化剂,因而微生物燃料电池可以用于测定许多微生物活性。
3 影响微生物燃料电池型生物传感器性能的因素
微生物燃料电池型生物传感器的性能主要取决于微生物燃料电池的性能,而电池的性能主要受一些物理、化学和生物化学的因素影响,如图3 所示[33]。主要包括以下几方面[6, 32-33]:(1) 微生物氧化底物的速率;(2) 电子从微生物传递到阳极的效率;(3) 外电阻;(4) 质子从阳极扩散到阴极的速度;(5) 阴极反应效率;(6) 阴极氧化剂扩散到阳极的影响;(7) 非理想的流体特性。在所有这些影响因素中,底物的转化效率、电子从微生物传递到阳极的效率、质子的迁移速度及阴极反应效率是最重要的影响因素。具体来说,电池的性能取决于微生物的性质、阳极电极的性质、阴极电极的性质、电池结构及操作条件。针对上述影响因素,可以通过提高微生物的活性,改善阳极电极的性能,增强阴极的反应效率,改进电池构造及优化操作条件等方法提高微生物燃料电池的性能,进而提高传感器的性能。

图3 限制微生物燃料电池性能的因素
Fig.3 Factors limiting performance of microbial fuel cell
4 提高微生物燃料电池型生物传感器性能的方法
4.1 提高微生物活性
许多微生物如脱硫弧菌(D. desulfuricans)、变形杆菌(P. vulgaris)、大肠杆菌(E. coli)、地杆菌属(Geobacter species)、腐败希瓦氏菌属(Shewanella species)及铁还原红育菌(R. ferrireducens)等[2]可用作微生物燃料电池的生物催化剂。海底沉积物、废水、淡水沉积物及活性污泥都是这些微生物的丰富来源。但是,地杆菌属、腐败希瓦氏菌属和铁还原红育菌应用最为广泛,因为它们能将电子直接传递到阳极。微生物会影响底物的转化速率和电子的传递效率。尽管微生物燃料电池可以用纯微生物接种作为催化剂,但是,在实际中混合微生物应用最多,这是因为它们代谢底物的范围广,且具有更好的催化性能。高活性的混合微生物可以从自然界中筛选获得,也可以通过生物技术改造获取。将微生物学和快速发展的基因工程方法结合起来,根据预定的目的控制或改变代谢途径,从而获得的一些“超级微生物”用于微生物燃料电池。因为微生物产电不是与其生存直接相关的自然选择压力,只是厌氧呼吸过程的延伸,所以,微生物的产电效率在自然条件下是很低的。对现有的产电微生物进行驯化改良是进一步提高产电微生物的产电效率的重要一步。其主要途径之一是对微生物进行基因工程改造,以增加与胞外电子传递有关的胞外蛋白酶或纳米导线的量,这样可以大大增强微生物与阳极之间电子的传递,提高电子传递率。
4.2 改善阳极电极性能
阳极电极的材料和结构会影响微生物的量、微生物的附着及电子传递,有时直接影响底物的氧化。碳基质导电材料(如碳纸、碳布及石墨毡)经常被用于阳极材料,因为它们具有较强的稳定性、较高导电性及较大表面积。具有较高比表面积的多孔性导电材料最适合用作阳极电极,因为这类材料可以固定更多的微生物,有利于提高底物的氧化速率。Chaudhuri等[34]用石墨毡和石墨泡沫代替石墨棒作为电池的阳极,结果增加了电能输出。用石墨毡做电极产生的电流是用石墨棒做电极产生电流的3倍,而用石墨泡沫产生电流密度是石墨棒的2.4倍,这说明增大电极比表面积可以增大吸附在电极表面的微生物,从而增大电能输出。利用金属、金属氧化物、电子媒介体或导电聚合物对电极进行修饰,可以提高电极的性能。Park等[35]将电子媒介体(Mn4+或中性红)掺入到石墨阳极里,使电流增大了10倍。Schr?der等[36]用导电聚合物聚苯胺修饰载铂阳极后,电池的电流密度增加了1倍,这是因为聚苯胺既保护了铂催化剂的活性,同时也起到了电化学催化作用。最近,Adachi等[37]利用聚乙烯亚胺对石墨毡表面进行修饰,然后键合上电子传递中间体9, 10-anthraquinone-2, 6-disulfate,以G. sulfurreducens为接种微生物,电流密度达到1.2 A/m2。电流密度的增加是由于固定的电子传递中间体9, 10-anthraquinone-2, 6-disulfate 增强了电子的传递。此外,用氨气对碳布阳极进行处理后,也提高了电极的性能,这是因为氨气处理后增加了电极表面电荷[38]。
4.3 增强阴极反应效率
阴极的还原反应往往是影响电池性能的限制因素。阴极反应效率取决于氧化剂的种类和浓度、质子的获取、催化剂性能、电极结构及操作条件。许多不同的方法被用于改善阴极性能,如用催化剂对电极进行修饰,利用氧化还原电势高的氧化剂或采用过电势较低的氧化剂及优化操作条件等。
氧因为具有高氧化还原电势,从而是微生物燃料电池中应用最为广泛的阴极电子受体。当使用普通的碳电极或石墨电极时,阴极反应的效率比较低,因此,有必要用催化剂对电极表面进行修饰。Pham等[39]报道用铂修饰阴极电极后,其电流比电极未修饰时的电流高3~4倍。因为载铂电极更容易与氧结合,催化氧气参与电极反应,同时可以减小氧气向阳极的扩散,因而能提高电池性能。尽管有许多关于催化剂的报道,如PbO2[40]、铁螯合物[41]及钴螯合物[41-42]等,铂催化剂仍是最为广泛应用的催化剂,因为它的催化性能好及稳定性强。
增加电极表面积可以为阴极反应提供更多的反应位点,从而提高了阴极反应速率,进而可以增加电池的能量输出。Sangeun等[43]使用表面镀铂的石墨电极做阴极,当阴极表面积从22.5 cm2增大到67.5 cm2时,电能输出增大了24%;而当表面积减小至5.8 cm2时,电能减小了56%。因此,具有较大比表面积的石墨毡、碳布、碳纸及石墨颗粒,尤其是石墨毡和碳布经常被用作微生物燃料电池型传感器的电极材料。
4.4 改进电池结构
MFC的结构对MFC的性能有很大的影响,它取决于MFC的内阻、氧的利用方式及流体特性等。高内阻是限制MFC能量输出的关键因素[44]。许多方法可以降低内阻,其中最有效的方法是减小电极间距离。Liu等[45]将两电极间距离由4 cm缩短到2 cm时,电池的能量输出提高了68%。Ringeisen等[46]利用1个阳极体积只有1.2 mL、横截面为2 cm2的微型MFC获得了3 W/m2的能量密度。这种微型电池电极间距小,降低了内阻,同时有利于质子扩散。此外,该微型电池具有很大的表面积与体积之比,大的表面积与体积之比减小了液体扩散到电极表面的平均距离,从而提高了阳极室内电荷运输效率。同时,小型MFC减小了水力停留时间,因而能缩短响应时间。Moon等[47]将电池阳极的体积由25 mL减小到5 mL,当溶液的BOD由50 mg/L降到100 mg/L时,传感器的响应时间则由原来的(36±2) min缩短到(5±1) min。
氧是微生物燃料电池中应用最为广泛的阴极电子受体。电池的能量输出与阴极电解质中的溶氧浓度成正比关系[32]。在室温下,氧在水中的溶解度很低(其饱和质量浓度<8 mg/L),当阴极反应消耗氧的速率超过氧的溶解速率时,水中氧的浓度会下降,最终会抑制阴极反应。在双室微生物燃料电池中这种现象经常发生。大部分微生物燃料电池型BOD生物传感器采用双室结构,但是,氧在水中低的溶解浓度严重影响了该类传感器的性能。除了搅拌和鼓空气外,可以使用空气阴极改善阴极氧的供应[48]。单室微生物燃料电池由于提高了阴极氧的供应,更适合作为BOD传感器。Lorenzo等[49]设计了一个单室MFC用于检测废水中的化学需氧量的方法,电池的电流与化学需氧量的线性范围 达350 mg/L,而产电量与化学需氧量的线性范围达500 mg/L。
此外,电池结构影响电池内流体特性,而流体特性反过来又影响电池性能。具有好的流体特性的MFC产生的电流和电荷要比流体特性差的MFC的大[50]。
综上所述,具有大的表面积与体积比、短的水力停留时间及好的流体特性的单室微型MFC是微生物燃料电池型生物传感器最理想的反应器结构。
4.5 优化操作条件
操作参数,如pH、外电阻、电解质类型、底物浓度、给料流速及温度等同样会影响电池性能。Gil等[32]讨论了pH、外电阻、电解质类型及阴极溶氧浓度对电池性能的影响。结果表明:当阳极室和阴极室不使用缓冲液时,随着时间的变化,阳极室的pH会逐渐升高,而阴极室的pH则会逐渐降低。同时发现:当阳极室的pH在7左右时,MFC产生的电流最大。使用50 mmol/L的磷酸缓冲液加100 mmol/L的NaCl作为电解质液要比单独使用50 mmol/L的磷酸缓冲液或100 mmol/L的NaCl效果好。这是因为缓冲液在一定程度上减小了质子供应的限制,而NaCl电解质起到降低电池内阻的作用。当外电阻大于500 Ω时,外电阻是速率限制因素;而当外电阻小于500 Ω时,质子扩散和氧的供应限制了阴极反应。许多研究表明:外电阻除了影响电池的能量输出外,同样会影响电池的响应时间[32, 47, 49, 51-52]。外电阻越大,电池的输出电流越小,响应时间越长。当外电阻为10 Ω时, 生化需氧量为400 mg/L的样品可使电池的输出电流迅速升高至1 mA,并在15 h内下降到基线;但当外电阻为500 Ω时,同一样品可使电池的输出电流在0.3 mA维持30 h[32]。微生物燃料电池型传感器的响应时间与底物浓度有关,浓度越高,响应时间越长。当生化需氧量为206.4 mg/L时,电池的响应时间约为10 h;当生化需氧量为2. 58 mg/L和6. 45 mg/L时,电池的响应时间<30 min[14]。因此,可通过稀释样品来缩短响应时间。如果样品中存在高氧化还原电势的电子受体如氧或硝酸盐,会降低电池的响应信号。Chang等[53]利用叠氮化物和氰化物作为呼吸抑制剂,既消除了阳极室中硝酸盐、氧气等高氧化性电子受体的负面影响,又不影响输出电流,从而提高了底物的转化效率和传感器的灵敏度。待测样品中的有毒物质会严重影响微生物燃料电池的稳定性。当有毒物质进入电池阳极室时,电化学活性微生物的代谢速率受到抑制,从而引起电流骤减,同时降低电池的产电效率。一定浓度的Hg,Cr6+,Pb以及苯酚、有机磷化合物、多氯联苯等都可抑制电化学活性微生物的代谢速率[23]。可以通过对样品进行预处理,降低有毒物质的浓度或去除有毒物质,以消除它们的影响。
5 问题与展望
微生物燃料电池型生物传感器具有稳定性好和维护要求低等优点,且可以用于在线监测和过程控制,因而具有广阔的应用前景。目前,基于微生物燃料电池技术开发了许多不同用途的生物传感器,除部分成功应用并投放市场外,大都停留在实验室研究阶段,仍需进一步改进与完善。目前,微生物燃料电池型生物传感器仍然存在许多局限性,从而影响了它在实际中的运用,这些局限性包括:(1) 响应时间长;(2) 灵敏度低;(3) 对样品中含有的很多有毒物质缺乏抵抗性。为了解决传感器存在的以上问题,进一步的研究工作应集中在提高微生物的活性、改善阳极电极的性能、增强阴极的反应效率、改进电池构造及优化操作条件等方面。随着MFC技术的进一步发展和完善,以及对该技术的深入了解,将开发出各种响应快、灵敏度高及稳定性好,且具有实际应用价值的微生物燃料电池型生物传感器。
参考文献:
[1] Bullen R A, Arnot T C, Lakeman J B, et al. Biofuel cells and their development[J]. Biosens Bioelectron, 2006, 21(11): 2015-2045.
[2] Du Z W, Li H R, Gu T Y. A state of the art review on microbial fuel cells: A promising technology for wastewater treatment and bioenergy[J]. Biotechnol Adv, 2007, 25(5): 464-482.
[3] Potter M C. Electrical effects accompanying the decomposition of organic compounds[J]. Proc R Soc London Ser B, 1911, 84(571): 260-276.
[4] Cohen B. The bacterial culture as an electrical half-cell[J]. J Bacteriol, 1931, 21(1):18-19.
[5] Karube I, Matsunaga T, Mitsuda S, et al. Microbial electrode BOD sensors[J]. Biotechnol Bioeng, 1977, 19(10): 1535-1547.
[6] Rabaey K, Verstraete W. Microbial fuel cells: novel biotechnology for energy generation[J]. Trends Biotechnol, 2005, 23(6): 291-298.
[7] Chang I S, Moon H, Bretschger O, et al. Electrochemically active bacteria (EAB) and mediator-less Microbial fuel cells[J]. J Microbiol Biotechnol, 2006, 16(2): 163-177.
[8] Liu J, Mattiasson B. Microbial BOD sensors for wastewater analysis[J]. Water Res, 2002, 36(15): 3786-3802.
[9] MoonH, Chang I S, Jang J K, et al. On-line monitoring of low biochemical oxygen demand through continuous operation of a mediator-less microbial fuel cell[J]. J Microbiol Biotechnol, 2005, 15(1): 192-196.
[10] Thurston C F, Bennetto H P, Delaney G M, et al. Glucose metabolism in a microbial fuel cell: Stoichiometry of product formation in a thionine-mediated proteus vulgaris fuel cell and its relation to coulombic yields[J]. J Gen Microbiol, 1985, 131(6): 1393-1401.
[11] Pasco N, Baronian K, Jeries C, et al. Biochemical mediator demand—A novel rapid alternative for measuring biochemical oxygen demand[J]. Appl Microbiol Biotechnol, 2000, 53(5): 613-618.
[12] Morris K, Catterall K, Zhao H, et al. Ferricyanide mediated biochemical oxygen demand-development of a rapid biochemical oxygen demand assay[J]. Anal Chim Acta, 2001, 442(1): 129-139.
[13] Pasco N, Baronian K, Jeffries C, et al. J. MICREDOX?— development of a ferricyanide-mediated rapid biochemical oxygen demand method using an immobilized Proteus vulgaris biocomponent[J]. Biosens Bioelectron, 2004, 20(3): 524-532.
[14] Kim B H, Chang I S, Gil G C, et al. Novel BOD (biological oxygen demand) sensor using mediator-less microbial fuel cell[J]. Biotechnol Lett, 2003, 25(7): 541-545.
[15] Chang I S, Jang J K, Gil G C, et al. Continuous determination of biochemical oxygen demand using microbial fuel cell type biosensor[J]. Biosens Bioelectron, 2004, 19(6): 607-613.
[16] Kim M, Youn S M, Shin S H, et al. Practical field application of a novel BOD monitoring system[J]. J Environ Monit, 2003, 5(4): 640-643.
[17] Kang K H, Jang J K, Lee J Y, et al. A low BOD sensor using a microbial fuel cell[J]. J Korean Soc Environ Eng, 2004, 26(1): 58-63.
[18] Kim H J, Hyun M S, Chang I S, et al. A microbial fuel cell type lactate biosensor using a metal-reducing, Shewanella putrefaciens[J]. J Microbiol Biotechnol, 1999, 9(3): 365-367.
[19] Tront J M, Fortner J D, Pl?tze M, et al. Microbial fuel cell technology for measurement of microbial respiration of lactate as an example of bioremediation amendment[J]. Biotechnol Lett, 2008, 30(8): 1385-1390.
[20] Tront J M, Fortner J D, Pl?tze M, et al. Microbial fuel cell biosensor for in situ assessment of microbial activity[J]. Biosens Bioelectron, 2008, 24(4): 586-590.
[21] Matsunaga T, Karube I, Suzuki S. A specific microbial sensor for formic acid[J]. European J Appl Microbiol Biotechnol, 1980, 10(3): 235-243.
[22] Kim H J, Choi D W, Hyun M S, et al. Method and device for detecting toxic material in water using microbial fuel cell: United States, US20050164331-A1[P]. 2005-07-28.
[23] Kim M, Hyun M S, Gadd G M, et al. A novel biomonitoring system using microbial fuel cells[J]. J Environ Monit, 2007, 9(12): 1323-1328.
[24] Huang J C, Yang J W, Lai W D, et al. Impedance method for rapid detection of total counts of bacteria and fungi in bottled purified water[J]. J AOAC Int, 2003, 86(4): 719-721.
[25] DeBlanc H J Jr, DeLand F, Wagner H N Jr. Automated Radiometric Detection of Bacteria in 2967 Blood Cultures[J]. Appl Microbiol, 1971, 22(5): 846-849.
[26] Tanaka H, Shinji T, Sawada K, et al. Development and application of a bioluminescence ATP assay method for rapid detection of coliform bacteria[J]. Water Res, 1997, 31(8): 1913-1918.
[27] Matsunaga T, Karube I, Suzuki S. Electrode system for the determination of microbial populations[J]. Appl Environ Microbiol, 1979, 37(1): 117-121.
[28] Nishikawa S, Sakai S, Karube I, et al. Dye-coupled electrode system for the rapid determination of cell populations in polluted water[J]. Appl Environ Microbiol, 1982, 43(4): 814-818.
[29] Patchett R A, Kelly A F, Kroll R G. Use of a microbial fuel cell for the rapid enumeration of bacteria[J]. Appl Microbiol Biotechnol, 1988, 28(1): 26-31.
[30] 卢智远, 牛中奇, 刘启, 等. 一种微生物检测的生物电化学方法研究[J]. 传感技术学报, 2005, 18(3): 481-484.
LU Zhi-yuan, NIU Zhong-qi, LIU Qi, et al. A study on bio-electrochemical method for microbial detection[J]. Chinese Journal of Sensors and Actuators, 2005, 18(3): 481-484.
[31] Holtmann D, Schrader J, Sell D. Quantitative comparison of the signals of an electrochemical bioactivity sensor during the cultivation of different microorganisms[J]. Biotechnol Lett, 2006, 28(12): 889-896.
[32] Gil G C, Chang I S, Kim B H, et al. Operational parameters affecting the performance of a mediator-less microbial fuel cell[J]. Biosens Bioelectron, 2003, 18(4): 327-334.
[33] Kim B H, Chang I S, Gadd G M. Challenges in microbial fuel cell development and operation[J]. Appl Microbiol Biotechnol, 2007, 76(3): 485-494.
[34] Chaudhuri S K, Lovley D R. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature Biotech, 2003, 21(10): 1229-1232.
[35] Park D H, Zeikus J G. Impact of electrode composition on electricity generation in a single-compartment fuel cell using Shewanella putrefaciens[J]. Appl Microbiol Biotechnol, 2002, 59(1): 58-61.
[36] Schr?der U, Niessen J, Scholz F. A generation of microbial fuel cells with current outputs boosted by more than one order of magnitude[J]. Angew Chem Int Ed, 2003, 42(25): 2880-2883.
[37] Adachi M, Shimomura T, Komatsu M, et al. A novel mediator–polymer-modified anode for microbial fuel cells[J]. Chem Commun, 2008(17): 2055-2057.
[38] Cheng S, Logan B E. Ammonia treatment of carbon cloth anodes to enhance power generation of microbial fuel cells[J]. Electrochem Commun, 2007, 9(3): 492-496.
[39] Pham T H, Jang J K, Chang I S, et al. Improvement of cathode reaction of a mediator-less microbial fuel cell[J]. J Microbiol Biotechnol, 2004, 14(2): 324-329.
[40] Morris J M, Jin S, Wang J Q, et al. Lead dioxide as an alternative catalyst to platinum in microbial fuel cells[J]. Electrochem Commun, 2007, 91(7): 1730-1734.
[41] Zhao F, Harnisch F, Schr?der U, et al. Challenges and constraints of using oxygen cathodes in microbial fuel cells[J]. Environ Sci Technol, 2006, 40(17): 5193-5199.
[42] Cheng S, Liu H, Logan B E. Power densities using different cathode catalysts (Pt and CoTMPP) and polymer binders (Nafion and PTFE) in single chamber microbial fuel cells[J]. Environ Sci Technol, 2006, 40(1): 364-369.
[43] Sangeun O H, Bookin M, Logan B E. Cathode performance as a factor in electricity generation in microbial fuel cells[J]. Environ Sci Technol, 2004, 38(18): 4900-4904.
[44] Logan B E, Hamelers B, Rozendal R, et al. Microbial fuel cells:Methodology and technology[J]. Environ Sci Technol, 2006, 40(17): 5181-5192.
[45] Liu H, Cheng S, Logan B E. Power generation in fed-batch microbial fuel cells as a function of ionic strength, temperature, and reactor configuration[J]. Environ Sci Technol, 2005, 39(14): 5488-5493.
[46] Ringeisen B R, Henderson E, Wu P K, et al. High power density from a miniature microbial fuel cell using Shewanella oneidensis DSP10[J]. Environ Sci Technol, 2006, 40(8): 2629-2634.
[47] Moon H, Chang I S, Kang K H, et al. Improving the dynamic response of a mediator-less microbial fuel cell as a biochemical oxygen demand (BOD) sensor[J]. Biotechnol Lett, 2004, 26(22): 1717-1721.
[48] Liu H, Logan B E. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J]. Environ Sci Technol, 2004, 38(14): 4040-4046.
[49] Di Lorenzo M, Curtis T P, Head I M, et al. A single-chamber microbial fuel cell as a biosensor for wastewaters[J]. Water Res, 2009, 43(13): 3145-3154.
[50] Moon H, Chang I S, Jang J K, et al. Residence time distribution in microbial fuel cell and its influence on COD removal with electricity generation[J]. Biochem Eng J, 2005, 27(1): 59-65.
[51] Kumlanghan A, Liu J, Thavarungkul P, et al. Microbial fuel cell-based biosensor for fast analysis of biodegradable organic matter[J]. Biosens Bioelectron, 2007, 22(12): 2939-2944.
[52] Kang K H, Jang J K, Pham T H, et al. A microbial fuel cell with improved cathode reaction as a low biochemical oxygen demand sensor[J]. Biotechnol Lett, 2003, 25(16): 1357-1361.
[53] Chang I S, Moon H, Jang J K, et al. Improvement of a microbial fuel cell performance as a BOD sensor using respiratory inhibitors[J]. Biosens Bioelectron, 2005, 20(9): 1856-1859.
(编辑 陈爱华)
收稿日期:2009-11-15;修回日期:2010-01-25
基金项目:国家自然科学基金资助项目(20877046);中科院知识创新工程重要方向项目(KGCX2-YW-373-2)
通信作者:郭荣波(1970-),男,山东寿光人,博士,研究员,从事生物燃气与微生物燃料电池研究;电话:0532-80662708;E-mail:guorb@qibebt.ac.cn

