古矿井区域酸性矿坑水微生物群落的多样性
刘新星,霍 强,刘学端,邱冠周
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
通过生态群落16S rRNA基因库的重建并采用限制性酶切长度多态性(RFLP)分析的方法,对铜绿山铜矿酸性矿水中微生物群落的多样性进行研究。通过RFLP对扩增出的327个16S rRNA PCR产物进行分析,对44个16S rRNA的克隆子进行测序。每个样点各有2~6个主要操作分类单元,这些操作分类单元所对应的克隆子数分别占各样点克隆子总数的56.3%~69.6%。93.8%的克隆子序列与现在的数据库中序列相似性大于90%。样点酸性矿坑水主成分分析与系统发育分析结果显示:在低pH值、高离子浓度的样点tls1与tls2中多数克隆子属于gamma-Proteobacteria (主要为Acidithiobacillus ferrooxidans) 和Nitrospira 科(主要为 Leptospirillum);而在较高pH值、低离子浓度的样点tls3的克隆子多属于gamma-Proteobacteria (没有 A. ferrooxidans) 和 alpha- Proteobacteria。在古矿井区域酸性矿坑水中微生物群落的多样性很低,生物地球化学特性相近的酸性矿坑水由具有相近的微生物群落组成。
关键词:酸性矿坑水;古矿井;微生物群落;多样性;限制性酶切片断多样性;生物地球化学
中图分类号:Q983.1 文献标识码:A 文章编号:1672-7207(2007)03-0414-07
Diversity of microbial community in acid mine drainage in
ancient mine area
LIU Xin-xing, HUO Qiang, LIU Xue-duan, QIU Guan-zhou
(School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: The diversities of microbial community in acid mine drainage of Tonglushan copper mine were analyzed by recombining the community 16S rRNA genes library and restriction fragment length polymorphisms analyses approach. 327 amplified community 16S rRNA PCR products were analyzed by RFLP, and 44 unique 16S rRNA clones were identified. About 56.3%-69.6% of the total number of 16S rRNA clones in the clone library of each was affiliated with 2-6 dominant operational taxonomic units. The similarity for 93.8% of the sequences of the unique 16S rDNA clones was greater than 90% with those in current database. The principal-components analysis of the biogeochemical properties and phylogenetic analysis show that most of the bacterial clones are affiliated with members of the gamma-Proteobacteria family (mainly Acidithiobacillus ferrooxidans) and the Nitrospira family (mainly Leptospirillum) in tls1 and tls2 where the concentrations of ions are high, while those are affiliated with members of the gamma-Proteobacteria family (no Acidithiobacillus ferrooxidans) and the alpha-Proteobacteria family in tls3 where concentrations of ions are very low. The diversity of microbial community in acid mine drainage is at low level and samples with similar biogeochemical properties have similar microbial communities.
Key words: acid mine drainage; ancient mine; microbial community; diversity; restriction fragment length polymorphisms; biogeochemistry
铜绿山矿山是列入联合国世界文化遗产目录的矿山,坐落于中国的湖北省大冶市。该矿山是一座从商代晚期就开始开采的古铜矿,距今已有3000多年的历史。随着采矿活动的进行,硫化矿的加速氧化已成为一个严重的环境问题。暴露于空气、水和微生物中的硫化矿分解,产生酸性矿坑水(AMD)。酸性矿坑水富含金属离子[1],呈酸性。由于酸性矿坑水在生物学和化学上的简单性,其环境成为分析生物、化学交互作用以及微生物群落结构与功能的典型系统[2]。随着人们对酸性矿坑水微生物生态的认识,酸性矿坑水群落的组成分布以及酸浸环境中环境因素的影响成为当前研究的热点[3-4]。为此,本文作者利用16S rRNA克隆技术[5]检测铜矿酸性矿坑水中微生物的组成与群落结构,对其形成过程中起重要作用的样点化学元素[2]与微生物因素进行研究。
1 材料与方法
1.1 样地描述与样品采集
铜绿山矿系岩浆期后矽卡岩型铜铁矿床,铜和铁是铜绿山矿山的主要元素。当地人们利用铜绿山某废弃铜矿井进行生物浸出,将浸出液通过交换池时与铁屑发生置换反应,然后排出酸性矿坑水。tls1酸性矿坑水采自此交换池排水口,为发生置换反应后的酸性矿坑水;tls2酸性矿坑水取自铜绿山另一废弃多年的铜矿井的地面积水;tls3酸性矿坑水采自铜绿山仍在开采的矿井的循环水排水口,此矿井与古矿井相距仅约1 km。
1.2 DNA抽提与纯化
将水样通过真空滤膜进行真空抽滤,然后利用DNA提取方法[6]从滤泥中提取基因组DNA,得到粗DNA。在加入抽提缓冲液前,将滤泥进行反复冻融研磨,使各种类型的细菌均能破碎。粗DNA利用E.Z.N.A.TM的纯化试剂盒进行纯化并进行琼脂糖电泳检测DNA含量[7]。
1.3 16S rRNA 基因的PCR扩增
样品16S rRNA 基因PCR扩增的引物为细菌通用引物63F和1387R[8]。加入牛血清白蛋白(BSA)来增强G+C含量较高序列的扩增。PCR扩增产物进行琼脂糖凝胶电泳,约1.6 kb的片断被切下并利用Promega凝胶回收试剂盒进行纯化。
1.4 克隆和RFLP分析
纯化后的PCR产物连接到PCR2.1载体并利用大肠杆菌TOP10感受态进行转化。通过蓝白筛选挑取白色阳性克隆子,利用通用引物M13F 和M13R对插入片断进行扩增。在37 ℃时用1 U限制性内切酶HinPI和MspI消化扩增后的PCR产物。RFLP后的产物进行3%的琼脂糖凝胶电泳并在溴乙锭与紫外线下显色。利用分子分析软件对RFLP条带类型进行分析,典型的RFLP条带类型对应的克隆子被挑取并进行测序。
1.5 测序与系统发育分析
对16S rDNA克隆子进行测序,通过NCBI的BLASTN软件进行序列比对。利用软件CLUSTAL X构建系统发育树。
1.6 统计学方法
通过软件SPSS将各样地的主要成分(PC)之间的差异归结到2个主要成分轴PC1和PC2上。PC1和PC2分别表示主要成分线性与特征向量的矩阵结合起来产生的主要差异值与次要差异值。主成分分析(PCA)同时考虑许多个正变量并识别一些低值数据来精确地描绘数据结构,将这些变量线性与特征向量的矩阵结合起来并产生主要成分轴。PCA用来估定样地属性的差异性以及分析所测定的各化学元素参量对样地间差异性的影响;以各样地的典型RFLP条带类型为操作分类单元(OTUs),其相互作用也应用PCA进行分析。
利用SigmaPlot软件进行稀疏分析,利用SigmaPlot 8.0的非线性软件的指数模型y=a×[1- exp(-bx)]分析克隆子分布数据,SAS用于分析克隆数据的主要成分。
1.7 核酸序列登录号
44个克隆子序列在GenBank数据库的登录号为:DQ458045 (tls1-1), DQ463181 (tls1-2), DQ458011(tls1-3), DQ463182 (tls1-4), DQ463183 (tls1-5), DQ463184 (tls1-6), DQ463185 (tls1-7), DQ458042(tls1-8), DQ463186 (tls1-9), DQ463187 (tls1-10), DQ463188 (tls1-11), DQ463189 (tls1-12), DQ458005 (tls1-13), DQ463190 (tls1-14), DQ463191 (tls2-1), DQ463192 (tls2-2), DQ463193 (tls2-3), DQ463194 (tls2-4), DQ463195 (tls2-5), DQ463196 (tls2-6), DQ458034 (tls2-7), DQ463197 (tls2-8), DQ458001 (tls2-9), DQ463198 (tls2-10), DQ458036 (tls2-11), DQ463199 (tls3-2), DQ458007 (tls3-3), DQ458010 (tls3-4), DQ463200 (tls3-5), DQ463201 (tls3-6), DQ463202 (tls3-7), DQ463203 (tls3-8), DQ463204 (tls3-9), DQ463205 (tls3-10), DQ463206 (tls3-11), DQ463207 (tls3-12), DQ463208 (tls3-13), DQ458037 (tls3-14), DQ458025 (tls3-15), DQ458042 (tls3-16), DQ458038 (tls3-17), DQ463209 (tls3-18), DQ463210 (tls3-19), DQ463211 (tls3-20)。
2 实验结果与分析
2.1 样地特性分析
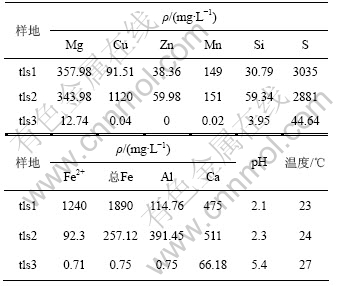
样品生物地球化学参量见表1所示。表1表明,tls1和tls2的各元素浓度很高,pH较低;tls3各元素浓度均很低,pH较高。
表 1 3个样品的生物地球化学参量
Table 1 Main biogeochemical parameters of three sites
PCA用来估定样地属性的差异性。软件分析结果表明,PC1显示样地属性差异性为75.0%,PC2显示样地属性差异性为17.9% (见图1)。PCA揭示出3个样点有一定的差异,tls1和tls2有着相对较近的生物地球化学参量,而tls3与这2个样点的差异较大。
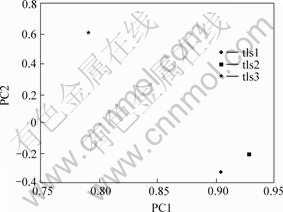
图1 3个样地生物地球化学参量的PCA
Fig.1 Ordinate plots from PCA Of biogeochemical propreties
PCA同时可以用于分析所测定的各化学元素参量对样地间差异性的影响。软件分析结果表明,PC1显示样地属性差异性为74.4%,PC2显示样地属性差异性为25.3%。PCA分析结果表明,3个样地间pH值、铜、亚铁、总铁的含量有较大的差异,其余元素含量差异不大(图2)。

图2 样地化学元素的PCA
Fig.2 Ordinate plot from PCA based on pH, and biogeochemical data from three different sites
2.2 16S rDNA 克隆文库的RFLP分析
对3个样点进行RFLP分析的PCR扩增产物共有327个,tls1,tls2和tls3分别有112,113和102个。结果显示,tls1和tls2的多样性较低,tls2检测到的典型RFLP条带类型(OTUs)最少,为11个,tls1的OTUs有14个;2个样点主要RFLP条带类型分别为3种和2种。tls3 多样性较高,共检测到19个OTUs,但tls3没有主要的RFLP条带类型(图3)。

(a) t1s1; (b) t1s2; (c) t1s3
图3 AMD样品克隆文库基于RFLP条带类型的OTUs分布图
Fig.3 Distribution of OTUs in clone libraries based on RFLP patterns in three AMD samples
tls1的主要条带类型为tls1-1,tls1-3和tls1-8, tls2的主要条带类型为tls2-1和 tls2-2。tls1和tls2中有4种相同的OTUs,分别为tls1-3和 tls2-2,tls1-7 和tls2-3,tls1-8和tls2-1,tls1-11和 tls2-6。其中tls1-3 和 tls2-2, tls1-8 and tls2-1分别为2个样点的主要条带类型。tls3的多数OTUs与其他2个样点的OTUs不同,6个OTUs(tls3-2, tls3-4, tls3-7, tls3-8, tls3-9, tls3-12)占有相似的比例(9%~12%)。
对酸性矿坑水样品所挑取的克隆子数量进行评估,结果如图4所示。饱合曲线分析结果(以OTU的数量作为克隆子数的函数)显示tls1,tls2和tls3分别在57,37,99个克隆子时达到饱和。本研究已检测到样品中绝大部分OTUs,未被检测到的OTU只占很少一部分。本研究的克隆子数完全可以反映样品的分子多态性和微生物群落的分布。
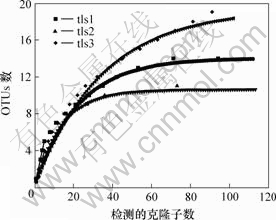
图4 酸性矿坑水样水所挑取的克隆子数的饱合曲线分析
Fig.4 Evaluation of representation of clones obtained from acid mine drainage samples by rarefaction analysis
2.3 序列分析与系统发育分析
对典型OTU所对应的克隆子进行序列测定,共获得44条序列。73.3%的序列与当前数据库中的16S rDNA序列相似性大于95%,20.5%的序列与当前数据库中的16S rDNA序列的相似性为90%~95%,只有序列tls3-17与已知16S rDNA序列的相似性低于90%。
系统发育分析显示,本研究所得序列主要分为5个类群(见图5)。表2列出了3个样地与5个类群相关的克隆子数分别占各自克隆文库的百分比。
表2 3个样地与5个类群相关的克隆子数分别占各自克隆文库的比例
Table 2 Percentages of clone numbers affiliated to five divisions in three sites
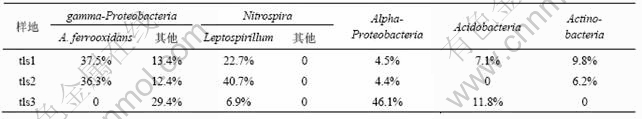
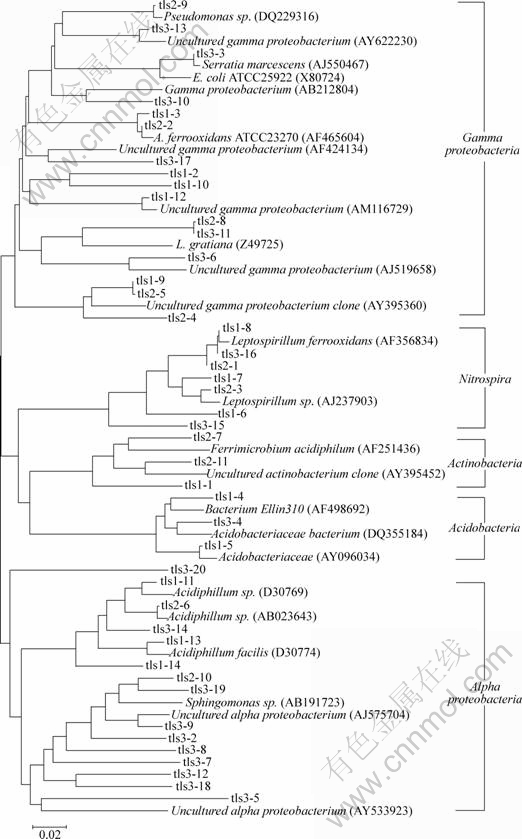
图5 酸性矿坑水样品中存在的16S rDNA序列的系统发育树
Fig.5 Phylogenetic distribution of 16S rDNA sequences present in three acid mine drainage samples
以各样点5个类群(gamma-Proteobacteria, nitrospira, alpha-Proteobacteria, acidobacteria, actinobacteria)中的克隆子数为PC进行PCA分析,软件分析结果表明,PC1显示样地属性差异性为66.7%,PC2显示样地属性差异性为31.8%(见图6)。由图6可见,tls1与tls2差异较小,而tls3与这2个样点差异较大。
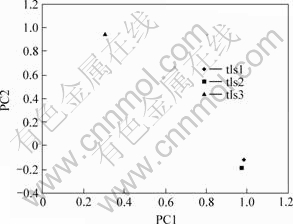
图6 3个样地克隆子类型的PCA分析
Fig.6 PCA of 6-unit cases at three sites
3 讨 论
对16S rDNA克隆文库进行RFLP分析来确定铜绿山铜矿酸性矿坑水中微生物群落组成。研究结果表明,此酸性矿坑水生态系统中只含有为数不多的类 群[2-3, 9]。例如,土壤中序列可分成13个不同的类群[11],而本研究中酸性矿坑水样品中只发现5个类群。一些基于培养的分析以及一些分子生物学分析结果表明,酸性环境中微生物群落多样性较低且其中主要微生物已经被分离培养[12-13]。在本研究中,所有的克隆子序列与当前数据库中的序列相似性均大于85%,3个样品(尤其是tls1和tls2)中多数克隆子序列均与已知的和已培养的嗜酸细菌的序列相关。
3.1 样品中的A. ferrooxidans与Leptospirillum
tls1和tls2中,与A. ferrooxidans相近的克隆子占很大部分,但在tls3中并未发现相关克隆子。表1表明,tls1和tls2的金属离子浓度相对于tls3较高,pH值相对于tls3则较低,这与已有研究结果“A. ferrooxidans可以加快酸性矿坑水产生”[13]相符。研究表明,在低pH值的自然环境中Leptospirillum的含量将会更 多[14],Leptospirillum也是极端酸性环境中极为重要的嗜酸铁氧化或硫氧化细菌[7]。本研究中,在低pH值的tls1和tls2中检测到大量的Leptospirillum, 在pH较高的tls3中只有7个克隆子与Leptospirillum相关。
研究结果表明,在tls1和tls2中A. ferrooxidans所占的比例相似,但在tls2中Leptospirillum所占比例比tls1所占比例低很多,原因有:
a. A. ferrooxidans可以耐受较高浓度的重金属离子[15],并且可以在较宽浓度范围的铁和铜环境中生长,Leptospirillum对铜离子较为敏感[16]。
b. tls2中的Fe3+与Fe2+的氧化还原电位比tls1的高,在tls1中,由于Fe2+含量较高,使得A. ferrooxidans快速生长;在tls2中,Fe3+与Fe2+氧化还原电位比高,由于Leptospirillum与亚铁有更高的亲合力,Leptospirillum有着较快的生物速率[17]。
3.2 样品中的Acidiphillum与Ferrimicrobium acidiphilum
Acidiphilum cryptum最初是从东德一个与煤矿相连的湖底淤泥中分离出来的[18],此淤泥呈酸性(pH=3.0),富含铁。虽然克隆子序列与Acidiphillum相关的较少,但它们也许在生态系统中起着十分重要的作用。研究结果表明,Acidiphillum有催化酸性矿坑水系统中亚铁的异还原作用[19]。
Ferrimicrobium acidiphilum可以从酸性矿坑水系统中分离出来[20]。虽然Ferrimicrobium acidiphilum为异养菌,但在好氧条件下可以氧化铁而在厌氧条件下可以还原铁[21]。本研究中,在tls1和tls2中均有少量克隆子与Ferrimicrobium acidiphilum相关,而tls3中无克隆子与Ferrimicrobium acidiphilum相关,tls1和tls2均含有高浓度的铁,而tls3则因为铁浓度太低而使Ferrimicrobium acidiphilum无法生长。
3.3 样地属性与微生物群落结构组成
PCA(图1)分析结果显示,tls1和tls2有相似的样地属性,tls3的样地属性与前两者有较大的差异。PCA(图2)表明3个样地的pH值以及全铁、亚铁和铜的含量相差很大。系统发育分析结果显示,tls1和tls2中多数的克隆子序列与gamma-Proteobacteria和Nitrospira相关,而只有很少部分与alpha- Proteobacteria相关,tls3中与gamma-Proteobacteria和alpha- Proteobacteria相关的克隆子比较多,只有很少的克隆子序列与Nitrospira相关。
PCA(图6)分析显示,tls1和tls2由有着相似的微生物群落结构组成,tls3与前两者的微生物群落结构组成有较大差异。系统发育分析结果表明,ts1和tls2有着相对接近的微生物群落结构。tls1中有6个OTU的序列与tls2中的序列相似性大于96%。在这6个OTU中,tls1-3(占tls1克隆文库的37.5%)的序列与tls2-2(占tls2克隆文库的36.3%)的序列相似性大于99%;tls1-8和tls1-7(分别占tls1克隆文库的17.0%和4.5%)的序列分别与tls2-1和 tls2-3(分别占tls1克隆文库的33.0%和8.0%)的序列十分相近。研究结果表明,样地属性相近的酸性矿坑水由具有相近的微生物群落组成。
4 结 论
a. 采用16S rRNA基因扩增以及限制性酶切长度多态性分析的方法可以分析酸性矿坑水中微生物群落组成。
b. 在铜绿山矿古矿井区域的酸性矿坑水中微生物仅发现5个类群,多样性低。
c. 在铜绿山矿古矿井区域的低pH值、高离子浓度的酸性矿坑水中,微生物群落结构主要由gamma-Proteobacteria (主要为A. ferrooxidans) 和Nitrospira (主要为Leptospirillum)构成;在较高pH、低离子浓度的酸性矿坑水中,微生物群落结构主要由gamma-Proteobacteria(很少有A. ferrooxidans)和alpha-Proteobacteria构成。
d. 在铜绿山矿古矿井区域酸性矿坑水中,微生物群落结构与样地属性有很大关系,样地属性相近的样点有着相类似的微生物群落结构。
参考文献:
[1] Nordstrom D K, Alpers C N. Negative pH, efflorescent mineralogy, and consequences for environmental restoration at the Iron Mountain Superfund site, California[J]. Proc Natl Acad Sci, 1999, 96: 3455-3462.
[2] Baker B J, Banfield J F. Microbial communities in acid mine drainage[J]. FEMS Microbiol Ecol, 2003, 44: 139-152.
[3] Johnson D B. Biodiversity and ecology of acidophilic microorganisms[J]. FEMS Microbiol Ecol, 1998, 27(4): 307-317.
[4] Schrenk M O, Edwards K J, Goodman R M, et al. Distribution of Thiobacillus ferrooxidans and Leptospirillum ferrooxidans: Implications for generation of acid mine drainage [J]. Science, 1998, 279(5356): 1519-1522.
[5] Bond P L, Smriga S P, Banfield J F. Phylogeny of microorganisms populating a thick, subaerial, predominantly lithotrophic biofilm at an extreme acid mine drainage site [J]. Appl Environ Microbiol, 2000, 66: 3842-3849.
[6] Hurt R A, Qui X, Wu L, et al. Simultaneous recovery of RNA and DNA from soils and sediments [J]. Appl Environ Microbiol, 2001, 67: 4495-4503.
[7] Zhou J, Bruns M A, Tiedje J M. DNA recovery from soils of diverse composition [J]. Appl Environ Microbiol, 1996, 62: 316-322.
[8] Marchesi J R, Sato T A, Weightman J T, et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA [J]. Appl Environ Microbiol, 1998, 64: 795-799.
[9] Clark D A, Norris P R. Acidimicrobium ferrooxidans gen. nov., sp. nov.: mixed-culture ferrous iron oxidation with Sulfobacillus species [J]. Microbiology, 1996, 142: 785-790.
[10] Zhou J, Xia B, Huang H, et al. Bacterial phylogenetic diversity and a novel candidate division of two humid region, sandy surface soils [J]. Soil Biol Biochem, 2003, 35: 915-924.
[11] Goebel B M, Stackebrandt E. Cultural and phylogenetic analysis of mixed microbial populations found in natural and commercial bioleaching environments [J]. Appl Environ Microbiol, 1994, 60:1614-1621.
[12] Walton K C, Johnson D B. Microbiological and chemical characteristics of an acidic stream draining a disused copper mine [J]. Environ Pollut, 1992, 76: 169-175.
[13] Nordstrom D K, Gordon Southam. Geomicrobiology of sulfide mineral oxidation [J]. Reviews in Mineralogy and Geochemistry, 1997, 35: 361-390.
[14] Ehrlich H L. Geomicrobiology[M]. New York: Marcel Dekker, 1996.
[15] Dopson M, Baker-Austin C, Koppineedi P R, et al. Growth in sulfidic mineral environments: metal resistance mechanisms in acidophilic microorganisms[J]. Microbiology, 2003, 149: 1959-1970.
[16] Sampson M I, Phillips C V. Influence of base metals on the oxidizing ability of acidophilic bacteria during the oxidation of ferrous sulfate and mineral sulfide concentrates, using mesophiles and moderate thermophiles [J]. Mineral Engineering, 2001, 14(3):317-340.
[17] Rawlings D E, Tributsch H, Hansford G S. Reasons why ‘Leptospirillum’-like species rather than Thiobacillus ferrooxidans are the dominant iron-oxidizing bacteria in many commercial processes for the biooxidation of pyrite and related ores [J]. Microbiology, 1999, 145: 5-13.
[18] Kusel K, Dorsch T, Acker G, et al. Microbial reduction of Fe (III) in acidic sediments: isolation of Acidiphilum cryptum JF-5 capable of coupling the reduction of Fe (III) to the oxidation of glucose [J]. Appl Environ Microbiol, 1999, 65: 3633-3640.
[19] Johnson D B, Dziurla M A, Kolmert A, et al. The microbiology of acid mine drainage: genesis and biotreatment [J]. South African Journal of Science, 2002, 98(5/6): 249-256.
[20] Bacelar-Nicolau P, Johnson D B. Leaching of pyrite by acidophilic heterotrophic iron-oxidizing bacteria in pure and mixed culture [J]. Appl Environ Microbiol, 1999, 65: 585-590.
[21] Bridge T A N, Johnson D B. Reduction of soluble iron and reductive dissolution of ferric iron-containing minerals by moderately thermophilic iron-oxidizing bacteria [J]. Appl Environ Microbiol, 1998, 64: 2181-2186.
收稿日期:2006-08-22
基金项目:国家自然科学基金资助项目(50374076); 国家自然科学基金创新群体基金资助项目(50321402);国家重点基础研究发展规划项目 (2004CB619201)
作者简介:刘新星(1955-),女,湖南长沙人,教授,从事生物冶金和生物信息学研究
通讯作者:刘新星,女,教授;电话:0731-8876697;E-mail:x-mine@mail.csu.edu.cn