文章编号:1004-0609(2008)S1-0092-04
硫酸钙在卤水输送管道中的结垢抑制
王红庆1, 包宗宏1, 段东平2, 李志宝2, 柯家骏2,G. P. DEMOPOULOS 3
(1. 南京工业大学 化工学院,南京 210009;
2. 中国科学院 过程工程研究所,北京 100080;
3. Department of Mining, Materials Engineering, McGill University,3610 University Street, Montreal, Quebec, H3A 2B2, Canada)
摘 要:对含少量CaSO4的NaCl-Na2SO4-H2O卤水体系中结垢的抑制技术进行研究,15~75 ℃时通过等温溶解方法测定工业卤水中(NaCl 300 g/L;Na2SO4 20 g/L)硫酸钙的溶解度,得出其结垢原因。开发一种新型吸附剂,可以选择性去除卤水中过饱和硫酸钙,以达到抑制CaSO4结垢的目的。结果表明:卤水中硫酸钙过饱和度的去除率与加入吸附剂的质量成比例;15 ℃时,当加入吸附剂的量为1.50 g/L时,15 min内过饱和的去除率就可达到75.2%,温度对吸附剂过饱和度去除率影响也较为显著,温度越高,去除速率越快。
关键词:二水硫酸钙;过饱和度;吸附剂;卤水;
中图分类号:TQ 132. 3.2 文献标识码:A
Inhibition of calcium sulfate scale formation in pipes of brine
WANG Hong-qing 1, BAO Zong-hong1, DUAN Dong-ping2, LI Zhi-bao2, KE Jia-jun2, G. P. DEMOPOULOS3
(1. School of Chemical Engineering, Nanjing University of Technology, Nanjing 210009, China;
2. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100080, China;
3. Department of Mining and Materials Engineering, McGill University, 3610 University Street, Montreal, Quebec, H3A 2B2, Canada)
Abstract: The inhibition of CaSO4 scale formation in concentrated NaCl-Na2SO4 brines was studied. The cause of scale formation was obtained by measuring the solubility of calcium sulfate dihydrate in the industrial brines(NaCl: 300 g/L; Na2SO4: 20 g/L) at temperature ranging from 15 to 75 ℃ with the aid of dissolution method. A novel sorbent obtained through the surface modification of calcium sulfate crystal was synthesized, which could selectively remove supersaturated calcium sulfate in the brines. Furthermore, it was found that the elimination ratio of supersaturation was directly proportional to the quality of sorbent. The elimination ratio was 75.2% only in 15 min when the sorbent was 1.50 g/L at 15 ℃. The effect of temperature on the absorption rate is remarkable. The higher the temperature, the faster the absorption rate.
Key words: calcium sulfate dihydrate; supersaturation; sorbent; brines
在湿法冶金、制盐、石油开采、海水淡化、盐湖资源开发等领域都广泛遇到硫酸钙结垢的问题[1-3]。结垢会给工业生产带来严重问题,如传热表面结垢不仅腐蚀设备,而且会使传热效率显著降低;输送管道结垢不仅导致输送能耗的增加,而且需要经常清洗,增加生产成本。因此对硫酸钙结垢的预防和抑制具有重要的现实意义和直接的经济效益。
DUTRIZAC[1]的研究结果表明,硫酸钙以3种型式存在,随着温度的升高,结垢的顺序依次为CaSO4?2H2O、CaSO4?0.5H2O和CaSO4。在卤水溶液中CaSO4?2H2O的溶解平衡如下式所示[4]:
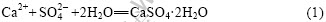
在采用洞室水溶法溶解岩盐矿制取NaCl的生产过程中,卤水输送管道的CaSO4结垢问题是困扰企业生产的一个重大难题。目前主要的抑制方法有化学净化、阻溶方法和添加阻垢剂等[5-8]。虽然化学净化法效果较好,但往往需要大量净化试剂,且处理过程中往往产生大量“盐泥”,难以处理,造成二次污染。阻溶方法虽然工艺简单,但阻溶剂往往价格昂贵,且井下情况复杂,生产操作难度大。加阻垢剂方法在换热器、循环水冷却等生产过程被广泛应用,但针对卤水输送过程中的抑制技术未见报道。实验中开发出一种基于对硫酸钙晶体改性的吸附剂。
1 实验
1.1 实验原料及仪器
实验原料主要有新型吸附剂(自行合成);二水硫酸钙(分析纯);工业卤水。实验仪器为自制反应釜,其结构示意图如图1所示。
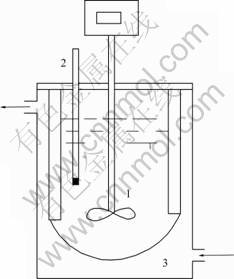
图 1 实验装置示意图
Fig.1 Schematic diagram of experimental apparatus: 1—Stirrer; 2—Thermometer; 3—Water circulator
1.2 分析方法
用络合滴定法[9]测定Ca2+,用BaSO4质量法[9]测定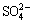 ,用离子色谱测定Cl-。用SEM检测吸附剂吸附前后的晶体形貌。
,用离子色谱测定Cl-。用SEM检测吸附剂吸附前后的晶体形貌。
1.3 CaSO4在卤水中溶解度的测定
采用二水硫酸钙溶解方法[10]测定了不同温度下卤水中硫酸钙的溶解度。以恒温水浴控制温度(±0.1 ℃),向卤水中加入过量二水硫酸钙,以磁力搅拌器搅拌,隔一定时间抽取上层清液,以0.22 μm微孔滤膜过滤后,用EDTA滴定卤水中Ca2+浓度,至Ca2+浓度不变。最后确定硫酸钙在卤水中达到溶解平衡的时间为24 h。
1.4 吸附剂对卤水中硫酸钙吸附性能的测定
向反应釜中加入1 L卤水,恒温后,加入一定量的吸附剂,搅拌器转速为300 r/min,间隔一定时间,抽取少许浊液,以0.22 μm微孔滤膜过滤后,用EDTA滴定卤水中Ca2+浓度。吸附剂的除垢率计算如下:

2 结果及讨论
2.1 CaSO4在卤水中的溶解度
5~75 ℃时测定了CaSO4?2H2O在工业卤水(组成见表1)中的溶解度,结果如图2所示。由图可知,随着温度的升高,CaSO4?2H2O在该卤水体系中的溶解度逐渐增大,65 ℃时达到最大值,随后又迅速降低,这是因为CaSO4?2H2O发生相变转变成CaSO4?0.5H2O的缘故[11]。
表1 25 ℃时卤水成分及其浓度分析结果
Table 1 Concentration and density of brine at 25 ℃
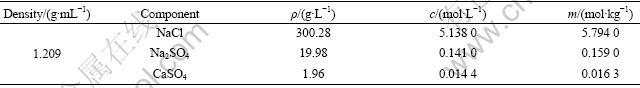
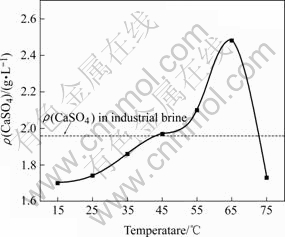
图 2 卤水中硫酸钙的饱和溶解度
Fig.2 Solubility of CaSO4 in brine
2.2 结垢机理的探讨
如图2所示,卤水中硫酸钙浓度为1.96 g/L,接近45 ℃时卤水中硫酸钙的饱和浓度。这是因为井下盐层的溶解过程中会释放大量的溶解热,使井下温度升高,从而使硫酸钙具有较高的浓度。当处于室温条件时,温度降低,卤水中的硫酸钙浓度达到过饱和。如在25 ℃硫酸钙的饱和溶解度为1.74 g/L,则此时的过饱和度为(1.96-1.74)=0.22 g/L。研究发现,管道结垢的机理主要是由初次成核引起的,几乎不会出现二次成核[12-14]。在输送过程中,管道表面作为外来物质,降低了成核所需的表面能,作为成核基点引起非均相成核[15],导致结垢,垢的生长即硫酸钙的沉积过程则是表面控制过程[16]。
2.3 温度对吸附剂去除硫酸钙过饱和度的影响
实验条件下,向1 L卤水中加入0.5 g吸附剂,考察不同温度下卤水中硫酸钙浓度随时间的变化,结果如图3所示。从图中可以看出,25 ℃下卤水中硫酸钙浓度的下降速率明显大于15 ℃时的下降速率。因此,为了达到较快的除垢效果,冬季时要加入更多量吸附剂。
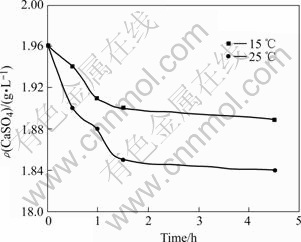
图 3 不同温度时卤水中硫酸钙浓度随时间的变化曲线
Fig.3 Changing curves of concentration of CaSO4 with time at different temperatures
2.4 吸附剂用量对卤水过饱和度去除率的影响
在15 ℃时15 min后测定了不同用量的吸附剂与卤水过饱和度去除率的关系,结果如图4所示。由图可知,15 h内加入少量的吸附剂就可以明显地达到除垢效果,同时随着加入吸附剂量的增加,除垢率也增加,当加入吸附剂为1.5 g/L,就可以达到75.2%除垢效果。
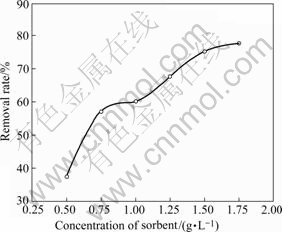
图 4 25 ℃时吸附剂质量对除垢率的影响
Fig.4 Effect of sorbent mass on removal rate
2.5 吸附剂形态的变化
图5所示为吸附剂生长前后的SEM像。由图可知,吸附前吸附剂颗粒大小不一,且形状不规则;而吸附后颗粒明显增大,大小相对整齐,形状多为斜方体。

图 5 吸附前后吸附剂的SEM像
Fig.5 SEM morphologies of sorbent before and after adsorption: (a) Sorbent before adsorption; (b) Sorbent after adsorption
3 结论
1) 通过对CaSO4在工业卤水(NaCl-Na2SO4-H2O)中溶解度的测定,得出卤水输送管道结垢的原因,即由于井下温度和室温条件的温度差,使卤水中硫酸钙达到过饱和,在输送管道中产生非均相成核,导致结垢。
2) 开发了一种新型吸附剂,通过对不同温度下吸附剂对卤水中硫酸钙吸附效果,得出温度对吸附剂的除垢效果有较大影响。温度越高,过饱和度去处率越快,因此在冬季要加入更多的吸附剂。
3) 通过考察不同质量的吸附剂对除垢效果的影响。得出在15 ℃下,15 min内吸附剂的浓度为1.50 g/L时,就可达到75.2%的除垢效果。
REFERENCES
[1] DUTRIZAC J E. Calcium sulphate solubilities in simulated zinc processing solutions [J]. Hydrometallurgy, 2002, 65: 109-135.
[2] KUIPER A, DUTRIZAC J E. The solubility of calcium sulphate in simulated nikel sulphate-chloride processing solutions [J]. Hydrometallurgy, 2006, 82: 13-31.
[3] GIRGIN S. Crystallization of alpha-calcium sulphate hemihydrate by aqueous reaction of calcium chloride with sulphuric acid [D]. Montreal: McGill University, 2006: 24-28.
[4] KUMAR A, SANGHAVI R, MOHANDAS V P. Solubility pattern of CaSO4?2H2O in the system NaCl+CaCl2+H2O and solution densities at 35 ℃: Non-ideality and ion pairing [J]. J Chem Eng Data, 2007, 52: 902-905.
[5] LINNIKOV O D, PODBEREZNYI V L. Prevention of sulfate scale formation in desalination of Aral Sea water [J]. Desalination, 1996, 105: 143-150.
[6] AHMED S B, TLILI M, AMOR M B, BACHA B H, ELIEUCH B. Calcium sulfate scale in a desalination unit using the SMCEC technique [J]. Desalination, 2004, 167: 311-318.
[7] SHIH W Y, ALBRECHT K, GLATER J, COHEN Y. A dual-probe approach for evaluation of gypsum crystallization in response to antiscalant treatment [J]. Desalination, 2004, 169: 213-221.
[8] 周晓薇, 周柏青. 聚天冬氨酸阻垢性能的研究[J]. 工业水处理, 2005, 31(3): 31-34.
ZHOU Xiao-wei, ZHOU Bai-qing. Research on the performance of resist-scale of polyaspartic acid [J]. Technology of Water Treatment, 2005, 31(3): 31-34.
[9] 中国科学院青海盐湖研究所. 卤水和盐的分析方法[M]. 北京:科学出版社, 1973: 1-300.
Qinghai Institute of Salt Lakes, Chinese Academy of Sciences. Analysis method for brine and salt [M]. Beijing: Science Press, 1973: 1-300.
[10] LI Zhi-bao, DEMOPOULOS G P. Solubility of CaSO4 phases in aqueous HCl+CaCl2 solutions from 283 K to 353 K [J]. J Chem Eng Data, 2005, 50: 1971-1982.
[11] BLOCK J, WATERS O B. The CaSO4-Na2SO4-NaCl-H2O system at 25-100 ℃ [J]. J Chem Eng Data, 1968, 13(3): 336- 344.
[12] WEY J, TERWILLINGER J, GINGELLO A. Analysis of AgBr precipitation in a continuous suspension crystallizer[J]. AIChE Symposium Series, 1980, 193(76): 34–42.
[13] BRE?EVI? L, GARSIDE J. On the measurement of crystal size distributions in the micrometer size range [J]. Chemical Engineering Science, 1981, 36(5): 867–869.
[14] BLOMEN L, WILL E, BIJVOET O, LINDEN H V. Growth kinetics of calcium oxalate monohydrate: II. The variation of seed concentration [J]. Journal of Crystal Growth, 1983, 64 (2): 306–315.
[15] MULLIN J W. Crystallization [M]. 4th ed. Oxford: Butterworth- Heinemann, 2001: 195-197.
[16] HOANG T A, ANG H M, ROHL A L. Effects of temperature on the scaling of calcium sulphate in pipes [J]. Powder Technology, 2007, 179: 31-37.
基金项目:国家重点基础研究发展计划资助项目(2007CB613501)
通讯作者:李志宝,研究员,博士;电话:010-62551557;E-mail:zhibaoli@home. ipe .ac cn
(编辑 龙怀中)