文章编号:1004-0609(2007)06-0984-06
钴酸锂的再生及其电化学性能
刘云建,胡启阳,李新海,王志兴,郭华军,彭文杰
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:采用提取的含少量Co3O4的LiCoO2为原料,在不同温度下合成正极材料LiCoO2,烧结时间为12 h,并采用XRD和SEM技术研究合成的LiCoO2的晶相结构与微观形貌。结果发现:烧结温度对LiCoO2的晶体结构影响较大,烧结温度越高,LiCoO2的层状结构发育越完整。循环伏安曲线很好地反映了再生LiCoO2的脱/嵌锂行为。将LiCoO2样品做成电池进行电化学检测,结果发现,烧结温度为850 ℃的样品首次放电容量为151mA?h/g,30次循环之后,放电容量仍有141mA?h/g,表现出良好的电化学性能。
关键词:钴酸锂;正极材料;再生;电化学性能
中图分类号:TM 912 文献标识码:A
Recovery of LiCoO2 and its electrochemical performance
LIU Yun-jian, HU Qi-yang, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, PENG Wen-jie
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: LiCoO2 was synthesized at different temperatures from recycled power containing little Co3O4, and the calcinating time was 12 h. The structure and morphology of resulted samples were observed by XRD and SEM, respectively. The results show that the calcinating temperature has great significant on the structure of LiCoO2. The layered structure of LiCoO2 is improved when the calcinating temperature increases. The cyclic voltammagrams curve shows the exaction/insertion performance of LiCoO2 well. The initial discharge capacity of LiCoO2 calcined at 850 ℃ is 151 mA?h/g. The discharge capacity after cycled 30 times is still 141 mA?h/g.
Key words: lithium cobalt oxide; cathode materials; recovery; electrochemical performance
锂离子二次电池因为其工作电压高、比能量大、自放电小、循环寿命长、无记忆效应、环境污染少等优点,已经在移动电子设备、电动汽车技术等领域得到广泛的应用。锂离子电池的核心——锂离子电池正极材料一直都是研究与开发的热点。LiCoO2由于电化学性能优异,所以成为目前应用最广泛的正极材料。
锂离子电池行业的迅速发展导致钴的需求量急剧增加,但是由于钴资源缺乏,价格昂贵,且本身对环境有不良影响,所以目前一方面人们正在积极研究LiCoO2正极材料的替代品,如LiMn2O4[1?3]和LiFePO4[4?8],或者其他含钴量较低的复合氧化物正极材料[9?12],以降低生产成本;另一方面,国内外很多学者已经开始研究锂离子电池的回收问题[13?16],以便通过回收废旧锂离子蓄电池来制备新的锂离子电池正极材料,从而降低生产成本。
本文作者从利用不合格锂离子电池正极边角料的角度出发,针对不合格正极片的组成,根据之前的研究成果[17],合理地调整其中的锂钴摩尔比,在高温下使混合粉末中Li、Co和O原子再生成电池级的钴酸锂。结果发现,在高温下提取样品中少量的Co3O4与碳酸锂反应,并全部转化为LiCoO2。利用X射线衍射和扫描电镜对再生LiCoO2进行检测和表征,并且研究了再生LiCoO2的电化学性能。
1 实验
1.1 实验原料
首先用二甲基乙酰胺浸泡正极边角料,取出铝箔,过滤。将滤饼在120 ℃下干燥12 h,然后将得到的粉末分别在450 ℃和600 ℃下烧结2 h和5 h,得到再生原料。详细过程见文献[16]。
1.2 LiCoO2的再生
以制得的含少量Co3O4的LiCoO2为原料,利用原子吸收光谱和容量分析法分析回收LiCoO2样品中Li、Co、C和F等元素的含量以及Li与Co的摩尔比,然后加入一定量的Li2CO3(99.9%,新余市赣丰锂业有限公司),调整其n(Li)/n(Co)为1,添加适量乙醇充分研磨后烘干。在400 ℃下预热4 h,再分别在750、800、850、900及950 ℃下烧结12 h后随炉冷却至室温,得到LiCoO2样品粉末。
1.3 物相分析和形貌表征
利用X射线衍射仪(Rigaku公司,日本)分别对文献[16]中的提取样品和再生LiCoO2样品粉末进行物相分析,以Cu Kα靶作为辐射源,电压为40 kV,电流为50 mA,步宽为0.02?,扫描速度为2(?)/min,扫描范围为10?~90?。
用JSM?5600型扫描电子显微镜对再生LiCoO2的表面形貌进行表征。
1.4 循环伏安测试
循环伏安测试采用三电极体系,辅助电极和参比电极采用金属锂,工作电极分别为再生LiCoO2和原生LiCoO2,测试仪器为上海辰华CHI660电化学工作站。扫描速度为0.1 mV/s,扫描电位区间为3.0~4.4 V。
1.5 电化学性能检测
通过2025型扣式电池测试材料的电化学性能。LiCoO2、乙炔黑(电池级,广东省化工进出口公司)和PVDF(聚偏二氟乙烯,电池级,法国阿托化学)按质量比8?1?1混合并研磨均匀后,加入适量有机溶剂N-甲基吡咯烷酮(NMP,纯度99.9%,南京京龙化工厂生产)研磨成均匀糊状物后涂于铝箔上,在120℃真空干燥12 h。在充满干燥氩气的手套箱中,以金属锂片作为负极 ,以Celgard2400微孔聚丙烯膜(Celgard Inc.USA)为隔膜,以1mol/L LiPF6的EC(碳酸乙烯酯)/DMC(1,2-二甲基碳酸酯)/EMC(碳酸甲乙酯)(体积比为1?1?1)的溶液为电解液组装2025型扣式电池。在BTS-51型二次电池性能检测仪(深圳新威尔多电子设备有限公司生产)上测试电池的充放电性能。采用恒流恒压法对电池进行充放电,充放电电压为3.0~4.2 V,充电电流为0.2 C,温度维持在25 ℃左右。
2 结果与讨论
2.1 提取样品的XRD分析
图1所示是提取样品的XRD谱。从图中可以看出,提取样品的XRD谱中在衍射角为32.220?和36.821?处出现杂质Co3O4的衍射峰,但是其衍射峰高度较低,强度较弱,这证明提取样品中的Co3O4含量比较少。因为在热处理过程中,只有少部分的LiCoO2结构遭到破坏,从而生成杂质Co3O4[16]。
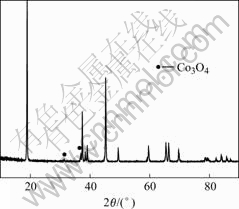
图1 提取样品的XRD谱
Fig.1 XRD pattern of recovered sample
分别采用原子吸收光谱和容量分析法分析提取样品中的Li和Co含量以便确定添加锂盐的量。并且利用CS800型红外碳硫检测仪(Eltar公司,德国)对样品中的碳进行分析,用蒸馏比色法测定样品中氟的含量,结果列于表1。从表1可以折算出Li与Co的摩尔比为0.914,这与正常的LiCoO2中Li与Co的摩尔比有较大的差异,这主要是由于提取过程造成的[17]。
表1 提取样品中各元素的含量
Table 1 Content of elements in recovered sample (mol)

2.2 再生LiCoO2的结构与形貌
温度是影响高温固相反应的重要因素。本实验研究不同烧结温度对产物结构的影响。图2所示是750、800、850、900和950 ℃下烧结的LiCoO2的XRD谱。从图2可知,750、800、850和900 ℃下再生的样品都没有出现Co3O4的衍射峰。再生LiCoO2呈现明显的α-NaFeO2型层状结构。

图2 不同烧结温度下LiCoO2的XRD谱
Fig.2 XRD patterns of LiCoO2 calcined at different temperatures
当温度达到950 ℃时,在LiCoO2的XRD谱中又出现很明显的杂质Co3O4衍射峰,且LiCoO2的各条衍射峰强度变弱,宽度变宽。这是因为在高温下,LiCoO2发生分解,又重新生成了Co3O4,并且破坏了原来LiCoO2的层状结构, Co3O4的出现导致LiCoO2的结晶程度下降[18?19]。
不同烧结温度下LiCoO2的I(003)/I(104)的比值列于表2中。由表可知,该比值是先随着温度的升高而增加,当烧结温度为850 ℃时,其比值达到最大;当温度进一步升高时,其比值又开始下降。这主要是因为温度过高,造成一部分锂损失,从而引起晶格缺陷和结晶程度下降。I(003)/I(104)的比值越大,证明LiCoO2的层状结构发育越完善[20?21]。由此可见,适当提高烧结温度,有利于LiCoO2晶格的发育和完善,进而有利于电化学性能的提高。因此,850 ℃为LiCoO2的理想再生温度。经过XRD分析,850 ℃烧结12 h后样品的晶格参数a=0.281 7 nm,c=1.406 3 nm,c/a=4.992,这与文献[22]报道的结果非常吻合。
表2 不同烧结温度下LiCoO2的I[003]/I[104]值
Table 2 Ratio of I(003) to I(104) of LiCoO2 calcined at different temperatures

图3所示是不同烧结温度时样品的SEM像。从图3可以看出,温度较低时,样品颗粒较小,粒径大约为1~5 μm,且表面还存在许多细小的附着物。但是随着烧结温度的升高,产品颗粒粒径有所增大,并且随着温度的升高,产物出现一定程度的团聚现象。当温度到达900 ℃时,团聚现象基本消失,并且出现较大颗粒。这是由于熔融状态的Li2CO3促进了小颗粒的进一步熔融长大。

图3 不同烧结温度下LiCoO2的SEM像
Fig.3 SEM images of LiCoO2 calcined at different temperatures: (a) 750 ℃; (b) 800 ℃; (c) 850 ℃; (d) 900 ℃
2.2 再生LiCoO2电极过程的循环伏安研究
图4所示是850 ℃下烧结12 h的再生LiCoO2样品和原生LiCoO2样品的循环伏安曲线。由图可知,两种LiCoO2样品在氧化过程中出现2个明显的氧化峰以及1个不太明显的氧化峰(如箭头所示),在还原过程中出现3个还原峰。其主氧化峰分别为4.045和4.047 V,而主还原峰为3.818和3.819 V。两者的氧化峰和还原峰电位一致,可以证明再生LiCoO2和原生LiCoO2在结构上没有区别,再生过程可以很好地还原LiCoO2的结构。
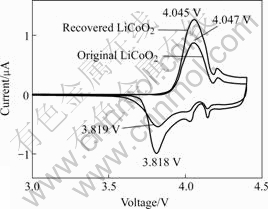
图4 LiCoO2的循环伏安曲线
Fig.4 Cyclic voltammagrams curves of LiCoO2
此外,再生LiCoO2的氧化还原峰比较尖锐,表明脱嵌锂较为容易。Jeong和Lee[23]的研究表明,放电过程中3.818 V处的主还原峰对应LiCoO2到Li0.8CoO2规则结构的转变,而其它2个氧化还原峰则对应Li0.8CoO2从规则六方晶系结构到不规则Li0.5CoO2单斜晶系结构的转变。该图能够很好地反映了再生LiCoO2在充放电过程中的脱/嵌锂行为。
2.3 电化学性能
将750、800、850和900 ℃制备的再生LiCoO2做成扣式电池,对其进行电化学性能检测(950 ℃下再生LiCoO2中出现Co3O4,实验中没有测试其电化学性能)。充电方式为恒流恒压,充电电流约为0.2 C。充电终止电压为4.2 V,放电终止电压为3.0 V。4个样品的首次放电曲线如图5所示。

图5 不同烧结温度下LiCoO2的首次充放电曲线
Fig.5 Curves of initial charge and discharge capacity of LiCoO2 calcined at different temperatures
4种再生样品的首次放电容量分别为142, 145, 151和147 mA?h/g。其中850 ℃下再生的LiCoO2首次放电容量最高,这是因为其I(003)/I(104)比值最大,层状结构发育最完善,Li+脱/嵌最为容易。此外,从图中还可以看出,4条放电曲线重合很好,这证明在不同温度下再生的LiCoO2的基本结构是相同的。从放电曲线中可以看出,其首次放电的主平台为3.9~4.0 V,此外,在4.05 V以上分别还出现了2个小平台。这与循环伏安实验结果相吻合。
图6所示是不同温度下,4种再生LiCoO2的循环性能曲线图,30次充放电后容量分别为126、135、141和136 mA?h/g。容量损失率分别为11.3%、6.9%、6.6%和7.5%,表现出较好的循环性能,其中 850 ℃下烧结12 h再生LiCoO2的循环性能最佳。由此可见,适当提高烧结温度有利于循环性能的改善。综合首次放电曲线和循环性能曲线可知,850 ℃下焙烧12 h再生LiCoO2的电化学性能最优,因为其I(003)/I(104)的比值最大,层状结构发育最为完善。

图6 不同烧结温度下再生LiCoO2的循环性能曲线
Fig.6 Curves of cycling performance of recovered LiCoO2 calcined at different temperatures
3 结论
1) 采用提取的含少量Co3O4的LiCoO2为原料,加入Li2CO3,分别在750,800,850,900和950 ℃下合成正极材料LiCoO2,烧结时间为12 h,反应完成后Co3O4已经全部转化为LiCoO2(950 ℃时的除外);样品颗粒细小,分布均匀。
2) 循环伏安曲线很好地反映了再生LiCoO2的脱/嵌锂行为。烧结温度为850 ℃的样品首次放电比容量达到151 mA?h/g,30次循环后,可逆容量仍有141mA?h/g,容量损失仅为6.6%。经过回收处理后再生的LiCoO2仍具有较好的电化学性能,并且该工艺简单,易于操作,具有较强的应用前景。
REFERENCES
[1] Dong H J, Young J S, Seung M O. Dissolution of spinel oxides and capacity losses in 4 V Li/LiMn2O4 cells [J]. J Electrochem Soc, 1996, 143(7): 2204?2210.
[2] Pistoia G, Zane D, Zhang Y, Yoshio M. Some aspects of LiMn2O4 electrochemistry in the 4 V range [J]. J Electrochem Soc, 1995, 142(8): 2551?2557.
[3] Yong Y X, Takeshige H, Noguchi H. Synthesis and electrochemical behaviour of LixMn2O4[J]. J Power Sources, 1995, 56(1): 61?67.
[4] Andersson A S, Kalska B, Haggstrom L, Thomas J O. Lithium extraction/insertion in LiFePO4: an X-ray diffraction and Mossbauer spectroscopy study [J]. Solid State Ionics, 2000, 130(1/2): 41?52.
[5] Yamada A, Chung S C, Hinokuma K. Optimized LiFePO4 for lithium battery cathodes [J]. J Electrochem Soc, 2001, 148(3): A224?229.
[6] Takahashi M, Tobishima S,Takei K, Sakurai Y. Characterization of LiFePO4 as the cathode material for rechargeable batteries [J]. J Power Sources, 2001, 97/98(5): 508?511.
[7] Andersson A S, Thomas J O. The source of first-cycle capacity loss in LiFePO4 [J]. J Power Source, 2001, 5(97/98): 498?502.
[8] YANG Shou-feng, Peter Y Z, Whittinggham M S. Hydrothermal synthesis of lithium iron phosphate cathodes [J]. Electrochemistry Communications, 2001, 3 (9): 505?508.
[9] Naoaki Y, Ohzuku T. Novel lithium insertion material of LiCo1/3Ni1/3Mn1/3O2 for advanced lithium-ion batteries [J]. J Power Sources, 2003, 119/121(1): 171?174.
[10] MacNeil D D, Lu Z, Dahn J R. Structure and electrochemical of Li[CoxNi1?2xMnx]O2(0≤x≤1/2) [J]. J Electrochem Soc, 2002, 149(10): 1332?1336.
[11] Kang S H, Kim J, Stoll M E, Abraham D, Sun Y K, Amine K. Layered  (M′=Co, Al, Ti; x=0, 0.025) cathode materials for Li-ion rechargeable batteries [J]. J Power Sources, 2002, 112 (1): 41?48.
(M′=Co, Al, Ti; x=0, 0.025) cathode materials for Li-ion rechargeable batteries [J]. J Power Sources, 2002, 112 (1): 41?48.
[12] Masaki Y, Hideyki N, Itoh J I, Okada M, Mouri T. Preparation and properties of LiCoyMnxNi1?x?yO2 as a cathode for lithium ion batteries [J]. J Power Sources, 2000, 90(2): 176?181.
[13] ZHANG Ping-wei, Yokoyama T, Itabashi O, Suzuki M T, Inoue K. Hydrometallurgical process for recovery of metal from spent lithium-ion secondary batteries [J]. Hydrometallurgy, 1998, 47(2/3): 259?271.
[14] 吴 芳. 从废旧锂离子二次电池中回收钴和锂 [J]. 中国有色金属学报, 2004, 14(4): 697?701.
WU Fang. Recovery of cobalt and lithium from spent lithium-ion secondary batteries [J]. The Chinese Journal of Nonferrous Metals, 2004, 14(4): 697?701.
[15] 钟海云,李 荐,柴立元. 从锂离子二次电池正极废料—铝钴膜中回收钴的工艺研究[J]. 稀有金属与硬质合金, 2001, 144(4): 1?4.
ZHONG Hai-yun, LI Jian, CHAI Li-yuan. Study on technology for recycling cobalt from Li-ion secondary battery anodes scrap of Al-Co film [J]. Rare Metals and Cemented Carbides, 2001, 144(4): 1?4.
[16] Contestable M, Panero S, Scorosato B. A laboratory-scale lithium-ion battery recycling process [J]. J Power Sources, 2001, 92(1/2): 65?69.
[17] 刘云建,胡启阳,李新海,王志兴,郭华军,彭文杰. 从不合格锂离子蓄电池中直接回收钴酸锂[J]. 电源技术, 2006, 30(4): 308?310.
LIU Yun-jian, HU Qi-yang, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, PENG Wen-jie. Study on the direct recovery LiCoO2 from the Li-ion battery[J]. Chinese Journal of Power Sources, 2006, 30(4): 308?310.
[18] Markovsky B, Rodkin A, Salitra G. The impact of Co2+ ions in solutions on the performance of LiCoO2, Li, and lithiated graphite electrodes [J]. J Electrochem Soc, 2004, 151(7): 1068?1076.
[19] Amatucci G G, Tarascon J M, Klein L C. CoO2, the end member of the LixCoO2 solid solution[J]. J Electrochem Soc, 1996, 143(4): 1114?1118.
[20] Myung S T, Kumagai N, Komaba S, Chung H T. Effects of Al doping on the microstructure of LiCoO2 cathode materials[J]. Solid State Ionics, 2001, 139(1): 47?56.
[21] Fang T, Duh J G, Sheen S R. LiCoO2 cathode material coated with nano-crystallized ZnO for Li-ion batteries[J]. Thin Solid Films, 2004, 469/470(1): 361?365.
[22] 刘 景,温兆银,吴梅梅,顾中华,曹佳弟,林祖缳. LiCoO2正极材料的络合法合成及其电化学性能研究 [J]. 无机材料学报, 2002, 17(6): 1157?1162.
LIU Jing, WEN Zhao-yin, WU Mei-mei, Gu Zhong-hua, CAO Jia-di, LIN Zu-xiang. Synthesis by a complexation route and characterization of LiCoO2 cathode materials [J]. Journal of Inorganic Materials, 2002, 17(6): 1157?1162.
[23] Jeong W T, Lee K S. Electrochemical cycling behavior of LiCoO2 cathode by mechanical alloying of hydroxides[J]. J Power Sources, 2002, 104(1): 195?200.
基金项目:国家自然科学基金资助项目(50302016)
收稿日期:2006-10-13;修订日期:2007-01-31
通讯作者:胡启阳,男,副教授;电话:0731-8836633;E-mail;hqyangbox@163.com
(编辑 龙怀中)