BTEX污染模拟含水层的生物地球化学作用
王霄,曲丹,赵胜,苏燕,陶怡,周睿
(吉林大学 地下水资源与环境教育部重点实验室,吉林 长春,130021)
摘要:通过98 cm砂柱实验模拟BTEX污染含水层的过程,分析含水层中总有机碳、硫酸盐、铁、无机氮和可溶性碳酸盐含量的变化,揭示其厌氧生物地球化学作用。研究结果表明:以BTEX为电子供体,以环境中NO3-,Fe3+及SO42-为电子受体的微生物降解过程为主要作用,NO3-,Fe3+及SO42-电子受体的还原分别发生在距砂柱入水口70~89,55~70及34~55 cm处;有机氮矿化作用和CO2对碳酸盐的溶蚀作用发生在整个受污染区域;硫化亚铁沉淀生成主要发生在0~55 cm处,使该区域总铁量较55~70 cm处有所升高;可溶性碳酸盐含量变化由H+的溶解作用,0~70 cm处发生的碳酸亚铁沉淀生成及70~89 cm处CO2对碳酸盐的溶蚀作用共同决定;BTEX污染源附近污染晕中形成了高浓度有机碳的典型特征。
关键词:BTEX;厌氧生物地球化学;电子受体
中图分类号:X523 文献标志码:A 文章编号:1672-7207(2013)06-2617-06
Anaerobic biogeochemical process in BTEX contaminated aquifer
WANG Xiao, QU Dan, ZHAO Sheng, SU Yan, TAO Yi, ZHOU Rui
(Key Laboratory of Groundwater Resources and Environment, Ministry of Education, Jilin University, Changchun130021, China)
Abstract: A lab-scale column was constructed to investigate the pollution process of aquifer by BTEX to analyze the variations of mass fraction of total organic carbon, sulfate, iron, inorganic nitrogen and soluble carbonate, and to clarify biogeochemical process of the pollution process. Experimental results indicate the dominating process is that microbes degrade electron donors-BTEX by using NO3-, Fe3+, SO42- and CO2 as electron acceptors; reduction reactions of NO3-, Fe3+ and SO42- take place in regions away from the inlet 70-89, 55-70 and 34-55 cm respectively; mineralization of organic nitrogen and corrosion that CO2 does on carbonate appear in whole contaminated region; generation of Iron(II) sulfide mainly happens in 0-55 cm, which makes total iron content here higher than the content in 55-70 cm; variation of soluble carbonate content was determined by the content of H+ which can dissolve it together with the generation of ferrous carbonate in 0-70 cm and corrosion effect which CO2 does no it in 70-89 cm. That high concentration of organic carbon generate in pollution plume near pollutants becomes typical characteristic.
Key words: BTEX; anaerobic biogeochemistry; electron acceptors
石油化工产品污染地下水和土壤是一个普遍存在的严重环境问题,BTEX(苯benzene,甲苯toluene,乙苯ethyl-benzene,二甲苯xylenes)是石油化工行业在生产、加工、储存和运输过程中容易释放到环境中的常见污染物,对生态系统及人体健康构成威胁[1-2]。BTEX在污染含水层中发生自然衰减的主要机理为生物地球化学作用[3-4]。因此,在污染源的下游会产生顺序氧化还原带,依次为:氧还原带、硝酸盐还原带、铁还原带、硫酸盐还原带以及产甲烷带[5-8]。本文作者模拟BTEX污染含水层的过程,通过分析污染前后含水层介质中总有机碳、硫酸盐、铁、无机氮和可溶性碳酸盐含量的空间变化情况,剖析含水层受BTEX污染过程中发生的生物地球化学作用,为受污染含水层BTEX自然衰减、强化自然衰减和工程修复的后续研究提供理论及数据支持,并对BTEX污染场地的风险评价和控制具有一定意义。
1 实验材料及方法
在实验室建立一维柱模拟BTEX污染含水层的过程。实验装置如图1所示,柱高98 cm,内径14 cm,侧部7个取样口距底部进水口距离依次为11,24,37,50,63,76和89 cm,并为柱子内部创造避光环境。柱中所填介质为细砂,表1所示为细砂理化性质,其pH为7.62。向实验用地下水中溶解苯、甲苯、乙苯和二甲苯,制成BTEX污染水,表2所示为污染水理化性质,其pH为7.05。马氏瓶中BTEX污染水由柱下部进入,上部流出,流速为8 cm/d。
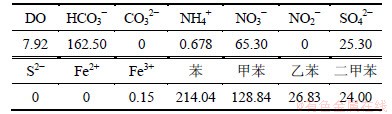
首先从7个侧口取水样,测定水样中溶解氧(DO),NO3-和NO2-,Fe3+和Fe2+,SO42-和S2-,HCO3-,BTEX的含量及氧化还原电位Eh。分析所测指标随时间以及在空间的变化情况,当模拟柱形成顺序氧化还原带时停止进水[6-7, 9]。继而测定各带介质中总有机碳、硫酸盐、铁、可溶性碳酸盐和无机氮(铵态氮、硝态氮和亚硝态氮)的含量,分析其在污染前后的含量变化情况。其中液相组分的测试方法采用《水和废水监测分析方法》[10],BTEX监测采用气相色谱法;含水层介质组分的测试方法为:总有机碳采用重铬酸钾容量法,硫酸盐含量采用硫酸钡容量法,不同形态铁采用Tessier顺序提取法[11],可溶性碳酸盐采用HCl滴定法,各形态氮采用氯化钾溶液提取-分光光度法。
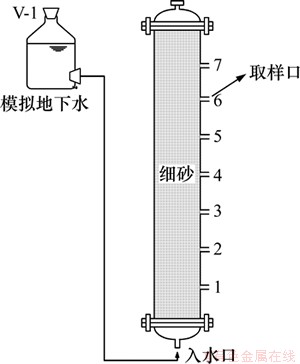
图1 实验装置示意图
Fig. 1 Diagram of experimental equipment
表1 细砂理化性质(质量分数)
Table 1 Physical and chemical properties of sands mg/kg
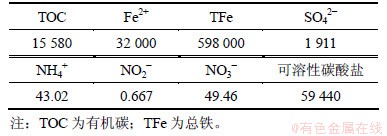
表2 模拟地下水理化性质(质量浓度)
Table 2 Physical and chemical properties of simulated groundwater mg/L
2 受污染含水层中厌氧生物地球化学作用
2.1 总有机碳
图2所示为受污染介质中总有机碳含量空间变化图。由图2可以看出:介质中有机碳含量在距入水口越近处越高,越远处越低。有机碳含量最高处达25.53 g/kg,为污染前的1.64倍。这是由于微生物降解介质吸附的BTEX时产生有机弱酸附着在介质上,使有机碳含量升高,且研究表明有机碳含量越高的土壤介质对有机物吸附能力越强[12]。因此模拟柱中污染越严重的区域有机碳含量越高,吸附BTEX能力越强,微生物降解BTEX所产生的有机碳含量也越高,形成了BTEX污染源附近污染晕中高浓度有机碳的典型特征。受污染越轻的区域,有机碳含量相对越低。
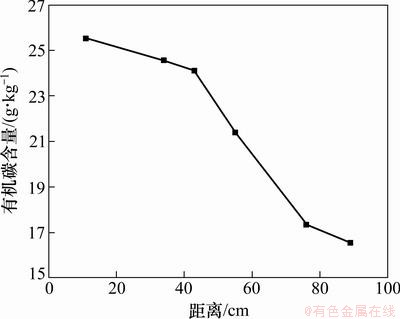
图2 介质中总有机碳含量空间变化
Fig. 2 Spatial variations of total organic carbon content in media
2.2 硫酸盐
未受污染介质中硫酸盐的含量为1.911 g/kg,图3所示为受污染介质中硫酸盐含量空间变化图。由图3可以看出:距入水口越近,硫酸盐含量越低;在距入水口89 cm处,硫酸盐含量为1.847 g/kg;自55 cm到34 cm处,硫酸盐含量从1.656 g/kg降至0.932 g/kg,34 cm处为污染前含量的48.77%。这是硫酸盐还原菌作用的结果。硫的生物还原包括硫的同化还原和异化还原2条途径,在强还原性土壤和沉积物中,硫可作为电子受体氧化有机物而发生异化还原,即硫酸根可成为重要的电子受体,有机物为电子供体,在微生物的参与下还原成硫化物[13]。因此,在34~55 cm处发生了硫的生物异化还原作用,硫酸盐还原菌利用SO42-作为电子受体,降解BTEX,使SO42-含量下降,以甲苯为代表,反应式如下。
C6H6+3.75SO42-+3H2O→2.25H++6HCO3-+3.75HS- (1)
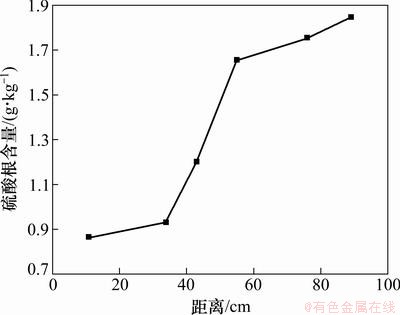
图3 介质中硫酸盐含量空间变化
Fig. 3 Spatial variations of sulfate content in media
而在BTEX污染更严重的0~34 cm处,根据微生物降解有机污染物利用电子受体存在顺序的原理判定此处已经发生过硫酸盐还原作用[7, 14-15],因此介质中硫酸盐含量最低。
总之受污染含水层中硫酸盐含量的变化由硫的生物还原作用决定,并且硫的生物还原作用发生在距模拟柱入水口34~55 cm处。
2.3 总铁、三价铁和二价铁
未受污染介质中总铁含量为598 g/kg,其中,三价铁和二价铁分别为495.742 g/kg和102.258 g/kg。受污染区域总铁量均下降,如图4所示;在距入水口0~70 cm处下降幅度较大,70~98 cm处下降幅度很小;且0~55 cm处相比55~70 cm处的下降趋势出现回升;55 cm处含量最低,为444.314 g/kg。三价铁含量在0~70 cm处发生了大幅度下降,11 cm处最低,较未污染介质含量降低了38.86%。二价铁在受污染区域中均有升高,尤其在0~50 cm处;11 cm处二价铁含量为224.942 g/kg,为未受污染介质的2.20倍。
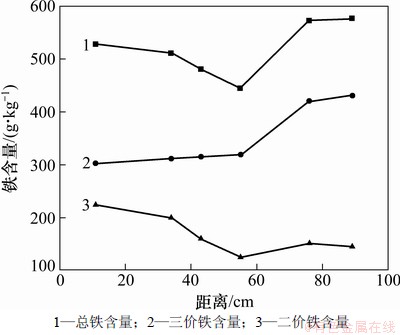
图4 介质中总铁、三价铁和二价铁含量空间变化
Fig. 4 Spatial variations of TFe, Fe3+ and Fe2+ contents in media
首先,在0~70 cm处总铁和三价铁含量的下降是由于发生了铁还原作用,即铁还原菌利用介质中Fe3+作为电子受体,降解BTEX,Fe3+转化为Fe2+进入液相,反应如式(2)所示,以甲苯为例;而70~98 cm尚未发生铁还原作用。其次,总铁从55 cm到入水口相比55~70 cm呈升高趋势是由于二价铁沉淀的生成。由2.2的分析知在0~55 cm处发生了硫酸盐还原反应,生成的HS-与Fe2+反应生成FeS沉淀,反应方程如式(3)所示。二价铁含量在70~98 cm处升高是因为55~70 cm处生成的Fe2+随水流的迁移作用。
C6H6+30Fe3++12H2O→6CO2+30H++30Fe2+ (2)
Fe2++H2S→FeS(s)+2H+ (3)
因此,介质0~70 cm处总铁及三价铁含量因铁还原菌作用下降;介质0~55 cm处总铁及二价铁含量因亚铁沉淀生成作用而较55~70 cm处有所升高;铁的生物还原作用发生在55~70 cm处。
2.4 无机氮
图5所示为受污染介质中无机氮含量空间变化图。首先未污染介质中NH4+-N含量为43.02 mg/kg,受污染后NH4+-N含量均有大幅度升高,最小增长倍数为12.67倍,发生在出水口附近,最大增长倍数为30.70倍,发生在距入水口34 cm处。分析可知NH4+-N含量的增加与介质中发生的有机氮矿化作用相关。有机氮矿化包括2个阶段:第1阶段为氨基化阶段,第2阶段为氨化阶段,如图6所示。一般土壤中的有机氮占总氮的90%以上,在有机物被降解的同时,发生有机氮矿化,使介质中NH4+-N含量升高[16-17]。因此,污染严重处NH4+-N含量较污染轻处增幅大。
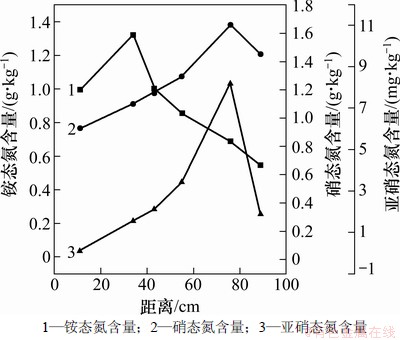
图5 介质中无机氮含量的空间变化
Fig. 5 Spatial variations of inorganic nitrogen content in media
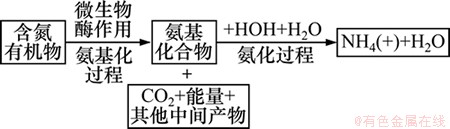
图6 有机氮矿化过程
Fig. 6 Mineralization of organic nitrogen
如图5所示,NO3--N含量相比未受污染介质中的49.46 mg/kg也有大幅度升高。污染轻的区域NO3--N含量增幅相对较大。在距柱入水口76 cm处,NO3--N含量达到最大值1 659.23 mg/kg,为未受污染介质的33.55倍。这是由硝化/反硝化作用导致,如图7所示。可以看出硝化作用要求环境满足其硝化需氧量[18]。在污染较轻处,可提供硝化过程所需氧量,因此发生了硝化作用,使得介质中NO3--N含量上升。
NO2--N含量有增有减,趋势与NO3--N保持一致。最大值为8.33 mg/kg,发生在距柱入水口约76 cm处,较污染前的0.667 mg/kg增大了12.49倍,说明此处的反硝化细菌最为活跃。反硝化细菌降解BTEX,而硝化作用生成的硝酸根又成为反硝化细菌降解BTEX的电子受体,以苯为例,反应方程式如下。
C6H6+6NO3-+6H+→6CO2+6H2O+3N2 (4)
综上所述,受BTEX污染的土壤介质中,氮的存在形态和含量由有机氮的矿化作用和硝化/反硝化作用共同决定。有机氮的矿化作用发生在整个受污染区域,硝化/反硝化作用集中发生在距离入水口70~89 cm处,矿化作用为硝化作用提供铵态氮,硝化为反硝化提供硝态氮。
2.5 可溶性碳酸盐
图8所示为介质中可溶性碳酸盐含量空间变化图。未受污染介质中可溶性碳酸盐含量为59.44 g/kg,受污染介质中含量均表现为不同程度的下降。有机质浓度越低处,可溶性碳酸盐含量相对较低,在76 cm处可溶性碳酸盐含量最低为23.50 g/kg,为未污染介质的39.54%,在氧还原带处,含量有升高趋势。
首先系列氧化还原过程伴随着H+的消耗与生成,H+会发生如式(5)的溶解作用使可溶性碳酸盐含量下降。通过实验测定,在模拟柱中,pH随着远离入水口而逐渐降低,从8.43降至7.21。因此H+溶解作用使远离入水口处的可溶性碳酸盐含量下降幅度较靠近入水口处大。
2 H++CaCO3→Ca2++H2CO3 (5)
其次由2.3分析可知在0~70 cm处已经经历或正在经历Fe3+还原过程,生成Fe2+,各还原菌降解BTEX时生成的HCO3-会与Fe2+反应生成FeCO3沉淀[19],反应如式(6),导致0~70 cm处介质中可溶性碳酸盐含量升高。
Fe2++HCO3-→FeCO3(s)+H+ (6)
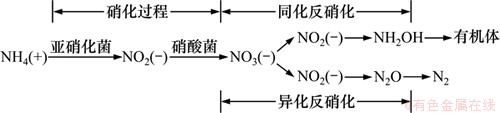
图7 硝化和反硝化过程
Fig. 7 Nitrification and denitrification process
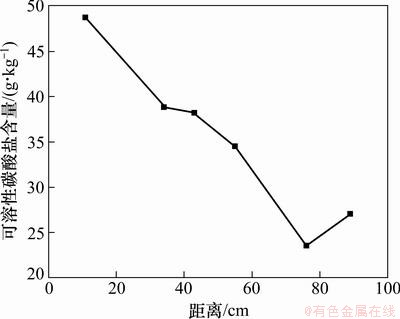
图8 介质中可溶性碳酸盐含量空间变化
Fig. 8 Spatial variations of soluble carbonates content in media
再者微生物活动产生的CO2会对碳酸盐产生溶蚀作用,如式(7)~(9)所示,因此,相比70 cm处,89 cm处污染较轻,微生物活动较弱,产生的CO2量较低,从而导致89 cm处的可溶性碳酸盐含量较70 cm处的高。
CO2+H2O=H2CO3 (7)
H2CO3=H++HCO3- (8)
CaCO3+H++HCO3-=Ca(HCO3)2 (9)
因此受污染含水层中可溶性碳酸盐含量变化由H+溶解作用,碳酸亚铁沉淀生成及CO2对碳酸盐的溶蚀作用共同决定。H+溶解作用使受污染介质中可溶性碳酸盐含量下降,碳酸亚铁沉淀生成作用发生在0~70 cm处,CO2对碳酸盐的溶蚀作用主要发生在70~89 cm。
3 结论
(1) BTEX污染源附近污染晕中形成了高浓度有机碳的典型特征。
(2) 硫的生物还原作用发生在距入水口34~55 cm处;使该处介质中的硫酸盐含量下降。
(3) 铁的生物还原作用发生在距入水口55~70 cm处,加之微生物利用电子受体顺序,导致0~70 cm处介质总铁和三价铁含量下降;0~55 cm处发生了硫化亚铁沉淀生成作用,导致该处总铁较55~70 cm处升高。
(4) 有机氮矿化作用发生在整个受污染区域,硝化/反硝化作用集中发生在距入水口70~89 cm处,他们共同决定了氮的存在形态和含量,矿化作用为硝化作用提供铵态氮,硝化为反硝化提供硝态氮。
(5) H+溶解作用导致污染后介质可溶性碳酸盐含量下降;CO2的溶蚀作用发生在70~89 cm处,导致此处可溶性碳酸盐含量降低,且污染较重区域含量较低;0~70 cm处发生的碳酸亚铁沉淀生成作用使可溶性碳酸盐含量升高。
参考文献:
[1] An Y J. Toxicity of benzene, toluene, ethylbenzene, and xylene (BTEX) Mixtures to Sorghum bicolor and Cucumis sativus.Bull[J]. Bulletin of Environmental Contamination and Toxicology, 2004, 72: 1006-1011.
[2] 范亚维, 周启星. BTEX的环境行为与生态毒理[J]. 生态学杂志, 2008, 27(4): 632-638.
FAN Yawei, ZHOU Qixing. Research advances on environmental behavior and ecological toxicology of BTEX[J]. Chinese Journal of Ecology, 2008, 27(4): 632-638.
[3] Ojuri O O, Ola S A. Plume Behaviour for Petroleum Hydrocarbon in a Tropical sand tank: Laboratory Experiments and scenario-specific modeling[J]. European Journal of Scientific Research, 2010, 28(2): 523-541.
[4] 周睿, 赵勇胜, 任何军, 等. BTEX在地下环境中的自然衰减[J]. 环境科学, 2009, 30(9): 2804-2808.
ZHOU Rui, ZHAO Yongsheng, REN Hejun, et al. Natural attenuation of BTEX in the underground environment[J]. Environmental Science, 2009, 30(9): 2804-2808.
[5] Rittmann B E. Definition, objectives and evaluation of natural attenuation[J]. Biodegradation, 2004, 15(6): 349-357.
[6] Christonsen T H, Kjeldsen P, Bjerg P L, et al. Biogeochemistry of landfill leachate plumes[J]. Applied Geochemistry, 2001, 16(6/7): 659-718.
[7] Christonsen T H, Bjerg P L, Banwart S A, et al. Characterization of redox conditions in groundwater contaminant plumes[J]. Journal of Contaminant Hydrology, 2000, 45(3/4): 165-241.
[8] Basberg L, Banks D, Saether O M. Redox processes in groundwater impacted by landfill leachate[J]. Aquatic Geochemistry, 1998, 4(2): 253-272.
[9] 董军, 赵勇胜, 韩融, 等. 垃圾渗滤液污染羽在地下环境中的分带现象研究[J]. 环境科学, 2006, 27(9): 1091-1095.
DONG Jun, ZHAO Yongsheng, HAN Rong, et al. Study on redox zones of landfill leachate plume in subsurface environment[J]. Chinese Journal of Environmental Science, 2006, 27(9): 1901-1905.
[10] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社, 2002: 88-285.
State Environmental Protection Administration of China. Water and wastewater monitoring and analysis method[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 88-285.
[11] 王亚平, 黄毅, 王苏明, 等. 土壤和沉积物中元素的化学形态及其顺序提取法[J]. 地质通报, 2005, 24(8): 728-734.
WANG Yaping, HUANG Yi, WANG Suming, et al. Chemical speciation of elements in sediments and soils and their sequential extraction process[J]. Geological Bulletin of China, 2005, 24(8): 728-734.
[12] Isaacson P J, Frink C R. Nonreversible sorption of phenolic compounds by sediments fractions: The role of sediment organic matter[J]. Environment Science and Technology, 1984, 18(1): 43-48.
[13] Anderson R T, Lovely D R. Anaerobic bioremediation of benzene under sulfate-reducing conditions in a petroleum- contaminated aquifer[J]. Environment Science and Technology, 2000, 34(11): 2261-2266.
[14] Heider J, Sporman A M, Beller H R, et al. Anaerobic bacterial metabolism of hydrocarbons[J]. FEMS Microbiology Review, 1999, 22(5): 447-498.
[15] Borden R C, Gomez C A, Becker M T. Geochemical indicators of intrinsic bioremediation[J]. Groundwater, 1995, 33(2): 180-189.
[16] 王艳杰, 邹国元, 付桦, 等. 土壤氮素矿化研究进展[J]. 中国农学通报, 2005, 21(10): 203.
WANG Yanjie, ZOU Guoyuan, FU Hua, et al. Development and advance of soil nitrogen mineralization[J]. Chinese Agricultural Science Bulletin, 2005, 21(10): 203.
[17] DOU Junfeng, LIU Xiang, HU Zhifeng, et al. Anaerobic BTEX biodegradation linked to nitrate and sulfate reduction[J]. Journal of Hazardous Materials, 2008, 151(2/3): 720-729.
[18] Postma D, Boesen C, Kristiansen H, et al. Nitrate reduction in an unconfined sandy aquifer: water chemistry, reduction processes, and geochemical modeling[J]. Water Resources Research, 1991, 27(8): 2027-2045.
[19] Banwart S A. Reduction of iron(Ⅲ) minerals by natural organic matter in groundwater[J]. Geochimical et Cosmochimica Acta, 1999, 63(19): 461-467.
(编辑 杨幼平)
收稿日期:2012-06-04;修回日期:2012-10-22
基金项目:吉林省科技发展计划项目(201101020);国家环保公益性行业科研专项(201009009)
通信作者:周睿(1980-),女,辽宁抚顺人,博士,讲师,从事污染场地修复方向研究;电话:13504417567;E-mail:zhour@jlu.edu.cn