文章编号:1004-0609(2013)11-3218-07
配合-沉淀体系中铁与钴、镍的分离性能
韩新罡,席晓丽,马立文,聂祚仁,周志理
(北京工业大学 材料科学与工程学院,北京 100124)
摘 要:研究不同配合-沉淀体系中铁与钴、镍的分离性能。通过热力学理论计算预测碳酸体系、氨水体系和碳酸-氨水体系中溶液金属离子浓度与pH值之间的关系,结合实验确定碳氨体系具有最佳的除铁效果,能保证较小的钴、镍损失,且有利于后续钴、镍的分离。通过条件实验确定碳氨体系最佳除铁工艺条件如下:(CoNi)/Fe3+浓度比为1.5~2.5,氨水浓度为1 mol/L,Na2CO3浓度为0.01 mol/L,pH值为4.0。在(CoNi)/Fe3+浓度比为2.5,其他条件为最佳条件时,除铁率>99%,钴的损失率为11.4%,镍的损失率为10.6%。该方法除铁效果明显、过滤性能良好,具有较好的应用前景。
关键词:配合-沉淀体系;钴;镍;除铁
中图分类号:P618.31;TF815;TF816 文献标志码:A
Separation properties of ion to cobalt and nickel in complexation-precipitation system
HAN Xin-gang, XI Xiao-li, MA Li-wen, NIE Zuo-ren, ZHOU Zhi-li
(College of Material Science and Engineering, Beijing University of Technology, Beijing 100124, China)
Abstract: The separation properties of ion to cobalt and nickel in complexation-precipitation system were studied. The relationship between metal ion concentration and pH value in the complexation-precipitation systems of carbonate system, ammonia system and carbonate-ammonia system was simulated by the thermodynamic calculation. Combined with the experiments, the carbonate-ammonia system was considered as the best ion-removal system, which can guarantee a high iron removal efficiency, small amount of cobalt, nickel lost, and is conducive to the subsequent separation of cobalt and nickel. The results show that the optimal ion-removal conditions in carbonate-ammonia system are determined as follows: (CoNi)/ Fe3+ concentration ratio of 1.5-2.5; ammonia concentration of 1 mol/L; Na2CO3 concentration of 0.01 mol/L; pH value of 4.0. Under this condition of (CoNi)/ Fe3+=2.5, the ion-removal rate is over 99%, the cobalt loss rate is about 11.4%, and the nickel loss rate is 10.6%. This ion-removal method has the advantages of high iron removal efficiency, favorable filtration performance and good application prospect.
Key words: complexation-precipitation system; cobalt; nickel; ion removal
钴是重要的战略金属,具有耐高温、耐腐蚀、高强度和强磁性等特点[1]。镍是一种近似银白色的金属,具有铁磁性和延展性,能导电和导热,主要用途为不锈钢、合金钢、特种钢、镍基合金、电镀和非金属领域[2]。钴、镍金属及其化合物应用广泛,但中国钴资源比较稀缺,以贫矿居多,独立成矿的钴矿物仅占5%,每年需从国外进口钴约1 000~1 200 t[3]。中国镍矿产量的增长速度低于镍的消费增长速度,自给率逐年降低,只能通过大量进口各种镍产品来满足国内日益增长的镍需求[4]。因此,充分有效地回收利用钴、镍二次资源具有重大意义。
钴、镍二次资源种类繁多,如含钴和镍的工业废液、工业废渣、废旧合金、废催化剂等,它们除含钴、镍外,还含有大量的其他元素,如铁、锰、铬、铜、锌、铝、钙、镁等,有效分离这些金属元素是回收钴、镍二次资源中的一个重要问题[5]。某些钴、镍废料中铁含量(质量分数)较高,能达到3.76%~13.87%[6-7],有效除铁对于这类钴、镍二次资源的回收利用十分必要。传统的除铁方法有黄钠铁矾法[8]、针铁矿法[9]、赤铁矿法[10-11]、硫化物沉淀法[12]和中和水解法等。这些方法虽然较为成熟,但仍然具有改进的空间。例如,利用黄钠铁矾法或针铁矿法除铁[13-14],实验条件要求温度大于90 ℃,并伴随一定的搅拌,实验过程比较复杂、实验条件的控制要求较高、反应时间相对较长。例如,自贡某材料公司钴冶车间钴渣溶解后, 采用中和水解法除铁, 铁渣以Fe(OH)3胶体存在, 过滤性差且渣湿, 渣中夹带的金属含量较高(w(Ni+Co)在20%~30%之间),铁渣送洗后,金属的回收率只有50%~60%[15]。
为了尽可能提高除铁率同时保证钴、镍的回收率,可以考虑在常规沉淀除铁的方法上进行改进,利用配合剂和沉淀剂构成配合-沉淀体系,将配合作用和沉淀作用相结合,使钴、镍以配合物的形式配合于溶液中,而铁以沉淀物的形式单独从溶液中分离出来。近年来,金属分离的相关研究不仅集中在传统的工艺流程开发上[16],还体现在热力学和动力学模型的建立上[17-19]。因此,针对钴、镍二次资源成分特性,以配合-沉淀体系理论研究为指导开发金属分离工艺,对于钴、镍二次资源的处理将具有良好的适用性。
本文作者为研究钴、镍二次资源中的除铁问题,以钴、镍、铁为金属元素,OH-、NH3为配合剂,OH-、CO32-为沉淀剂,构建配合-沉淀体系,通过热力学计算从理论上分析不同配合-沉淀体系的除铁效果,再根据理论预测,进行实验验证,从而实现钴、镍、铁溶液除铁效果的优化。
1 实验
1.1 配合-沉淀体系热力学计算
以钴、镍、铁为金属元素(Me), OH-、NH3为配合剂,OH-、CO32-为沉淀剂,可以构建Me-CO32--H2O体系(以下简称碳酸体系)、Me-NH3-H2O体系(以下简称氨水体系)、Me-NH3-CO32--H2O体系(以下简称碳氨体系)3个配合-沉淀体系,这些体系主要化学反应及平衡常数见表1。根据表1化学反应及平衡常数结合质量守恒定律及同时平衡原理,可以建立各体系金属离子浓度[Mex+]([Mex+]为[Ni2+]、[Co2+]、[Fe2+]、[Fe3+])与溶液参数pH值的关系图(lg[Mex+]—pH图),从理论上分析镍、钴、铁在溶液中的分离行为,为充分除铁提供理论依据。
表1 配合-沉淀体系涉及的化学反应及平衡常数[20]
Table 1 Chemical reactions and equilibrium constants in complexation-precipitation system[20]

1.2 配合-沉淀体系验证实验
采用实验分别验证碳酸体系、氨水体系和碳氨体系中各金属离子浓度与溶液pH值的关系。取0.02 mol/L Na2CO3溶液10 mL,与混合金属模拟液(0.25 mol/L Co2++0.25 mol/L Ni2++0.1 mol/L Fe3+)10 mL混合、搅拌,调节pH值为3~5,沉淀、过滤、洗涤,用电感耦合等离子体原子发射光谱仪(ICP-AES, Optima 7000DV, PerkinElmer, USA)检测过滤前后溶液的金属离子浓度,计算碳酸体系镍、钴、铁的沉淀率。取2 mol/L氨水10 mL,与混合金属模拟液(0.25 mol/L Co2++0.25 mol/L Ni2++0.1 mol/L Fe3+)10 mL混合、搅拌,调节pH值为3~7,沉淀、过滤、洗涤,计算氨水体系镍、钴、铁的沉淀率。取3 mol/L氨水、0.03 mol/L Na2CO3溶液各10 mL,与混合金属模拟液(0.25 mol/L Co2++0.25 mol/L Ni2++0.1 mol/L Fe3+)10 mL混合、搅拌,控制溶液中氨水浓度为1 mol/L,[CO32-]=0.01 mol/L,调节pH值为3~6.5,沉淀、过滤、洗涤,计算碳氨体系镍、钴、铁的沉淀率。
1.3 碳氨体系条件实验
对碳氨体系中不同实验参数进行条件实验。首先考察与不同金属离子配比对金属沉淀率的影响,分别取混合金属模拟液(0.15 mol/L Co2++0.15 mol/L Ni2++ 0.1 mol/L Fe3+、0.25 mol/L Co2++0.25 mol/L Ni2++0.1 mol/L Fe3+、0.35 mol/L Co2++0.35 mol/L Ni2++0.1 mol/L Fe3+)10 mL,与碳氨溶液(3 mol/L氨水+0.03 mol/L Na2CO3)20 mL混合、搅拌,调节pH=4,沉淀、过滤、洗涤,计算碳氨体系镍、钴、铁的沉淀率。然后考察氨水浓度对金属沉淀率的影响,分别取3 mol/L氨水5、10和15 mL,与0.03 mol/L Na2CO3溶液10 mL和混合金属模拟液(0.25 mol/L Co2++0.25 mol/L Ni2++0.1 mol/L Fe3+)10 mL混合,控制pH=4,沉淀、过滤、洗涤,计算碳氨体系镍、钴、铁的沉淀率。
2 结果与讨论
2.1 配合-沉淀体系理论预测与实验验证
2.1.1 碳酸体系
对碳酸体系进行热力学计算,碳酸体系中CO32-作为沉淀剂,而OH-既可以作为弱配合剂又可以作为沉淀剂。体系主要化学反应及平衡常数见表1。根据表1中的化学反应、平衡常数和质量守恒定律,通过平衡原理可以建立体系中各反应物种的平衡关系,设置[C]=0.01 mol/L(总的碳酸根离子浓度),利用Matlab编制程序得到碳酸体系中的lg[Mex+]—pH理论曲线(见图1)。由图1可知,在Na2CO3量一定的情况下,溶液中各金属离子浓度均随着pH值的增加而减小,其中Fe3+在pH=3时,浓度<10-5 mol/L,实现完全沉淀,而其他金属完全沉淀的pH值均需大于5.5。这说明理论上在pH 3.0~5.5条件下,Fe3+与Ni2+、Co2+有分离效果,而Fe2+不能与Ni2+、Co2+分离。
在碳酸体系中进行除铁的实验验证。图2所示为碳酸浓度为0.01 mol/L时碳酸体系各金属沉淀率—pH实验曲线。由图2可知,在碳酸体系中,在pH值为3.4~4.7范围内,Fe3+基本沉淀完全,沉淀率均大于98%;Ni2+和Co2+的沉淀率随着pH值的增加而增加,pH=2.4时,镍的沉淀率为27.3%,钴的沉淀率为35.5%,当pH>4.6时,钴、镍沉淀率均>40%。这说明在实际碳酸体系中,由于碳酸根的对镍、钴、铁均有沉淀作用,导致除铁率在pH<5的范围内能够接近100%,但钴、镍也部分沉淀,损失率较高,对后续钴、镍回收不利,故碳酸体系不适合用于钴、镍二次资源回收过程中的除铁。

图1 碳酸体系中lg[Mex+]—pH理论曲线
Fig. 1 Theoretical lg[Mex+]—pH curves in carbonate system
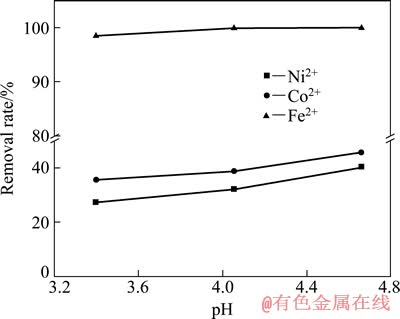
图2 碳酸体系中金属沉淀率—pH实验曲线
Fig. 2 Experimental metal removal rate—pH curves in carbonate system
2.1.2 氨水体系
对氨水体系进行热力学计算,氨水体系中NH3作为配合剂,而OH-既可以作为弱配合剂又可以作为沉淀剂。体系主要化学反应及平衡常数见表1。建立体系中各反应物种的平衡关系式,设置[N]=1 mol/L(总的氨水浓度),利用Matlab编制程序得到氨水体系中的lg[Mex+]—pH理论曲线(见图3)。由图3可知,在氨水量一定的情况下,溶液中各金属离子浓度随着pH值的增加而减小,其中Fe3+在pH=3时,实现完全沉淀,而其他金属完全沉淀的pH值均需大于8。这说明由于氨水的配合作用,理论上在pH<8条件下,使得Fe3+与Ni2+、Co2+具有较好的分离效果,而Fe2+不能与Ni2+、Co2+分离。此外,由于氨水对Ni2+和Co2+的配合能力较强,钴、镍很容易同时被配合在溶液中,这使得氨水体系虽然具有较好的除铁效果,但后续分离钴、镍的性能较差。

图3 氨水体系中lg[Mex+]—pH理论曲线
Fig. 3 Theoretical lg[Mex+]—pH curves in ammonia system
在氨水体系中进行除铁的实验验证。图4所示为氨水浓度为1 mol/L时氨水体系各金属沉淀率—pH实验曲线。由图4可知,在pH值为4.0~7.0范围内,随着pH值的增大,金属钴、镍和铁的沉淀率均增大;其中铁的沉淀率保持在94%以上;pH=4时,镍和钴的沉淀率分别为5.16%和9.25%;pH=7.0时,镍和钴的沉淀率分别为19.8%和23.0%。这说明在酸性pH值范围,铁能够与镍、钴实现较好的分离,保证除铁率较高,而钴、镍损失率较低。氨水体系在pH=5时仍然具有较好的铁与镍、钴分离的效果,与理论预测基本相符。此外,实验中还发现,铁的沉淀形式主要为Fe(OH)3胶体,过滤非常困难。总体说来,氨水体系存在低pH值除铁过滤困难、高pH值钴和镍分离困难的缺陷,不利于钴、镍二次资源的回收。

图4 氨水体系中金属沉淀率—pH实验曲线
Fig. 4 Experimental metal removal rate—pH curves in ammonia system
2.1.3 碳氨体系
对碳氨体系进行热力学计算,碳氨体系中CO32-作为沉淀剂,NH3作为配合剂,而OH-既可以作为弱配合剂又可以作为沉淀剂。体系主要化学反应及平衡常数见表1。建立体系中各反应物种的平衡关系式,设置[C]=0.01 mol/L,[N]=1 mol/L,利用Matlab编制程序得到碳氨体系中的lg[Mex+]—pH理论曲线(见图5)。由图5可知,在氨水和碳酸钠量一定的条件下,溶液中各金属离子浓度随着pH值增加呈现下降的趋势,其中Fe3+在pH=3时,实现完全沉淀,而其他金属完全沉淀的pH值均需大于5.5。这说明由于氨水和碳酸根的共同作用,理论上在pH<5.5条件下,使得Fe3+与Ni2+、Co2+具有分离效果,而Fe2+不能与Ni2+、Co2+分离。此外,由于氨水对Ni2+和Co2+的配合能力较强,而碳酸根对Ni2+和Co2+的沉淀能力有所差异,致使在碳氨体系中钴、镍不像在氨水体系中那样均被配合在溶液中,而是具有配合差异,能够保证后续分离的效果。

图5 碳氨体系中lg[Mex+]—pH理论曲线
Fig. 5 Theoretical lg[Mex+]—pH curves in carbonate- ammonia system
在碳氨体系中进行除铁的实验验证。图6所示为氨水浓度为1 mol/L、碳酸浓度为0.01 mol/L时碳氨体系各金属沉淀率—pH实验曲线。由图6可知,在pH值为3.5~6.0范围内,随着pH值增大,金属钴、镍和铁的沉淀率均增大;其中铁的沉淀率在pH=3.6时达到到94%以上;pH>4时,沉铁率几乎达100%;镍和钴的沉淀率在pH=3.6时分别为9.1%和9.3%,在pH=6.0时分别为18.4%和22.3%。这说明在酸性pH值范围,铁能够与镍、钴实现较好的分离,保证除铁率较高,而钴、镍损失率较低。碳氨体系在pH<5.5时具有较好的铁与镍、钴分离的效果,这与理论预测基本相符。此外,实验中还发现,生成的铁沉淀与溶液分层明显,极易过滤,这可能是由于产生的少量碳酸盐沉淀附着于Fe(OH)3胶体上,改变了其胶体沉降特性。总体说来,碳氨体系在低pH值除铁过滤较容易,最优pH值为4.0,且在高pH值能够分离钴、镍,有利于钴、镍二次资源的回收。

图6 碳氨体系中金属沉淀率—pH实验曲线
Fig. 6 Experimental metal removal rate—pH curves in carbonate-ammonia system
2.2 碳氨体系除铁工艺优化
由2.1节可以知,碳氨体系在pH值为4.0时,对钴、镍溶液具有较好的除铁效果,能保证除铁率较高,而钴、镍损失率较低,且有利于后续钴、镍分离,因此,有必要研究碳氨体系的除铁工艺优化。
2.2.1 金属离子配比的影响
图7所示为氨水浓度为1 mol/L、碳酸浓度为0.01 mol/L、pH=4时碳氨体系各金属离子沉淀率与(CoNi)/Fe3+浓度比的关系曲线。由图7可知,在碳氨体系中,(CoNi)/Fe3+浓度比在一定范围内对金属沉淀率的影响不大,但随着(CoNi)/Fe3+浓度比的增加,镍、钴、铁的沉淀率缓慢增加,这是因为溶液中镍和钴的浓度增大时会消耗更多的配合剂,使铁更容易沉淀,同时镍、钴浓度增大也使自身的沉淀趋势增大。当(CoNi)/Fe3+浓度比从1.5增加到2.5时,钴、镍的损失率分别从13.4%和10.7%变化到12.9%和10.9%;当(CoNi)/Fe3+浓度比为3.5时,钴、镍损失率分别上升到18.7%和13.2%,而铁的沉淀率均>97%。经综合考虑,选择合适的(CoNi)/Fe3+浓度比为1.5~2.5。

图7 (CoNi)/Fe3+浓度比对镍、钴、铁沉淀率的影响
Fig. 7 Effect of concentration ratio of (CoNi)/Fe3+ on removal rates of Ni2+, Co2+ and Fe3+
2.2.2 氨水的影响
图8所示为碳酸浓度为0.01 mol/L、溶液pH=4时碳氨体系各金属离子沉淀率与氨水浓度的关系曲线。

图8 氨水浓度对镍、钴、铁沉淀率的影响
Fig. 8 Effect of ammonia concentration on removal rates of Ni2+, Co2+ and Fe3+
由图8可知,在碳氨体系中,随着氨水浓度的增加,溶液中金属钴、镍和铁的沉淀率均呈增加趋势。当氨水浓度为1 mol/L时,铁沉淀率为97.5%,钴的沉淀率为12.9%,镍的沉淀率为10.8%,从减小钴镍损失和原料消耗的角度考虑,选择最佳的氨水浓度为1 mol/L。
2.2.3 碳氨体系除铁优势
NaOH沉淀法除铁过程中一般都有胶体产生,沉淀与溶液分层不明显,因而过滤困难,一般要采用加压抽滤等措施。而在碳氨体系除铁过程中,溶液中产生的沉淀与溶液分层明显,过滤容易且迅速,能够大大增加处理效率,降低处理成本。
为此,对NaOH沉淀法除铁及碳氨体系除铁的滤渣进行了SEM分析,以说明两者在过滤性能方面的差别。对NaOH沉淀法除铁及碳氨体系除铁的滤渣进行SEM分析,结果如图9~10所示。
图9所示为NaOH沉淀法除铁滤渣SEM像及EDS谱。从图9(a)和(b)可以看出,其滤渣颗粒细小且团聚;从图9(c)可以看出,滤渣中除含有大量杂质铁外,还吸附有钴、镍等元素。这与该体系沉铁时产生大量胶体,过滤困难,过滤性能差,钴镍损失较大的实验现象相符。

图9 NaOH沉淀法除铁滤渣的SEM像及EDS谱
Fig. 9 SEM images and EDS pattern of Fe precipitate by NaOH
图10所示为碳氨体系除铁滤渣SEM像及EDS谱。从图10(a)和(b)可以看出,其滤渣颗粒粗大且分散;从图10(c)可以看出,滤渣中只含有大量杂质铁,几乎没有钴、镍元素。这与该体系沉铁过滤容易且迅速,过滤性能良好,钴、镍损失小的实验现象相符,说明碳氨体系具有较好的沉铁优势。

图10 碳氨体系滤渣的SEM像及EDS谱
Fig. 10 SEM images and EDS pattern of Fe precipitate in NH3-CO32- system
3 结论
1) 通过热力学理论计算,借助Matlab,从理论上模拟了碳酸体系、氨水体系和碳氨体系中镍、钴、铁3种金属的分离行为,并通过分离实验进行验证,发现碳氨体系具有最佳的除铁效果,能保证较小的钴、镍损失,且有利于后续钴、镍的分离。
2) 通过模拟液条件实验,确定了碳氨体系除铁的最佳条件如下:(CoNi)/Fe3+浓度比为1.5~2.5,氨水浓度为1 mol/L,Na2CO3浓度为0.01 mol/L,pH值为4。在(CoNi)/Fe3+浓度比为2.5,其他条件为最佳条件时,除铁率>99%,钴的损失率为11.4%,镍的损失率为10.6%; 与NaOH沉淀法除铁相比,碳氨体系具有更好的过滤性能,其滤渣粗大且分散,过滤性能良好。
REFERENCES
[1] 郭学益, 姚 标, 李晓静, 石文堂, 田庆华. 水钴矿中选择性提取铜和钴的新工艺[J]. 中国有色金属学报, 2012, 22(6): 1778-1784.
GUO Xue-yi, YAO Biao, LI Xiao-jing, SHI Wen-tang, TIAN Qing-hua. Novel process of selective extraction of copper and cobalt from heterogenite[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(6): 1778-1784.
[2] 朱凌霄. 镍资源及利用[J]. 新疆有色金属, 2011(5): 27-29.
ZHU Ling-xiao. Nickel resource and its utilization [J]. Xinjiang Nonferrous Metals, 2011(5): 27-29.
[3] 吉鸿安. 锂离子电池正极废料中钴和锂的回收[J]. 甘肃冶金, 2012, 34(4): 63-66.
JI Hong-an. Recovery of cobalt and lithium from anode scrap of exhausted Li-ion batteries[J]. Gansu Metallurgy, 2012, 34(4): 63-66.
[4] 程 波. 镍市的中国因素[J]. 中国金属通报, 2011(14): 18-19.
CHENG Bo. China factors in nickel market[J]. China Metal Bulletin, 2011(14): 18-19.
[5] KANG J, SOHN J, CHANG H, SENANAYAKE G, SHIN S M. Preparation of cobalt oxide from concentrated cathode material of spent lithium ion batteries by hydrometallurgical method[J]. Advanced Powder Technology, 2010, 21(2): 175-179.
[6] 陈 亮, 唐新村, 张 阳, 瞿 毅, 王志敏.从废旧锂离子电池中分离回收钴镍锰[J]. 中国有色金属学报, 2011, 21(5): 1192-1198.
CHEN Liang, TANG Xin-cun, ZHANG Yang, QU Yi, WANG Zhi-min. Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1192-1198.
[7] 李金辉, 李新海, 周友元, 胡启阳, 张 明, 张琏鑫. 镍钴锰三元电池废料浸出液除铜铁净化[J]. 过程工程学报, 2009, 9(4): 676-681.
LI Jin-hui, LI Xin-hai, ZHOU You-yuan, HU Qi-yang, ZHANG Ming, ZHANG Lian-xin. Purification of leaching solution of spent NixCoyMnz battery material by removing Cu and Fe[J]. The Chinese Journal of Process Engineering, 2009, 9(4): 676-681.
[8] 黄震海. 低污染黄钾铁矾法除铁的生产实践[J]. 大众科技, 2012(1): 171-172.
HUANG Zhen-hai. Low pollution jarosite process to remove iron and production practice[J]. Dazhong Keji, 2012(1): 171-172.
[9] ISMAEL M, CARVALHO J. Iron recovery from sulphate leaching liquors in zinc hydrometallurgy[J]. Minerals Engineering, 2003, 16(1): 31-39.
[10] RIVEROS P, DUTRIZAC J. The precipitation of hematite from ferric chloride media[J]. Hydrometallurgy, 1997, 46(2): 85-104.
[11] RIVEROS P, DUTRIZAC J. The precipitation of hematite from ferric chloride media at atmospheric pressure[J]. Metallurgical and Materials Transactions, 1999, 30(6): 993-1001.
[12] TABAK H H, SCHARP R, BURCKLE J, KAWAHARA F K, GOVIND R. Advances in biotreatment of acid mine drainage and biorecovery of metals: 1. Metal precipitation for recovery and recycle[J]. Biodegradation, 2003, 14(3): 423-426.
[13] 王英彬. 黄钠铁矾法除铁在阜冶的应用浅析[J]. 新疆有色金属, 2011(S2): 112-114.
WANG Ying-bin. Study on removal of iron by natrium jarosite in Fuyie[J]. Xinjiang Nonferrous Metals, 2011(S2): 112-114.
[14] 陈红彬. 用针铁矿法从钴白合金酸浸液中除铁研究[J]. 金属材料与冶金工程, 2012, 40(4): 28-29.
CHEN Hong-bin. Iron removal from acidic leaching solution of Co white alloy by goethite process[J]. Metal Materials and Metallurgy Engineering, 2012, 40(4): 28-29.
[15] 孙亚丽, 李 涛, 黄 新, 唐 楷, 余祖孝, 金永中. 钴溶液中除铁工艺的研究[J]. 化学工程师, 2008(11): 4-6.
SUN Ya-li, LI Tao, HUANG Xin, TANG Kai, YU Zu-xiao, JIN Yong-zhong. Study on elimination of iron in cobalt solution[J]. Chemical Engineer, 2008(11): 4-6.
[16] 石剑锋, 王志兴, 胡启阳, 郭华军, 李新海, 彭文杰. 硫酸氢铵硫酸化焙烧法红土镍矿提取镍钴[J]. 中国有色金属学报, 2013, 23(2): 510-515.
SHI Jian-feng, WANG Zhi-xin, HU Qi-yang, GUO Hua-jun, LI Xin-Hai, PENG Wen-jie. Recovery of nickel and cobalt from nickel laterite ore by sulfation roasting method using ammonium bisulfate[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(2): 510-515.
[17] TIAN Q H, GUO X Y, YI Y, LI Z H. Kinetics of oxidation-precipitation of cobalt(Ⅱ) from solution by ozone[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(S1): s42-s45.
[18] 熊富强, 桂卫华, 阳春华, 李勇刚. 基于针铁矿法的沉铁过程动态建模[J]. 中南大学学报: 自然科学版, 2012, 43(2): 541-547.
XIONG Fu-qiang, GUI Wei-hua, YANG Chun-hua, LI Yong-gang. Dynamic modeling for process of iron precipitation based on goethite method[J]. Journal of Central South University: Science and Technology, 2012, 43(2): 541-547.
[19] 马立文, 聂祚仁, 席晓丽, 韩新罡. Co-Ni-Fe-Mn配合-沉淀体系的平衡热力学[J]. 中国有色金属学报, 2013, 23(2): 516-527.
MA Li-wen, NIE Zuo-ren, XI Xiao-li, HAN Xin-gang. Thermodynamic equilibrium in Co-Ni-Fe-Mn complexation- precipitation system[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(2): 516-527
[20] DEAN J A.兰氏化学手册[M]. 2版. 魏俊发, 等译. 北京: 科学出版社, 2003: 8.80-8.104.
DEAN J A. Lange’s handbook of chemistry[M]. 2nd ed. WEI Jun-fa, et al transl. Beijing: Science Press, 2003: 8.80-8.104.
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(51174010);北京市自然科学基金资助项目(2132016)
收稿日期:2012-10-09;修订日期:2013-08-01
通信作者:席晓丽,教授,博士;电话:010-67391536;E-mail:xixiaoli@bjut.edu.cn