微生物异化还原大洋多金属结核的机理
赖斌1,刘欣伟1, 2,李浩然1
(1. 中国科学院 过程工程研究所 生化工程国家重点实验室,北京,100080;
2. 北京科技大学 土木与环境工程学院,北京,100083)
摘要:为考查异化还原微生物在浸出金属氧化物中的行为,从大洋海底沉积物中分离出能异化还原金属氧化矿的金属还原菌,在厌氧条件下进行异养微生物异化还原浸出大洋多金属结核的实验,Mn,Co,Ni和Cu的浸出率分别为98.6%,96.4%,95.8和89.6%。利用Geobacter metallireducens 构建微生物燃料电池,研究微生物异化还原金属氧化物的机理。研究结果表明:微生物将金属氧化物作为其呼吸作用的最终电子受体,以直接吸附接触方式还原金属氧化物,并在其颗粒表面形成生物膜,这种生物膜在异化还原过程中起关键作用。
关键词:大洋多金属结核; 金属氧化物; 生物膜; 异化还原; 金属还原菌
中图分类号:TF 111.311; TF 803.21; Q 939.99 文献标志码:A 文章编号:1672-7207(2011)S2-0356-05
Mechanism of microbial dissimilatory reduction marine nodules
LAI Bin1, LIU Xin-wei1, 2, LI Hao-ran1
(1. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering,
Chinese Academy of Sciences, Beijing 100080, China
2. Civil and Environmental Engineering School,
University of Science and Technology Beijing, Beijing 100083, China)
Abstract: In order to study the behavior of microbial dissimilatory reduction in the process of bioleaching metal oxide, dissimilatory metal reducing microorganism (DMRM) was isolated from deep sea floor sediment of the pacific ocean. The DMRM was adopted to the bioleaching process of the metals in marine manganese nodules of deep sea bed under anaerobic leaching condition. The leaching rates of Mn, Co, Cu and Ni are 98.6%, 96.4%, 95.8% and 89.6%, respectively. Microbialfuel cell was set up with the bacteria of Geobacter metallireducens, and the mechanism of microbial dissimilatory metal reduction was studied. The results show that metal oxide is the final electron acceptor of microbial respiration. The biofilm formed by the way of directly adsorption on the surfaces of the metal oxide mineral plays a key role during the metal dissimilatorilly reduction process.
Key words: marine manganese nodules; metal oxide; biofilm; dissimilatory reduction; metal reducing miroorganisms
大洋多金属结核是近期最具开发前景的一种海洋金属矿产资源,它含有近80种金属元素,特别是富含约20%的锰以及约2%的铜、钴和镍等贵金属元素。海底多金属结核壳是一种多矿物集合体,结晶程度都很差,多呈隐晶质、半晶质甚至非晶质。矿物颗粒十分细小,通常都是紧密随机地交织在一起,很难用常规的物理选矿方法进行富集和分离[1]。而微生物浸出技术是一种浸出效率高,运行成本低,对环境无污染的选矿方法[2-3]。这类技术主要是在厌氧环境下利用微生物还原金属氧化物[4],在此过程中微生物以二氧化锰等金属氧化物作为其呼吸作用的最终电子受体,以形成完 整的电子传递链,为细胞提供各项生理活动所需的能量[5-6]。
本文作者利用从深海沉积物中分离出的能异化还原金属氧化物的细菌,浸出大洋多金属结核中的锰、镍、钴和铜等金属元素。并且在进行大洋多金属矿生物还原的研究中,设计一套微生物燃料电池体系[7],利用生物燃料电池模拟细胞表面电化学过程来研究微生物在矿物表面传递电子的过程[8]。微生物电池体系不仅能克服MnO2还原培养体系中的二次成矿等带来的干扰因素,而且可以直接通过外电路电流记录氧化还原速率,能准确、迅速地反映出微生物将电子传递给固态电子受体的过程[9]。
1 实验材料与方法
1.1 菌种及培养条件
分离菌种所用的深海沉积物及大洋多金属结核均由“大洋一号”在东太平洋采得,其中Mn,Fe,Cu,Ni和Co元素的质量分数分别为:20.98%,11.02%,1.02%,0.97%和0.34%,使用前将样品磨细至粒度低于75 μm。
培养基成分(1 L)中KCl,NH4Cl,NaH2PO4和NaHCO3的质量分别为0.1,0.2,0.6和2.5 g,Wolfe微量维生素混合液 10 mL,Wolfe微量矿物元素混合液10 mL,电子供体NaAc(醋酸钠)根据还原氧化物量的需要,按化学计量比加入,调节pH为 6.8~7.0。利用80% N2+20% CO2混合气除去灭菌前培养基中的氧气后,分装入厌养培养管中,于121 ℃灭菌15 min,而后转入厌氧箱中,接种和培养均在严格的厌氧环境中进行。
微生物分离试验选择柠檬酸铁和MnO2等作为电子受体,培养基同上,并加入微量维生素混合液及微量矿物元素混合液(具体可参见美国菌种库ATCC Medium 1768),整个过程要求在严格的厌氧环境中培养。
1.2 微生物燃料电池的构建
微生物燃料电池由阴极和阳极2个电极室构成,通过质子交换膜连接(Nafion-117, Dupont),每个电极室装入250 mL溶液[10-12]。
电极均为不抛光的高纯石墨电极。物理表面积为75 cm2,使用前用1 mol HCl浸泡去除杂质离子,再用1.0 mol NaOH浸泡以除去其表面吸附的细胞。电极室及溶液均采用高温湿热灭菌。阳极接种细菌,接种前通80% N2+20% CO2混合气除去装入培养基中的氧气,接种后密封或者缓慢通混合气。阴极持续通空气,保持其内部溶解氧的浓度,在两极室中均缓慢搅拌。整个电池的组装和接种过程均为无菌操作,电池实验体系如图1所示。

图1 微生物燃料电池体系示意图
Fig.1 Schematic diagram of microbial fuel cell system
1.3 分析方法及数据采集设备
采用原子吸收法对溶液中金属离子进行测定。
采用Bradford法测量电池阳极室内及电极表面生物的浓度。
使用数据采集卡(瑞博华AD8201H, 16位,32通道,编程双端方式工作,采集精度为0.1 mV)进行电流采集。
2 结果与讨论
2.1 异化还原菌的分离和培养
首先采用微溶的柠檬酸铁为电子受体,醋酸盐为电子供体对深海沉积物中的细菌进行筛选和驯化,快速分离出能稳定、迅速还原Fe3+的微生物,再将其转接入以二氧化锰为电子受体的培养基中,经多次重复实验,驯化出能快速还原二氧化锰的微生物。时间对MnO2还原率的影响如图2所示。从图2可看出:驯化出来的微生物能较快地还原MnO2,生成二价锰,97%的MnO2能被分离出来的微生物还原。
2.2 微生物异化还原大洋多金属结核
将用MnO2富集培养的菌液,按15%接种量转接到以深海多金属结核为固体电子受体的培养基中,进行微生物浸出实验,使用150 g/L糖蜜和10 g/L大洋多金属矿,在厌氧条件下进行摇瓶实验,反应温度为30 ℃,摇床转速为170 r/min。结果如图3 所示,锰结核中98.6%的四价锰可被微生物异化还原为二 价锰。
在无氧条件下,MnO2是异氧微生物代谢呼吸链的最终电子受体,还原后的金属离子溶于培养液中。大洋多金属矿中的锰主要以不溶的MnO2形式存在,在微生物呼吸过程中,还原生成可溶性二价锰离子,伴随MnO2晶格的破坏过程,矿物中的其它元素如Co,Ni和Cu等有价金属也可溶浸于酸性溶液中,浸出率分别为96.4%,95.8%和89.6%。以醋酸钠为有机底物,该反应过程见式(1)和(2)。
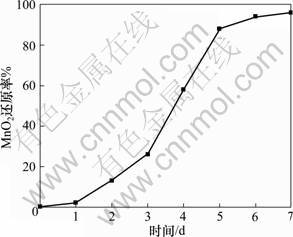
图2 反应时间对深海沉积物分离菌种异化还原MnO2还原率的影响
Fig.2 Effect of time on bioreduction rate of MnO2 by dissimilatroy metal reducing microorganisms isolated from marine sediments

图3 反应时间对厌氧条件下异养微生物还原大洋多金属结核中MnO2还原率的影响
Fig.3 Effect of time on bioreduction rate of marine nodules reduced by mixed heterotrophic microbes under anaerobic conditions
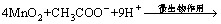
 (1)
(1)
 (2)
(2)
接入异养微生物后,有机物的聚集促使锰较快速地还原,四价锰还原过程中以有机碳作为电子供体,MnO2为电子受体,细菌把氧化有机碳产生的还原能力传递给MnO2,生成Mn(OH)2或MnCO3,在酸性条件及细菌还原酶的作用下形成可溶性Mn2+。
2.3 微生物异化还原金属氧化物的机理
微生物异化还原金属氧化物的主要特征是微生物利用固态的金属氧化矿作为其呼吸作用的最终电子受体,并将位于细胞外膜的还原型细胞色素上累积的电子传递给固体氧化矿物,主要采取以上3种方式: (1)通过络和剂络和金属离子成游离状态[13];(2) 通过游离的电子传递中间体在细胞和固体金属氧化矿之间的电子[14-16];(3)直接吸附接触后传递电子[17]。前2种方式需要环境中存在的外界物质参加,而直接吸附接触异化还原不需要外界物质,是自然界常见的方式。
为了消除干扰因素,更直接、准确地研究异化还原菌直接吸附时胞外电子传递的方式,选择能够异化还原锰和铁等金属氧化物的典型菌种Geobacter metallireducens (DSMZ 7210, ATCC 53774),构建微生物燃料电池。先用Fe(OH)3作为最终电子受体,让细胞适应固态的电子受体,再将其转入最终电子受体培养基二氧化锰中,最后转接入微生物电池中。电池中阳极石墨电极代替MnO2作为最终电子受体。
微生物燃料电池体系不仅完整保持了微生物通过直接吸附接触传递电子给固体电子受体过程的特征,而且可以直接通过外电路电流记录氧化还原速率,能更准确、迅速地反映出微生物将电子传递给固态电子受体的过程。在整个细胞代谢醋酸盐的过程中,细胞膜外累积的还原型细胞色素失去电子给阳极石墨棒,电子再通过外电阻达到阴极石墨棒,在阴极的溶解氧最终得到电子,被还原生成水。整个电池反应过程如下:
阳极:
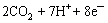 (3)
(3)
阴极: (4)
(4)
微生物燃料电池接种10%细胞后电流的变化见图4。由图4可知:从零时刻接种到电流达到一个稳定的平台,需要很长的时间。
加入新的培养基后电流变化如图5所示。可见:电池长时间(30 d)反应后,用新的含醋酸盐的培养基替换阳极溶液,保留原来的电极,不仅不需要再接种细胞,而且还可以使电池迅速达到原来的电子传递速率。
如图6所示,若电池长时间反应,醋酸盐消耗完尽,注入醋酸盐溶液后,电池也能迅速恢复到原来的电子传递水平。

图4 微生物燃料电池接种10%细胞后电流的变化
Fig.4 Electron transfer in microbial fuel cell by 10% inoculum Geobacter metallireducens

图5 加入新的培养基电流恢复情况
Fig.5 Current recovery condition after addition of new medium
由图6可知:将一个新的石墨棒电极(洗净、灭菌)替换为稳定运转的燃料电池体系中的阳极石墨棒,在很长时间内电流都处于很低的水平。这些现象表明:Geobacter metallireducens在利用石墨电极作最终的电子受体时,真正起主导作用的是长时间反应后逐渐生长、吸附在电极上的细胞。这些细胞通过自身的分泌物相互连接,形成致密的生物膜, 如图7所示。而游离在溶液中的细胞由于一直没有呼吸作用的电子受体,缺乏能量来源,其生物活性逐渐降低直至死亡。该结果说明如果没有配合物和电子传递中间体复合物,微生物在异化还原金属氧化物时,需要吸附接触才能进行胞外的电子传递,且吸附过程需要很长时间。

图6 醋酸盐消耗完后补充醋酸电流恢复情况
Fig.6 Current recovery condition after sodium acetate was added to anodic chamber

图7 电池运转1月后阳极石墨棒上吸附细胞(生物膜)的SEM图
Fig.7 SEM images of anodic electrode surface covered by Geobacter metallireducens
由此可知:在这类微生物电池里,达到稳定电流平台的时间是微生物吸附在电极上逐渐形成成熟生物膜所需的时间,电流受生物膜的影响。同样,如图2和图3所示,在微生物还原金属氧化物的过程中,在没有电子传递中间体时,开始还原的速度很慢,这是因为微生物还在缓慢的生长和吸附,一旦生物膜成熟,还原速度就会达到一个较高的稳定值。
3 结论
(1) 从深海沉积物中分离的异氧微生物还原浸出大洋多金属结核中的锰、镍、钴和铜等金属元素,其浸出率分别为98.6%,96.4%,95.8%和89.6%。
(2) 利用Geobacter metallireducens构建微生物燃料电池,以细胞在电极上的放电过程模拟微生物异化还原金属氧化物的固体电子受体行为。微生物在氧化物颗粒表面形成的生物膜在异化还原过程中起关键作用。
(3) 微生物以金属氧化物作为其呼吸作用的最终电子受体,异化还原二氧化锰浸出深海多金属结核。伴随MnO2晶格的破坏,矿物中的其他元素如Co和Ni等有价金属也被浸出。
参考文献:
[1] 冯雅丽, 李浩然. 深海矿产资源开发与利用[M]. 北京: 海洋出版社, 2004: 153-163.
FENG Ya-li, LI Hao-ran. Deep-sea mineral resources development and utilization[M]. Beijing: Ocean Press, 2004: 153-163.
[2] XIANG Yun, WU Ping-xiao , ZHU Neng-wu, et al. Bioleaching of copper from waste printed circuit boards by bacterial consortium enriched from acid mine drainage[J]. Journal of Hazardous Materials, 2010, 184: 812-818.
[3] WANG Jun, QIN Wen-qing, ZHANG Yan-sheng, et al. Bacterial leaching of chalcopyrite and bornite with native bioleaching microorganism[J]. Transactions of Nonferrous Metals Society in China, 2008(18): 1468-1472.
[4] Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ) and Mn (Ⅳ) reduction [J]. Advances in Microbial Physiology, 2004, 49: 219-286.
[5] 冯雅丽, 李浩然. 异氧微生物异化还原大洋多金属结核[J]. 北京科技大学学报, 2006, 28(12): 1111-1114.
FENG Ya-li, LI Hao-ran. Dissimilatory reduction of marine nodules with heterot rophic microbes[J]. Journal of University of Science and Technology Beijing, 2006, 28(12): 1111-1114.
[6] Nealson K H, Little B. Microbial metal2ion reduction and mars: Extraterrestrial expectation [J]. Curr Opinion Microbiol, 2002(5): 296.
[7] 冯雅丽, 周良, 祝学远, 等. Geobacter metallireducens 异化还原铁氧化物三种方式[J]. 北京科技大学学报, 2006 , 28(6): 524.
FENG Ya-li, ZHOU Liang, LIAN Jing, et al. Study on the three paths taken by Geobacter metallireducens to reduce ferric oxides[J]. Journal of University of Science and Technology Beijing, 2006, 28(6): 524.
[8] 连静, 祝学远, 李浩然, 等. 直接微生物燃料电池的研究现状及应用前景[J]. 科学技术与工程, 2005, 5(22): 1747.
LIAN Jing, ZHU Xue-yuan, LI Hao-ran, et al. Progress in research and application prospect for direct microbial fuel cell[J]. Science Technology and Engineering, 2005, 5 (22): 1747.
[9] 刘志丹, 周良, 杜竹玮, 等. 异化金属还原菌的研究进展[J]. 微生物学通报, 2005, 32(5): 156.
LIU Zhi-Dan, ZHOU Liang, DU Zhu-Wei, et al. Research progress on dissimilatory metal reduction microorganisms[J]. Microbiology Bulletin, 2005, 32(5): 156.
[10] Hai P, Jae K J. Construction and operation of a novel mediator- and membrane-less microbial fuel cell[J]. Process Biochemistry, 2004, 39(8): 1007.
[11] Byung H K, Geun-Cheol G, In-Seop C. Operational parameters affecting the performance of a mediator-less microbial fuel cell[J]. Biosensors and Bioelectronics, 2003, 18: 327.
[12] Chaudhuri S K, Lovley D R. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature biotechnology, 2003, 21(10): 1229-1232.
[13] Joan C W, Lovley D R, Francis H C. Stimulated anoxc biodegradation of aromatic hydrocarbon using Fe (Ⅱ)ligands[J]. Nature, 1994, 370: 128.
[14] Newman D K, Kolter R. A role for excreted quinones in extracellul arelectron transfer[J]. Nature, 2000, 405: 94.
[15] Coates J D, Bluntharris E L, Phillips E J P, et al. Humic substances as electron acceptors f or microbial respiration[J]. Nature, 1996, 382(6590): 445.
[16] Lovley D R, Blunt-Harris E L. Role of humic-bound iron as an electron transfer agent in dissimilatory Fe (Ⅲ) reduction[J]. Appl Environ. Microbiol, 1999, 65(9): 4252-4254.
[17] Ciufo S, Childers S E, Lovley D R. Geobacter metallireducens accesses in soluble Fe (Ⅲ) oxide by chemotaxis[J]. Nature, 2002, 416(6882): 767-769.
(编辑 方京华)
收稿日期:2011-06-15;修回日期:2011-07-15
通信作者:李浩然(1968-),男,北京人,博士,副研究员,从事矿物加工工程研究;电话:010-82627064;E-mail: hrli@home.ipe.ac.cn