DOI: 10.11817/j.ysxb.1004.0609.2020-39601
硫酸钴溶液氧化-水解除铁及除铁渣的水热处理
刘 博,周秋生,李小斌,彭志宏,刘桂华,齐天贵
(中南大学 冶金与环境学院,长沙 410083)
摘 要:采用氧化-水解法从高铁硫酸钴溶液中除铁,再采用水热法对除铁渣进行脱硫转型成赤铁矿的过程。考察双氧水用量、pH值、温度、晶种及添加剂对除铁率、钴损失率,除铁渣粒度、形貌及浆液沉降速度的影响,以及水热温度、时间、NaOH浓度对除铁渣水热转型成赤铁矿中铁、硫含量及物相和形貌的影响。结果表明:双氧水用量1.5倍理论量、pH值2.6、反应温度70 ℃,在此条件下采用半连续-并加法反应4 h,除铁率达到99.68%,钴损失率低至2.87%。添加Fe(OH)3晶种或PAM与PEG2000复配添加剂能大幅提高反应后浆液的沉降速度。对除铁渣进行水热转型,升高温度、延长时间、提高碱浓度均有利于无定型除铁渣向赤铁矿转化。在水热温度230 ℃、水热时间2 h、NaOH浓度40 g/L时,渣中物相全部转化成赤铁矿,铁含量达65.63%,硫含量仅为0.014%。
关键词:赤铁矿;高铁硫酸钴溶液;氧化水解;除铁;水热转型
文章编号:1004-0609(2020)-11-2672-12 中图分类号:TF816 文献标志码:A
钴是制造高温、硬质、磁性合金和含钴化合物的重要原料,广泛应用于航空航天、电机电器、化工、陶瓷和电池工业等领域[1-3]。但我国钴资源匮乏,储量小、矿石品位低、伴生矿多[4-5]。因此,对废旧二次电池、含钴合金、废催化剂、冶炼钴渣等含钴二次资源的回收利用具有重要意义。目前,含钴二次资源处理以湿法为主,通常采用硫酸溶解,在钴溶解过程中杂质金属铁、铜、镍、锰等也进入到溶液中。由于铁的性质较其他杂质金属活泼,从溶液中对其进行净化处理的难度较大[6-8]。
目前,从硫酸钴溶液中除铁的方法主要有黄钾铁矾法、针铁矿法、赤铁矿法和中和水解法等[9-10]。黄钾铁矾法相对简单、投资低且除铁渣易于过滤,但渣量大,铁钒渣稳定性差,其中的重金属在自然堆存条件下会不断溶出,污染地下水和土壤[11]。针铁矿法对物料适应性强,渣易于过滤,同时对铁、砷、锑、氟的去除效果较好,但阴、阳离子夹带量多,铁渣利用 难[12-14]。赤铁矿法渣量少,渣过滤性能好且渣中铁含量高,可作炼铁原料,但投资费用高,蒸汽、硫酸耗量大[15-17]。中和水解法工艺简单、操作方便,但易生成无定型的氢氧化铁细小颗粒,过滤性能差且水解沉淀的过程中会吸附大量其他有价金属,造成溶液中有价金属损失[18]。
为此,众多学者对酸性溶液中氧化-水解沉淀除铁过程开展了研究。刘久清等[19]采用中和水解法和超滤、纳滤处理工艺对低品位铜矿浸出液进行除铁和铜富集,除铁率达到80%时,铜损失率低于2%,但此工艺条件要求高,实现工业化困难。薛济来等[20]对粉煤灰硫酸焙烧熟料溶出液空气和双氧水两段协同除铁过程进行了研究,先后在空气中氧化7 h、H2O2中氧化0.5 h,除铁率达99.25%,但此法适用于低铁浓度体系,且空气氧化时间太长。GüLER等[21]以过硫酸铵为氧化剂对锌浸出液中的除铁过程进行了研究,得出pH值和温度是影响除铁渣成分的主要因素,氧化剂浓度影响铁及其他杂质离子的去除量,但过硫酸铵为氧化剂成本较高,且有价金属损失率偏高。韩新罡等[22]以OH-和NH3为配合剂、OH-和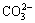 为沉淀剂,研究了碳氨体系中铁与钴、镍的分离性能,除铁率大于99%时钴、镍的损失率分别为11.4%和10.6%。其采用的间歇式-正加法易出现溶液局部过饱和度过大,继而瞬间生成大量晶核,使除铁渣的粒度变小、形貌不规整,造成浆液沉降缓慢,钴和镍的直接析出和吸附损失增加。为了精准控制溶液的过饱和度,最大限度减少除铁过程中钴和镍的损失,本文提出了半连续-并加法,使除铁过程保持在较恒定的pH下进行,同时加入晶种及添加剂,促使颗粒附聚,以改善浆液的沉降性能。并加法下溶液反应时局部过饱和度不会过大而导致爆发式成核,生成的除铁产物粒度更大,形貌更规整,吸附造成的有价金属损失率较小。得到的无定型铁渣再经水热处理转化为高铁低硫的赤铁矿渣,可作为炼铁或水泥行业的原料。对除铁过程,研究双氧水用量、pH、温度、晶种及添加剂对除铁率、钴损失率、除铁渣粒度形貌及浆液沉降性能的影响;对除铁渣水热转化过程,重点研究水热温度、时间、NaOH浓度对除铁渣中铁、硫含量及物相和形貌的影响。
为沉淀剂,研究了碳氨体系中铁与钴、镍的分离性能,除铁率大于99%时钴、镍的损失率分别为11.4%和10.6%。其采用的间歇式-正加法易出现溶液局部过饱和度过大,继而瞬间生成大量晶核,使除铁渣的粒度变小、形貌不规整,造成浆液沉降缓慢,钴和镍的直接析出和吸附损失增加。为了精准控制溶液的过饱和度,最大限度减少除铁过程中钴和镍的损失,本文提出了半连续-并加法,使除铁过程保持在较恒定的pH下进行,同时加入晶种及添加剂,促使颗粒附聚,以改善浆液的沉降性能。并加法下溶液反应时局部过饱和度不会过大而导致爆发式成核,生成的除铁产物粒度更大,形貌更规整,吸附造成的有价金属损失率较小。得到的无定型铁渣再经水热处理转化为高铁低硫的赤铁矿渣,可作为炼铁或水泥行业的原料。对除铁过程,研究双氧水用量、pH、温度、晶种及添加剂对除铁率、钴损失率、除铁渣粒度形貌及浆液沉降性能的影响;对除铁渣水热转化过程,重点研究水热温度、时间、NaOH浓度对除铁渣中铁、硫含量及物相和形貌的影响。
1 实验
1.1 实验原料
实验所用高铁硫酸钴溶液(Co2+ 45.17 g/L、Fe2+ 35.63 g/L)是用七水合硫酸亚铁(FeSO4·7H2O)和七水合硫酸钴(CoSO4·7H2O)按一定要求配制而成,该溶液的pH值为1.38。晶种为氢氧化铁(Fe(OH)3),中和剂为碳酸铵((NH4)2CO3)溶液,氧化剂为30%H2O2,所用试剂全部为分析纯试剂。
1.2 实验方法
实验所用的硫酸钴溶液总量为200 mL,操作方式采取半连续-并加法,即取50 mL高铁硫酸钴溶液加入三口平底烧瓶作底液,置于恒温水浴槽中加热并搅拌,此时分别通过三台蠕动泵同时向三口烧瓶中加料。第一台缓慢滴加双氧水,第二台缓慢滴加100 g/L碳酸铵溶液,第三台滴加剩余相同浓度的150 mL硫酸钴溶液,目的使硫酸钴溶液与沉淀剂、氧化剂充分接触,分散效果更好,缓解局部析出与过氧化的情况,整个除铁体系反应相对稳定,从而使溶液反应时局部过饱和度不会过大导致爆发式成核,形成粒度细小、含水率高的无定型沉淀。全过程利用电位pH计实时监测溶液pH值,待pH达到设定值并稳定后反应一段时间,固液分离得到滤液与除铁渣,滤液用于分析铁、钴含量,滤饼经去离子水(80 ℃)充分洗涤后用电热鼓风干燥箱烘干,用于固相分析和后续水热实验。
移取80 mL某浓度的氢氧化钠溶液,加入到高压反应群釜的钢弹(容积为150 mL)中,然后称取5 g烘干后除铁渣(液固比恒定为16)加入到钢弹中,再加入2个直径为15 mm的钢球以加强搅拌,将钢弹加盖拧紧密封后置于高压反应群釜中,于预定温度下反应预定时间。反应后浆液经真空抽滤,滤饼用去离子水(80 ℃)洗涤,洗涤后滤饼在电热鼓风干燥箱烘干后制样供检测分析。
1.3 分析与检测
采用电感耦合等离子体光谱仪(ICP-OES,IRIS Intrepid Ⅱ,Thermo Eleetron Corporation)分析溶液中铁、钴、硫元素的含量;采用Mastersizer 2000型激光粒度分析仪(英国马尔文公司)对反应产物进行粒度分析;采用JSM-6360LV型扫描电镜(日本JEOL公司)观察除铁渣与转型后赤铁矿渣的形貌;采用X射线衍射仪(XRD,Rigaku D/max-TTR III)分析样品物相(发光源为Cu Kα靶,管压为40 kV,管流为250 mA,λ=0.154056×10-10 m,2θ为10.0°~80.0°)。对除铁后滤液中铁和钴元素的含量分析检测,以进行除铁率与钴损失率的计算及元素走向的分析,采用并按式(1)和(2)计算铁的沉淀率与钴的损失率:
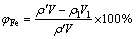 (1)
(1)
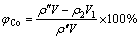 (2)
(2)
式中: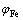 与
与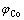 分别为除铁率与钴损失率,%;
分别为除铁率与钴损失率,%;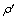 与
与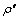 分别为高铁硫酸钴溶液中铁与钴的初始浓度,g/L;
分别为高铁硫酸钴溶液中铁与钴的初始浓度,g/L;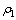 与
与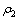 分别为除铁后固液分离滤液中铁与钴的浓度,g/L;V1与V分别为除铁后固液分离滤液的体积和高铁硫酸钴溶液总体积,V=200 mL。
分别为除铁后固液分离滤液中铁与钴的浓度,g/L;V1与V分别为除铁后固液分离滤液的体积和高铁硫酸钴溶液总体积,V=200 mL。
2 结果与讨论
2.1 硫酸钴溶液中氧化水解除铁
2.1.1 双氧水加入量的影响
根据浓度积常数估算本实验中Co2+、Fe2+、Fe3+的开始沉淀pH分别为6.66、6.53、1.59。Co2+与Fe2+的开始沉淀pH过于接近,除铁的同时易使钴大量析出,但Co2+与Fe3+的开始沉淀pH相差大,所以本实验先将溶液中Fe2+全部氧化成Fe3+。在温度70 ℃,终点pH=2.6,反应时间4 h,不加晶种与其他添加剂,操作方式采取半连续-并加法的固定条件下,改变双氧水用量以考察其对除铁率及钴损失率的影响,结果如图1所示。
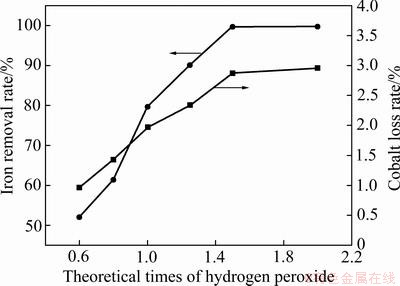
图1 双氧水加入量对除铁率和钴损失率的影响
Fig. 1 Influence of hydrogen peroxide addition on iron removal rate and cobalt loss rate
由图1可知,除铁率和钴损失率都随着双氧水用量的增大而显著升高。当双氧水用量由理论量的0.6倍提高至1.5倍时,除铁率由52.01%上升至99.68%,此后继续增大双氧水用量至理论量的2倍,除铁率微升至99.72%。溶液的钴损失率在0.6倍双氧水理论用量时为0.96%,在1.5倍理论用量时升至2.87%,继续增大至理论量的2倍,钴损失率微升至2.96%。所产生的钴损失一方面是因为除铁产物为无定型胶体,表面疏松多孔,吸附性强,造成钴的夹带损失;另一方面是中和剂碳酸铵溶液滴加过程产生的局部pH过高所造成[23]。Fe2+的氧化与Fe3+的水解在溶液中同步进行,此反应需要消耗大量OH-,当双氧水理论用量从0.6倍增至1.5倍时,析出的除铁产物增多,且消耗的中和剂也增加,致使由吸附夹带与局部pH过高共同造成的钴损失增加。因此,从除铁率、双氧水用量及中和剂消耗量等方面综合考虑,选择双氧水最佳用量为1.5倍理论量。
2.1.2 pH的影响
pH是氧化水解除铁的重要影响因素,体系中的pH越高,形成氢氧化铁胶体的趋势越大,吸附造成的有价金属损失也越多。在温度70 ℃、双氧水用量为1.5倍理论量、反应时间4 h、不加晶种与其他添加剂、操作方式采取半连续-并加法的固定条件下,改变pH值以考察其对除铁率及钴损失率的影响,结果如图2所示。
由图2可知,pH值对硫酸钴溶液除铁过程影响较为显著。随着溶液pH值在1.5~2.6间变化,除铁率从26.3%迅速升至99.68%;当pH值大于2.6时,继续增大pH值除铁率变化不明显;在pH为4.1时,除铁率为99.95%。钴损失率在pH值1.5~2.2间先平缓增加,
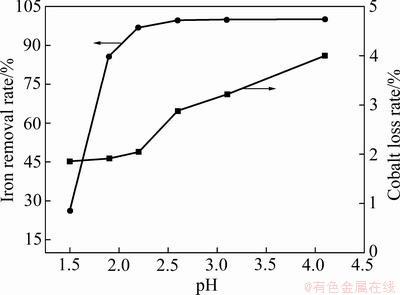
图2 溶液终点pH值对除铁率和钴损失率的影响
Fig. 2 Influence of pH value of solution final solution on iron removal rate and cobalt loss rate
2.2~4.1间迅速增加。在pH为1.5和2.6时,钴损失率分别为1.86%和2.87%,进一步升高pH至4.1时,钴损失率升至4%。因此,从除铁率、钴损失率及中和剂消耗量等方面综合考虑,选择合适的pH值为2.6。
2.1.3 温度的影响
温度对氧化水解除铁过程中除铁渣的成核、长大与附聚具有重要影响。在pH=2.6、双氧水用量为1.5倍理论量、反应时间4 h、不加晶种与其他添加剂、操作方式采取半连续-并加法的固定条件下,改变温度以考察其对除铁率、钴损失率、除铁渣形貌及粒度的影响规律,结果如图3、4和5所示。
由图3可知,温度对硫酸钴溶液除铁过程影响较为显著。当温度为20 ℃时,除铁率只有88.73%,随着温度的升高,除铁率继续增大,当温度升至70 ℃时,除铁率达到最大为99.68%。此后继续升高温度至90 ℃,除铁率下降至97.74%,可能是由于反应温度过高使双氧水受热部分分解,降低了双氧水的氧化效率。钴损失率随反应温度的升高逐渐下降。在20 ℃时,钴损失率为4.91%;当温度升至90 ℃,钴损失率降至2.67%。
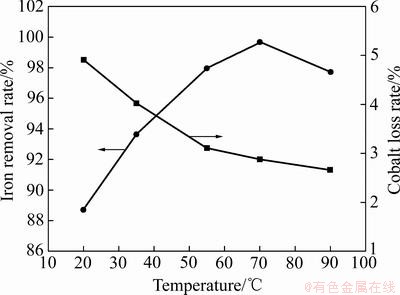
图3 反应温度对除铁率和钴损失率的影响
Fig. 3 Influence of reaction temperature on iron removal rate and cobalt loss rate
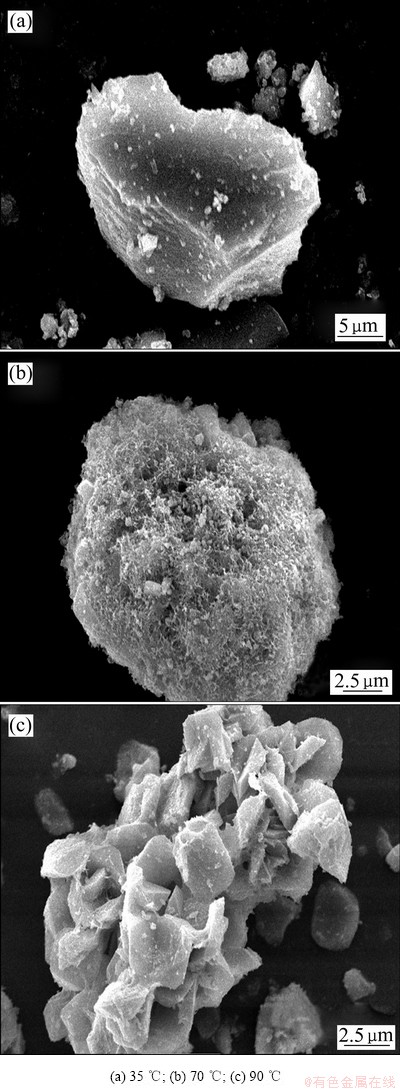
图4 不同反应温度下除铁渣的SEM像
Fig. 4 SEM images of iron removal residue at different reaction temperatures
图4(a)~(c)所示分别为反应温度在35、70和90 ℃所得到的除铁渣的SEM像。温度在35 ℃时,除铁产物形貌呈棱台状,表面光滑致密。温度在70 ℃时,除铁产物形貌较规则,表面粗糙且附着许多针丝状颗粒。温度升高至90 ℃时,除铁产物由很多形貌、粒度相似的小颗粒附聚在一起,呈“葡萄串”状,结晶形貌良好。由图4可知,温度对除铁渣的粒度影响较为明显,除铁渣的粒度随反应温度的升高而变小。温度为35 ℃时,粒度分布范围较宽,中位粒径D50为26.97 μm;温度升至70 ℃时,除铁渣的粒度分布大幅度减少,中位粒径D50降至14.47 μm;继续升高温度至90 ℃,中位粒径D50降至10.26 μm。原因可解释为Fe2+氧化水解除铁伴随着除铁渣晶核的形成、晶粒长大和晶粒团聚过程,随着反应温度的升高,反应溶液中 Fe2+的氧化速率增大,Fe3+的过饱和度增加,使得除铁渣晶粒的成核速率大于其长大速率,从而在高温下获得晶粒细化的除铁渣[24]。
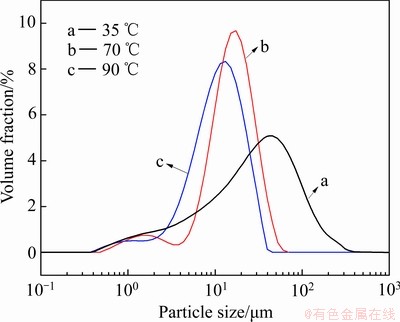
图5 不同反应温度下除铁渣粒度分布曲线
Fig. 5 Particle size distribution curves of iron removal residue obtained at different reaction temperatures
2.1.4 添加晶种及添加剂的影响
针对氧化水解除铁后易生成无定型细小颗粒造成浆液沉降困难的问题,本实验分别考察添加晶种、表面活性剂PEG2000和絮凝剂PAM(其中晶种Fe(OH)3用量10 g/L,PEG2000和PAM添加量分别为20 mg/L)对除铁率、钴损失率、除铁渣形貌及粒度、浆液沉降性能的影响规律。在pH=2.6、温度为70 ℃、双氧水用量为1.5倍理论量、反应时间4 h、操作方式采取半连续-并加法的固定条件下,实验结果如表1、图6及图7所示。
由表1可知,与空白实验相比,添加晶种、表面活性剂PEG2000和絮凝剂PAM对硫酸钴溶液深度除铁与浆液沉降性能都有较大的改善。空白实验下结晶颗粒的沉降性能最差,沉降速度为0.91 cm/min,滤液中含铁量达114×10-6。当添加晶种时,沉降速度较空白实验大幅度提高,升至4.2 cm/min,滤液中铁含量低至50×10-6。此外,由于絮凝剂容易与其他物质产生协同作用,而非离子型表面活性剂PEG2000与其他类型添加剂相溶性好,可以很好地混合复配使用,基于这方面的考虑,本实验研究了PAM与PEG2000复配使用对钴溶液反应结晶净化过程的影响。当PAM与PEG2000共同作用时,结果表明:浆液形成大絮团,絮凝沉降时界面清晰,且上清液清亮,沉降效果显著提高至5.1 cm/min,滤液中含铁量低至57×10-6,说明复配添加剂的使用极大改善了反应体系颗粒的沉降行为。
表1 晶种及不同添加剂对硫酸钴溶液中Fe3+反应结晶与除铁渣沉降速度的影响
Table 1 Effect of seeds and different additives on reaction crystallization of Fe3+ and settling velocity of iron removal residue in cobalt sulfate solution
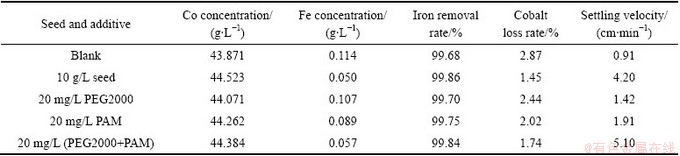

图6 不同条件下所得除铁渣的SEM像
Fig. 6 SEM images of iron removal residue under different conditions
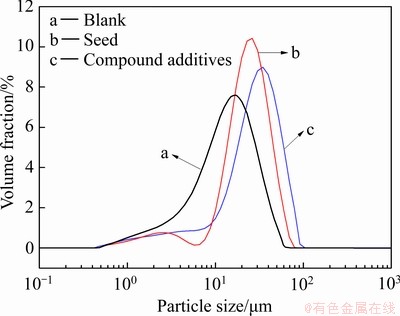
图7 不同条件下所得除铁渣粒度分布曲线
Fig. 7 Particle size distribution curves of iron removal residues obtained under different conditions
图7中曲线a~c所示分别为空白、添加晶种、添加复配添加剂所得到的除铁渣的粒度分布。由图6和7可知:与空白实验相比,添加晶种与复配添加剂能使颗粒相互黏结、附聚在一起,颗粒粒度增大,进而提高浆液沉降速度。添加晶种的除铁产物由大量粒度,形貌相似的小颗粒附聚在一起,成“麻花状”,粒度分布范围较窄,中位粒径D50为21.84 μm,较空白实验的中位粒径12.69 μm增大了近一倍。添加复配添加剂的除铁产物也由颗粒附聚生成,且粒度最大,中位粒径D50达到26.72 μm。在Fe2+氧化水解除铁过程中,无晶种存在时,溶液中Fe3+的浓度需要达到或超过其均相成核的临界饱和度才会形成晶核并逐渐长大析出;而晶种的存在为Fe3+析出提供了大量的核心,使得Fe3+在未达到均相成核的临界饱和度之前,就已扩散至晶种表面,并在晶种表面发育长大析出[25-26]。PEG2000作为聚合物类非离子表面活性剂,其长分子链结构可通过其含有的极性基团吸附在小粒子表面,形成诱导疏水颗粒,使颗粒表面疏水,有利于多个细颗粒聚集在一起形成粗颗粒[27]。聚丙烯酰胺是一种线状的有机高分子聚合物,依靠大分子链在溶液中的缠绕和吸附架桥作用,将大分子颗粒脱稳形成比较大的絮团并沉降下来,加快沉淀的速度[28]。而复配添加剂作用效果高于PEG2000与PAM单独作用的,原因是两者复配时既发挥了PEG2000的电中和吸附作用,又发挥了PAM 的大分子链缠绕与架桥作用,不仅表面所带的正电荷增加,静电吸附能力增强,而且水解产物的体积和支化度也增大,提高了吸附架桥能力,以高分子聚合物为链接,可架桥成为更大的积聚絮凝体。
2.1.5 钴和硫在除铁渣中的分布及赋存状态
对1.5倍理论量H2O2、pH=2.6、70 ℃、4 h反应下除铁渣进行了SEM-EDS元素面扫描、傅里叶红外光谱分析及XPS分析,并探究不同pH条件下除铁渣比表面积与钴损失率的关系,其结果如图8、图9、图10及表2所示。
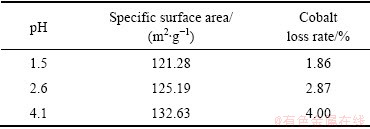
由图8可知,颗粒所在区域铁含量丰富,硫含量较高,钴含量最低,且铁、硫、钴分布情况都呈无规律分散分布。由表2可知,在其他条件不变的情况 下,除铁渣比表面积与钴损失量呈正相关关系,钴损失率增大,除铁渣的比表面积增大。这也间接验证了钴损失是由于除铁产物表面疏松多孔,吸附性强造成的。
对除铁渣进行红外光谱分析,结果如图9所示,在900~1300 cm-1范围内的3个红外波段是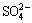 的震动吸收峰。由图9可以看出,分别在1000.97、1084.29和1125.95 cm-1波数处出现吸收峰,分别对应着S—O键的拉伸震动。
的震动吸收峰。由图9可以看出,分别在1000.97、1084.29和1125.95 cm-1波数处出现吸收峰,分别对应着S—O键的拉伸震动。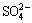 是以双配位络合反应的形式吸附于除铁渣表面的,
是以双配位络合反应的形式吸附于除铁渣表面的,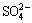 的吸附还与除铁产物表面的形貌有关。由图8可知,除铁渣是由细小的晶体颗粒附聚长大形成的,其表面由很多细小的孔隙,这种物理表面有利于硫酸根的吸附,元素面扫图硫元素的分布也是随扫描区域呈分散分布。对除铁渣中进行 XPS 检测分析,结果见图10,硫的 2p3/2和 2p1/2 峰结合能分别为168.17 eV和169.46 eV,由相关物质结和能的数据[29]可知,硫是以某种硫酸盐的形式存在于除铁渣表面,进一步确定除铁渣中硫元素以
的吸附还与除铁产物表面的形貌有关。由图8可知,除铁渣是由细小的晶体颗粒附聚长大形成的,其表面由很多细小的孔隙,这种物理表面有利于硫酸根的吸附,元素面扫图硫元素的分布也是随扫描区域呈分散分布。对除铁渣中进行 XPS 检测分析,结果见图10,硫的 2p3/2和 2p1/2 峰结合能分别为168.17 eV和169.46 eV,由相关物质结和能的数据[29]可知,硫是以某种硫酸盐的形式存在于除铁渣表面,进一步确定除铁渣中硫元素以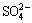 状态赋予存在。
状态赋予存在。
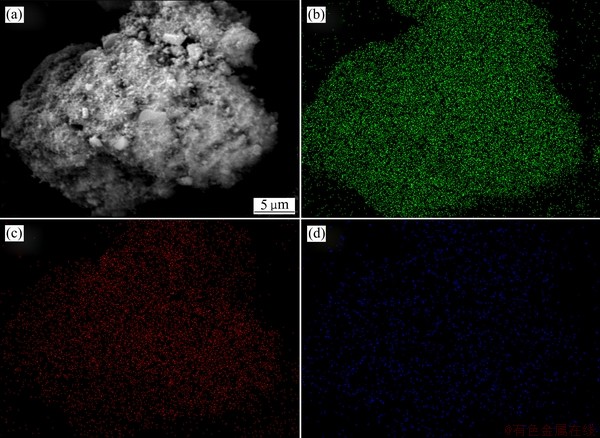
图8 除铁渣的SEM像及EDS面扫描分布
Fig. 8 SEM image(a) and EDS element map scanning distribution of Fe(b), S(c), Co(d) in iron removal residue
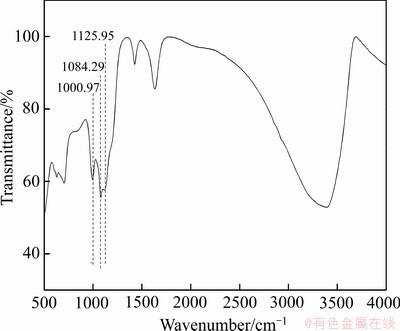
图9 除铁渣的红外光谱
Fig. 9 FT-IR spectra of iron removal residue
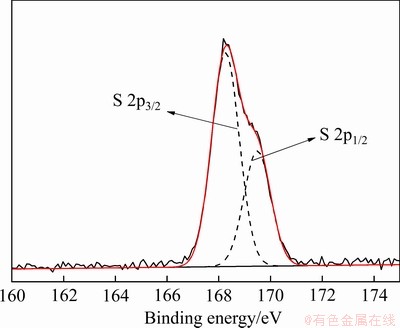
图10 除铁渣的XPS谱
Fig. 10 XPS patterns of iron removal residue
表2 除铁渣的比表面积与钴损失率的关系
Table 2 Relationship between specific surface area of iron removal slag and cobalt loss rate
2.2 除铁渣的转型与脱硫
低温氧化水解除铁得到的除铁渣为无定型胶状渣(铁含量40.81%、硫含量7.51%,质量分数)。本文实验后期对除铁渣进行水热处理,得到的赤铁矿渣铁含量高,硫含量低,可作为副产品销售给炼钢、水泥制造以及涂料行业。
2.2.1 水热温度的影响
在反应时间2 h,NaOH溶液浓度为40 g/L,NaOH溶液与除铁渣的液固比为16:1(mL/g),搅拌速度为200 r/min,改变水热温度以考察其对除铁渣水热处理后的化学组成及物相、除铁渣形貌及粒度的影响规律,结果如表3、图11、12和13所示。
由表3可知,水热温度在170~230 ℃内,随着温度的升高,赤铁矿渣中铁的含量逐步上升,硫的含量缓慢下降。其中反应温度在170 ℃时,铁的含量为57.63%,硫的含量为0.097%,温度升高到230 ℃,铁的含量增加至65.63%,硫的含量降低至0.014%。结合图11的XRD谱,温度为170 ℃时,反应产物以赤铁矿和针铁矿为主。温度升至190 ℃,产物中针铁矿的衍射峰明显减少,且衍射峰的强度显著减弱。温度升至230 ℃,产物中针铁矿的衍射峰消失,全部都是赤铁矿的衍射峰,且赤铁矿的衍射峰变窄。表明随着温度的升高除铁渣逐渐全部转化成赤铁矿,且升高温度可以破坏部分针铁矿的晶格,有助于提高赤铁矿的结晶度,产出更纯净的赤铁矿渣。从渣中铁、硫含量,物相转化及节能降耗等方面综合考虑,选择最佳的水热温度为230 ℃。
表3 水热温度对除铁渣中铁、硫含量的影响
Table 3 Effect of hydrothermal temperature on iron and sulfur content in iron removal residue
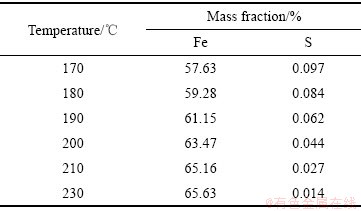
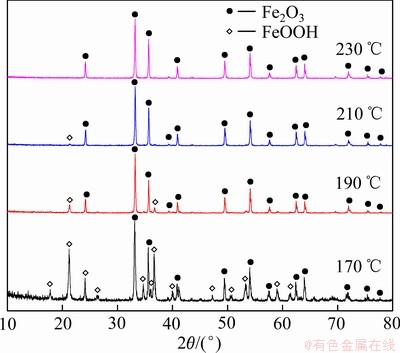
图11 不同水热温度下除铁渣的XRD谱
Fig. 11 XRD patterns of iron removal residues obtained at different hydrothermal temperatures

图12 170 ℃和230 ℃时除铁渣的SEM像
Fig. 12 SEM images of iron removal residues obtained at 170 ℃(a) and 230 ℃(b)
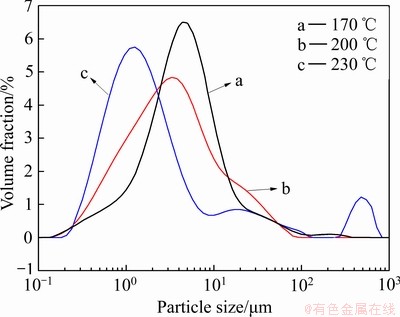
图13 不同反应温度下除铁渣粒度分布图
Fig. 13 Particle size distribution curves of iron removal residues obtained at different reaction temperatures
由图12和13可知,水热后除铁渣的粒度随着温度的升高而减小。170、200、230 ℃下中位粒径D50分别为4.04、2.94、1.47 μm。温度为170 ℃时,产物a表面有大量的片状赤铁矿颗粒和条状针铁矿颗粒,针铁矿分散地附在产物表面,进一步与170 ℃下沉铁渣衍射图对应。温度升至230 ℃时,产物b由很多片状的赤铁矿颗粒团聚在一起,颗粒之间的界面模糊,这种聚合状保证了赤铁矿渣拥有较好的过滤性能,与230 ℃下除铁渣衍射图全部是赤铁矿的物相对应。结合上述不同水热温度下除铁渣的物相、形貌及粒度,可以认为在170~230 ℃下除铁渣转型反应是一个溶 解-再析出过程[30],具体可认为:随着温度的升高,针铁矿的晶格被破坏,渣中的针铁矿通过溶解过程得以释放到溶液中,使得Fe3+的过饱和度增加,发生新的成核与长大过程,析出新相赤铁矿,且赤铁矿晶粒的成核速率大于其长大速率,从而在高温下获得晶粒细化的赤铁矿渣。溶液中析出顺序为[31-32]:
Fe3+→FeOOH·H2O (amorphous)→α-FeOOH or β-FeOOH→ α-Fe2O3 (3)
2.2.2 水热时间与碱浓度的影响
在反应温度230 ℃,NaOH溶液与除铁渣的液固比(mL/g)为16:1,搅拌转速为200 r/min,分别改变水热时间与碱浓度以考察其对水热处理后除铁渣的化学组成及物相的影响规律,结果如表4、表5、图14和15所示。
由表4与5可知,随着反应时间和碱浓度的增大,除铁渣中铁的含量缓慢上升,硫的含量缓慢下降。其中反应时间为2 h,碱浓度为40 g/L时,铁的含量为65.63%,硫的含量为0.014%。结合图14的XRD谱,当反应时间为30 min时,反应产物以赤铁矿和针铁矿为主。反应时间延长到60 min,产物中针铁矿的衍射峰消失,全部都是赤铁矿的衍射峰,说明除铁渣中物相已经完全转化成赤铁矿。结合图15的XRD谱可知,当碱浓度增加至40 g/L时,产物中全部都是赤铁矿的衍射峰,此时除铁渣物相已经完全转化成赤铁矿。从渣中铁、硫含量,物相转化及节能降耗等方面综合考虑,选择最佳水热时间为2 h,最佳NaOH浓度为40 g/L。
表4 水热时间对除铁渣中铁、硫含量的影响(NaOH浓度40 g/L)
Table 4 Effect of hydrothermal time on iron and sulfur contents in iron removal residue (40 g/L NaOH)
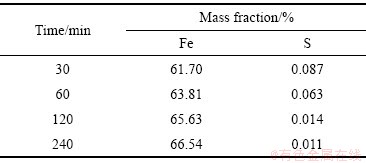
表5 碱浓度对除铁渣中铁、硫含量的影响(水热时间2 h)
Table 5 Effect of alkali concentration on iron and sulfur contents in iron removal residue (hydrothermal time 2 h)
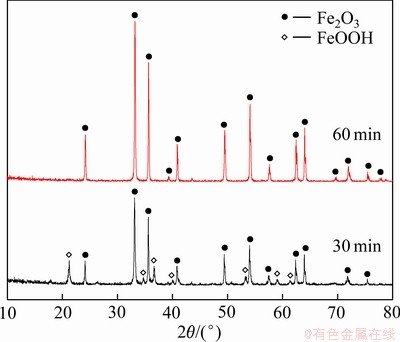
图14 不同水热时间下除铁渣的XRD谱
Fig. 14 XRD patterns of iron removals at different hydrothermal time
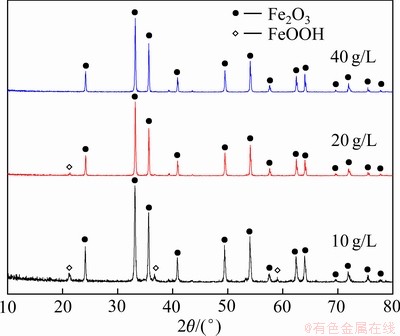
图15 不同碱浓度下除铁渣的XRD谱
Fig. 15 XRD patterns of iron removal residue residues at different alkali concentrations
3 结论
1) 采用氧化水解法处理高铁硫酸钴溶液的较优条件如下:双氧水用量1.5倍理论量、pH值2.6、反应温度70 ℃。在此条件下采用半连续-并加法反应4 h,除铁率达到99.68%,钴损失率降低至2.87%。
2) 添加Fe(OH)3晶种或PAM与PEG2000复配混合添加剂能降低除铁后溶液铁含量,并通过使颗粒附聚成团提高除铁渣的粒度,进而大幅提高反应后浆液的沉降速度。
3) 采用水热法对除铁渣进行脱硫与转型的较优条件如下:水热温度230 ℃、水热时间2 h、NaOH浓度40 g/L。在此条件下,渣中物相全部转化成赤铁矿,渣中铁含量65.63%,硫含量0.014%。可以认为在170~230 ℃下除铁渣水热反应是一个溶解-再析出过程。
REFERENCES
[1] HAJI M N, SLOCUM A H. An offshore solution to cobalt shortages via adsorption-based harvesting from seawater[J]. Renewable and Sustainable Energy Reviews, 2019, 105: 301-309.
[2] DHIMAN S, GUPTA B. Partition studies on cobalt and recycling of valuable metals from waste Li-ion batteries via solvent extraction and chemical precipitation[J]. Journal of Cleaner Production, 2019, 225: 820-832.
[3] HE Jian-yong, ZHANG Chen-yang, SONG Shao-le, WEI Sun, HU Yue-hua, LEI Shu-ya, YANG Yue. Computational and experimental investigation of dimethyldithiocarbamate for effective recovery of cobalt and nickel from the leach liquor of high manganese slag[J]. Separation and Purification Technology, 2019, 223: 55-62.
[4] TIAN Qing-hua, XIN Yun-tao, WANG Heng-li, GUO Xue-yi. Potential-controlled selective recovery of manganese and cobalt from cobalt slag leaching solution[J]. Hydrometallurgy, 2017, 169: 201-206.
[5] ZENG Xian-lai, LI Jin-hui. On the sustainability of cobalt utilization in China[J]. Resources, Conservation and Recycling, 2015, 104: 12-18.
[6] 孟 奇, 张英杰, 董 鹏, 梁 风. 废旧锂离子电池中钴、锂的回收研究进展[J]. 化工进展, 2017, 36(9): 3485-3491.
MENG Qi, ZHANG Ying-jie, DONG Peng, LIANG Feng. Recovery of Co and Li from spent lithium ion batteries[J]. Chemical Industry and Engineering Progress, 2017, 36(9): 3485-3491.
[7] MUDD G M, WENG Z, JOWITT S M, TURNBULL I D, GRAEDEL T E. Quantifying the recoverable resources of by-product metals: The case of cobalt[J]. Ore Geology Reviews, 2013, 55: 87-98.
[8] SONG Shao-le, SUN Wei, WANG Li, LIU Run-qing, HAN Hai-sheng, HU Yue-hua, YANG Yue. Recovery of cobalt and zinc from the leaching solution of zinc smelting slag[J]. Journal of Environmental Chemical Engineering, 2019(7): 1-9.
[9] 何 静, 罗 超, 唐谟堂, 鲁君乐, 王小能, 王 涛. 采用铅黄铁矾去除硫酸体系中的铁[J]. 中国有色金属学报, 2012, 22(10): 2890-2895.
HE Jing, LUO Chao, TANG Mo-tang, LU Jun-yue, WANG Xiao-neng, WANG Tao. Technique of ferrum-removal by lead jarosite from sulfuric acid solution[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(10): 2890-2895.
[10] 陈家镛, 余淑秋, 伍志春. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991: 58-60.
CHEN Jia-yong, YU Shu-qiu, WU Zhi-chun. Separation and utilization of iron in hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991: 58-60.
[11] PELINO M, CANTALINI C, ABBRUZZESE C, PLESCIA P. Treatment and recycling of goethite waste arising from the hydrometallurgy of zinc[J]. Hydrometallurgy, 1996, 40: 25-35.
[12] HAN Hai-sheng, SUN Wei, HU Yue-hua, YUE Tong, WANG Li, LIU Run-qing, GAO Zhi-yong, CHEN Pan. Induced crystallization of goethite precipitate from nickel sulfate solution by limonite seeding[J]. Hydrometallurgy, 2017, 174: 253-257.
[13] WANG Meng, HU Hui-ping, LIU Jin-wei. Negative effects of dissolved organic compounds on settling performance of goethite in Bayer red mud[J]. Transactions of Nonferrous Metals Society of China, 2017, 27: 429-439.
[14] 李海军, 杨洪英, 陈国宝, 周立杰, 刘媛媛. 中心复合设计针铁矿法从含钴生物浸出液中除铁[J]. 中国有色金属学报, 2013, 23(7): 2040-2046.
LI Hai-jun, YANG Hong-ying, CHEN Guo-bao, ZHOU Li-jie, LIU Yuan-yuan. Goethite deironization process for cobaltiferous bioleaching solution by central composite design[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2040-2046.
[15] 易烁文, 李存兄, 魏 昶, 邓志敢, 李兴彬, 王益昭, 宋宇轩, 黄亚宁. Fe2(SO4)3-ZnSO4-H2O体系中Fe3+水热水解赤铁矿[J]. 过程工程学报, 2018, 18(2): 361-368.
YI Shuo-wen, LI Cun-xiong, WEI Chang, DENG Zhi-gan, LI Xing-bin, WANG Yi-zhao, SONG Yu-xuan, HUANG Ya-ning. Hydrothermal hydrolysis of Fe3+ to produce hematite in Fe2(SO4)3-ZnSO4-H2O system[J]. The Chinese Journal of Process Engineering, 2018, 18(2): 361-368.
[16] BEURIA P C, BISWAL S K, MISHRA B K, ROY G G. Study on kinetics of thermal decomposition of low LOI goethetic hematite iron ore[J]. International Journal of Mining Science and Technology, 2017, 27: 1031-1036.
[17] MASAMBI S, DORFLING C, BRADSHAW S. Comparing iron phosphate and hematite precipitation processes for iron removal from chloride leach solutions[J]. Minerals Engineering, 2016, 98: 14-21.
[18] 岳 明, 孙宁磊, 邹 兴, 邵建春, 刘金山, 王魁珽, 陆业大. 锌浸出液三价铁直接水解赤铁矿法除铁的探讨[J]. 中国有色冶金, 2012, 41(4): 80-85.
YUE Ming, SUN Ning-lei, ZOU Xing, SHAO Jian-chun, LIU Jin-shan, WANG Kui-ting, LU Ye-da. The discussion on hydrolysis precipitation of ferric oxide directly from ferric-ion rich zinc leachate[J]. China Nonferrous Metallurgy, 2012, 41(4): 80-85.
[19] 王红军, 刘久清, 周 钦, 何俊颖. 低品位铜矿浸出液除铁及纳滤浓缩铜的研究[J]. 中南大学学报(自然科学版), 2014, 45(12): 4111-4115.
WANG Hong-jun, LIU Jiu-qing, ZHOU Qin, HE Jun-ying. Iron removal and copper concentrate by nanofiltration for bioleaching solution of low grade copper mine[J]. Journal of Central South University (Science and Technology), 2014, 45(12): 4111-4115.
[20] 韩新罡, 席晓丽, 马立文, 聂祚仁, 周志理. 配合-沉淀体系中铁与钴、镍的分离性能[J]. 中国有色金属学报, 2013, 23(11): 3218-3224.
HAN Xin-gang, XI Xiao-li, MA Li-wen, NIE Zuo-ren, ZHOU Zhi-li. Separation properties of ion to cobalt and nickel in complexation-precipitation system[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(11): 3218-3224.
[21] 刘 康, 薛济来, 朱 骏, 谭奇伟. 粉煤灰硫酸焙烧熟料溶出液的除铁过程研究[J]. 中南大学学报(自然科学版), 2016, 47(10): 3295-3301.
LIU Kang, XUE Ji-lai, ZHU Jun, TAN Qi-wei. Process study on iron removal of leachate from coal fly ash sintered by concentrated sulfuric acid[J]. Journal of Central South University (Science and Technology), 2016, 47(10): 3295-3301.
[22] GULER E, SEYRANKAYA A. Precipitation of impurity ions from zinc leach solutions with high iron contents—A special emphasis on cobalt precipitation[J]. Hydrometallurgy, 2016, 164: 118-124.
[23] 李玉虎, 高禄鹏, 刘志宏. 湿法炼锌厂针铁矿渣的表征[J]. 中南大学学报(自然科学版), 2019, 50(2): 257-263.
LI Yu-hu, GAO Lu-peng, LIU Zhi-hong. Characterization analysis of goethite residue from zinc hydrometallurgy plants[J]. Journal of Central South University (Science and Technology), 2019, 50(2): 257-263.
[24] 李存兄, 魏 昶, 邓志敢, 李兴彬, 樊 刚, 王益昭, 易烁文, 李旻廷. FeSO4-H2O体系中水热赤铁矿沉铁及亚稳态铁物相转变行为[J]. 中国有色金属学报, 2018, 28(3): 628-636.
LI Cun-xiong, WEI Chang, DENG Zhi-gan, LI Xing-bin, FAN Gang, WANG Yi-zhao, YI Shuo-wen, LI Min-ting. Hydrothermal hematite precipitation and conversion behavior of metastable iron phase in FeSO4-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2018, 28(3): 628-636.
[25] LU Jian-ming, DREISINGER D. Pressure oxidation of ferrous ions by oxygen and hematite precipitation from concentrated solution of calcium, copper and iron chlorides[J]. Hydrometallurgy, 2013, 140(9): 59-65.
[26] 王益昭, 李存兄, 魏 昶, 邓志敢, 李兴彬, 樊 刚, 易烁文. 湿法炼锌过程中赤铁矿生成及硫的吸附转化[J]. 中国有色金属学报, 2017, 27(10): 2145-2153.
WANG Yi-zhao, LI Cun-xiong, WEI Chang, DENG Zhi-gan, LI Xing-bin, FAN Gang, YI Shuo-wen. Production of hematite and conversion of adsorption S in zinc hydrometallurgy process[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(10): 2145-2153
[27] 尹周澜, 敬叶灵, 陈启元, 张艾民. 聚合物对铝酸钠溶液种分过程的影响[J]. 中国有色金属学报, 2007, 17(6): 1002-1007.
YIN Zhou-lan, JING Ye-ling, CHEN Qi-yuan, ZHANG Ai-min. Effect of polymers on seed precipitation of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(6): 1002-1007.
[28] 赵鹏飞. 聚合氯化铝聚丙烯酰胺絮凝效果分析与优化[J]. 辽宁石油化工大学学报, 2019, 39(2): 37-41.
ZHAO Peng-fei. Analysis and optimization of flocculation effect of polyaluminium chloride polyacrylamide[J]. Journal of Liaoning Shihua University, 2019, 39(2): 37-41.
[29] BRIGGS D. X 射线与紫外光电子能谱[M]. 桂琳琳, 黄惠忠, 郭国霖, 译. 北京: 北京大学出版社, 1984: 23.
BRIGGS D. Handbook of X-ray and ultraviolet photoelectron spectroscopy[M]. GUI Lin-lin, HUANG Hui-zhong, GUO Guo-lin, transl. Beijing: Peking University Press, 1984: 23.
[30] CHENG T C M, DEMOPOULOS G P. Analysis of the hematite precipitation process from a crystallization point of view[C]// MISHRI B. Proceedings of EPD Congress. Warrendale: TMS, 1997: 599-617.
[31] VOIGT B, GOBLER A. Formation of pure hematite by hydrolysis of iron(Ⅲ) salt solutions under hydrothermal conditions[J]. Crystal Research and Technology, 1986, 21(9): 1177-1183.
[32] 杨 凡, 邓志敢, 魏 昶, 李兴彬, 李存兄, 邱伟佳, 朱如龙. 高铁闪锌矿赤铁矿法除铁中锌离子和镁离子的影响及存在机理[J]. 中国有色金属学报, 2014, 24(11): 2906-2913.
YANG Fan, DENG Zhi-gan, WEI Chang, LI Xing-bin, LI Cun-xiong, QIU Wei-jia, ZHU Ru-long. Effect and existence mechanism of zinc ion and magnesium ion in iron removal from high iron sphaleriteby hematite process[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(11): 2906-2913.
Removal of iron from cobalt sulfate solution by oxidation-hydrolysis and hydrothermal conversion of iron removal residue
LIU Bo, ZHOU Qiu-sheng, LI Xiao-bin, PENG Zhi-hong, LIU Gui-hua, QI Tian-gui
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: Iron removal from high-iron cobalt sulfate solution by oxidative hydrolysis, and subsequent hydrothermal conversion of the iron residue into hematite were investigated. The factors influencing iron removal rate, cobalt loss rate and slurry settling speed, such as hydrogen peroxide dosage, pH value, temperature, seeds and additives, were investigated. This study also elucidates the influences of temperature, duration, NaOH concentration on iron and sulfur content, phase and morphology on the treated residue during the hydrothermal conversion process. The results show that, under the optimal conditions of 1.2 times of theoretical amount of H2O2, pH of 2.6, temperature of 70 ℃ and time of 4 h, the iron removal rate can reach 99.68% and the cobalt loss rate is as low as 2.87%. The addition of Fe(OH)3 seeds, PAM and PEG2000 mixed additives can greatly increase the slurry settling performance. Raising temperature, prolonging time and increasing alkali concentration are beneficial to the conversion of amorphous iron hydroxide into hematite. When the hydrothermal temperature is 230 ℃, the hydrothermal duration is 2 h and the NaOH concentration is 40 g/L, the amorphous phase in the iron residue are completely converted into hematite, with iron and sulfur content of 65.63% and 0.014%, respectively.
Key words: hematite; high-iron cobalt sulfate solution; oxidative hydrolysis; iron removal; hydrothermal conversion
Foundation item: Project(51874372) supported by the National Natural Science Foundation of China
Received date: 2019-09-20; Accepted date: 2020-05-25
Corresponding author: ZHOU Qiu-sheng; Tel: +86-731-88830453; E-mail: qszhou@csu.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(51874372)
收稿日期:2019-09-20;修订日期:2020-05-25
通信作者:周秋生,教授,博士;电话:0731-88830453;E-mail:qszhou@csu.edu.cn