光Fenton氧化降解染料阳离子红GTL
张亚平1, 2,韦朝海1
(1. 华南理工大学 环境科学与工程学院,广东 广州,510640;
2. 集美大学 生物工程学院,福建 厦门,361021)
摘 要:利用Ce-Fe/Al2O3为催化剂的非均相光Fenton体系降解阳离子红GTL,考察H2O2浓度、催化剂用量、初始pH值及不同工艺过程对降解效果的影响;依据紫外-可见吸收光谱、离子色谱、气相色谱-质谱联用对降解中间产物和最终产物的分析结果,探讨阳离子红GTL的降解路径和机理。研究结果表明:在功率为11 W的低压汞灯照射下,非均相光Fenton体系能够有效地降解结构稳定的阳离子红GTL,在pH=6.0,反应温度为20 ℃,时间为90 min,Ce-Fe/Al2O3 催化剂用量为2 g/L,H2O2质量浓度为0.34 g/L,含50 mg/L阳离子红GTL模拟废水总有机碳TOC去除率为92.40%;降解路径为:助色基团脱落,偶氮键断裂,苯环化合物和小分子醇、醛等中间产物形成,中间产物继续降解为小分子有机酸,最终产物为Cl-,NO3-,SO42-,CO2和H2O。
关键词:水处理;光Fenton;阳离子染料;Ce-Fe/Al2O3
中图分类号:X703 文献标识码:A 文章编号:1672-7207(2008)04-0688-06
Oxidation degradation of cationic red GTL by photo-Fenton
ZHANG Ya-ping1, 2, WEI Chao-hai1
(1. School of Environmental Science and Engineering, South China University of Technology, Guangzhou 510640, China;
2. School of Biology Engineering, Jimei University, Xiamen 361021, China)
Abstract: Degradation of cationic red GTL by heterogeneous photo-Fenton system using Ce-Fe/Al2O3 as catalyst was studied. The effects of initial concentration of H2O2, catalyst loading, initial pH value and various processes on degradation were investigated. The intermediates and final products during the reaction were detected by UV-vis absorption spectrography, ion chromatography and gas chromatography–mass spectrography. Degradation pathways and mechanism of cationic red GTL were discussed. The results show that cationic red GTL with stable structures can be degraded by heterogeneous photo-Fenton system. 92.40% of total organic carbon (TOC) removal ratio is achieved at pH=6.0, 20 ℃ of reaction temperature, 90 min of reaction time, 2 g/L of catalyst loading, 0.34 g/L of H2O2 concentration and 11 W low mercury light to 50 mg/L GTL-containing simulated wastewater. Degradation pathways include de-auxochrome, cleavage of azo bond, formation of benzene ring and small molecular compounds alcohol, aldehyde, further degradation of intermediate products to low molecular weight organic acid. The final products are Cl-, NO3-, SO42-, CO2 and water.
Key words: water treatment; photo-Fenton; cationic dye; Ce-Fe/Al2O3
全世界每年排放到环境中的染料占其生产总量的15%[1],偶氮染料是商业产品中最重要的染料系列,占工业应用染料的50%以上[2],在厌氧环境情况下形成具有致癌性的芳胺类化合物,属于持久性有机污染物。目前,人们采用吸附法[3]、化学沉淀法[4]、电化学氧化法[5]、臭氧氧化法[6]、次氯酸盐氧化法[7]、光催化氧化法[8]、超声催化氧化法[9]、光Fenton法[10-11]处理偶氮染料。采用吸附法和化学沉淀法,仅仅使污染物实现了相转移,因而需要额外的后处理;采用臭氧和次氯酸盐氧化存在投资高,运行成本高的不足;采用电化学法、超声催化氧化法时,光催化反应速度慢,处理能力有限[12]。而采用光Fenton法时,处理过程绿色化,H2O2生产成本降低,并且染料的矿化效果好,不足之处在于,均相光Fenton法因需要处理后续的铁泥而增加了处理成本。阳离子红GTL(碱性红18)作为一种重要的具有代表性的阳离子偶氮染料,广泛地应用于腈纶及其混纺织物的印染,它的处理目前还鲜见报道,在此,本文作者利用先期研制的Ce-Fe/Al2O3催化剂[13]光助催化H2O2降解阳离子红GTL模拟废水,以期揭示阳离子红GTL的降解路径和机理,为阳离子类染料处理提供借鉴。
1 实 验
1.1 试剂及仪器设备
试剂有:阳离子红GTL,为化学纯,最大吸收波长为530 nm,使用前未进行纯化处理,用去离子水配成质量浓度为200 mg/L的储备液备用,用时稀释至50 mg/L;Ce-Fe/Al2O3催化剂,为实验室制备[13]。
仪器设备有:小型光催化流化床反应器;1020A TOC分析仪;日立U-3010型紫外-可见分光光度计,Dionex 2010i离子色谱仪;岛津 QP2010色质联用仪。
1.2 实验方法
取质量浓度为50 mg/L阳离子红GTL模拟废水3 L于流化床反应器中,加入定量的Ce-Fe/Al2O3后曝气30 min混匀,加入H2O2迅速调节pH值(pH值调节采用H2SO4+NaOH),开启紫外光灯计时,每隔一段时间迅速取样进行总有机碳(TOC)测定。
1.3 分析方法
TOC采用美国O-I公司1020A TOC分析仪测定;紫外-可见吸收光谱采用日立U-3010型紫外-可见分光光度计测定;离子色谱采用美国Dionex 2010i离子色谱仪,电导检测器,数据处理采用 Dionex 4290积分仪,分离柱为HPIC-AG3和HPIC-AS3,淋洗液采用 Na2CO3和NaHCO3;GC-MS分析采用日本岛津QP2010,将反应15,60和90 min的样品混合酯化后进行二氯甲烷萃取,萃取后进行分析,经过多次实验后,具体条件确定为:于40 ℃保持2 min,以8 ℃/min升温到120 ℃,保持2 min,以10 ℃/min升温到200 ℃,保持1 min,以10 ℃/min升温到250 ℃,保持1 min,以10 ℃/min升温到300 ℃,保持2 min。
2 结果与讨论
2.1 阳离子红GTL降解影响因素
2.1.1 H2O2浓度对TOC 去除率的影响
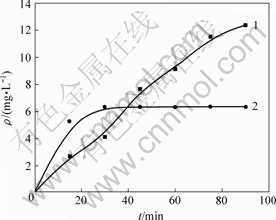
H2O2浓度在Fenton和光Fenton过程中起到较大的作用,当H2O2浓度较低时,随着H2O2浓度增加,光催化效率大大提高,因为H2O2是一种中等强度氧化剂,可以产生具有强氧化能力的自由基,同时H2O2过多时将成为自由基的清除剂。在催化剂用量为 2.0 g/L,pH=6.0,反应温度为20 ℃,功率为11 W的紫外灯照射条件下,H2O2浓度对TOC去除率的影响如图1所示。从图1可以看出,随着H2O2质量浓度从0.17 g/L增加到0.34 g/L,阳离子红GTL 90 min的TOC去除率从76.04%增加到92.40%,但是,当H2O2质量浓度超过0.34 g/L时,由于发生H2O2对自由基的捕获作用而导致自由基数量减少,降低了TOC的去除速率,因此,H2O2质量浓度最佳值为0.34 g/L。
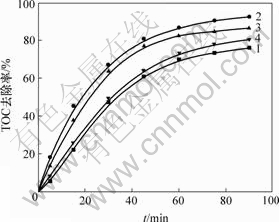
ρ(H2O2)/(g?L-1): 1—0.17; 2—0.34; 3—0.51; 4—0.68
图1 H2O2浓度对TOC 去除率的影响
Fig.1 Effect of H2O2 concentration on TOC removal ratio
2.1.2 催化剂用量对TOC 去除率的影响
催化剂用量对光Fenton过程有显著的影响,在H2O2 质量浓度为0.34 g/L,pH=6.0,反应温度为20 ℃,功率为11 W的紫外灯照射条件下,不同催化剂用量对阳离子红GTL TOC去除率的影响如图2所示。可见,催化剂用量在2.0 g/L以内增加时,TOC去除速度增加,当催化剂用量超过2.0 g/L时,阳离子红GTL模拟废水TOC去除率降低。催化剂在反应体系中起到2个作用:一是随催化剂用量增加加快了H2O2的分解;另一方面,过多的催化剂使光的透射受阻,抑制自由基的产生。这2方面相互作用的结果,使得体系有一个最佳催化剂用量。
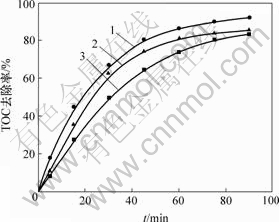
催化剂用量/(g?L-1):1—2.0; 2—3.0; 3—1.0
图2 催化剂用量对TOC去除率的影响
Fig.2 Effect of catalyst loading on TOC removal ratio
2.1.3 pH值对TOC 去除率的影响
pH值对阳离子红GTL模拟废水TOC 去除率的影响见图3。实验在初始pH值为3.0,6.0和9.0下进行;H2O2质量浓度为0.34 g/L,催化剂用量为2.0 g/L,反应温度为20 ℃,紫外灯功率为11 W,阳离子红GTL降解速度最快在pH=3.0和6.0时最初速度比较慢,在90 min和pH=3.0达到基本相同的效果;当pH=9.0时,降解速度比较慢,阳离子红GTL完全降解需要90 min以上。均相光Fenton体系中,最佳pH值在2.5~3.0之间,Fe3+主要以[Fe(OH)]2+存在,其光催化活性最高;当pH值降低时,Fe3+和Fe2+的转化受到抑制,pH值升高时,铁将形成沉淀,降低甚至失去催化能力。对于非均相体系,铁离子是固定化且高度分散的,与均相体系相比,该催化剂在pH=3.0~6.0之间具有相当高的催化活性而拓宽体系的pH值。
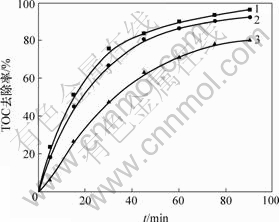
pH:1—3.0; 2—6.0; 3—9.0
图3 pH值对TOC 去除率的影响
Fig.3 Effect of pH value on TOC removal ratio
2.1.4 不同氧化体系对TOC 去除率的影响
在H2O2质量浓度为0.34 g/L,催化剂用量为2 g/L,pH=6.0,反应温度为20 ℃,紫外灯功率为11 W的条件下,研究不同氧化体系条件下阳离子红GTL模拟废水的TOC 去除效果,结果如图4所示。从图4可以看出,单独采用紫外光解,阳离子红GTL基本不降解;在暗Fenton反应条件下,TOC去除率为9.36%;通过紫外光光解Fe(III)产生?OH,阳离子红GTL反应90 min时TOC去除率为16.29%;在非均相光Fenton条件下,90 min时TOC去除率为92.40%;采用与催化剂负载量相同的铁离子在相同条件下进行均相光Fenton反应,90 min时TOC去除率为76.48%。比较不同氧化体系,可以得到对阳离子红GTL模拟废水降解能力由大至小的顺序为:非均相 光Fenton,均相光Fenton,紫外光+催化剂,暗Fenton,紫外光。
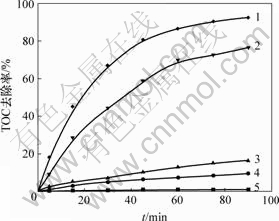
1—非均相光Fenton; 2—均相光Fenton;3—紫外光+催化剂;4—暗Fenton;5—紫外光
图4 不同氧化体系对TOC去除率的影响
Fig.4 Effect of different oxidation systems on TOC removal ratio
2.2 阳离子红GTL降解过程表征
2.2.1 阳离子红GTL降解过程紫外-可见吸收光谱
阳离子红GTL有2个吸收峰,其中287 nm处的吸收峰对应于苯环类物质的吸收,530 nm处的吸收峰是阳离子红GTL分子的共轭结构引起的,它使阳离子红GTL呈现特有的红色。图5所示为阳离子红GTL的最大吸收峰由反应前530 nm 紫移到5 min时的518 nm,10 min时最大吸收峰紫移到505 nm。Zhao等[14]在阳离子红X-GRL臭氧降解过程中同样发现最大吸收峰紫移,是给电子性质的助色基团脱落,使染料生色基上的电子云密度下降,引起紫移。随着反应时间的延长,最大吸收峰消失,偶氮双键被破坏,染料发生脱色,287 nm处的苯环吸收峰消失,苯环类化合物开环降解。
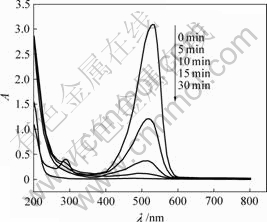
图5 阳离子红GTL降解过程中紫外-可见吸收光谱
Fig.5 UV-vis absorption spectra change of cationic red GTL during degradation process
2.2.2 离子色谱
运用离子色谱尝试检测反应过程中可能产生的SO2-4,NH+4,NO-3,NO-2,Cl-以及有机酸,反应15 min时阴离子色谱见图6。NO-3的来源可能有3个:偶氮基、硝基以及助色基团上的氮原子,·OH直接攻击与苯环相连的偶氮键。罗汉金等[15-17]通过研究发现偶氮基会以N2的形式分解,并未发现NH+4和NO-2的存在,说明二者直接转化成了NO-3;从吸收光谱变化上可以看到,30 min内染料达到完全脱色,表明此时偶氮键已全部从苯环上断开,但此时溶液中的NO-3的生成率明显低于理论计算量,说明有其他含氮物质生成,可以认为NO-3由助色基团氮原子和苯环上的硝基产生。Cl-来源于苯环上的脱氯,它的变化并不明显,在氧化初期30 min就很快从苯环上脱下(图7)。反应15 min时有甲酸出现,由助色基团上的甲基氧化生成。
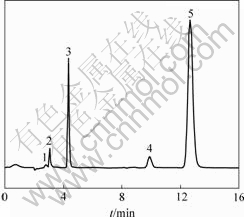
1—HCOO-; 2—CH3COO-; 3—Cl-; 4—NO-3; 5—SO2-4
图6 阳离子红GTL降解15 min时的离子色谱图
Fig.6 IC chromatogram of cationic red GTL at 15 min of degradation time
1—NO-3; 2—Cl-
图7 阳离子红GTL降解时的Cl-和NO-3浓度变化
Fig.7 Change of nitrate and chloride concentration of cationic red GTL during degradation process
2.2.3 GC-MS分析
为进一步了解阳离子红GTL降解过程的中间产物和最终产物,采用GC-MS手段对不同反应时间的样品进行分析,总离子流见图8,可能产生的中间产物见表1。
表1 阳离子红GTL降解过程中间产物
Table 1 Intermediate products produced by GC/MS during degradation process of cationic red GTL
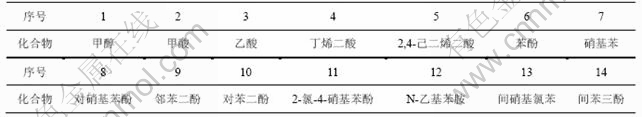
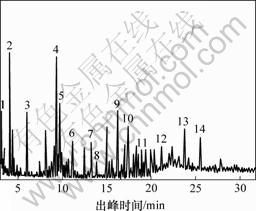
图8 阳离子红GTL降解过程总离子流图
Fig.8 TIC of organic compound during degradation process of cationic red GTL
2.2.4 阳离子红GTL降解路径
结合紫外-可见吸收光谱、离子色谱、GC-MS分析,可以推断出阳离子红GTL降解的可能路径(图9)为:
a. 阳离子红降解过程第1步为助色基团的脱 落,从紫外-可见吸收光谱中最大吸收峰的紫移可以验证。
b. 偶氮双键的断裂,从紫外-可见光谱最大吸收峰的消失,同时,GC-MS中检测到N—乙基苯胺化合物,可以说明偶氮双键断裂。
c. 助色基团的降解,离子色谱检测到有甲酸的 生成。
d. 苯环类化合物的形成,GC-MS中检测到硝基苯、苯酚、对苯二酚、间苯三酚、邻苯二酚等苯环类化合物。
e. 苯环类化合物的降解,苯酚降解的中间产物为醌[18],通过GC-MS很难检测到,但是,液相色谱技术可以检测到[19],醌进一步降解为有机酸,顺丁烯二酸是苯环开环产生的[20]。
f. 乙基的降解,中间产生乙醇酸,顺丁烯二酸进一步降解成草酸,直至降解为CO2。

图9 阳离子红GTL降解路径
Fig.9 Probable degradation pathways of cationic red GTL
3 结 论
a. 非均相光Fenton体系降解了阳离子红GTL,为阳离子染料废水的处理提供一个好的选择。阳离子红GTL模拟废水的处理参数为pH=6.0,Ce-Fe/Al2O3催化剂用量为2.0 g/L,H2O2质量浓度为0.34 g/L,反应温度为20 ℃,功率为11 W的紫外灯,阳离子红GTL TOC去除率达到92.40%。不同氧化体系对阳离子红GTL的降解能力由大至小为:非均相光Fenton,均相光Fenton,紫外光+催化剂,暗Fenton,紫外光。
b. 结合紫外-可见吸收光谱、离子色谱、GC-MS手段表征,阳离子红GTL的降解路径为助色基团脱落,偶氮双键断裂,苯环化合物和小分子醇、醛等中间产物形成,中间产物继续降解为小分子有机酸,最终产物为Cl-,NO-3,SO2-4,CO2和H2O。
参考文献:
[1] LIU Guang-ming, ZHAO Jin-cai. Photocatalytic degradation of dye sulforhodamine B: A comparative study of photocatalysis with photosensitization[J]. New Journal Chemistry, 2000, 24(6): 411-417.
[2] ZHU Chun-mei, WANG Liang-yan, KONG Lin-ren, et al. Photocatalytic degradation of AZO dyes by supported TiO2+UV in aqueous solution[J]. Chemosphere, 2000, 41(3): 303-309.
[3] GONG Ren-min, LI Mei, YANG Chao, et al. Removal of cationic dyes from aqueous solution by adsorption on peanut hull[J]. Journal of Hazardous Materials, 2005, 121(1/3): 247-250.
[4] Georgiou D, Aivazidis A, Hatiras J, et al. Treatment of cotton textile wastewater using lime and ferrous sulfate[J]. Water Research, 2003, 37(9): 2248-2250.
[5] Raghu S, Ahmed B C. Electrochemical treatment of procion black 5B using cylindrical flow reactor—A pilot plant study[J]. Journal of Hazardous Materials, 2007, 139(2): 381-390.
[6] Lackey L W, Mines J R O, McCreanor P T. Ozonation of acid yellow 17 dye in a semi-batch bubble column[J]. Journal of Hazardous Materials, 2006, 138(2): 357-362.
[7] Szpyrkowicz L, Juzzolino C, Kaul S. A comparative study on oxidation of disperse dyes by electrochemical process, ozone, hypochlorite and Fenton reagent[J]. Water Research, 2001, 35(9): 2129-2136.
[8] 丁敦煌, 曾冬铭, 唐兆麒, 等. 光催化分解活性染料及其高效催化剂[J]. 中南工业大学学报: 自然科学版, 2002, 33(5): 480-483.
DING Dun-huang, ZENG Dong-ming, TANG Zhao-qi, et al. Degradation of active dyes by photo-catalysis and its effective catalyst[J]. Journal of Central South University of Technology: Natural Science, 2002, 33(5): 480-483.
[9] Vajnhandl S, Marechal A M L. Case study of the sonochemical decolouration of textile azo dye Reactive Black 5[J]. Journal of Hazardous Materials, 2007, 141(1): 329-335.
[10] LI Yi-min, LU Yue-qing, ZHU Xiao-liu. Photo-Fenton discoloration of azo dye X-3B over pillared bentonites containing iron[J]. Journal of Hazardous Materials, 2006, 132(2/3): 196-201.
[11] Modirshahla N, Behnajady M A, Ghanbary F. Decolorization and mineralization of C.I. Acid Yellow 23 by Fenton and photo-Fenton processes[J]. Dyes and Pigments, 2007, 73(3): 305-310.
[12] Malik P K, Saha S K. Oxidation of direct dyes with hydrogen peroxide using ferrous ion catalyst[J]. Separation and Purification Technology, 2003, 31(3): 241-250.
[13] 张亚平, 韦朝海, 吴超飞, 等. 光Fenton反应的Ce-Fe/Al2O3催化剂制备及性能表征[J]. 中国环境科学, 2006, 26(3): 320-323.
ZHANG Ya-ping, WEI Chao-hai, WU Chao-fei, et al. Preparation and characterization of CeO2 doped with Fe/Al2O3 catalyst in photo-Fenton reaction[J]. China Enviromental Science, 2006, 26(3): 320-323.
[14] ZHAO Wei-rong, SHI Hui-xiang, WANG Da-hui. Ozonation of cationic X-GRL in aqueous solution: Degradation and mechanism[J]. Chemosphere, 2004, 57(9): 1189-1199.
[15] 罗汉金, 刘佳乐, 韦朝海, 等. 染料溶液的臭氧脱色效率和残留物的分析研究[J]. 环境化学, 2006, 25(5): 602-606.
LUO Han-jin, LIU Jia-le, WEI Chao-hai, et al. Research on the decolorization efficiency by ozone and residues of dye aqueous solution[J]. Environmental Chemistry, 2006, 25(5): 602-606.
[16] Konstantinou I K, Albanis T A. TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: kinetic and mechanistic investigation A review[J]. Applied Catalysis B: Environmental, 2004, 49(1): 1-14.
[17] Behnajady M A, Modirshahla N, Daneshvar N, et al. Photocatalytic degradation of an azo dye in a tubular continuous-flow photoreactor with immobilized TiO2 on glass plates[J]. Chemical Engineering Journal, 2007, 127(1/3): 167-176.
[18] Fukushima M. The fate of aniline after a photo-Fenton reaction in aqueous system containing iron(III), humic acid, and hydrogen peroxide[J]. Environmental Science and Technology, 2000, 34(10): 2006-2013.
[19] 李治国, 董 里, 史惠祥, 等. Fenton试剂处理2, 4-D废水研究[J]. 浙江大学学报: 理学版, 2004, 31(4): 442-445.
LI Zhi-guo, DONG Li, SHI Hui-xiang, et al. Oxidation of 2,4-Dichlorphenoxyacetic Acid by Fenton reagent[J]. Journal of Zhejiang University: Science Edition, 2004, 31(4): 442-445.
[20] Stylidi M, Kondarides D. Visible light-induced photocatalytic degradation of acid orange 7 in aqueous TiO2 suspensions[J]. Applied Catalysis B: Environmental, 2004, 47(3): 189-201.
收稿日期:2007-09-06;修回日期:2007-11-12
基金项目:国家自然科学基金资助项目(20277010);集美大学科研基金资助项目(C60649,C60603)
通信作者:韦朝海(1962-),男,广西河池人,博士,教授,从事水污染控制理论与工程技术研究;电话:020-39380588;E-mail: Cechwei@scut.edu.cn