DOI: 10.11817/j.ysxb.1004.0609.2020-39533
难冶金精矿烟尘中铁砷碳的脱除对氰化浸金的影响
曹 攀,张霜华,郑雅杰
(中南大学冶金与环境学院,长沙 410083)
摘 要:以难冶金精矿烟尘为原料,研究了氢氧化钠浸出、硫酸浸出以及硫酸与氢氧化钠联合浸出对烟尘中砷、铁和碳脱除及氰化浸金的影响。结果表明:在氢氧化钠浓度为6mol/L时,砷、碳脱除率分别为99.66%和60.63%,金浸出率为58.90%,较直接氰化浸出仅提高4.60%,砷的有效去除不能有效提高金的浸出率。在硫酸质量分数为15%时,铁、砷和碳脱除率分别为33.65%、80.38%和12.59%,金的浸出率为80.40%,与氢氧化钠浸出相比,硫酸浸出解离铁能有效提高金的浸出率。烟尘分别经过质量分数为15%硫酸浸出后氰化浸金,两次2 mol/L氢氧化钠浸出和氰化浸金后,烟尘中铁、砷和碳的总脱除率分别为33.65%、 95.63%和79.60%,渣率为80.33%。此时,金的总浸出率为91.90%,氰化渣中金的含量为3.31g/t。与烟尘直接氰化浸出相比金的浸出率提高37.60%。
关键词:金精矿;焙烧;烟尘;浸出除杂;氰化
文章编号:1004-0609(2020)-05-1142-11 中图分类号:TF831 文献标志码:A
难处理金矿指经细磨后氰化浸出率小于 80%的金矿石[1-2]。这些矿石难冶的程度和原因取决于其固有的化学组成和物理特性[1, 3-6]。这些矿石氰化浸出前通常需要经过氧化焙烧、加压氧化、化学氧化和生物氧化等预处理[7-13]。
氧化焙烧具有投资适中、效率高和技术成熟等特点,因此被广泛的用于难冶金精矿脱硫、脱砷[7, 14-15]。难冶金精矿经过焙烧,产生焙砂和烟尘,焙砂通过酸浸或碱浸预处理后氰化浸金,金的浸出率一般大于90%[16-18]。而烟尘颗粒粒度细小,杂质含量高,一般金的浸出率低于80%[19]。
对于硫含量较高的烟尘,通过焙烧烟尘的方法,充分脱除硫,金的浸出率可提高到了90%以上[20]。对于砷和碳含量较高的烟尘,由于砷脱除需要在弱氧化气氛下进行,然而碳的脱除需要在强氧化条件下进行,因此通过简单的焙烧不能同时彻底脱除砷和碳,提高金的浸出率[21]。同时,烟尘焙烧时由于热值不够需要补加煤或天然气,因此能耗高。实际工厂采用返回焙烧炉与金精矿一起焙烧,但是受沸腾炉处理能力以及工艺的限制,往往不能够完全处理。因此,本研究采用了硫酸和氢氧化钠联合浸出除杂后,金的氰化浸出率与烟尘直接氰化浸金相比,金的浸出率从54.30%提高到91.90%。研究揭示了杂质对金浸出率的影响,并得出了适宜难冶金精矿烟尘的湿法处理工艺。
1 实验
1.1 实验原料
实验所用难冶金精矿烟尘来自新疆某金冶炼厂,经过充分混合后用做实验原料。外观呈红褐色粉末状,平均粒径为4 μm。主要化学成分如表1所列。
表1 烟尘主要化学成分
Table 1 Chemical composition of dust (mass fraction, %)
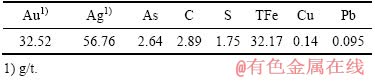
由表1可知,实验所用难冶金精矿烟尘的主要组分为Fe,其含量为32.17%,有价组分Au、Ag含量分别为32.52 g/t和56.76 g/t,As和C元素含量分别为2.64%和2.89%。
为进一步明确难冶金精矿烟尘的矿物组成,实验进行了矿物解离度分析(MLA),结果如表2所列。由表2可知,难冶金精矿烟尘主要的矿物包括赤铁矿、磁赤铁矿、磁铁矿、石英、云母、硬石膏、砷氧化物和碳质物等。
表2 烟尘主要矿物组成
Table 2 Major minerals composition in dust (mass fraction, %)

试验药剂:氢氧化钠、硫酸均为分析纯,氰化物为工业纯。
1.2 实验步骤
1.2.1 氢氧化钠浸出
将一定浓度的氢氧化钠溶液加入1L三颈瓶中,启动加热套加热至90 ℃恒温,在300 r/min的搅拌条件下缓慢加入烟尘或氰化渣,在液固比3:1条件下反应2 h后过滤,滤渣进行氰化浸出。
1.2.2 硫酸浸出
将一定浓度的硫酸溶液加入1L三颈瓶中,启动加热套加热至90 ℃恒温,在300 r/min的搅拌条件下将200 g难冶金精矿烟尘缓慢加入,在液固比4:1条件下反应4h后过滤,滤渣浆洗3遍,过滤,滤渣进行氰化浸出。
1.2.3 氰化浸出
称取100 g上述酸浸渣或碱浸渣置于500 mL三颈瓶中,按液固比4:1,加入质量分数为0.6%的氰化钠溶液,滴加氢氧化钠溶液调节矿浆pH=11,用空气泵向矿浆中泵入空气,在搅拌强度为300 r/min条件下常温浸出48 h。
1.3 分析方法
采用矿物解离分析仪(MLA,FEI.Quanta 600, JKtech MLA suite)分析烟尘矿物组成;采用电感耦合等离子体发射光谱仪(ICP-OES, iCAP 7000 series, Thermo Fisher Scientific)分析溶液元素含量;采用高频红外碳硫分析仪(HCS-800,凯德仪器公司生产)测定酸浸及碱浸渣中碳含量;采用扫面电镜(SEM,FEI ESEM,Quanta 200)分析固体形貌;采用火试金法(GB/T 11066.1—1989)测定烟尘及氰化渣中金的含量用。金的浸出率由式(1)计算。
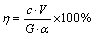 (1)
(1)
式中:c为浸出液中金的浓度,g/L;V为浸出液体积,L;G为烟尘质量,g。
2 结果与讨论
2.1 氢氧化钠浸出对烟尘杂质去除及氰化浸金的影响
研究了氢氧化钠预浸出过程氢氧化钠浓度对烟尘中砷碳脱除率、碱浸渣率及碱浸渣中金氰化浸出率的影响,试验结果如图1所示。
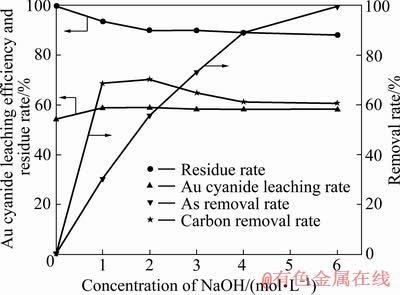
图1 氢氧化钠浓度对烟尘中有害元素脱除率、碱浸渣率及碱浸渣中金氰化浸出率的影响
Fig. 1 Effects of NaOH concentrations on removal rate of harmful element in dust, alkali leaching residue rate and gold cyanide leaching efficiency
由图1可知,当氢氧化钠浓度从0升高到6 mol/L时,碱浸渣渣率由100.00%下降到88.20%,砷的脱除率由0逐渐增加至99.66%。结果表明氢氧化钠能有效的脱除烟尘中的砷。当氢氧化钠浓度从0增加到2 mol/L时,碳的脱除率由0升高至70.23%,继续增加氢氧化钠浓度,碳的脱除率逐渐下降至60.63%。当氢氧化钠浓度从0增加到2 mol/L时,金的浸出率由54.30%升高至58.90%,随着氢氧化钠浓度的继续增加,金的浸出率基本不变。
烟尘中不同砷的化合物如表3所列。
表3 烟尘中不同砷的化合物含量
Table 3 Contents of arsenic-bearing compound in dust
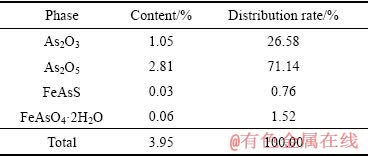
由表3可知,烟尘中砷主要以三氧化二砷和五氧化二砷等氧化物的形式存在,砷的氧化物与氢氧化钠的反应如式(2)和式(3)[22]所示:
As2O3+2NaOH=2NaAsO2+H2O (2)
As2O5+6NaOH=2Na3AsO4+3H2O (3)
当三氧化二砷溶解反应达到平衡时,其平衡常数如下:
 (4)
(4)
在标准状态下,反应的标准吉布斯自由能变化为
 (5)
(5)
根据热力学数据表[23]可知, =-50.26 kJ/mol,则标准状态下反应的平衡常数为1×108.81。标准状态下五氧化二砷与氢氧化钠反应的平衡常数为1×1049.46。热力学计算表明,三氧化二砷和五氧化二砷与氢氧化钠反应趋势很大。砷的氧化物极易溶于氢氧化钠溶液,且随氢氧化钠浓度的增加,亚砷酸根及砷酸根浓度也会随之增加,从而导致氢氧化钠预浸过程中砷脱除率的增加。所以氢氧化钠浸出能够有效脱除烟尘中的砷,砷最高脱除率达到了99.66%。
=-50.26 kJ/mol,则标准状态下反应的平衡常数为1×108.81。标准状态下五氧化二砷与氢氧化钠反应的平衡常数为1×1049.46。热力学计算表明,三氧化二砷和五氧化二砷与氢氧化钠反应趋势很大。砷的氧化物极易溶于氢氧化钠溶液,且随氢氧化钠浓度的增加,亚砷酸根及砷酸根浓度也会随之增加,从而导致氢氧化钠预浸过程中砷脱除率的增加。所以氢氧化钠浸出能够有效脱除烟尘中的砷,砷最高脱除率达到了99.66%。
砷对氰化浸金的影响主要体现在如下两个方面:一方面,砷的氧化物会消耗溶液中的碱,降低溶液pH值。然而当pH低于9.3时,氰化物急剧水解生成挥发性的氰氢酸气体,氰氢酸与氰根的比例将大于1。pH值越低氰根离子所占比例越低,与金反应的氰根离子的浓度越低,进而影响金的浸出。在缺乏游离碱时,砷的氧化物还可与氰化物起作用生成氢氰酸气体,消耗氰化物,影响金的浸出。另一方面,含砷矿物在碱性矿浆中分解生成亚砷酸盐、砷酸盐等含砷盐,它们与金粒表面接触时可在金颗粒表面生成相应的薄膜,阻碍金粒表面与溶解氧和氰根离子的接触,进而阻碍金的浸出[21, 24]。氢氧化钠预浸出,能有效脱除烟尘中的砷,从而减少砷对氰化浸出的不利影响,但是氢氧化钠浸取脱砷后,并不能有效提高金的浸出率。说明烟尘中砷不是影响金浸出的主要因素。
烟尘中碳的化学物相分析结果如表4所列。烟尘中碳质物偏光显微镜及SEM像如图2所示。
表4 烟尘中碳的化学物相组成
Table 4 Chemical phase composition of carbon in dust


图2 烟尘中碳质物图像
Fig. 2 Images of carbonaceous matter in dust
由表4可知,烟尘中碳的存在形式为石墨、有机碳和碳酸盐,其含量分别为0.22%、0.25%和2.42%,占总碳的比例分别为7.61%、8.65%和83.74%。
由图2可知,碳质物呈细小的片状、叶片状或针线状,具单向延伸形态,反射光下具有较显著双反射,后一特征说明样品中部分碳质物已发生晶质化而向石墨转变。碳质物与铁矿物、氧化砷和其他非金属矿物的嵌连关系并不十分密切,粒度2~5 μm。
根据烟尘中碳存在的形式可知,以石墨和腐殖酸类有机物形式存在的碳质物对氰化过程有严重不利影响。主要表现为上述碳质物在氰化浸金过程中的截金作用,使以金氰络合物形式溶解的金被吸附到碳质物上,最后损失在尾矿中,从而降低金的浸出率与回收率[4, 18, 25-26]。
烟尘氢氧化钠溶液预浸出过程,部分有机碳质物及可溶碳酸盐溶解于氢氧化钠溶液导致碳脱除率的增加[27],从而减小碳质物对氰化过程的不利影响。但氢氧化钠浓度过高时,矿浆粘度增加,扩散系数减小,从而导致碳的脱除率下降。
烟尘XRD物相分析结果及其EDS面扫描分析结果分别如图3和图4所示。
由图3可知,烟尘成分复杂,磁铁矿、赤铁矿、石英、云母及石膏为烟尘中主要矿物。由图4可知,金和铁元素总体分布均匀,但不同区域元素含量差别较大。金元素与铁元素交织在一起,在焙烧过程中,金粒表面形成氧化铁覆盖物[28]。一方面氢氧化钠预浸过程中,金粒表面覆盖的铁氧化物并不能溶解进入溶液,从而阻止氰化浸出过程金粒与氰化物的接触。另一方面与金粒连生在一起的铁氧化物,虽然不会完全阻止金粒与氰化物的反应,但是会减少其接触面积,影响金的浸出速率,从而影响金的浸出[16]。
综上所述,在氢氧化钠预浸出过程中当氢氧化钠浓度从0增加到2 mol/L时,金的浸出率由54.30%升高至58.90%,金浸出率增加的主要原因为砷、碳脱除率的增加。然而,当氢氧化钠浓度从2 mol/L增加到6 mol/L时,金的浸出率并没有随砷的进一步脱除而逐渐增加,其主要原因为铁氧化物对金氰化浸出的阻碍及碳脱除率的下降。
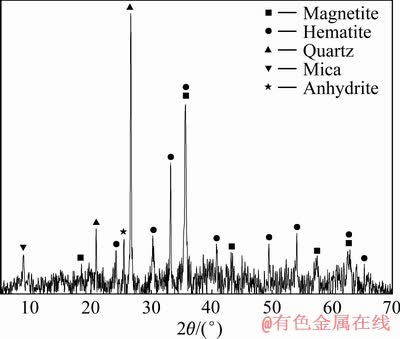
图3 烟尘的XRD谱
Fig. 3 XRD pattern of dust
2.2 硫酸浸出对烟尘杂质去除及氰化浸金的影响
研究了硫酸浓度对烟尘中砷、铁和碳脱除率及酸浸渣中金氰化浸出率的影响,结果如图5所示。

图4 烟尘的形貌及面扫描图
Fig. 4 Morphologies((a), (d)) and surface scanning maps((b), (c), (e), (f)) of dust
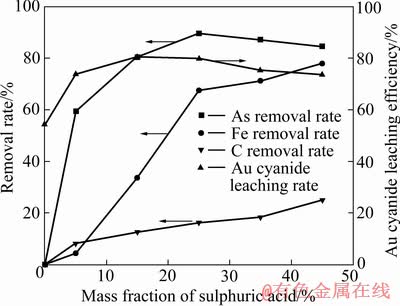
图5 硫酸浓度对烟尘中砷、铁和碳脱除率及酸浸渣中金氰化浸出率的影响
Fig. 5 Effects of sulphuric acid concentrations on As, Fe and C removal rate in dust and Au cyanide leaching efficiency in acid leaching residues
由图5可知,当硫酸质量分数从0增加到45%时,铁和碳的脱除率分别从0增加到24.92%和77.79%。对砷而言,硫酸质量分数从0增加到25%时,砷的脱除率从0增加到89.60%;而硫酸质量分数增加到45%时,砷的脱除率下降至84.60%。当硫酸质量分数由0增加到15%时,金的浸出率由54.30%增加到80.40%,随着硫酸质量分数的继续增加,金的浸出率逐渐降低,硫酸质量分数为45%时,金的浸出率仅为73.52%。
烟尘中铁的化学物相分析结果分别如表5所列。
表5 烟尘中铁的化学物相分析
Table 5 Chemical phase analysis of iron in dust
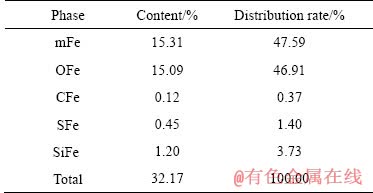
由表5可知,烟尘中赤铁矿和磁铁矿所占比例分别为47.5%和46.91%,以碳酸盐、硫化物和硅酸盐形式存在的铁所占比例仅为5.50%。三氧化二铁和四氧化三铁溶于硫酸的反应如反应式(6)和式(7)[29]式所示:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O (6)
Fe3O4+4H2SO4=Fe2(SO4)3+FeSO4+4H2O (7)
当三氧化二铁溶解反应达到平衡时,其平衡常数如下:
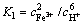 (8)
(8)
在标准状态下,反应的标准吉布斯自由能变化为
 (9)
(9)
根据热力学数据表[23]可知, =-261.21 kJ/mol,则标准状态下反应的平衡常数为K1=1×1045.76。同样的方法标准状态下四氧化三铁与硫酸反应的平衡常数K2=1×1063.55。
=-261.21 kJ/mol,则标准状态下反应的平衡常数为K1=1×1045.76。同样的方法标准状态下四氧化三铁与硫酸反应的平衡常数K2=1×1063.55。
热力学计算表明,三氧化二铁和四氧化三铁在酸性溶液中反应趋势很大,随硫酸浓度增加,铁的浸出率逐渐升高,因此铁的脱除率随硫酸浓度的增加而升高。通过硫酸浸出,可有效地解离铁氧化物,减少其对浸金过程的不利影响。
硫酸浸出过程中,五氧化二砷极易溶于硫酸溶液,然而,三氧化二砷在硫酸溶液中的溶解度随硫酸浓度的升高而下降[30-31]。当硫酸质量分数大于25%后,砷的浸出率略有下降,是由于过高硫酸浓度导致三氧化二砷溶解度下降所致。通过酸浸,能够有效脱除烟尘中部分砷,减少砷对金浸出的有害影响。
烟尘经酸浸后渣中碳含量测试结果如图6所示。

图6 硫酸浓度对酸浸渣中碳含量的影响
Fig. 6 Effect of H2SO4 concentrations on carbon content in acid leaching residues
由图6可知,当硫酸质量分数从0增加到45%时,酸浸渣率从100.00%下降到53.50%,酸浸渣中碳含量从2.89%增加到4.06%。由于酸浸时渣量减少,烟尘中碳溶出少,导致酸浸渣碳含量的增加。相同质量的烟尘和酸浸渣在相同氰化条件氰化浸出时,由于酸浸渣中碳含量高于烟尘中的碳含量,因此,酸浸渣中碳的总质量高于烟尘中碳的总质量,碳质物在氰化浸金过程中的截金作用增强,使以金氰络合物形式溶解的金更多的被吸附到碳质物上,最后损失在尾矿中,从而金的浸出率降低。
综上所述,当硫酸质量分数由0增加到15%时,硫酸浸出能有效溶解烟尘渣中的铁氧化物和砷,从而使金的浸出率达到了80.40%,与氢氧化钠浸出相比,硫酸浸出解离铁能有效提高金的浸出率。
2.3 硫酸和氢氧化钠联合浸出对烟尘氰化浸金的影响
2.3.1 硫酸浸出后氢氧化钠浸出对杂质去除及金浸出的影响
研究表明硫酸和氢氧化钠浸出能够有效消除烟尘中阻碍金浸出的因素,但是单独处理时,金浸出率低于90%。因此,研究了烟尘硫酸和氢氧化钠联合浸出对氰化浸金的影响。
以15%硫酸浸出渣为原料,研究了氢氧化钠浓度对酸浸渣中砷、碳脱除率以及碱浸渣渣率和金氰化浸出率的影响,试验结果分别如图7和8所示。
由图7可知,当氢氧化钠浓度由0升高到6 mol/L时,碱浸渣渣率由100.00%下降到95.50%。当氢氧化钠浓度由0升高到2 mol/L时,砷的脱除率由0升高到10.82%,碳的脱除率由0升高到61.38%,砷脱除率的升高是由硫酸浸出过程中未溶解完全的砷氧化物与氢氧化钠反应进入溶液所致,碳脱除率的增加是由于有机碳质物及可溶碳酸盐溶解于氢氧化钠溶液。继续增加氢氧化钠浓度,砷和碳的脱除率无明显变化。
由图8可知,当氢氧化钠浓度由0升高到6 mol/L时,碱浸渣渣率由100.00%下降到95.50%,金的浸出率由80.40%逐渐下降至63.49%。
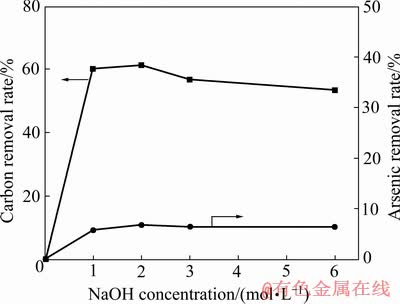
图7 氢氧化钠浓度对酸浸渣中砷和碳脱除率的影响
Fig. 7 Effects of NaOH concentrations on As and C removal rate in acid leaching residues
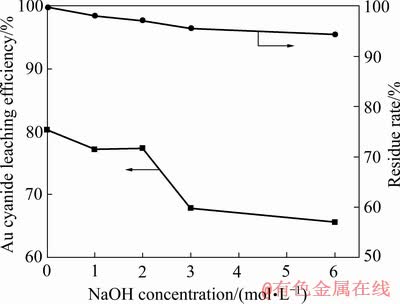
图8 氢氧化钠浓度对碱浸渣渣率及金浸出率的影响
Fig. 8 Effect of NaOH concentrations on alkali leaching residue rate and Au cyanide leaching efficiency
不同氢氧化钠浓度浸出条件下得到的碱浸渣SEM分析实验结果如图9所示。
由图9(a)可知,颗粒呈疏松多孔结构。图9(b)~(d)所示为酸浸渣经过氢氧化钠处理后渣,颗粒部分孔道被堵塞,孔隙率降低,且随着氢氧化钠浓度的增加,颗粒孔隙率降低,当氢氧化钠浓度为6 mol/L时,颗粒出现了板结现象。
当氢氧化钠浓度由0升高到6 mol/L时,金的浸出率不随砷、碳去除率增加而增加,反而逐渐下降。从氢氧化钠浸出渣分析,随着碱浸过程氢氧化钠浓度的升高,颗粒孔隙率降低,且细小颗粒团聚现象加剧,阻碍了金矿物颗粒与氰化物溶液的接触,从而导致金浸出率随氢氧化钠浓度的增大而下降。
2.3.2 硫酸浸出氰化后氢氧化钠对杂质去除及金浸出的影响
由上述分析可知,烟尘经15%硫酸酸浸预处理后氰化浸出,金的浸出率为80.40%,然而15%硫酸酸浸渣经氢氧化钠碱浸预处理后,金的浸出率反而下降,可能的原因是酸浸后部分已解离和裸露金,在碱浸预处理过程又重新被其他矿物包裹或罩盖,从而不能与氰化物接触,导致金的浸出率下降。因此研究了氢氧化钠浓度对酸浸后浸金渣中杂质去除及氰化浸金的影响。
本部分氰化浸出时间均为24 h,其他条件与小节1.3中氰化实验条件相同。15%硫酸浸出渣氰化24 h时,金的浸出率为62.00%,得到一次浸金渣中金含量为15 g/t。氢氧化钠浓度对一次浸金渣中砷、碳脱除率及碱浸渣中金氰化浸出的影响如图10所示。
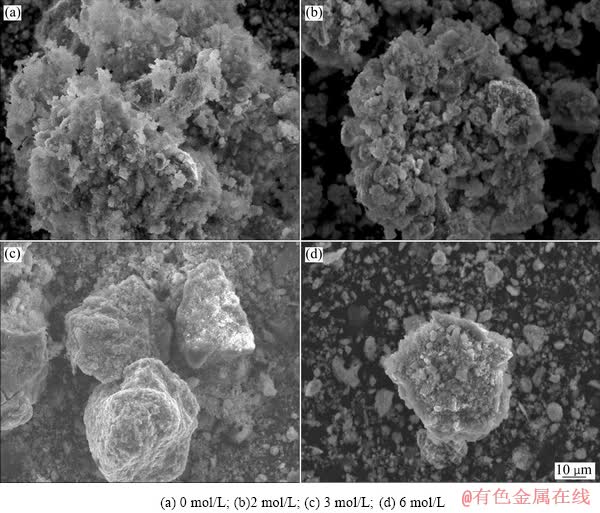
图9 不同氢氧化钠浓度浸出条件下得到的碱浸渣SME像
Fig. 9 SME images of alkali leaching residues obtained under different NaOH concentrations

图10 氢氧化钠浓度对一次浸金渣中砷碳脱除率、渣率及碱浸渣中金氰化浸出率的影响
Fig. 10 Effect of NaOH concentrations on As and C removal rate in first cyanide leaching residue, residue rate and Au cyanide leaching efficiency in alkali leaching residues
由图10可知,当氢氧化钠浓度由0升高到6 mol/L时,渣率由100.00%下降到98.00%。当氢氧化钠浓度由0升高到2 mol/L时,砷、碳脱除率分别由0升高到47.45%和70.50%,金的浸出率由50.96%升高到64.62%,此时金的浸出率占烟尘中金金属量的24.55%;继续增加氢氧化钠浓度砷、碳脱除率和金的浸出率反而下降;当氢氧化钠浓度为6 mol/L时,砷、碳脱除率和金的浸出率分别为36.42%、60.74%和52.78%,金浸出率的变化趋势基本与砷碳脱除率的变化规律一致。
由此可知,在酸浸解离铁后,氢氧化钠浸出能够继续去除浸金渣中砷和碳,从而金浸出率提高。在杂质脱除后,进行氰化有利于氰化物溶解金活性的提高[32]。
不同氢氧化钠浓度条件下碱浸渣的SEM像如图11所示。由图11可知,酸浸氰化后,再氢氧化钠浸出,颗粒孔隙度减少,特别是当氢氧化钠浓度为6 mol/L时,颗粒板结现象严重。当氢氧化钠浓度大于2 mol/L后,金浸出率下降的原因,一是砷碳脱除率的降低;另一方面可能是随氢氧化钠浓度的增加,渣中颗粒表面板结现象加重,从而导致孔隙率下降,从而影响金矿物颗粒与氰化物溶液的接触,因此金浸出率下降。
烟尘经15%硫酸浸出后一次氰化,一次浸金渣经2 mol/L氢氧化钠浸出后氰化,金的总浸出率为86.55%,砷的总脱除率为91.38%,碳的总脱除率为74.10%,二次浸金渣中金含量为5.31 g/t。为了进一步降低浸金渣中金的含量,采用2 mol/L的氢氧化钠溶液浸出二次浸金渣后氰化,实验结果如表6所列。
由表6可知,第二次碱浸过程砷的脱除率为40.01%,碳脱除率为17.23%,碱浸液中金含量为0。第三次氰化浸出过程金浸出率为37.67%,占烟尘中金金属量的5.35%。通过三次氰化浸出金的总浸出率为91.90%,最终氰化尾渣中金的含量为3.31g/t。对于碱浸后二次浸金渣再次碱浸,由于渣中碳和砷含量降低,因此经过第三次氰化,金的浸出率可以提高5.35%。可以说明在解离铁后和去除砷碳后,氰化可有效进行。
鉴于酸浸和碱浸能有效去除氰化浸金的不利因素以及氰化尾渣金含量为3.31 g/t,烟尘浸金工艺如图12所示。

图11 不同氢氧化钠浓度浸出条件下得到的碱浸渣SME像
Fig. 11 SME images of alkali leaching residues obtained under different NaOH concentrations
表6 二次浸金渣氢氧化钠浸出实验结果
Table 6 Result of NaOH leaching of second cyanide residue


图12 烟尘硫酸解离和氢氧化钠除杂氰化浸金工艺流程
Fig. 12 Cyanide leaching process flowsheet of dust through H2SO4 leaching dissociation and NaOH leaching edulcoration
3 结论
1) 烟尘中主要组分为Fe,其含量为32.17%,有价组分Au、Ag含量分别为32.52 g/t和56.76 g/t,As和C元素含量分别为2.64%和2.89%。主要的矿物包括赤铁矿、磁赤铁矿、磁铁矿、石英、云母、硬石膏、氧化砷矿物和碳质物等。
2) 在本试验研究范围内,当氢氧化钠浓度从0增加到6 mol/L时,砷脱除率从0升高至99.66%,碳脱除率从0增加至70.23%后降低至60.63%,金浸出率由54.30%增加到58.90%。砷的有效去除不能有效提高金的浸出率。当硫酸浓度由0增加到15%时,铁、砷和碳脱除率分别从0增加到33.65%、80.38%和12.59%,金的浸出率由54.3%增加到80.40%,与氢氧化钠预浸出相比,硫酸浸出解离铁能有效提高金的浸出率。
3) 研究表明,难冶金精矿烟尘分别经过浓度为当硫酸浓度为15%硫酸浸出后氰化浸金,两次2 mol/L氢氧化钠浸出和氰化浸金后,烟尘中铁、砷和碳的总脱除率分别为33.65%、 95.63%和79.60%,渣率为80.33%。此时金的总浸出率为91.90%,氰化渣中金的含量为3.31 g/t。与烟尘直接氰化浸出相比金的浸出率提高37.60%。
REFERENCES
[1] GONZALEZ-ANAYA J A, NAVA-ALONSO F, PECINA-TREVINO E T. Gold recovery optimization of a refractory concentrate by ultrafine grinding—A laboratory study [J]. Minerals & Metallurgical Processing, 2011, 28(2): 94-101.
[2] GUDYANGA F P, MAHLANGU T, ROMAN R J, MUNGOSHI J, MBEVE K. An acidic pressure oxidation pre-treatment of refractory gold concentrates from the Kwekwe roasting plant, Zimbabwe[J]. Minerals Engineering, 1999, 12(8): 863-875.
[3] DYER L G, SAUBER M, DIXON D G, ASSELIN E. On the refractory nature of precious metal tellurides[J]. Hydrometallurgy, 2017, 169: 488-495.
[4] MUBAROK M Z, WINARKO R, CHAERUN S K, RIZKI I N, ICHLAS Z T. Improving gold recovery from refractory gold ores through biooxidation using iron-sulfur-oxidizing/ sulfur-oxidizing mixotrophic bacteria[J]. Hydrometallurgy, 2017, 168: 69-75.
[5] AMANKWAH R K, PICKLES C A. Microwave roasting of a carbonaceous sulphidic gold concentrate[J]. Minerals Engineering, 2009, 22(13): 1095-1101.
[6] SEITKAN A, REDFERN S A T. Processing double refractory gold-arsenic-bearing concentrates by direct reductive melting[J]. Minerals Engineering, 2016, 98: 286-302.
[7] WANG G H, XIE J P, LI S P, GUO Y J, PAN Y, WU H, LIU X X. Two-step oxidation of refractory gold concentrates with different microbial communities[J]. Journal of Microbiology & Biotechnology, 2016, 26(11): 1871-1880.
[8] LI J, DABROWSKI B, MILLER J D, ACAR S, DIETRICH M, LEVIER K M, WAN R Y. The influence of pyrite pre-oxidation on gold recovery by cyanidation[J]. Minerals Engineering, 2006, 19(9): 883-895.
[9] MCDONALD R G, MUIR D M. Pressure oxidation leaching of chalcopyrite. Part Ⅰ. Comparison of high and low temperature reaction kinetics and products[J]. Hydrometallurgy, 2007, 86(3): 191-205.
[10] XU B, YANG Y B, JIANG T, LI Q, ZHANG X, WANG D. Improved thiosulfate leaching of a refractory gold concentrate calcine with additives[J]. Hydrometallurgy, 2015, 152: 214-222.
[11] HASHEMZADEHFINI M, FICERIOVA J, ABKHOSHK E, SHAHRAKI B K. Effect of mechanical activation on thiosulfate leaching of gold from complex sulfide concentrate[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(12): 2744-2751.
[12] TANAKA M, YAMAJI Y, FUKANO Y, SHIMADA K, ISHIBASHI J I, HIRAJIMA T, SASAKI K, SAWADA M, OKIBE N. Biooxidation of gold, silver, and antimony- bearing highly refractory polymetallic sulfide concentrates, and its comparison with abiotic pretreatment techniques[J]. Geomicrobiology Journal, 2014, 32(6): 538-548.
[13] YU R L, WU F D, CHEN A, SHI L J, ZENG W M, GU G H, QIN W Q, QIU G Z. Effect of mixed moderately thermophilic adaptation on leachability and mechanism of high arsenic gold concentrate in an airlift bioreactor[J]. Journal of Central South University, 2015, 22(1): 66-73.
[14] de MICHELIS I, OLIVIERI A, UBALDINI S, FERELLA F, BEOLCHINI F, VEGLIO F. Roasting and chlorine leaching of gold-bearing refractory concentrate: Experimental and process analysis[J]. International Journal of Mining Science and Technology, 2013, 23(5): 709-715.
[15] HAMMERSCHMIDT J, GUNTNER J, KERSTIENS B, CHARITOS A. Roasting of gold ore in the circulating fluidized-bed technology[J]. Developments in Mineral Processing, 2005, 15(9): 433-453.
[16] ZHANG S H, ZHENG Y J, CAO P, LI C H, LAI S Z, WANG X J. Process mineralogy characteristics of acid leaching residue produced in low-temperature roasting-acid leaching pretreatment process of refractory gold concentrates[J]. International Journal of Minerals, Metallurgy and Materials, 2018, 25(10): 1132-1139.
[17] DANG X E, KE W S, TANG C, LU J, LIU C P. Increasing leaching rate of gold cyanide of two-stage calcination generated from refractory ore containing arsenopyrite and pyrrhotite[J]. Rare Metals, 2016, 35(10): 804-810.
[18] LI Q, JI F Z, XU B, HU J J, YANG Y B, JIANG T. Consolidation mechanism of gold concentrates containing sulfur and carbon during oxygen-enriched air roasting[J]. International Journal of Minerals, Metallurgy and Materials, 2017, 24(4): 386-392.
[19] THOMAS K G, COLE A P. Roasting developments- especially oxygenated roasting[J]. Developments in Mineral Processing, 2005, 15: 403-432.
[20] 张跃红, 李 云, 刘洪晓, 栾东武, 黄海辉, 王 云. 难处理金精矿两段焙烧流程的技术改造[J]. 有色金属: 冶炼部分, 2015, 11: 36-38.
ZHANG Yue-hong, LI Yun, LIU Hong-xiao, LUAN Dong-wu, HUANG Hai-hui, WANG Yun. Technical transformation of two-stage roasting for refractory gold concentrates[J]. Nonferrous Metals: Extractive Metallurgy, 2015, 11: 36-38.
[21] 黄礼煌. 金银提取技术[M]. 北京: 冶金出版社, 2005: 133-299.
HUNGLi-huang. Extraction technology of gold and silver[M]. Beijing: Metallurgical Industry Press, 2005: 133-299.
[22] 水志良, 陈启超, 水浩东. 砷化学与工艺学[M]. 北京: 化学工业出版社, 2014: 20-22.
SHUI Zhi-liang, CHEN Qi-chao, SHUI Hao-Dong. Arsenic chemistry and technology[M]. Beijing: Chemical Industry Press, 2014: 20-22.
[23] DEAN J A. 兰氏化学手册[M]. 北京: 科学出版社, 1991: 6.92-6.93.
DEAN J A. Handbooks of lan-shi chemistry [M]. Beijing: Science Press, 1991: 6.92-6.93.
[24] 卢宜源, 宾万达. 贵金属冶金学[M]. 长沙: 中南大学出版社, 2004: 74-82.
LU Yi-yuan, BIN Wan-da. Metallurgy of precious metals [M]. Changsha: Central South University Press, 2004: 74-82.
[25] PYKE B L, JOHNSTON R F, BROOKS, P. The characterisation and behaviour of carbonaceous material in a refractory gold bearing ore[J]. Minerals Engineering, 1999, 12(8): 851-862.
[26] OFORI-SARPONG G, OSSEO-ASARE K. Preg-robbing of gold from cyanide and non-cyanide complexes: Effect of fungi pretreatment of carbonaceous matter[J]. International Journal of Mineral Processing, 2013, 119: 27-33.
[27] 张晓璐. 酸、碱污染土的试验研究[D]. 南京: 河海大学, 2007: 58-60.
ZHANG Xiao-lu. Experimental research on soil contaminated by acid and alkali[D]. Nanjing: Hohai University, 2007: 58-60.
[28] 王 勇. 含金砷硫精矿回收金的工艺研究[D]. 长沙: 中南大学, 2012: 5-6.
WANG Yong. Process study on recovery gold from surful concentrate containing gold and arsenic[D]. Changsha: Central South University, 2012: 5-6.
[29] 郑雅杰. 硫铁矿烧渣制备聚合硫酸铁和聚磷硫酸铁新工艺及基础理论研究[D]. 长沙: 中南大学, 2002: 13-14.
ZHENG Ya-jie. Study on new technology and fundumental theory of polyferric sulfate and phosphorous polyferric sulfate prepared from pyrite cinders[D]. Changsha: Central South University, 2002: 13-14.
[30] 黄 虹, 王钧阳. 从高砷金矿浸出液中提取砷的研究[J]. 金属材料与冶金工程, 1997, 4: 12-13.
HUANG Hong, WANG Jun-yang. Extraction of arsenic from leaching solution of high arsenic gold ore[J]. Metal Materials and Metallurgical Engineering, 1997, 4: 12-13.
[31] 王钧扬, 黄 虹. 在硫酸介质中处理含砷物料[J]. 中国资源综合利用, 1999, 3: 15-16.
WANG Hong, WANG Jun-yang. Treatment of arsenic containing materials in sulfuric acid medium[J]. China Resources Comprehensive Utilization, 1999, 3: 15-16.
[32] 徐天允. 采用阶段浸洗提高黄金氰化总回收率[J]. 中国矿山工程, 1982, 6: 17-22.
XU Tian-yun. Improving total recovery rate of gold by stage cyanide[J]. China Mining Engineering, 1982, 6: 17-22.
Effects of iron, arsenic and carbon removal from a dust of refractory gold concentrates on cyanide leaching
CAO Pan, ZHANG Shuang-hua, ZHENG Ya-jie
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: A dust of refractory Au concentrates was used as raw material. The effects of sodium hydroxide leaching, sulfuric acid leaching and sulfuric acid-sodium hydroxide combined leaching on the As, Fe, and C removal and cyanide leaching were studied.The results show that As and C removal rate, at 6 mol/L NaOH concentration, are 99.66% and 60.63%, respectively. And Au leaching is 58.90% and increases by 4.60% compared to direct cyanide of the dust. The effective removal of arsenic can not effectively improve the gold leaching efficiency. Fe, As and C removal rate, at 15% sulfuric acid concentration, increases from 0 to 33.65%, 80.38% and 12.59%, respectively. And Au leaching effieciency increases to 80.40%. Compared with sodium hydroxide aching, Fe removal with sulfuric acid leaching can effectively improve the gold leaching efficiency. Through once cyanide leaching after 15% sulfuric acid leaching and twice 2 mol/L NaOH and cyanide leaching, the total removal rates of iron, arsenic and carbon in the dust are up to 33.65%, 95.63% and 79.60%, respectively, the total leaching efficiency of gold is 91.90%, and the content of gold in cyanide residue is 3.31 g/t with residue rate of 80.33%. Compared with the direct cyanide leaching, the gold leaching efficiency increases by 37.60%.
Key words: gold concentrates; roasting; dust; impurity removal by leaching; cyanidation
Foundation item: Project(201515108) supported by the Funding Project of Xinjiang High Technology Research and Development Program, China; Project(201552) supported by Funding Project for Xinjiang Autonomous Region Strategic Emerging Industries, China
Received date: 2019-05-21; Accepted date: 2019-12-19
Corresponding author: ZHENG Ya-jie; Tel: +86-731-88836285; E-mail: zyj@csu.edu.cn
(编辑 王 超)
基金项目:新疆高新技术研究开发项目(201515108);新疆自治区战略性新兴产业项目(201552)
收稿日期:2019-05-21;修订日期:2019-12-19
通信作者:郑雅杰,教授,博士;电话:0731-88836285;E-mail:zyj@csu.edu.cn