文章编号:1004-0609(2014)03-0752-06
生物医用多孔Nb-Ti合金的孔隙率和力学性能
刘 超,杨海林,李 婧,阮建明
(中南大学 粉末冶金国家重点实验室,长沙 410083)
摘 要:结合模板浸渍和粉末冶金烧结法,制备出具有良好孔隙性能和力学性能的多孔Nb-Ti合金。采用X射线衍射分析仪(XRD)、力学试验机、体视显微镜(SM)以及扫描电子显微镜(SEM),研究Ti含量(0~15%,质量分数)对多孔Nb-Ti合金成分、力学性能、孔隙结构及微观形貌的影响。结果表明:Nb-Ti合金烧结过程完全,孔隙三维连通程度高,孔隙率为68.50%。随Ti含量从0增加到15%,合金的力学性能发生明显变化,其中抗压强度从(27.6±0.872) MPa增加到(59.3±1.354) MPa后降为(33.7±1.045) MPa,弹性模量从(0.21±0.0136) GPa增加到(0.46±0.0191) GPa。合金孔隙结构均匀化和三维连通程度增加,孔隙结构从块状转变为蜂窝状,颗粒间烧结颈长大,结合变紧密,Ti颗粒对Nb-Ti合金烧结的促进作用明显增强。多孔Nb-10Ti合金的孔隙形貌与松质骨类似,力学性能与人体松质骨相匹配,适合于医学植入应用。
关键词:Nb-Ti合金;多孔金属;力学性能;孔隙率;微观结构
中图分类号:TG146.4 文献标志码:A
Porosity and mechanical properties of biomedical porous Nb-Ti alloy
LIU Chao, YANG Hai-lin, LI Jing, RUAN Jian-ming
(National Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: Porous Nb-Ti alloys, possessing good mechanical and pore property, were fabricated by the combination of slurry impregnation with polymer sponge and powder metallurgy sintering method. X-ray diffractometer (XRD), mechanical testing machine, stereoscopic microscope (SM) and scanning electron microscope (SEM) were utilized to identify the composition, mechanical properties, porous structure and microstructure of the porous Nb-Ti alloys with Ti contents ranging from 0 to 15% (mass fraction). The results show that, the alloys are sintered completely, the pore with highly three-dimensional connected structure is remained and the porosity is 68.50%. The mechanical properties of the alloys change obviously, the compressive strength increases from (27.6±0.872) MPa to (59.3±1.354) MPa, and then decreases to (33.7±1.045) MPa with the Ti contents increasing from 0 to 15%, meanwhile the elastic modulus increases from (0.21±0.0136) GPa to (0.46±0.0191) GPa. Pore structures of the alloys are in more even distribution and own cellular construction, sintering neck of particles grows and particles combine more closely, and the accelerating action of Ti particles on the sintering of Nb-Ti alloys is obviously strengthened. The mechanical properties and pore morphology of porous Nb-10Ti alloy are similar to those of human cancellous bone. The Nb-10Ti alloy is suitable for clinical application.
Key words: Nb-Ti alloy; porous metals; mechanical property; porosity; microstructure
生物材料又称为生物医用材料,主要用于替代受损或缺失的人体组织结构,达到修复组织外形和性能的目的[1]。金属Nb和Ti具有良好力学相容性、强耐腐蚀性和优异的生物相容性,被广泛应用于人体骨组织替代领域[2-3]。目前应用的医用Ti合金植入物弹性模量与人骨的不匹配,在临床应用中容易导致“应力遮蔽”效应[4],此外,Ti合金植入物在人体复杂环境中的低耐磨性对制品寿命形成制约,以上因素最终导致植入失败。多孔Nb合金的开发能降低合金植入物的弹性模量,避免“应力遮蔽”效应,独特孔隙结构有利于成骨细胞的粘附和增殖,且Nb金属具有良好的耐磨性,因此多孔Nb合金具有广阔医学应用前景。
目前国内外应用最多的几种多孔合金制备方法包括铸造法、金属沉积法、纤维冶金法和粉末冶金法等[5-6]。浸渍法最早由SCHWARTZWALDEN等[7]应用于多孔陶瓷和多孔玻璃的制备,近年来该法越来越多地被用于多孔合金制备。与其他方法比较,浸渍法操作简单,设备要求低,制备的多孔合金孔隙率高,孔径大小可调控程度高,具有类似人骨的三维连通孔隙,且容易制备形状复杂的植入物,有利于个性化植入物的开发。
本文作者选择Nb作为基体材料,适量Ti作为第二组元,采用浸渍法与粉末冶金法制备Nb-Ti合金。ELIAS等[8]、马秀梅等[9]和LONG等[10]发现,与Ti相比,Nb具有高强度、低弹性模量、良好的耐磨性、无毒性等优点,更适合于医学材料开发。节云峰等[11]的研究表明,纯Nb的高温难熔性限制其烧结工艺,纯Nb烧结制品颗粒结合强度不高,抗压强度偏低。本文作者利用Ti的低熔点和高温活性促进Nb粉颗粒的烧结,拟解决传统粉末冶金烧结法难以制备Nb合金的问题。
在此,制备了不同Ti含量的多孔Nb-Ti合金,成分分别为Nb、Nb-5Ti、Nb-10Ti和Nb-15Ti,并对其成分、力学性能和孔隙形貌进行检测,以研究Ti含量对Nb-Ti合金成分、孔隙、力学性能和微观形貌的影响。
1 实验
1.1 实验原料
实验所用原料包括株洲硬质合金厂提供的Nb粉(型号为FXNb-1)、北京有色金属研究总院提供的Ti粉(型号为TiMO-1)、聚氨酯泡沫以及聚乙烯醇(PVA)。Nb粉和Ti粉的纯度≥99.5%,其粒度分布如图1所示。其中,Nb粉的平均粒度为40.52 μm,Ti粉的平均粒度为22.38 μm。模板为聚氨酯泡沫,孔径为593~847 μm。粘接剂为聚乙烯醇,分子式为[C2H4O]n,平均相对分子质量为127745,纯度为97.0%。

图1 原料粉末的粒度分布
Fig. 1 Laser particle size distribution diagram of raw material powders
1.2 制备过程
Nb、Ti混合粉末采取机械混合法制备,其中球料比4:1、转速200 r/min、球磨时间4 h、氩气保护。混合粉末与8%PVA(质量分数)溶液混合制备成均匀料浆,将模板放入料浆中反复挤压进行浸渍,浸渍好的样品放入真空干燥箱中,在70 ℃温度下干燥4~6 h。干燥后浸渍样品采取真空烧结,烧结温度为1700 ℃,真空度≤7×10-2 Pa,保温时间2.5 h,随炉冷却得到不同Ti含量的多孔Nb-Ti合金样品。
1.3 检测与分析
采用质量体积计算法得出材料的孔隙率θ:
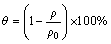 (1)
(1)
式中:ρ为试样密度;ρ0为相应材质的理论密度。
开孔隙率θk的测量原理为液体静力学法[12],计算公式如下:
 (2)
(2)
式中:m1为试样在空气中的质量;m2为浸渍后试样在空气中的质量;m3为浸渍后试样在液体介质(水)中的质量;ρ1为浸渍介质的密度;ρ2为液体介质(水)的密度,取ρ2=1 g/cm3。
采用X射线衍射仪(RIGAKU-3014)对多孔Nb-Ti合金进行物相分析;采用力学试验机(Instron3369)对多孔Nb-Ti合金进行力学性能检测;采用体视显微镜(SZM45)和扫描电子显微镜(JSM-5200)观察多孔Nb-Ti合金的孔隙形貌及微观结构。
2 结果与讨论
2.1 XRD谱分析
图2所示为烧结后不同Ti含量多孔Nb-Ti合金的XRD谱。由图2可见,4组样品的XRD谱中都只有β相衍射峰,未发现α相和其他过渡相的衍射峰。4组β相的衍射峰分别对应于立方晶系Nb(PDF卡16-0001)的(110)、(200)、(211)和(220)晶面。随着Ti含量的增加,溶入Nb原子晶格中的Ti原子增多,Nb的晶格畸变加剧,β相衍射峰的2θ值稍微向大角度偏 移。这表明,高温烧结后,两种金属粉末达到理想合金化,Ti原子溶入Nb原子的晶格,形成β相固溶体。

图2 烧结后不同Ti含量多孔Nb-Ti合金的XRD谱
Fig. 2 XRD patterns of porous Nb-Ti alloys with different Ti contents
2.2 孔隙率和开孔隙率
从表1可知,4组样品(每组含5个样品)的孔隙率和开孔隙率差值不大,其平均值分别为68.50%和66.18%,表明制备的多孔Nb-Ti合金具有高孔隙率和高开孔隙率,且Ti含量对合金孔隙率的影响不明显。此外,样品的开孔隙占总孔隙比率高达98%,能促进成骨细胞的粘附和增殖[13],增强植入物和人体组织的力学结合,有利于植入应用。
2.3 孔隙结构和微观形貌
图3所示为多孔Nb-Ti烧结样品孔隙结构的SEM像。图3(a)中Nb的孔隙结构大多为近圆形,连通部分为块状,孔隙数量少,且孔径大小在500 μm左右,与有机模板支架相比较,其孔隙形貌接近,孔径大小略有缩小,这与文献[11]研究结果一致;Nb-5Ti中初步形成连续的孔隙网络,连通部分由块状向树枝状结构转变,孔隙尺寸收缩(见图3(b));图3(c)所示为Nb-10Ti的孔隙结构,其孔隙分布均匀,相互连通,连通部分多为树枝状,整体呈现蜂窝状结构;当Ti含量为15%时,孔隙三维连通程度降低,孔隙分布杂乱(见图3(d))。这种孔隙结构的变化可能与烧结过程中Ti的液相烧结有关。在1700 ℃等温烧结过程中,液体Ti含量增多,促进了Nb-Ti合金的烧结,导致合金的孔隙尺寸变小,孔隙数量增多,孔隙和连通部分的形状也发生相应变化。
表1 样品的孔隙率和开孔隙率
Table 1 Porosities and open porosities of samples

图4所示为不同Ti含量多孔Nb-Ti烧结样品中粉末颗粒微观形貌的SEM像。图4(a)中Nb粉颗粒间的接触点初步形成粘接面,颗粒分界清晰,少部分粉末仍呈现机械堆积;在Nb中加入5%Ti后,粉末颗粒表面出现波浪花纹,粘接面扩大,形成明显烧结颈,但仍可分辨出部分粉末颗粒(见图4(b));Nb-10Ti中烧结颈长大,颗粒彼此连接无法分辨,孔隙数量显著增多,且出现闭孔隙球化现象(见图4(c));而图4(d)中仅残留少量隔离小孔隙,部分位置Ti含量过高,烧结后形成光滑亮面。低熔点Ti颗粒对于Nb-Ti合金的烧结有促进作用,Ti含量增高,合金的烧结颈明显长大,孔隙进一步缩小球化,孔隙数量先增多后减少。其中,Nb-10Ti的粉末颗粒紧密结合,合金处于烧结过程的闭孔隙球化和缩小阶段,Ti颗粒对Nb的烧结促进效果最好。

图3 多孔Nb-Ti合金的孔隙结构
Fig. 3 Pore structures of porous Nb-Ti alloys

图4 多孔Nb-Ti合金颗粒的SEM像
Fig. 4 SEM images of porous Nb-Ti alloys
图5所示为多孔 Nb-10Ti和人体松质骨孔隙的SEM像。从图5可看出,两者都具有三维连通孔隙,孔隙形貌接近,孔径大小相同,均为400~500 μm,这些共同点为骨髓中成骨细胞的增殖长大提供了三维空间,提高了植入物的骨传导作用[14]。此外,孔隙分布的非均匀性和各向异性,保证了植入物力学性能和生物性能的各项同性。
两者的区别在于人体骨组织孔壁光滑平坦,而合金的孔壁表面凹凸,存在10~20 μm的表面微孔。合金表面微孔的直径和弯曲率与人体骨原细胞的接近,有利于骨原细胞的吸附和沉淀,增强了植入物的骨引导作用[15]。此外,粗糙表面增大了合金的表面积,有利于新增殖成骨细胞的粘附,进一步增强植入物和人体的结合[16-17]。

图5 多孔Nb-10Ti合金和人体松质骨的SEM像
Fig. 5 SEM images of porous Nb-10Ti alloy (a) and cancellous bone (b)
2.4 力学性能
图6所示为多孔Nb-Ti合金抗压强度和弹性模量与Ti含量的关系,其数值为5个样品的平均值。由图6可看出,随Ti含量增加,合金抗压强度先增加后降低,其中Nb和Nb-15Ti的抗压强度偏低,分别为(27.6±0.872) MPa和(33.7±1.045) MPa,Nb-10Ti的抗压强度最高值为(59.3±1.354) MPa。合金的弹性模量和Ti含量呈线性关系,从(0.21±0.0136) GPa增加到(0.46±0.0191) GPa。合金的力学性能变化与以下因素有关:Ti粉对Nb-Ti合金烧结有促进作用,烧结颈长大,粉末颗粒结合更紧密,合金抗压强度随Ti增加呈现上升趋势;Nb-15Ti中部分位置形成光滑亮面,破坏样品的结合,导致抗压强度降低(见图4(d));纯Nb属于β相合金,其弹性模量低于α-Ti,随Ti含量增多,Nb-Ti合金的弹性模量趋向于α-Ti,呈现线性增加的趋势。
尽管Nb-Ti合金的力学性能随着Ti含量增加发生变化,但仍然在人体松质骨范围内(自然骨中密质骨的抗压强度为130~150 MPa,弹性模量为4.4~28.8 GPa;松质骨的抗压强度为10~50 MPa,弹性模量为0.01~3.0 GPa[18]),其中Nb-10Ti具有高抗压强度(59.3 MPa)和低弹性模量(0.35 GPa)的良好力学性能结合,满足人体骨骼修复与替代要求,具有潜在的医学植入应用价值。

图6 不同Ti含量多孔Nb-Ti合金的力学性能
Fig. 6 Mechanical properties of porous Nb-Ti alloys with different Ti contents
3 结论
1) 模板浸渍法制备的多孔Nb-Ti合金的孔隙率为68.5%,开孔隙占总孔隙比率高达98%,其孔隙分布均匀,相互连通,三维连通程度高。
2) 随Ti含量增加,多孔Nb-Ti合金的孔隙结构、微观形貌以及力学性能都发生明显变化。
3) 多孔Nb-10Ti合金颗粒微观形貌的烧结颈明显,闭孔隙球化;孔隙结构和形貌与人体松质骨的类似;其抗压强度和弹性模量分别为59.3 MPa和0.35 GPa,在人体松质骨范围内。多孔Nb-10Ti合金孔隙结构、力学性能与人体松质骨的匹配,作为一种新型β相生物合金,具有广阔的医学应用前景。
REFERENCES
[1] 阮建明, 邹俭鹏, 黄伯云. 生物材料学[M]. 北京: 科学出版社, 2004: 1-5.
RUAN Jian-ming, ZOU Jian-peng, HUANG Bo-yun. Biomaterials science[M]. Beijing: Science Press, 2004: 1-5.
[2] 王本力, 李 莉, 郑玉峰. 生物医用Ti-Nb基合金的显微组织与耐磨性[J]. 中国有色金属学报, 2010, 20(S1): s953-s957.
WANG Ben-li, LI Li, ZHENG Yu-feng. Microstructure and wear behavior of biomedical Ti-Nb based alloys[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(S1): s953-s957.
[3] SAKAGUCHI N, NIINOMI M, AKAHORI T, TAKEDA J, TODA H. Relationships between tensile deformation behavior and microstructure in Ti-Nb-Ta-Zr system alloys[J]. Mater Sci Eng C, 2005, 25: 363-369.
[4] SUΜMNER D R, TURNER T M, IGLORIA R, URBAN R M, GALANTE J O. Functional adaptation and ingrowth of bone vary as a function of hip implant stiffness[J]. Biomechanics, 1998, 31: 909-917.
[5] 刘培生, 黄林国. 多孔金属材料制备方法[J]. 功能材料, 2002, 33(1): 5-8.
LIU Pei-sheng, HUANG Lin-guo. Preparation methods for porous metal materials[J]. Functional Materials, 2002, 33(1): 5-8.
[6] QUEHEILLAL D T, KATSUMORA Y. Synthesis of stochastic open cell Ni-based foams[J]. Scripta Materialia, 2004, 50: 313-317.
[7] SCHWARTZWALDEN K, SOMERS A V. Method of making porous ceramic articles: US, 3090094[P]. 1963-05-21.
[8] ELIAS L M, SCHNEIDER S G, SCHNEIDER S, SILVA H M, MALVISI F. Microstructural and mechanical characterization of biomedical Ti-Nb-Zr(-Ta) alloys[J]. Mater Sci Eng A, 2006, 432: 108-112.
[9] 马秀梅, 孙 威, 杨永建. 生物医用Ti-Nb-(Ta)-Zr合金的微观结构与性能[J]. 中国有色金属学报, 2010, 20(6): 1195-1202.
MA Xiu-mei, SUN Wei, YANG Yong-jian. Microstructures and properties of biomedical Ti-Nb-(Ta)-Zr alloys[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(6): 1195-1202.
[10] LONG M, RACK H J. Surface deformation and mcirocrack formation in Ti-35Nb-8Zr-5Ta-O(x) alloys during reciprocating sliding wear[J]. Mat Sci Eng C, 2005, 25: 382-388.
[11] 节云峰, 邹俭鹏, 阮建明. 泡沫浸渍法制备的多孔铌基生物材料及性能[J]. 稀有金属材料与工程, 2010, 39(11): 2015-2017.
JIE Yun-feng, ZOU Jian-peng, RUAN Jian-ming. Fabrication of porous niobium-based biological materials via impregnation and their properties[J]. Rare Metal Materials and Engineering, 2010, 39(11): 2015-2017.
[12] 黄培云, 阮建明. 粉末冶金原理[M]. 北京: 冶金工业出版社, 1997: 370-372.
HUANG Pei-yun, RUAN Jian-ming. Powder metallurgy principle[M]. Beijing: Metallurgical Industry Press, 1997: 370-372.
[13] CORNELL C N, LANE J M. Current understanding of osteocondiuction in bone regeneration[J]. Clin Orthop Relat Res, 1998, 355(10): s267-s273.
[14] SOBALLE K, HANSEN E S, BRACKSEDT R H, BUNGER C. Hydroxyapatite coating converts fibrous tissue to bone around loaded implants[J]. Journal of Bone and Joint Surgery—British Volume, 1993, 75: 270-278.
[15] JANSEN J A, VANDE W J P, WOLKE J G C, GROOT K D. Histologic evaluation of the osseous adaptation to titanium and hydroxyapatite-coated titanium implants[J]. Biomedical Materials Research, 1991, 25: 973-989.
[16] KLEIN C P A, WOLKE J G C, BLIECK-H J M A, GROOT K D. Features of calcium phosphate plasma-srayed coatings: An in vitro study[J]. Biomedical Materials Research, 1994, 28: 961-967.
[17] JAYARAMAN M, MEYER U, BUHNER M, JOOS U, WIESMANN H P. Influence of titanium surfaces on attachment of osteoblast-like cells in vitro[J]. Biomaterials, 2004, 25: 625-631.
[18] BLACK J, HASTINGS G W. Handbook of biomaterials properties[M]. London: Chapman and Hall, 1998: 654-657.
(编辑 陈卫萍)
基金项目:国家自然科学基金资助项目(51274247);国家高技术研究发展计划资助项目(2012BAE06B00);湖南省博士生科研创新项目(CX2013D055);中南大学研究生自主创新项目(2012zztsa012)
收稿日期:2013-01-18;修订日期:2013-10-30
通信作者:阮建明,教授,博士;电话:0731-88876644;E-mail:jianming@mail.csu.edu.cn