文章编号:1004-0609(2011)09-2270-07
MgCl2改性柑橘皮对水溶液中重金属离子的吸附性能
郭学益, 梁 莎, 肖彩梅, 田庆华
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:以柑橘皮(OP)为原料,通过MgCl2进行改性制备新型柑橘皮生物吸附剂MgOP。考察溶液pH值、温度、固液比、吸附时间和金属离子浓度对MgOP从单组分溶液中吸附Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的吸附性能的影响。结果表明,pH值和固液比对吸附率的影响较明显;温度对吸附率的影响较小;所有吸附过程可在20 min内达到吸附平衡,对5种金属离子的吸附动力学均符合准二级动力学方程;与原始柑橘皮相比,MgOP对5种金属离子的最大吸附量显著提高;MgOP可重复使用10次以上;共存金属离子对吸附率影响很小。
关键词:改性柑橘皮;吸附;重金属离子;吸附剂
中图分类号:X703.1 文献标志码:A
Adsorption of heavy metal ions from
aqueous solutions by MgCl2 modified orange peel
GUO Xue-yi, LIANG Sha, XIAO Cai-mei, TIAN Qing-hua
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Orange peel (OP) was modified by MgCl2 to prepare a novel orange peel adsorbent named as MgOP. The effects of pH, temperature, solid/liquid ratio, adsorption time and metal ion concentration on the removal behavior of individual heavy metals such as Cu2+, Cd2+, Pb2+, Zn2+ and Ni2+ from aqueous solution with single component by MgOP were investigated. The results show that pH and solid/liquid ratio have positive effects on the adsorption efficiency; temperature has little impact on the adsorption efficiency. All adsorption processes can attain equilibrium within 20 min, and the kinetics data of five kinds of metal ions are fitted to pseudo-second-equation. The MgOP can increase the maximum adsorption capacities of Cu2+, Cd2+, Pb2+, Zn2+ and Ni2+, compared with those of OP. The MgOP can be used for more than 10 cycles. The effect of coexisting metal ions on adsorption can be neglected.
Key words: modified orange peel; adsorption; heavy metal ions; adsorbent
随着工业化进程的发展,重金属废水的无序排放导致严重的环境污染问题,并且废水中重金属离子经过水体中各种生物链产生富集,最终进入人体,给人类健康带来严重的危害。传统除去水中的重金属离子的方法通常成本较高,易造成二次污染,且不适合于低金属离子浓度(1~100 mg/L)废水的处理[1]。近年来,利用生态环境中现有的生物质作为吸附剂处理含重金属溶液,即生物吸附法,得到了广泛的关注,它具有原料来源广泛、成本低廉、吸附量高、吸附速度快等诸多优点[2]。用于生物吸附的原料主要包括细菌、真菌、藻类和农林废弃物,其中农林废弃物因其数量众多,廉价易得,应用最为广泛。目前,实验中已成功用于水溶液中去除重金属离子的农林废弃物有花生 壳[3-4]、锯末[5-6]、水果残渣[7-10]和秸秆[11-12]等。
湖南是我国柑橘工业大省,不仅种植面积和产量居全国首位,而且柑橘加工的企业众多。但柑橘的加工势必会产生大量的柑橘残渣,目前的主要处理方法是作为牲畜饲料的部分原料廉价卖出。考虑到柑橘皮中含有丰富的果胶、纤维素、半纤维素等多糖类高分子化合物和木质素,它们可提供氨基、酰胺基、羧基、羟基等官能团与金属离子结合,因此可用作制备生物吸附剂。但直接采用柑橘皮作吸附剂不仅存在吸附容量小、性能不稳定、不易长期存放保存等缺点,而且存在着由于一些可溶性有机物质如木质素、单宁酸、果胶质和纤维素的溶解而导致水中化学耗氧量增加等问题[13],因此需通过化学改性的方法提高柑橘皮的吸附容量和化学稳定性。目前,国内外已有相关学者通过各种改性方法,如皂化、交联、磷酸化、接枝、硫化等,改善了其物理化学性能,制备了吸附性能良好的柑橘类生物吸附剂[14-17]。本文作者以柑橘皮为基体,经乙醇、氢氧化钠和氯化镁改性处理,制备新型改性柑橘皮生物吸附剂,并研究其对 Cu2+、Cd2+、Pb2+、Zn2+和Ni2+等5种废水中常见重金属离子的吸附性能,考察多种因素对吸附过程的影响,分析吸附动力学及吸附等温模型,并研究生物吸附剂的循环再生性能及对二元组分重金属混合溶液的吸附行为。
1 实验
1.1 仪器与试剂
主要仪器如下:3510原子吸收分光光度计(安捷伦公司),PHS-3C酸度计(上海雷磁), SHA-C水浴恒温振荡器(江苏荣华),DZF-300真空干燥箱(郑州长城科工贸有限公司),日本电子JSM-6360LV扫描电镜,美国Nicolet 380傅立叶变换红外光谱仪。
主要试剂如下:CuCl2·2H2O,CdCl2,Pb(NO3)2,Zn(NO3)2·6H2O,Ni(NO3)2·6H2O,HCl,NaOH,乙醇,MgCl2等,均为分析纯。
1.2 改性柑橘皮生物吸附剂的制备
柑橘皮(OP)经自来水和蒸馏水洗净后于70 ℃干燥箱中烘干24 h,粉碎,过孔径为280 μm的筛子。取40 g OP置于500 mL的锥形瓶中,向其中加入200 mL无水乙醇以及100 mL浓度为 0.5 mol/L的NaOH,混合搅拌30 min后加入100 mL浓度为1 mol/L的MgCl2溶液,混合浸泡24 h,随后抽滤并用蒸馏水洗涤至pH为中性,在70 ℃鼓风干燥箱中烘干24 h,粉碎,再过孔径为280 μm的筛子,所得柑橘皮吸附剂简写为MgOP。
乙醇的作用是去除色素及一些可溶性小分子;氢氧化钠可以使果胶分子上甲酯化的羧基发生皂化,从而提高有效羧基官能团的数目[18],同时氢氧化钠可以部分地与纤维素、半纤维素和木质素分子中的醇羟基或酚羟基反应,生成醇钠[19];氯化镁的加入能起到交联作用,使吸附剂分子间结合得更紧密,减少有效物质的溶出。
1.3 因素吸附实验
在锥形瓶中加入一定固液比的改性柑橘皮生物吸附剂及金属离子溶液,用HCl和NaOH调节溶液pH,密封瓶口以防实验过程中体积的变化。将其放入一定温度的水浴恒温振荡器中振荡吸附一定时间后过滤,用原子吸收分光光度计测定滤液中金属离子的平衡浓度。
分别用式(1)和(2)计算吸附率(Ra)和吸附量(q):
 (1)
(1)
q =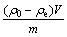 (2)
(2)
式中:ρ0和ρe分别表示金属溶液的初始浓度和平衡浓度,mg/L;m表示所用生物吸附剂的质量,g;V表示溶液体积,L。
1.4 解吸再生实验
为避免二次污染,必须采取适当的解吸方法,把吸附剂所吸附的金属离子洗脱下来。常选用的解吸附剂是酸,即将已吸附重金属离子的吸附材料置于强酸性溶液中,通过H+与金属离子竞争吸附剂表面的活性位点,置换出重金属离子。常用的酸有盐酸、硝酸、硫酸等。本研究采用盐酸作解吸剂再生MgOP的循环实验。分别取初始的0.5 g MgOP用于含Cu2+、Cd2+、Pb2+、Zn2+和Ni2+单组分溶液的吸附,固液比为5 g/L,室温吸附(30 ℃),金属离子初始浓度除Pb2+为100 mg/L外其余4种金属离子初始浓度均为50 mg/L,吸附时间为1.5 h,随后过滤并用蒸馏水洗涤,滤渣则为负载了金属离子的MgOP。将滤渣用0.1 mol/L的HCl溶液解吸3 h,过滤洗涤,滤渣为解吸后的样品,干燥后称量,以固液比5 g/L量取对应金属溶液体积,重复进行吸附实验。
2 结果与讨论
2.1 平衡pH值对吸附的影响
溶液pH值对吸附剂吸附重金属离子的效率起关键作用,它能影响吸附剂表面电荷,以及金属离子在溶液中的赋存状态。图1所示为在不同平衡pH(pHe)条件下,MgOP分别对含单一金属离子的Cu2+、Cd2+、Pb2+、Zn2+和Ni2+溶液的吸附结果。实验条件如下:温度30 ℃;吸附时间1.5 h;固液比5 g/L;初始金属浓度铅为100 mg/L,其余为50 mg/L。

图1 平衡pH值对MgOP吸附重金属离子的影响
Fig.1 Effect of equilibrium pH on adsorption of heavy metal ions by MgOP
从图1中可以看出,除Pb2+在整个实验pHe条件下吸附率均达到98%以上,其余4种金属离子的吸附率均随着pHe的增加而增加,并在pH值为5.0~5.5开始达到最大吸附率并保持平衡。金属离子的吸附率随pHe变化的现象可以理解为:溶液中的H+会与金属阳离子发生竞争吸附,使得吸附率降低;随着pHe的增加,吸附剂表面负电荷增多,阳离子与表面活性位点的静电吸引力增大,并且H+参与竞争吸附的作用也会减弱,因此吸附率增大[20]。
2.2 温度对吸附的影响
为考察温度对吸附效果的影响,在30~60 ℃范围内测试了MgOP对Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的吸附效率的影响,结果见图2。实验条件如下:pHe 5.0;吸附时间1.5 h;固液比5 g/L;初始金属浓度铅为100 mg/L,其余为50 mg/L。由图2可以看出,随着温度的升高,吸附率有所降低,温度对Cu2+的吸附影响较大,随温度从30 ℃升至60 ℃,吸附率从91.5%降到了78.7%。这说明MgOP对5种重金属离子的吸附可能是一种放热反应,以后的因素实验均在室温下进行。
2.3 固液比的影响
往一定体积M2+溶液中投加不同质量吸附剂MgOP,考察对其吸附效率的影响,结果如图3所示。实验条件如下:pH 5.0;温度30 ℃;吸附时间1.5 h;初始金属浓度铅为100 mg/L,其余为50 mg/L。由图3可见,随着固液比的增大,5种金属离子的吸附率均增大并逐渐趋于平缓。这可能是由于吸附剂量的增加使溶液中吸附官能团增多,吸附位点增多,因而吸附率提高。
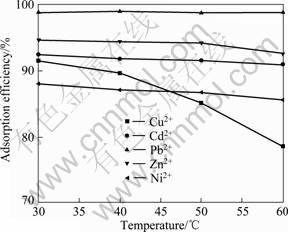
图2 温度对MgOP吸附重金属离子的影响
Fig.2 Effect of temperature on adsorption of heavy metal ions by MgOP
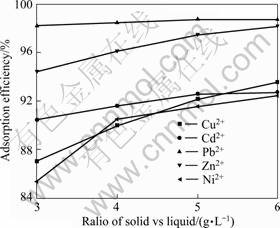
图3 固液比对MgOP吸附重金属离子的影响
Fig.3 Effect of ratio of solid to liquid on adsorption of heavy metal ions by MgOP
2.4 吸附动力学
25 ℃下,吸附量随吸附时间变化的结果见图4。实验条件如下:pHe 5.0;温度30 ℃;固液比5 g/L;初始金属浓度铅为100 mg/L, 其余为50 mg/L。由图4可知,MgOP对Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的吸附速率都很快,在20 min内基本达到吸附平衡,这对于柑橘皮吸附剂用于工业废水的处理有很大的实际意义。
在生物吸附动力学的研究中,通常用准二级动力学方程(式3)对实验数据进行模拟,来分析金属离子浓度随吸附时间的变化关系。
 (3)
(3)
式中: qe和qt分别为平衡时和时间t时的吸附量,mg/g;k2为准二级动力学常数,g/(mg·min)。
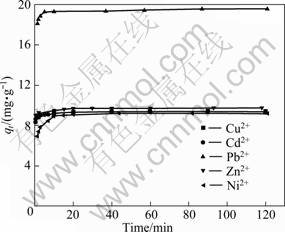
图4 时间对MgOP吸附重金属离子的影响
Fig.4 Effect of time on adsorption of heavy metal ions by MgOP
利用式(3)对MgOP吸附5种金属离子的动力学数据进行模拟,结果见表1。从表1可以看出,试验结果可以很好地用准二级动力学方程进行模拟,相关系数均接近于1,且qe的实验值与理论值相差很小。这表示吸附过程遵循准二级反应机理,吸附速率被化学吸附所控制[21-22]。
表1 MgOP吸附Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的准二级反应动力学参数
Table 1 Kinetic parameters of Cu2+, Cd2+, Pb2+, Zn2+ and Ni2+ adsorption by MgOP

2.5 吸附等温线
实验考察了金属离子初始浓度范围为20~1 000 mg/L时MgOP吸附Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的等温吸附曲线(见图5),其中Cu2+溶液的初始浓度为20~400mg/L,因为在pH为5.0时,初始浓度为500 mg/L Cu2+溶液有沉淀产生。实验条件如下:pHe 5.0;温度30 ℃;固液比5 g/L;吸附时间1.5 h。由图5可以看出,MgOP对5种金属离子的吸附量均随溶液中金属离子浓度的增加而增加,最后基本达到吸附平衡。
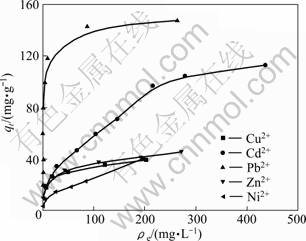
图5 MgOP吸附Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的等温线
Fig.5 Adsorption isotherms of Cu2+, Cd2+, Pb2+, Zn2+ and Ni2+ adsorption by MgOP
用Langmuir和Freundlich吸附等温模型对图5中的数据进行模拟。
Langmuir方程为
 (4)
(4)
式中:qm为吸附剂最大吸附量,mg/g;b为吸附常数,L/mg;qm和b可由ρe/qe对ρe所作直线的斜率(1/qm)和截距(1/(qmb))求出。
Freundlich方程为
 (5)
(5)
式中:KF和n分别为经验常数。n和KF由lgqe对lgρe作直线的斜率(1/n)和截距(lgKF)求出。
表2所列为MgOP对5种金属离子的Langmuir和Freundlich等温方程吸附参数,并与未改性的柑橘皮OP的对应参数进行对比。从表2中两个等温线方程的拟合系数可知,MgOP对Cu2+、Pb2+、Zn2+的吸附较符合Langmuir单分子层吸附模型,而对Cd2+和Ni2+的吸附Freundlich模型拟合更佳。比较OP和MgOP对5种金属离子拟合的Langmuir最大吸附量(qm)可知,通过化学改性制备的柑橘皮吸附剂MgOP较原始的柑橘皮吸附剂OP对Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的吸附量均有所提高,最大吸附量分别为41、125、149、46和45 mg/g,进一步说明了改性使得柑橘皮表面有效官能团增加,与金属离子结合能力增强。
2.6 解吸再生实验
实验研究了已吸附重金属离子的MgOP的再生方法。将已经吸附了Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的生物吸附剂MgOP用0.1 mol/L的HCl溶液进行解吸,并循环用于吸附实验,结果如图6所示。实验条件如下:pHe 5.0;温度30 ℃;吸附时间1.5 h;解吸时间3 h;固液比5 g/L;初始金属浓度铅为100 mg/L,其余为50 mg/L。由图6可见,经10次循环使用后,MgOP对Cu2+和Pb2+的吸附率降低很小,都分别维持在97%和99%以上,而对于Cd2+、Zn2+和Ni2+,第一次吸附后吸附率有明显的降低,随后分别基本上保持在87%、78%和74%左右。
表2 MgOP吸附重金属离子的等温线模型参数
Table 2 Parameters of isotherm models of heavy metal ions adsorption by MgOP


图6 MgOP吸附Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的循环吸附实验
Fig.6 Recycle experiments of Cu2+ (a), Cd2+ (b), Pb2+ (c), Zn2+ (d) and Ni2+ (e) adsorption by MgOP
2.7 共存离子实验
工业废水通常是多离子的复杂体系,溶液中存在的阳离子会与需要除去的重金属离子竞争吸附位点,从而对吸附产生干扰,影响生物吸附剂对重金属离子的吸附能力,或者说多种金属离子之间会出现竞争吸附效应。常见金属阳离子(如Na+、Ca2+、Mg2+等)对重金属的吸附影响较小,但重金属离子之间相互影响较大[23]。本文作者考察了两种金属离子共存对吸附率的影响,吸附条件如下:pH 5.0,吸附时间1.5 h,固液比5 g/L,二元系中金属离子浓度除Pb2+为100 mg/L外其余为50 mg/L,结果如表3所列。由表3可以看出,两种金属离子共存时,MgOP对Cu2+、Cd2+和Pb2+的吸附几乎没有影响,而对Zn2+和Ni2+的吸附率有所降低,但仍高于80%。由此可见,柑橘皮生物吸附剂MgOP有希望用于实际低浓度多组分重金属离子废水的处理。
2.8 吸附机理
MgOP吸附重金属离子的机理可能包括静电吸引、离子交换和表面配合。以铅为例对吸附机理进行分析,图7所示为MgOP吸附Pb2+前后的红外光谱图。由图7可以看出,红外光谱图无明显峰变化,只是一些特征峰发生了小范围的漂移,一是3 400 cm-1附近自由羟基峰(—OH)的振动频率的移动;二是羧基的变化,离子化羧基峰(1 640和1 430 cm-1)发生移动,而且吸收强度增加。这些说明在吸附过程中,MgOP的表面官能团羟基和羧基参与了金属离子的结合过程。
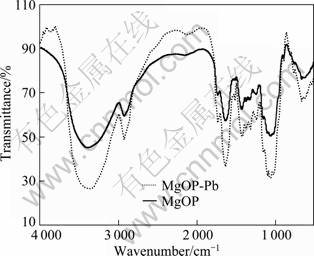
图7 MgOP吸附Pb2+前后的红外光谱图
Fig.7 FTIR spectra of MgOP before and after Pb2+ adsorption
3 结论
1) 以柑橘皮为原料经过简单化学改性制备的柑橘皮生物吸附剂MgOP可用于水溶液中Cu2+、Cd2+、Pb2+、Zn2+和Ni2+的吸附去除。MgOP对这5种金属离子的吸附效率高、吸附速度快、吸附容量大、再生性能好,且对二元组分的混合溶液也有很好的吸附效果。
2) pH值和固液比对吸附率的影响较明显,而温度对吸附率的影响较小。
3) MgOP对5种金属离子的吸附稳定性较好,可重复使用10次以上。
表3 二元系中MgOP对5种金属离子的吸附率
Table 3 Adsorption efficiencies of five heavy metal ions by MgOP in binary solutions (%)

REFERENCES
[1] AHLUWALIA S S, GOYAL D. Microbial and plant derived biomass for removal of heavy metals from wastewater[J]. Bioresource Technology, 2007, 98(12): 2243-2257.
[2] 梁 莎, 冯宁川, 郭学益. 生物吸附法处理重金属废水研究进展[J]. 水处理技术, 2009, 35(3): 13-17.
LIANG Sha, FENG Ning-chuan, GUO Xue-yi. Progress of heavy metal wastewater treatment by biosorption[J]. Technology of Water Treatment, 2009, 35(3): 13-17.
[3] BROWN P, JEFCOAT I A, PARRISH D, GILL S, GRAHAM E. Evaluation of the adsorptive capacity of peanut hull pellets for heavy metals in solution[J]. Advanced Environmental Resources, 2000, 4(1): 19-29.
[4] 黄 翔, 宗 浩, 陈文祥, 陈施羽, 张 翔. 花生壳对水溶液中铜离子的吸附特性[J]. 四川师范大学学报: 自然科学版, 2007, 30(3): 380-383.
HUANG Xiang, ZONG Hao, CHEN Wen-xiang, CHEN Shi-yu, ZHANG Xiang. Biosorption of copper (II) in aqueous solution by peanut shuck[J]. Journal of Sichuan Normal University: Natural Science, 2007, 30(3): 380-383.
[5] BULUT Y, TEZ Z. Removal of heavy metals from aqueous solution by sawdust adsorption[J].Journal of Environmental Sciences, 2007, 19(2): 160-166.
[6] 史晓燕, 肖 波, 李建芬, 杨小艳. 锯末在重金属废水处理中的应用[J]. 工业水处理, 2007, 27(4): 9-12.
SHI Xiao-yan, XIAO Bo, LI Jian-fen, YANG Xiao-yan. Application of sawdust to heavy metal containing wastewater treatment[J]. Industrial Water Treatment, 2007, 27(4): 9-12.
[7] JACQUEA R A, LIMAA E C,DIAS S L P, MAZZOCATO A C,PAVAN F A. Yellow passion-fruit shell as biosorbent to remove Cr(Ⅲ) and Pb(Ⅱ) from aqueous solution[J]. Separation and Purification Technology, 2007, 57(1): 193-198.
[8] IQBAL M, SAEED A, IQBAL Z S. FTIR spectrophotometry, kinetics and adsorption isotherms modeling, ion exchange, and EDX analysis for understanding the mechanism of Cd2+ and Pb2+ removal by mango peel waste[J]. Journal of Hazardous Materials, 2009, 164(1): 161-171.
[9] FARINELLA N V, MATOS G D, ARRUDA M A Z. Grape bagasse as a potential biosorbent of metals in effluent treatments[J]. Bioresource Technology, 2007, 98(10): 1940-1946.
[10] ANNADURAI A, JUANG R S, LEE D J. Adsorption of heavy metals from water using banana and orange peel[J]. Water Sci Technol, 2002, 47(1): 185-190.
[11] DANG V B H, DOAB H D, DAND-VU T, LOHI A. Equilibrium and kinetics of biosorption of cadmium(Ⅱ) and copper(Ⅱ) ions by wheat straw[J]. Bioresource Technology, 2009, 100(1): 211-219.
[12] ROCHA C G, ZAIA D A, ALFAYA R V S, ALFAYA A A S. Use of rice straw as bisorbents for removal of Cu(II), Zn(II) and Hg(II) ions in industrial effluents[J]. Journal of Hazardous Materials, 2009, 166(1): 383-388.
[13] NOELINE B F, MANOHAR D M, ANIRUDHAN T S. Kinetic and equilibrium modelling of lead(II) sorption from water and wastewater by polymerized banana stem in a batch reactor[J] . Separation and Purification Technology, 2005, 45(2): 131-140.
[14] PRASAD R, GHIMIRE K N, INOUE K. Adsorptive separation of heavy metals from an aquatic environment using orange waste[J]. Hydrometallurgy, 2005, 79(3/4): 182-190.
[15] 唐艳茹, 徐林林, 李斯思. 经修饰的橘子皮对重金属Zn2+的吸附研究[J]. 长春师范学院学报: 自然科学版, 2007, 26(2): 65-68.
TANG Yan-ru, XU Lin-lin, LI Si-si. Study on the preparation of biosorbents orange peels and biosorption of heavy metal Zn2+ ions[J]. Journal of Changchun Normal University: Natural Science, 2007, 26(2): 65-68.
[16] GHIMIRE K N, INOUE K, YAMAGUCHI H, MAKINO K, MIYAJIMA T. Adsorptive separation of arsenate and arsenite anions from aqueous medium by using orange waste[J]. Water Research, 2003, 37(20): 4945-4953.
[17] LIANG Sha, GUO Xue-yi, FENG Ning-chuan, TIAN Qing-hua. Application of orange peel xanthate for the adsorption of Pb2+ from aqueous solutions[J]. Journal of Hazardous Materials, 2009, 170(1): 425-429.
[18] BAIG T H, GARCIA A E, TIEMANN K J, GARDEA-TORRESDEY J L. Adsorption of heavy metal ions by the biomass of Solanum elaeagnifolium (Silverleaf night-shade). [C]//ERICKSON L E. Proceedings of the 10th Annual EPA Conference on Hazardous Waste Research. Washington DC: US Environmental Protection Agency, 1999: 131-139.
[19] LI Xiao-min, TAND Yan-ru, CAO Xiu-jun, LU Dan-dan, LUO F, SHAO Wen-jing. Preparation and evaluation of orange peel cellulose adsorbents for effective removal of cadmium, zinc, cobalt and nickel[J]. Colloids and Surfaces A: Physicochem Eng Aspects, 2008, 317(1/3): 512-521
[20] KHORMAEI M, NASERNEJAD B, EDRISI M, ESLAMZADEH T. Copper biosorption from aqueous solutions by sour orange residues[J]. Journal of Hazardous Materials, 2007, 149(2): 269-274.
[21] ?ENGIL ? A, ?ZACAR M. Competitive biosorption of Pb2+, Cu2+ and Zn2+ ions from aqueous solutions onto valonia tannin resin[J]. J Hazard Mater, 2009, 166(2/3): 1488-1494.
[22] ?ZACAR M, ?ENGIL ? A, TüRKMENLER H. Equilibrium and kinetic data, and adsorption mechanism for adsorption of lead onto valonia tannin resin[J]. Chemical Engineering Journal, 2008, 143(1/3): 32-42.
[23] SHENG Ping-xin, TING Yen-peng and Chen J P. Biosorption of heavy metal Ions (Pb, Cu, and Cd) from aqueous solutions by the marine alga Sargassum sp. in single- and multiple-metal systems[J]. Industrial and Engineering Chemistry Research, 2007, 46 (8): 2438-2444.
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(50774100)
收稿日期:2010-09-13;修订日期:2011-03-05
通信作者:郭学益,教授,博士;电话:0731-88877863;E-mail:xyguo@mail.csu.edu.cn