DOI:10.19476/j.ysxb.1004.0609.2017.08.14
化学镀制备Co/Al2O3催化硼氢化钠水解制氢
魏 磊,马麦霞,景学敏,卢艳红,张素玲,梁红莲,王雯倩
(廊坊师范学院 化学与材料科学学院,廊坊 065000)
摘 要:以商品化的氧化铝球为载体,通过化学镀法在其表面沉积金属钴,制备不同担载量的Co/Al2O3催化剂,并用于催化碱性溶液中硼氢化钠水解放氢反应。考察钴担载量、硼氢化钠浓度、反应温度、循环使用次数对催化剂性能的影响。通过扫描电子显微镜、能谱仪、X射线衍射分别对催化剂表面形貌、元素组成和晶相结构进行分析。结果表明:当钴的担载量为0.46%(质量分数)时,20 ℃下5NaBH4+5%NaOH体系的产氢速率最高,达3.26 L/(min·g);反应表观活化能为64.4 kJ/mol;循环使用4次后,催化剂活性降至初始值的72 %。
关键词:制氢;钴催化剂;硼氢化钠;水解;化学镀
文章编号:1004-0609(2017)-08-1651-08 中图分类号:TQ116.2 文献标志码:A
能源与环境依然是当今世界的两大热点话题,新能源的开发和利用已经迫在眉睫。氢气作为一种能源载体,其能量密度高,绿色无污染,且来源广泛[1-2]。“氢经济”时代的到来将有望解决严峻的能源与环境危机[3]。
目前,氢能的应用和普及仍有多方面的问题亟待解决。其中,氢气的安全储存和高效获取便是当下研究的热点。硼氢化钠(NaBH4)除了是一种熟悉的工业品外,更是一种理想的化学储氢材料,其自身储氢密度高达10.6%(质量分数)。另外,产氢速率快且纯度高、储运使用安全、副产物可回收利用等特点使得NaBH4水解制氢技术在氢燃料电池车和移动便携式电源领域备受青睐[4-7]。
由于NaBH4在水中极易发生水解,故常将其溶解于碱性溶液中,以便长期储存备用。为了实现可控制氢,需将催化剂引入到制氢反应中。目前,金属催化剂是研究和应用最多的一类,主要包括贵金属催化剂(如Ru、Pt)和非贵金属催化剂(如Co、Ni),徐东彦等[4]和梁艳等[5]都对此进行了较为详尽的综述。根据催化剂的结构不同,又可分为负载型和非负载型两大类。相比之下,负载型的非贵金属催化剂具有更高的实际应用价值。所用到的载体材料可以是活性炭[8-9]、金属氧化物[10]、蜂窝陶瓷[11-12]、泡沫镍[13-14]等。对于载体表面金属的沉积,化学镀是一种常用方法,它适用于各种不同材质、不同形貌的载体,且催化性金属镀层附着牢固,不易流失[13-15]。
目前,化学镀制备的催化剂主要是钴基催化剂[4-5, 16-17],如Co-B、Co-P、Co-Ni-P、Co-W-B等。其中,硼和磷的引入是由于使用了NaBH4或NaH2PO2作为还原剂。然而,使用水合肼作为还原剂化学镀制备纯钴催化剂的研究报道极少。前期的研究结果表明,化学镀纯钴催化剂也具有较高的催化活性。本文作者以球形氧化铝为载体材料,以水合肼为还原剂,通过化学镀法在载体表面沉积金属钴,考察了钴的最佳担载量,探讨了反应活化能和循环使用性能等。
1 实验
1.1 材料
球形氧化铝(直径约为1.0 mm)用作催化剂载体,购于淄博超科氧化铝材料有限公司。醋酸钴(Co(CH3COO)2·4H2O,AR)、D-酒石酸(C4H6O6,AR)、氯化铵(NH4Cl,AR)、氢氧化钠(NaOH,AR)、水合肼(N2H4·H2O,50%)、氯化亚锡(SnCl2·2H2O,AR)购于国药集团化学试剂有限公司。氯化钯(PdCl2,纯度99.9%)购于上海久岳化工有限公司。去离子水为实验室自制,电阻率大于18 MW·cm。
1.2 Co/Al2O3催化剂的制备
氧化铝载体分别经0.1 mol/L氢氧化钠和0.1 mol/L盐酸溶液浸泡,水洗,干燥后备用。钴镀液中含醋酸钴10 g/L、D-酒石酸 30 g/L、氯化铵 2 g/L,用氢氧化钠调节pH为12~13。以0.2 mol/L水合肼为还原剂,在化学镀开始前加入镀液中。镀浴温度恒定为50 ℃。最后,将SnCl2-PdCl2敏化活化处理过的载体放入镀液中施镀,反应方程式如下所示:
2Co2++N2H4+4OH-→2Co+N2↑+4H2O (1)
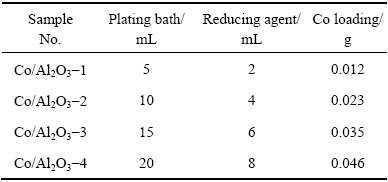
化学镀终点时,镀液颜色近似透明,原子吸收法测得其中钴浓度为微克级,说明镀液中的钴离子几乎全部沉积于载体表面。每次化学镀称量5 g载体,通过镀液的消耗量来推算载体表面金属钴的担载量。表1列出了不同Co/Al2O3催化剂的制备条件及钴担载量。制得的催化剂经反复水洗至中性,60 ℃下真空干燥。
表1 不同Co/Al2O3催化剂的制备条件
Table 1 Synthesis condition of different Co/Al2O3 catalysts
1.3 表征与测试
采用JEOL JSM-6510型扫描电子显微镜(加速电压20 kV)对样品表面微观形貌进行分析。通过配套的EDAX能谱仪对催化剂表面元素组成进行分析。通过X射线衍射(XRD,X’pert MRD/Philips)对样品的晶相结构进行分析。
自行搭建如文献[18]中所述的装置,用以测试每份Co/Al2O3催化剂催化硼氢化钠水解产氢性能。反应液中,NaBH4含量为1%~10%(质量分数),NaOH含量为5%,每次测试取用30 mL反应液。反应温度分别为20、30和40 ℃。催化剂活性通过产氢速率(Hydrogen generation rate,HGR)来体现,即单位时间内单位质量的催化剂下反应体系中氢气的生成量。根据不同温度下的催化剂活性来计算反应活化能。通过连续重复测试来评价所制备催化剂的循环使用性能。两次循环测试之间,对催化剂反复水洗至中性。
2 结果与讨论
2.1 催化剂微观形貌与晶相分析
化学镀前,氧化铝载体表面经敏化—活化处理,其表观颜色呈浅棕色,说明载体表面已附着一层由纳米钯颗粒组成的活化层。在化学镀钴过程中,镀液颜色逐渐变浅,并最终近似透明。同时,载体表面呈明显金属质地的银灰色。
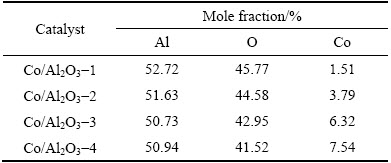
图1展示了氧化铝载体表面沉积钴层前后的微观形貌。从图1(a),(b)可知,载体材料形状规则,球形度较好,由不同粒径的氧化铝颗粒烧结而成。与图1(b)相比,沉积钴后的载体表面形貌变化明显。如图1(c)~(f)所示,陶瓷颗粒表面包裹金属钴,表面平整度和致密度随着钴担载量的增加而提高。催化剂表层元素分析结果见表2。由于沉积的钴层厚度相对较薄,EDS分析所用X射线对样品表层具有一定的穿透能力,因此仍能探测到载体中的铝元素和氧元素。由表2可知,随着镀液用量的增加,载体表面钴的担载量也随之增加,这与图1的结果相吻合。同时,催化层中不含有其他杂质。
通过X射线衍射技术对未负载钴的氧化铝微球和所制备的Co/Al2O3-4催化剂表层物质进行晶相分析,具体结果如图2所示。由XRD谱可知,氧化铝载体主要为γ-Al2O3晶型。另外,Al2O3与Co/Al2O3-4的谱图未见明显不同,未发现金属钴的特征衍射峰,其主要原因在于催化剂表层中钴含量相比于氧化铝而言极为少量;衍射峰信号过于微弱,不明显;即使存在钴的特征峰也将被氧化铝的特征衍射峰所遮盖。
2.2 催化产氢性能
2.2.1 钴担载量对产氢性能的影响
金属钴作为活性组分,其在氧化铝载体表面的担载量直接影响着催化活性。化学镀初期,以活化层钯晶种为核,在其表面沉积钴;沉积的钴自催化后续金属钴的沉积,并逐渐形成连续镀层。由化学镀过程可知,在形成连续的钴镀层之前,随着钴沉积量的增加,催化面积逐渐增加;并在形成连续镀层时达到最大催化面积;而继续沉积钴只能是增加厚度,有效催化活性反而会降低。因此,需确定氧化铝载体表面钴的最佳担载量。
图3(a)所示为使用4种催化剂下的累积产氢量随时间的变化曲线,反应液为5%NaBH4+5%NaOH,反应温度为20 ℃。对于Co/Al2O3-1、2、3、4这4种催化剂而言,分别在89、52、41、37 min时达到最大产氢量。通过计算得出,30 mL反应液中NaBH4完全水解产氢量约为3.67 L,而这4种催化剂均未能实现NaBH4的完全水解。如图3(b) 所示,使用催化剂Co/Al2O3-2时,NaBH4水解率最高,达96.5%。对总产氢量的前90%数据点进行线性拟合,HGR结果见图3(b)。其中,使用催化剂Co/Al2O3-2时,体系的产氢速率最高为3.26 L/(min·g),即Co/Al2O3-2的催化活性最高。随着钴担载量的增加,催化剂Co/Al2O3-3和Co/Al2O3-4的催化活性明显低于Co/Al2O3-2,说明此时增加钴担载量对催化活性无提升作用。综上所述可知,当钴的担载量为0.46%时,所制备的催化剂活性最佳。

图1 空白载体与各催化剂表面SEM像
Fig. 1 Surface SEM images of fresh support material and prepared catalysts
表2 所制备Co/Al2O3催化剂表面元素分析
Table 2 Surface element analysis of prepared Co/Al2O3 catalysts
2.2.2 NaBH4浓度对催化剂活性的影响
本研究考察了反应液中不同NaBH4浓度(1%、2.5%、5%、7.5%、10%)对Co/Al2O3-2催化剂性能的影响规律,如图4所示。当反应液中NaBH4浓度为2.5%时,催化剂活性最佳,HGR高达4.93 L/(min·g)。当反应液中NaBH4浓度较低时(如1%),催化剂的活性面积未得到充分利用,导致HGR偏低;随着NaBH4浓度的增加,BH4-在催化剂表面吸附量增加,并在NaBH4浓度为2.5%时达到饱和,催化剂活性面积得到充分利用;继续增大NaBH4浓度使得催化剂表面反应生成的NaBO2不易及时脱附,占据活性位,BH4-难以有效吸附,从而导致催化剂活性降低[11, 13-14, 18]。JEONG等[19]认为,NaBH4浓度的升高使得反应液的黏度增大,也是造成催化剂活性降低的原因。
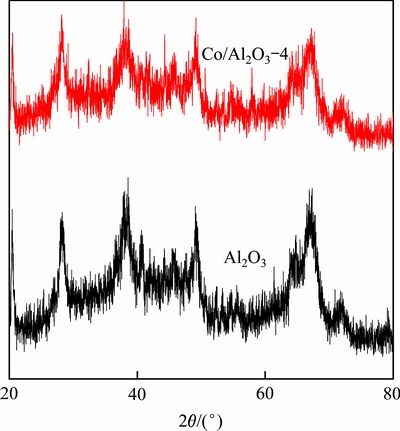
图2 氧化铝载体与Co/Al2O3-4催化剂的XRD分析结果
Fig. 2 XRD patterns of Al2O3 support and catalyst of Co/Al2O3-4
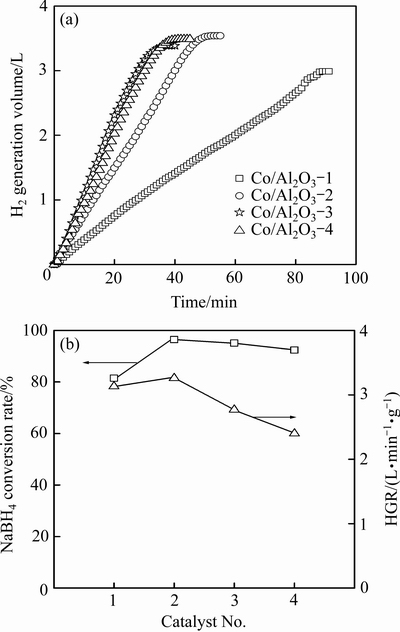
图3 不同催化剂下累积产氢量与反应时间的关系曲线以及不同催化剂下体系的NaBH4转化率和HGR
Fig. 3 Curves of hydrogen generation volume as a function of reaction time(a) and NaBH4 conversion rate and HGR of reaction solution using different catalysts(b)
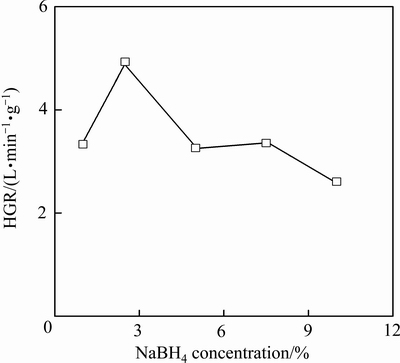
图4 NaBH4浓度对催化剂活性影响
Fig. 4 Effect of NaBH4 concentration on catalyst activity
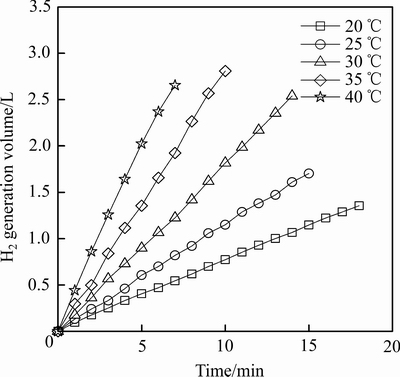
图5 反应温度对产氢性能的影响
Fig. 5 Effect of reaction temperature on hydrogen generation performance
2.2.3 反应温度对催化剂性能的影响
以5%NaBH4+5%NaOH的溶液为反应体系,考察了不同反应温度对Co/Al2O3-2催化产氢性能的影响,结果如图5所示。随着反应温度的提高,单位时间内氢气的生成量有显著的增加,说明升高温度有利于加快NaBH4水解反应速率。拟合计算后得出,Co/Al2O3-2催化剂在20、25、30、35和40 ℃下的HGR值分别为3.26、4.95、7.80、12.18和17.21 L/(min·g)
根据Arrhenius公式计算上述水解过程的表观活化能Ea。
 (2)
(2)
式中:k为反应速率,即HGR,L/(min·g);k0为速率常数,L/(min·g);R为气体常数,8.31 J/(mol·K);T为反应温度,K。如图6所示,对数据点进行拟合后算得,上述反应表观活化能为64.4 kJ/mol。
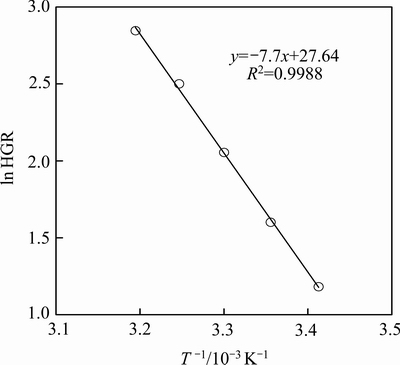
图6 NaBH4水解反应表观活化能
Fig. 6 Arrhenius plots for the hydrolysis of NaBH4
对本工作中制备的催化剂与文献报道的部分同类催化剂性能进行了对比(见表3)。结果表明,以纯钴作为催化剂时,其催化活性依然相对较高。从反应活化能来看,纯钴催化剂的表观活化能相对文献中Co-W-P/Al2O3[10]、Co-B/Silicon[21]、Co-P/Cu[23-24]的活化能值偏高,造成这种现象的原因可能在于催化剂的晶型结构和无其他元素掺杂。非晶态钴基合金具有短程有序,长程无序结构,有较高的表面活性中心密度和对反应物的吸附能力[25]。这些特点有利于降低催化反应的表观活化能,有利于反应的进行。除此之外,研究结果表明,过渡金属的掺杂也有利于降低水解反应的表观活化能[26-27]。
2.2.4 催化剂循环使用性能
循环使用性能是催化剂使用过程中的一项重要指标。本研究对所制备的Co/Al2O3-2催化剂进行了4次循环测试,反应温度为20 ℃,反应液组成为5%NaBH4+5%NaOH,具体测试结果见图7。随着循环使用次数的增多,催化剂活性发生了一定的衰减。经4次循环测试后,催化剂活性由最初的3.26 L·min-1·g-1降低至2.35 L·min-1·g-1,仍保持在初始活性的72%。由文献[10-11, 18, 22-23]中的同类结果可知,其主要原因应归结为催化剂微观形貌的改变和硼化物的吸附累积。
表3 NaBH4水解用不同催化剂的性能对比
Table 3 Comparison of catalytic performance of different catalysts for NaBH4 hydrolysis
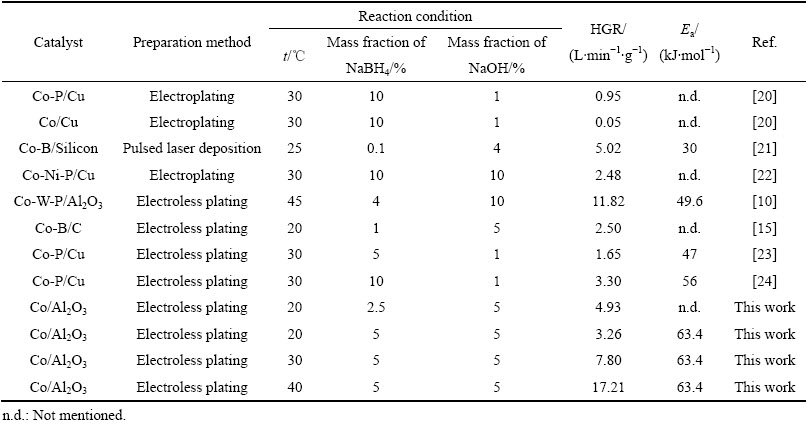
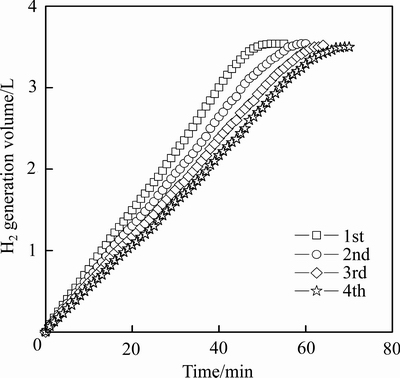
图7 催化剂循环使用情况
Fig. 7 Recycling results for Co/Al2O3-2 catalyst
3 结论
1) 通过化学镀法在球形氧化铝表面沉积金属钴,成功制备了不同钴担载量的Co/Al2O3催化剂,并用于硼氢化钠水解制氢反应。
2) 当钴的担载量为0.46%时,所制备的催化剂活性最高。
3) 与文献中报道的非晶态钴基催化剂相比,纯钴催化剂活性同样优异,但反应活化能偏高。
4) 4次循环测试后,催化剂活性仍保持在初始活性的72 %,说明所制备的催化剂具有较好的循环使用性能。
REFERENCES
[1] 毛宗强. 氢能—21世纪的绿色能源[M]. 北京: 化学工业出版社, 2005.
MAO Zong-qiang. Hydrogen energy—Clean energy for 21st century[M]. Beijing: Chemical Industry Press, 2005.
[2] MOMIRLAN M, VEZIROGLU T N. Current status of hydrogen energy[J]. Renewable & Sustainable Energy Reviewa, 2002, 6(1/2): 141-179.
[3] FERNANDES T R C, CHEN F Z, CARVALHO M G. “HySociety” in support of European hydrogen projects and EC policy[J]. International Journal of Hydrogen Energy, 2005, 30(3): 239-245.
[4] 徐东彦, 张华民, 叶 威. 硼氢化钠水解制氢[J]. 化学进展, 2007, 19(10): 1598-1605.
XU Dong-yan, ZHANG Hua-min, YE Wei. Hydrogen production from sodium bornhydride[J]. Progress in Chemistry, 2007, 19(10): 1598-1605.
[5] 梁 艳, 王 平, 戴洪斌. 硼氢化钠催化水解制氢[J]. 化学进展, 2009, 21(10): 2219-2228.
LIANG Yan, WANG Ping, DAI Hong-bin. Hydrogen generation from catalytic hydrolysis of sodium borohydride solution[J]. Progress in Chemistry, 2009, 21(10): 2219-2228.
[6] DEMIRCI U B, AKDIM O, ANDRIEUX J, HANNAUER J, CHAMOUN R, MIELE P. Sodium borohydride hydrolysis as hydrogen generator: Issues, state of the art and applicability upstream from a fuel cell[J]. Fuel Cells, 2010, 10(3): 335-350.
[7] BRACK P, DANN S E, WIJAYANTHA K G U. Heterogeneous and homogenous catalysts for hydrogen generation by hydrolysis of aqueous sodium borohydride (NaBH4) solutions[J]. Energy Science & Engineering., 2015, 3(3): 174-188.
[8] ZHAO J, MA H, CHEN J. Improved hydrogen generation from alkaline NaBH4 solution using carbon-supported Co-B as catalysts[J]. International Journal of Hydrogen Energy, 2007, 32(18): 4711-4716.
[9] XU D, DAI P, GUO Q, YUE X. Improved hydrogen generation from alkaline NaBH4 solution using cobalt catalysts supported on modified activated carbon[J]. International Journal of Hydrogen Energy, 2008, 33(24): 7371-7377.
[10] WANG L, LI Z, LIU X, ZHANG P, XIE G. Hydrogen generation from alkaline NaBH4 solution using electroless-deposited Co-W-P supported on γ-Al2O3[J]. International Journal of Hydrogen Energy, 2015, 40(25): 7965-7973.
[11] ZHUANG D W, DAI H B, ZHONG Y J, SUN L X, WANG P. A new reactivation method towards deactivation of honeycomb ceramic monolith supported cobalt-molybdenum-boron catalyst in hydrolysis of sodium borohydride[J]. International Journal of Hydrogen Energy, 2015, 40(30): 9373-9381.
[12] MARCHIONNI A, BEVILACQUA M, FILIPPI J, FOLLIERO M G, INNOCENTI M, LAVACCHI A, MILLER H A, PAGLIARO M V, VIZZA F. High volume hydrogen production from the hydrolysis of sodium borohydride using a cobalt catalyst supported on a honeycomb matrix[J]. Journal of Power Sources, 2015, 299: 391-397.
[13] DAI H B, LIANG Y, WANG P, YAO X D, RUFFORD T, LU M, CHENG H M. High-performance cobalt-tungsten-boron catalyst supported on Ni foam for hydrogen generation from alkaline sodium borohydride solution[J]. International Journal of Hydrogen Energy, 2008, 33(16): 4405-4412.
[14] LIANG Y, WANG P, DAI H B. Hydrogen bubbles dynamic template preparation of a porous Fe-Co-B/Ni foam catalyst for hydrogen generation from hydrolysis of alkaline sodium borohydride solution[J]. Journal of Alloys and Compounds, 2010, 491(1/2): 359-365.
[15] 蔡 凡, 沈晓晨, 戴 敏, 高 鸣, 王志斌, 赵 斌, 丁维平. CoB/C催化硼氢化钠水解制氢的性能[J]. 无机化学学报, 2013, 29(4): 689-696.
CAI Fan, SHEN Xiao-chen, DAI Min, WANG Zhi-bin, ZHAO Bin, DING Wei-ping. Catalytic performance of CoB/C for hydrolysis of NaBH4 aqueous solution[J]. Chinese Journal of Inorgnic Chemistry, 2013, 29(4): 689-696.
[16] DEMIRCI U B, AKDIM O, HANNAUER J, CHAMOUN R, MIELE P. Cobalt, a reactive metal in releasing hydrogen from sodium borohydride by hydrolysis: A short review and a research perspective[J]. Science China Chemistry, 2010, 53(9): 1870-1879.
[17] MUIR S S, YAO X. Progress in sodium borohydride as a hydrogen storage material: Development of hydrolysis catalysts and reaction systems[J]. International Journal of Hydrogen Energy, 2011, 36(10): 5983-5997.
[18] LI Z, LI H, WANG L, LIU T, ZHANG T, WANG G, XIE G. Hydrogen generation from catalytic hydrolysis of sodium borohydride solution using supported amorphous alloy catalysts (Ni-Co-P/γ-Al2O3)[J]. International Journal of Hydrogen Energy, 2014, 39(27): 14935-14941.
[19] JEONG S U, KIMA R K, CHO E A, KIM H J, NAM S W, OH I H, HONG S A, KIM S H. A study on hydrogen generation from NaBH4 solution using the high-performance Co-B catalyst[J]. Journal of Power Sources, 2005, 144(1): 129-134.
[20] CHO K W, KWON H S. Effects of electrodeposited Co and Co-P catalysts on the hydrogen generation properties from hydrolysis of alkaline sodium borohydride solution[J]. Catalysis Today, 2007, 120(3/4): 298-304.
[21] PATEL N, FERBABDES R, GUELLA G, KALE A, MIOTELLO A, PATTON B, ZANCHETTA C. Structured and nanoparticle assembled Co-B thin films prepared by pulsed laser deposition: A very efficient catalyst for hydrogen production[J]. Journal of Physics Chemistry C, 2008, 112(17): 6968-6976.
[22] KIM D R, CHO K W, CHOI Y I, PARK C J. Fabrication of porous Co-Ni-P catalysts by electrodeposition and their catalytic characteristics for the generation of hydrogen from an alkaline NaBH4 solution[J]. International Journal of Hydrogen Energy, 2009, 34(6): 2622-2630.
[23] WANG Y, QI K, WU S, CAO Z, ZHANG K, LU Y, LIU H. Preparation, characterization and catalytic sodium borohydride hydrolysis of nanostructured cobalt-phosphorous catalysts[J]. Journal of Power Sources, 2015, 284: 130-137.
[24] EOM K S, CHO K W, KWON H S. Effects of electroless deposition conditions on microstructures of cobalt-phosphorous catalysts and their hydrogen generation properties in alkaline sodium borohydride solution[J]. Journal of Power Sources, 2008, 180(1): 484-490.
[25] 李 忠, 王丽娜, 季付翔, 谢广文. 化学镀Cu-Co-P非晶合金及其催化性能表征[J]. 表面技术, 2015, 44(8): 65-70.
LI Zhong, WANG Li-na, JI Fu-xiang, XIE Guang-wen. Preparation of Cu-Co-P amorphous alloy by electroless deposition and characterization of its catalytic properties[J]. Surface Technology, 2015, 44(8): 65-70.
[26] PATEL N, FERNANDES R, MIOTELLO A. Promoting effect of transition metal-doped Co-B alloy catalysts for hydrogen production by hydrolysis of alkaline NaBH4 solution[J]. Journal of Catalysis, 2010, 271(2): 315-324.
[27] FERNANDES R, PATEL N, PARIS A, CALLIARI L, MIOTELLO A. Improved H2 production rate by hydrolysis of ammonia borane using quaternary alloy catalysts[J]. International Journal of Hydrogen Energy, 2013, 38(8): 3313-3322.
Hydrogen production from hydrolysis of sodium borohydride using electroless-deposited Co/Al2O3 catalysts
WEI Lei, MA Mai-xia, JING Xue-min, LU Yan-hong, ZHANG Su-ling, LIANG Hong-lian, WANG Wen-qian
(College of Chemistry & Material Science, Langfang Teachers University, Langfang 065000, China)
Abstract: Commercial alumina balls were employed as support material, and metal cobalt was deposited on their surface via electroless plating, resulting in a series of Co/Al2O3 catalysts with different Co loadings. The prepared catalysts were used for hydrogen production from the catalytic hydrolysis of alkaline sodium borohydride solution. In the present work, effects of Co loading, NaBH4 concentration, reaction temperature and recycling times on the catalyst activity were investigated. The surface morphology, element composition and phase structure of catalysts were analyzed by scanning electron microscopy (SEM), energy dispersive spectroscopy (EDS) and X-ray diffraction (XRD), respectively. The results show that the optimal Co loading is 0.46% (mass fraction); meanwhile, the 5%NaBH4+5%NaOH solution presents the highest hydrogen generation rate up to 3.26 L/(min·g). The apparent activation energy is 64.4 kJ/mol. Compared with the initial performance, the catalyst activity decreases to 72% after recycling for four times.
Key words: hydrogen production; Co catalyst; sodium borohydride; hydrolysis; electroless plating
Foundation item: Project(BJ2016044) supported by Hebei Education Department, China; Project(B2016408037) supported by Nature Science Foundation of Hebei Province, China; Project(2016011041) supported by Research project of Langfang Science and Technology Department, China
Received date: 2016-06-17; Accepted date: 2016-11-06
Corresponding author: WEI Lei; Tel: +86-316-2188370; E-mail: weilei1108@163.com
(编辑 王 超)
基金项目:河北省教育厅资助科研项目(BJ2016044);河北省自然科学基金资助项目(B2016408037);廊坊市科学技术研究与发展计划自筹经费项目(2016011041)
收稿日期:2016-06-17;修订日期:2016-11-06
通信作者:魏 磊,讲师,博士;电话:0316-2188370;E-mail: weilei1108@163.com