氧化亚铁硫杆菌对黄铜矿表面性质及其浸出的影响
顾帼华,陈明莲,苏丽君,李建华,胡岳华,邱冠周
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
摘 要:通过测定吸附量、Zeta电位和接触角,并通过对原子力显微镜表面进行表征及摇瓶浸出试验考察不同能源(Fe2+、单质硫和黄铜矿)培养的氧化亚铁硫杆菌A.ferrooxidans对黄铜矿表面性质的影响及其与黄铜矿浸出的关系。研究结果表明:不同能源培养的A.ferrooxidans菌对黄铜矿表面性质的影响规律相似;A.ferrooxidans菌均能快速吸附在黄铜矿表面,而矿驯化的A.ferrooxidans菌在矿表面的附着能力更强;细菌的吸附使黄铜矿的等电点朝细菌的等电点方向偏移,且由于在黄铜矿表面生成了硫膜和不稳定铜硫化物使得黄铜矿表面接触角增大,疏水性增强;在浸矿初期,细菌与黄铜矿作用以直接作用机理为主。
关键词:黄铜矿;氧化亚铁硫杆菌;微生物浸出;吸附
中图分类号:TF18 文献标志码:A 文章编号:1672-7207(2010)03-0807-06
Effects of Acidithiobacillus ferrooxidans on surface properties of
chalcopyrite and bioleaching
GU Guo-hua, CHEN Ming-lian, SU Li-jun, LI Jian-hua, HU Yue-hua, QIU Guan-zhou
(School of Mineral Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: Effects of Acidithiobacillus ferrooxidans cultured on different energy resources (Fe2+, sulfur and chalcopyrite) on surface properties of chalcopyrite and bioleaching were evaluated by zeta-potential, adsorption studies, contact angle measurement and atomic force microscope (AFM) images. The results show that after conditioning with bacterium cultured on different energy resources, the change trends of surface properties of chalcopyrite are similar. All types of A.ferrooxidans adhere to chalcopyrite surface rapidly, but adapted A.ferrooxidans has stronger adsorption ability. The isoelectric point of chalcopyrite after bacterial treatment moves towards the isoelectric point of pure cells. Due to the formation of elemental sulfur and intermediate copper sulphides on chalcopyrite surface, the contact angle and surface hydrophobicity of chalcopyrite increase. The direct mechanism of sulfide oxidation is essential in initial bioleaching.
Key words: chalcopyrite; Acidithiobacillus ferrooxidans; bioleaching; adsorption
黄铜矿(CuFeS2)是最重要的铜矿之一,对其微生物浸出的研究一直是湿法冶金领域的研究热点。微生物可以分解各种矿物,吸附是微生物浸矿的第1步[1-2]。不同生长条件下的微生物具有不同的表面性质,对矿物表面表现出不同的吸附能力,从而具有不同的浸矿活性。研究表明:生长在Fe2+培养基上的细胞与生长在固体培养基上(硫、黄铁矿)的细胞表面电性是不同的。表面电荷的差异主要是由于后者的蛋白质含量较高[3]。Edwards等[4]通过研究发现细菌由于新陈代谢引起表面性质的微小变化都会改变细菌的吸附性能,从而影响细菌与矿物的相互作用。微生物吸附在矿物表面将导致矿物表面化学性质发生变化,进而实现矿物之间的有效分离。硫化矿与石英可以通过细菌的预处理作用实现选择性絮凝与分散,从而实现分离[5-7]。细菌的吸附改变了煤炭中黄铁矿的表面性质,使其表面由疏水性变为亲水性[8],这一性质使得浮选法分离黄铁矿与煤炭成为可能[9]。Watling等[10-11]发现矿物吸附A. ferrooxidans菌后,矿物表面亲水性或疏水性发生变化,其可浮性发生变化。已报道的有关微生物与矿物作用后表面性质变化的研究主要是用于提高硫化矿生物浮选和絮凝效果,而对其与微生物浸矿机制的关系研究较少。为此,本文作者研究黄铜矿与不同能源培养的氧化亚铁硫杆菌A. ferrooxidans作用后表面性质的变化及其与黄铜矿浸出的关系,并探讨黄铜矿的浸出机理。
1 材料与方法
1.1 矿样
试验所用黄铜矿取自广东玉水铜矿。黄铜矿经手工挑杂选出纯矿物,破碎,经瓷球磨矿,干式筛分至粒径为0.045~0.074 mm,用于摇瓶浸出。细粒黄铜矿经玛瑙研磨至粒径低于5 μm,用于吸附研究和zeta 电位测定。各元素质量分数为:Cu 31.36%,Fe 30.50%,S 34.38 %。此外,挑选结晶良好的块状黄铜矿切割、打磨、抛光,用于接触角测定和原子力显微镜(AFM)测试。
1.2 菌种和培养
本研究所用氧化亚铁硫杆菌A. ferrooxidans (ATCC23270)取自于中南大学生物冶金教育部重点实验室。A. ferrooxidans菌选用9K培养基溶液,pH为2.0,适宜生长温度为30 ℃。9K培养基组成为:3 g/L (NH4)4SO4,0.1 g/L KCl,0.5 g/L K2HPO4,0.5 g/L MgSO4?7H2O,0.01 g/L Ca(NO3)2。以Fe2+为培养能源时,添加44.7 g/L FeSO4?7H2O;以S为培养能源时,添加10 g/L硫粉。矿驯化A. ferrooxidans菌是在9K介质中经反复、多次培养和不断增加矿浆浓度的条件下获得的。
1.3 细菌在矿物表面的吸附
取1 g矿物粉末置于100 mL已知细菌浓度为1×108个/mL、离子强度I=0.01 mol/L的NaCl溶液,调节至pH=2.0。黄铜矿与细菌的悬浮液通过磁力搅拌器搅拌作用90 min。作用后,将上清液过滤以分离矿粒,残留在液体中的细胞通过双目显微镜计数。
1. 4 Zeta电位的测定
利用DELSA440S Ⅱ型动电位测定仪测定Zeta电位。将菌悬液加入到一定离子强度(I=1 mmol/L)的NaCl溶液中, 细菌浓度控制在2×108个/mL,稍微搅拌,测定细菌Zeta电位。将1 g矿粉与菌浓度为1×108个/mL,pH为2.0的NaCl溶液相互作用90 min,采用离心法分离出矿粒。控制矿浆质量浓度为1 g/L, 在I=0.01 mol/L的NaCl溶液测定矿物Zeta电位。测试中用HCl和NaOH溶液调节pH。
1.5 矿物表面接触角的测定
采用长春光学仪器厂生产的JJC-1 型润湿角测量仪测量蒸馏水在矿物表面上的接触角。测量时, 用微量进样器(2.0 mL) 将蒸馏水在距固体表面约3 mm 处垂直滴加在固体表面, 形成座滴,测量时间不超过 1 min,取读数10次的接触角平均值作为该座滴的接触角。
1.6 原子力显微镜(AFM)形貌
试验采用美国Molecular Imaging公司的PicoSPM II型原子力显微镜。采用接触式(Contact mode)连续扫描,微悬臂由氮化硅(Si3N4)制成,弹性系数为0.16 N/m,最大扫描范围为125 μm×125 μm,扫描频率为0.5 Hz。
将黄铜矿块置于90 mL 9K培养基溶液中,接种10 mL菌浓度为1×108个/mL的细菌。3 d后,取出矿块,用蒸馏水轻轻冲洗矿块表面,晾干,用于观察试样表面的微生物膜;7 d后,取出矿块,经蒸馏水反复冲洗表面微生物膜后,自然晾干,用于观察试样表面的腐蚀形貌。
1.7 浸出实验
浸矿实验是在250 mL锥形瓶中加入90 mL 9K培养基溶液,接种10 mL菌浓度为1×108个/mL的细菌,矿浆浓度为1%条件下进行的。定期取样,分析浸出液中的pH和Cu2+含量。
2 结果与讨论
2.1 吸附
不同能源培养的A. ferrooxidans菌在黄铜矿表面的吸附曲线如图1所示。从图1可看出:不同能源培养的A. ferrooxidans菌在黄铜矿表面的吸附趋势相似,吸附均在30 min左右保持平衡。但硫和黄铜矿中生长的A. ferrooxidans菌比Fe2+培养的细菌在黄铜矿表面吸附得更多。这可能是由于固体培养基上生长的细菌表面具有更高的胞外多聚物(Extracellular polymeric substances, EPS)和蛋白质含量[12]。可见:不同能源培养的A. ferrooxidans菌对黄铜矿表面具有不同的吸附能力。

1—矿驯化A. ferrooxidans菌;2—硫养A. ferrooxidans菌;
3—Fe2+养A. ferrooxidans菌
图1 A. ferrooxidans 菌在黄铜矿表面的吸附
Fig.1 Adsorption of A. ferrooxidans on chalcopyrite surface
2.2 原子力显微镜(AFM)形貌
图2所示是矿驯化A. ferrooxidans菌浸黄铜矿3 d时细菌在矿物表面吸附的AFM形貌。从图2(a)可见:浸出3 d时,细菌不均匀地分布在矿物表面,且更倾向于吸附在矿物表面的裂缝处。由图2(b)可见:在浸出初期,细菌呈单个较零星地吸附在矿物表面。

(a) 浸出3 d;(b) 浸出初期
图2 吸附在黄铜矿表面的A. ferrooxidans菌的二维图
Fig.2 2D images of A. ferrooxidans cells adhered to chalcopyrite surface
图3(a)所示是浸蚀前黄铜矿表面的三维形貌。可见:黄铜矿表面较光滑,只有微小划痕;图3(b)所示是A. ferrooxidans菌浸蚀黄铜矿7 d后,用擦镜纸在蒸馏水中擦去表面附着的细菌后黄铜矿表面的腐蚀形貌。可见:由于A. ferrooxidans菌的腐蚀氧化作用,黄铜矿表面凹凸不平,呈不均匀状态。这进一步表明细菌在黄铜矿表面发生了吸附,并在矿物表面发生腐蚀氧化作用。

(a) 作用前黄铜矿表面的三维图;
(b) A. ferrooxidans菌作用后黄铜矿表面的三维图
图3 黄铜矿表面与A. ferrooxidans菌作用前、后的三维图
Fig.3 3D images of chalcopyrite surface before and after treated with A. ferrooxidans
2.3 Zeta电位
不同能源培养的A. ferrooxidan菌的Zeta电位与pH的关系如图4(a)所示,可见:Fe2+中生长的A. ferrooxidans菌等电点(即电位为0 mV时)pH为2.0,而硫和黄铜矿中生长的A. ferrooxidans菌的等电点pH为3.3~3.5,这与文献[13-14]中的报道结果一致,即生长在固体培养基上的A. ferrooxidans菌表面具有更高的EPS和蛋白质含量,使其具有更高的等电点。
图4(b)所示是黄铜矿与细菌作用前后的Zeta电位变化情况。从图4(b)可见:黄铜矿与细菌作用之前的等电点在pH=5.1左右。与细菌作用后,黄铜矿的等电点朝细菌的等电点方向移动,表明在矿物表面发生了细菌的特效吸附;此外,在酸性介质中,细菌作用后黄铜矿的Zeta电位下降,变得更负;当pH大于5.5时,A. ferrooxidans菌与Fe2+、硫基质上生长的细菌作用后黄铜矿的Zeta电位与未作用前的Zeta电位相似。这可能是由于在偏中性条件下,细菌没有吸附到黄铜矿表面,对黄铜矿Zeta电位没有太大影响;矿驯化的A. ferrooxidans菌对黄铜矿等电点的偏移幅度要比Fe2+、硫基质上生长的细菌等电点的偏移幅度大。不同细菌作用后黄铜矿表现出不同的电动行为,表明不同培养能源生长的细菌对黄铜矿具有不同的吸附能力。

(a) A. ferrooxidans菌;(b) 黄铜矿
图4 A. ferrooxidans菌及细菌作用前、后黄铜矿的
Zeta电位
Fig.4 Zeta-potential of A. ferrooxidans and chalcopyrite before and after conditioning with A. ferrooxidans
与细菌作用后黄铜矿Zeta电位的变化与其反应式有关。主要反应式如下:

由于发生上述反应,黄铜矿表面金属离子的不均衡溶解造成黄铜矿Zeta电位减小。
2.4 接触角测定
图5所示是黄铜矿与不同能源培养的A. ferrooxidans菌作用后黄铜矿表面接触角与浸出时间的关系。从图5可见:在浸出的前4 d,黄铜矿表面接触角变大,疏水性增强。由反应式(1)可知:氧化过程中生成的元素硫和中间态的铜硫化物覆盖在黄铜矿表面,导致其疏水性增强;随着浸出过程的进行,黄铜矿表面接触角变小,是由于表面元素硫被细菌进一步氧化,如反应式(4)所示。许多研究[15-18]表明:在黄铜矿初始氧化过程中会形成一层逐渐变厚的钝化层,该层物质可能是元素硫和斑铜矿,且会被继续氧化成非化学计量的铜硫化物(反应式为式(1),(3)和(4))。结合Zeta电位的研究结果,可以认为在黄铜矿浸出初期,细菌与黄铜矿作用以直接作用机理为主。

1—矿驯化A. ferrooxidans菌;2—硫养A. ferrooxidans菌;
3—Fe2+养A. ferrooxidans菌
图5 不同浸出条件下黄铜矿表面接触角的变化曲线
Fig.5 Change of contact angle of chalcopyrite in different bioleaching conditions
2.5 黄铜矿浸出实验
不同能源培养的A. ferrooxidans菌对黄铜矿的浸出实验结果如图6所示。由图6(a)可见:矿驯化A. ferrooxidans菌比Fe2+、硫基质上生长的细菌具有更好的浸出效果;7 d后,矿驯化细菌的Cu2+浸出率达到26.6%;而Fe2+和硫上生长的细菌浸出效果相差不多,Cu2+浸出率仅为15.6%左右。这与吸附试验及表面性质研究结果是一致的,即被矿驯化细菌对黄铜矿具有更强的吸附能力和腐蚀氧化作用。由图6(b)可见:在浸出初期,pH均比初始的2.0有所上升,即浸出初期是耗酸过程(对应于反应式(1));随着浸出的进行,细菌进一步氧化覆盖物硫膜,逐渐进入产酸阶段。这进一步表明黄铜矿浸出初期,细菌以直接作用机理为主。而在浸矿中后期,大多数研究者认为细菌的直接作用和间接作用往往同时存在,并以间接作用为主。
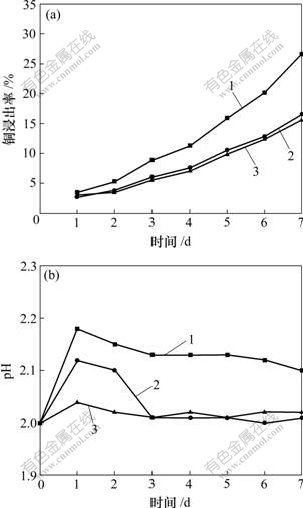
1—矿驯化A. ferrooxidans菌;2—硫养A. ferrooxidans菌;
3—Fe2+养A. ferrooxidans菌
(a) 铜浸出率与时间的关系;(b) pH与时间的关系
图6 铜浸出率和pH随浸出时间的变化
Fig.6 Copper extraction of chalcopyrite and variation of pH with leaching time of bioleaching
3 结论
(1) 矿驯化的A. ferrooxidans菌在黄铜矿表面的吸附能力比Fe2+、硫基质上生长的细菌的吸附能力强,矿驯化A.ferrooxidans菌具有较强的氧化腐蚀作用。
(2) 生长在固体培养基上的A. ferrooxidans菌由于表面具有高含量的蛋白质和EPS,因而拥有更高的等电点。A. ferrooxidans菌作用后黄铜矿的等电点向负方向偏移,介于初始黄铜矿等电点与纯细菌等电点之间,表明细菌在黄铜矿表面发生特效吸附。在浸矿初期,黄铜矿表面接触角变大,疏水性增强。
(3) 黄铜矿微生物在浸矿初期,细菌的直接作用占主导地位。
参考文献:
[1] Brierley C L. Microbiological mining[J]. Scientific American, 1982, 247(2): 42-53.
[2] Pradhan N, Nathasharma K C, Rao K S, et al. Heap bioleaching of chalcopyrite: A review[J]. Minerals Engineering, 2008, 21(5): 355-365.
[3] Sharma P K, Das A, Hanumantha Rao K, et al. Surface characterization of Acidithiobacillus ferrooxidans cells grown under different conditions[J]. Hydrometallurgy, 2003, 71(8): 285-292.
[4] Edwards K J, Rutenberg A D. Microbial response to surface microtopography: The role of metabolism in localized mineral dissolution[J]. Chemical Geology, 2001, 180(4): 19-32.
[5] Natarajan K A, Das A. Surface chemical studies on acidithiobacillus group of bacteria with reference to mineral flocculation[J]. International Journal of Mineral Processing, 2003, 72(1): 189-198.
[6] Chandraprabha M N, Natarajan K A, Modak J M. Selective separation of pyrite and chalcopyrite by biomodulation[J]. Colloids and Surfaces B: Biointerfaces, 2004, 37(3): 93-100.
[7] Chandraprabha M N, Natarajan K A, Somasundaran P. Selective separation of arsenopyrite from pyrite by biomodulation in the presence of Acidithiobacillus ferrooxidans[J]. Journal of Colloid and Interface Science, 2004, 276(2): 323-332.
[8] Ohmura N, Kitamura K, Saild H. Mechanism of microbial flotation using Thiobacillus ferrooxidans for pyrite suppression[J]. Biotechnol Bioeng, 1993, 41(6): 671-676.
[9] Attia Y A. Feasibility of selective biomodification of pyrite floatability in coal desulfurization by froth flotation[J]. Resources Conservation and Recycling, 1990, 3(2): 169-175.
[10] Watling H R. The bioleaching of sulphide minerals with emphasis on copper sulphides: A review[J]. Hydrometallurgy, 2006, 84(1): 81-108.
[11] Yelloji R M K, Natarajan K A, Somasundaran P. Effect of biotreatment with Thiobacillus ferrooxidans on the floatability of sphalerite and galena[J]. Miner Metallurg Processing, 1992, 9(4): 95-100.
[12] 傅建华, 邱冠周, 胡岳华, 等. 浸矿细菌的超微结构及其特性[J]. 中南大学学报: 自然科学版, 2004, 35(4): 562-568.
FU Jian-hua, QIU Guan-zhou, HU Yue-hua, et al. Ultrastructure and properties of leaching bacteria[J]. Journal of Central South University: Science and Technology, 2004, 35(4): 562-568.
[13] Sharma P K, Hanumantha R K. Adhesion of Paenibacillus polymyxa on chalcopyrite and pyrite: Surface thermodynamics and extended DLVO theory[J]. Colloids and Surfaces B: Biointerfaces, 2003, 29(1): 21-38.
[14] Ohmura N, Kitamura K, Saiki H. Selective adhension of T. ferrooxidans to pyrite[J]. Appl Environ Microbiol, 1993, 59: 4044-4050.
[15] Rodriguez Y, Ballester A, Blazquez M L, et al. New information on the chalcopyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003, 71(1): 47-56.
[16] 卢毅屏, 蒋小辉, 冯其明, 等. 常温酸性条件下黄铜矿的电化学行为[J]. 中国有色金属学报, 2007, 17(3): 465-470.
LU Yi-ping, JIANG Xiao-hui, FENG Qi-ming, et al. Electrochemical behavior of chalcopyrite at normal temperature in acidic solution[J]. Trans Nonferrous Met Soc China, 2007, 17(3): 465-470.
[17] Lu Z Y, Jeffrey M I, Lawson F. An electrochemical study of the effect of chloride ions on the dissolution of chalcopyrite in acidic solutions[J]. Hydrometallurgy, 2000, 56(2): 145-155.
[18] Schippers A, Sand W. Bacterial leaching of metal sulfides proceeds by the indirect mechanisms via thiosulfate or via polysulfides and sulfur[J]. Appl Environ Microbiol, 1999, 65(1): 319-321.
收稿日期:2009-02-11;修回日期:2009-04-28
基金项目:国家自然科学基金资助项目(50621063);国家重点基础研究研发项目(2004CB619204)
通信作者:顾帼华(1968-),女,江西南昌人,博士,教授,从事矿物加工及生物冶金研究;电话:0731-88830545;E-mail: guguohua@126.com
(编辑 陈灿华)