文章编号:1004-0609(2007)09-1543-07
蒸馏水中采用脉冲激光烧蚀制备Ag纳米粒子胶体
徐 兵1,宋仁国1,唐普洪1,王 晶1,柴国钟1,张银珠2,叶志镇2
(1. 浙江工业大学 机械制造及自动化教育部重点实验室,杭州 310014;
2. 浙江大学 硅材料国家重点实验室,杭州 310027)
摘 要:采用脉冲激光(重复率为10 Hz,能量密度为4.2 J/cm2)对蒸馏水中的Ag靶烧蚀不同时间后,制备得到Ag纳米粒子胶体,并对其进行紫外-可见分光光度计分析和透射电镜观察。结果表明:烧蚀时间为5~7.5 min时,Ag纳米粒子粒径及分布随烧蚀时间呈减少趋势,烧蚀时间从7.5变化至15 min时又随之增加,而烧蚀时间从15变化至25 min时又随之减少;获得的纳米粒子浓度增高,且溶液中粒子的团聚率也增大;烧蚀时间为7.5 min时,粒子粒径达到最小(D=14.48 nm),粒径分布最小(d=25.8 nm)。在实验基础上,应用纳米粒子对脉冲激光自吸收产生的“爆炸”与“熔化生长”模型解释了烧蚀时间对纳米粒子胶体的影响规律,证实通过改变烧蚀时间来控制纳米粒子尺寸和形貌、以及防止纳米粒子发生团聚的可行性。
关键词:Ag;纳米粒子胶体;激光烧蚀;爆炸;熔化生长
中图分类号:O 532 文献标识码:A
Ag nanoparticles colloids produced by pulsed laser ablation in distilled water
XU Bing, SONG Ren-guo, TANG Pu-hong, WANG Jing, CHAI Guo-zhong, ZHANG Yin-zhu, YE Zhi-zheng
(1. The MOE Key Laboratory of Mechanical Manufacturing and Automation,Zhejiang University of Technology, Hangzhou 310014, China;
2. State Key Laboratory of Silicon Materials, Zhejiang University, Hangzhou 310027, China)
Abstract: Silver nanoparticles colloids were prepared by pulsed laser ablation for different time in distilled water with repetition rate of 10 Hz and laser fluence of 4.2 J/cm2. The nanoparticles colloids were characterized by UV-visible transmission spectrometry and transmission electron microscopy. The results show that the average diameter and its distribution of silver colloidal nanoparticles are decreased with prolongation of ablation time from 5 to 7.5 min, while then increased from 7.5 to 15 min, then decreased from 15 to 25 min. When the concentration of Ag nanoparticles becomes higher, the degree of aggregation in the solution also becomes higher. Furthermore, after ablating for 7.5 min, the average diameter is the smallest (D=14.48 nm), and the diameter distribution is the narrowest (d=25.8 nm). Based on the experimental results, the effects mentioned above in terms of “fragmentation” and “melting induced growth” of nanoparticles is explained by self-absorption of laser pulses. Furthermore, it is also confirmed that both the control of nanoparticles size and shape and the prevention of nanoparticles colloid agglomeration are possible by condition of ablation time.
Key words: Ag; nanoparticle colloids; laser ablation; fragmentation; melting induced growth
目前,大量有关纳米材料的基础性研究正在进行,其中大部分研究旨在探索制备纳米粒子的技术[1-2]。液相中脉冲激光烧蚀法是一种新型技术,其优点是金属表面与激光作用过程中排除了传统方法中额外粒子的污染[3-4]。
由于纳米粒子的性质主要取决于粒子尺寸,因此在金属胶体的形成过程中,对粒子尺寸的控制就显得极为重要。Mafune等[5]研究了激光烧蚀制备Au纳米粒子胶体,提出了其成长机制,并揭示了粒子尺寸是可以由激光能量密度和表面活性剂浓度来控制。Tsuji等[6]研究了粒子尺寸是随着激光波长的增加而 减少,并根据胶体粒子的自吸收爆炸来解释此现象。Kazakevich等[7]通过激光在各种环境液体下烧蚀制备金属合金纳米粒子,揭示了环境液体和激光参数一样也会影响纳米粒子的性质。Sylvie等[8]通过测量团簇、观察等离子体和分析尺寸分布来研究飞秒激光烧蚀制备Au和Cu纳米粒子,揭示了粒子数量随尺寸的长大而减少,同时还发现在羽辉中存有两种粒子。以上的这些研究工作已经表明通过激光烧蚀条件来控制粒子尺寸是可行的。因此,在各种烧蚀条件下对其进行实验研究是必要的。
最近,国内外研究已经在讨论激光参数对粒子尺寸的影响[9-10],而关于激光烧蚀时间的研究几乎没有报道。本文作者通过脉冲激光烧蚀法制备Ag纳米粒子胶体,系统讨论了各种烧蚀时间对粒子尺寸和形貌的影响,以及胶体浓度与粒子稳定性之间的关系。
1 实验
实验前,首先将Ag靶(纯度为99.99%,试样尺寸为10 mm×10 mm,厚度为1 mm)用酒精清洗,再用蒸馏水去除靶上的有机杂质,接着采用10%盐酸冲洗10 min后去除表面氧化层,然后采用超声波清洗10 min去除表面杂质。重复上述步骤3次。最后将处 理过的Ag靶装入直径为50 mm的烧杯(经过蒸馏水洗净)中,并注入10 mL蒸馏水,之后将烧杯放在铁架台上。本实验用KrF准分子激光器(Lamban Compex-102型脉宽为30 ns,激光波长为248 nm,输入电压为20 kV,脉冲能量为164 mJ)作为激光源,同时调整激光光束焦距使得激光光斑最亮并聚焦到靶上。
实验中,Ag靶表面有浑浊物冒出,并伴有响声。随着照射时间的延长,Ag胶体浓度增加,水色变化从微黄→深黄→银灰,并最后稳定下来。
实验结束后,将获得的胶体溶液滴在铜网上,然后通过真空室蒸发烘干,重复上述实验5次以保证足够Ag纳米粒子沉积下来,制备好的粒子粒径和形貌由JEM200CX透射电镜来观察,同时粒径分布及大小可以在TEM图像中测量超过300个的纳米粒子来获得。紫外吸收光谱由JASCO V-550扫描分光光度计对装在石英单元(3.0 mL)中的胶体进行扫描来获得。
2 结果和讨论
2.1 烧蚀时间对Ag纳米粒子胶体的影响
图1所示为不同烧蚀时间下获得的Ag纳米粒子胶体的紫外吸收光谱。由图可知,存在长痕迹的宽带指向长波长,从而表明形成的是多分散的Ag溶胶,以及溶液中的Ag纳米粒子粒径不均匀且有团聚趋势。随着烧蚀时间的增加,吸收峰位先红移后蓝移,半峰宽先减少后增加再减少,同时紫外光谱的吸光度也随之增加。

图 1 不同烧蚀时间后获得的Ag纳米粒子胶体的紫外吸收光谱
Fig.1 UV-Vis absorption spectra of laser-ablated Ag nanoparticles colloid ablated for various time
另外,由于分布在Ag粒子间带跃迁的紫外区域中的等离子体共振带反映了Ag粒子粒径和形貌[11],故烧蚀效率可以通过250 nm时的间带吸收来估计。因此图1中的吸光度表明,随着烧蚀时间的增加,烧蚀效率先大幅提升,再趋于缓慢,到20 min后,再次大幅提升。
同时,有关研究表明,紫外可见吸收光谱中吸收峰位、形状与粒子的大小、形貌、分散状态等相关[12]。一般来说,最大吸收峰位可粗略地表征粒子的粒 径,吸收峰位的波长越大,相应的粒子粒径也越大。图2所示为不同烧蚀时间下制备的Ag纳米粒子胶体的TEM像及尺寸分布。由图可知,Ag纳米粒子胶体的平均粒径分别为:D5 min=14.57 nm,D10 min=17.54 nm,D15 min=29.79 nm,D20 min= 24.58 nm,D25 min=18.34 nm,即随着激光烧蚀时间的延长,粒径分布呈先减少后增加再减少的趋势,这与图1所示的紫外吸收光谱结果相一致。
鉴于上述实验现象,认为激光烧蚀制备金属纳米粒子胶体主要有3个阶段:1) 开始时,靶材吸收激光能量爆炸产生金属纳米粒子;2) 金属纳米粒子形成后的自吸收作用;3) 激光关掉后,金属纳米粒子快速凝固。
1) 激光对靶材的作用
首先,在单激光脉冲期间(脉宽约为10 ns),考虑到Ag靶(Agb)上极小的光斑区域在极短的时间内连续吸收1 000多个光子,其表面温度大幅提高并开始形成等离子体羽辉,其中包含大量的Ag原子(Agm)、小Ag团粒(Agp)等。之后,等离子体羽辉在蒸馏水中引起了急剧的膨胀和短暂的爆炸,并在水的作用下凝固
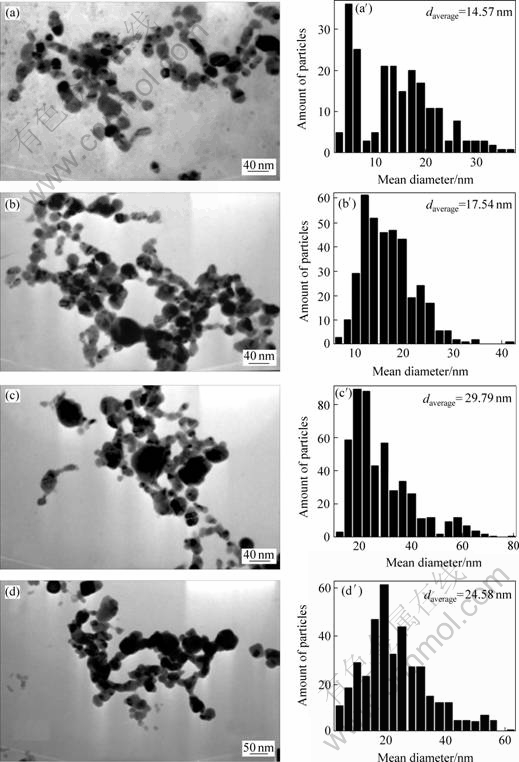

图2 不同烧蚀时间下制备的Ag纳米粒子胶体的TEM像及尺寸分布
Fig.2 TEM images and size distribution of laser-ablated Ag nanoparticles colloid ablated for various times: (a), (a′) 5 min; (b), (b′) 10 min; (c), (c′) 15 min; (d), (d′) 20 min; (e), (e′) 25 min; (f), (f′) 7.5 min
成球状纳米银粒子[13],反应式为:

接着,在激光照射后的纳秒或者更迟些的时间范围内,纳米粒子就开始“熔化生长”,其中包含团聚和吸附两种机制[9-10]。
①团聚 等离子体羽辉中存在着少量Ag原子组成的核心,这些核心是由浓度涨落随机形成的。之后核心继续吸附Ag原子、小团粒Ag生长成小型Ag纳米粒子(Agx),直到附近的Ag原子、小团粒Ag(Agp′)(离核心约100 nm)全部耗尽。反应式如下:

②吸附 当外部区域(离核心距离大于100 nm)的Ag原子、小团粒Ag通过漂移接近小型纳米Ag粒子时,小型纳米Ag粒子继续吸附并缓慢生长为大型纳米Ag粒子(Agd)。反应式如下:

这个阶段在极短的时间内形成最初的纳米粒子(包括Agx和Agd)。
2) 纳米粒子形成后的自吸收作用。
随时间的延长,当溶液中大型纳米粒子的数量不断增加,激光能量绝大部分都被Ag靶上的等离子体羽辉中的大型纳米粒子吸收,而真正达到Ag靶且被吸收的激光能量很少。然而,相对于每脉冲纳米粒子吸收的能量而言,Ag微结构的热损耗,以及纳米粒子和周围液体的传导/对流、辐射的热损耗是很少的[14]。故该阶段的烧蚀机理可能是:大型纳米粒子爆炸成较小的纳米粒子(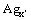 )和团粒(
)和团粒( ),然后再熔化团聚、吸附生长为较大纳米粒子(
),然后再熔化团聚、吸附生长为较大纳米粒子(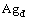 与
与 ),反应式如下:
),反应式如下:

Mafune等[15]报道在激光烧蚀制备金属纳米胶体过程中,吸收率通常是随激光发射数量的增加而减少,并最后稳定下来。该现象的可能原因如下:在恒定的能量密度激光照射下,金属纳米粒子吸收光能爆炸后,由于粒径变小,可再次吸收光能爆炸的粒子数量就大幅减少,最后随着激光照射数量的增加,溶液中的金属纳米粒子太小以致不能大量吸收能量后爆炸。换言之,纳米粒子的平均直径达到最小值。因此,本文作者认为当能量密度一定时,最小粒径的存在可由烧蚀过程中比较“爆炸”作用和“熔化生长”作用来解释。当它们之间达到平衡时,便产生了平均粒径最小且粒径分布最窄的纳米粒子。
实验中,激光烧蚀从开始到5 min内,获得的胶体中存在大量形貌规则、粒径分布较分散的小型纳米Ag粒子,其中包括大量粒径小于10 nm的粒子(见图2(a))。可能的解释为:Ag靶吸收光能后(这可以从吸光度中看出),爆炸产生粒径分布较宽的小型纳米粒子,而这些纳米粒子在5 min内来不及完全自吸收后“熔化生长”为大型纳米粒子。很明显,此时“爆炸”作用的效应大于“熔化生长”作用产生的效应。
当烧蚀到7.5 min左右,制备的纳米粒子的平均粒径减少到最小(见图3),这与图2(f)所示的TEM像相一致。这可能是由于烧蚀过程中“爆炸”作用和“熔化生长”作用达到平衡。

图 3 不同烧蚀时间下制备的Ag纳米粒子胶体粒径分布
Fig.3 Diameter of laser-ablated Ag nanoparticles colloid ablated for various laser irradiation time
当继续烧蚀直到15 min时,小型Ag纳米粒子继续吸收激光能量,粒径小于10 nm的纳米粒子急剧减少,少量粒径大于80 nm的粒子出现,且平均粒径有所增加,胶体浓度趋向稳定,这可能是由于形成的小型纳米粒子自吸收引起的,此时“熔化生长”发挥主要作用,“爆炸”作用几乎可忽略。
忽略“爆炸”作用下Ag纳米粒子在无表面活性剂和忽略“爆炸”作用的情况下(见图4),定义Va为Ag原子的有效体积,以及da为Ag原子云中Ag原子的数量密度。rp(t)表示缓慢生长t时间后粒子的半径,公式如下[16]:


图 4 忽略“爆炸”作用下Ag纳米粒子的“熔化生长”模型
Fig.4 Model of laser-ablated Ag nanoparticles melting induced aggregation without fragmentation
式中 va为Ag原子或团粒的粒子速度,以于本实验来说,va可看作恒定;k为系数;r0为“爆炸”作用和“熔化生长”作用达到平衡时的最小粒子半径;从银晶体中银原子的原子半径,计算得出va=1.25×10-29 m3,因此由式(6)可得,烧蚀时间从7.5到15 min,纳米粒子的平均粒径随着烧蚀时间的增加而增加,结果如图3所示。
烧蚀延续15 min后,“爆炸”才开始发挥作用,平均粒径开始减少。当激光烧蚀到25 min时,图2(e)中显示大量粒子粒径小于10 nm。这可能是因为在入射激光的路径中产生很多Ag纳米粒子,它们吸收足够的能量后克服结合能发生“爆炸”,从而引起平均粒径再次大幅度减小。这与图1中烧蚀20 min后紫外吸收光谱的变化相一致。
如上所述,随着烧蚀时间的延长,第二阶段中烧蚀不断的重复下面的循环过程:“爆炸”作用的效应大于“熔化生长”作用 “爆炸”作用的效应等于“熔化生长”作用
“爆炸”作用的效应等于“熔化生长”作用 “爆炸”作用的效应小于“熔化生长”作用
“爆炸”作用的效应小于“熔化生长”作用 “爆炸”作用的效应等于“熔化生长”作用。
“爆炸”作用的效应等于“熔化生长”作用。
3) 关掉激光后金属纳米粒子的快速凝固效应
当激光关掉后,爆炸过程也就停止了,此时只有极少数团聚吸附还在进行,使熔化了的Ag纳米粒子继续缓慢长大,直到所有的Ag原子和小团粒耗尽为止。同时由于周围溶剂的作用,这些球状的Ag液滴快速凝固成球状的Ag纳米粒子。这与图1所示的单一等离子体波峰相一致。此阶段不会对激光关掉时形成的纳米粒子形貌和粒径产生重大影响,因此没有太大的必要来考虑这个阶段。
2.2 制备的胶体浓度对Ag纳米粒子稳定性的影响
图5所示为Ag胶体的紫外可见吸收光谱。由图5(a)可知,将高浓度Ag胶体放置在密封的广口瓶中至10 d后,紫外可见光谱的吸光度大幅度降低,吸收峰位稍微有些红移,半峰宽有所窄化。由图5(b)可知,低浓度Ag胶体放置10 d后,吸光度少许增加,吸收峰位微有些红移,而半峰宽几乎没变。
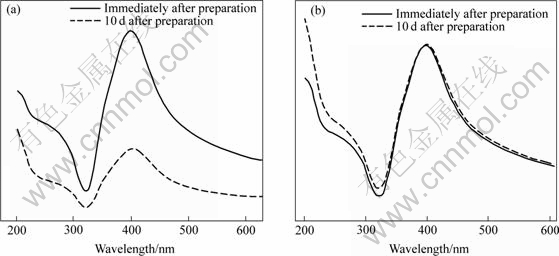
图 5 不同浓度的Ag胶体刚制备时和存放10 d后的紫外可见吸收光谱
Fig.5 UV-Vis absorption spectra of Ag nanoparticles colloid with different concentrations immediately or deposited for 10 d after preparation: (a) High concentration; (b) Low concentration
上述结果表明,在无表面活性剂的情况下,很大程度上团聚率取决于胶体的浓度。本文作者认为对于低浓度Ag胶体来说,其团聚率较低,且团聚后的粒子悬浮在溶液中,使得溶液中胶体粒子的平均粒径稍微增加,但并未出现很大的粒子,而其浓度几乎没有发生变化。这可以通过比较图2(b)和6(a)来证实。由朗伯定律知[17],此时的吸光度增加主要是由于吸光物质(Ag胶体粒子)厚度增加引起的。对于高浓度Ag胶体来说,团聚率较大,团聚后的大粒子都沉淀下来,从而使得胶体粒子浓度减少。图2(e)和图6(b)显示胶体粒径平均粒径明显增大,且出现大量粒径大于60 nm的粒子。由朗伯-比耳定律知[17],此时吸光度的减少主要是因为Ag胶体粒子团聚沉淀后引起溶液浓度减少。因此,防止高浓度下Ag胶体粒子团聚就变得更为重要。最近,Mafune等[18-19]和Yeh等[20]研究了在水溶液中加表面活性剂进行激光烧蚀以防止胶体团聚。

图 6 不同浓度的Ag胶体存放10 d后的TEM像
Fig.6 TEM images of laser-ablated Ag nanoparticles colloid with different concentrations after deposited for 10 d: (a) Low concentration; (b) High concentration
3 结论
1) 在恒定激光参数下,当烧蚀时间小于7.5 min时,Ag胶体平均粒径随着烧蚀时间的增加而减少,粒径分布呈窄化趋势;当烧蚀时间从7.5 min延至15 min时,平均粒径随之增加,粒径分布则呈宽化趋势;当烧蚀时间大于15 min后,平均粒径随之减少,粒径分布又呈窄化趋势。
2) 应用纳米粒子对脉冲激光自吸收产生的“爆炸”和“熔化生长”模型可以解释烧蚀时间对纳米粒子胶体的影响规律。通过改变激光烧蚀时间可控制Ag胶体粒子的特征。
3) 在无表面活性剂的情况下,低浓度Ag胶体的稳定性比高浓度的高,更容易保存。
REFERENCES
[1] 魏智强, 温贤伦, 王 君, 吴志国, 徐建伟, 吴现成, 闫鹏勋. 阳极弧等离子体制备镍纳米粉[J]. 中国有色金属学报, 2003, 13(5): 1136-1140.
WEI Zhi-qiang, WEN Xian-lun, WANG Jun, WU Zhi-guo, XU Jian-wei, WU Xian-cheng, YAN Peng-xun. Preparation of Ni nanopowders by anodic arc plasma[J]. The Chinese Journal of Nonferrous Metals, 2003, 13 (5): 1136-1140.
[2] 丁占来, 张建民, 齐芳娟, 彭 政. 铟纳米颗粒及纳米线的制备[J]. 中国有色金属学报, 2006, 16(1): 105-109.
DING Zhan-lai, ZHANG Jian-min, QI Fang-juan, PENG Zheng. Synthesis of indium nanoparticles and indium nanowires[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(1): 105-109.
[3] Lee P C, Meisel D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J]. J Phys Chem, 1982, 86: 3391-3395.
[4] Joo T H, Kim K, Kim M S. Surface-enhanced raman scattering of  in silver sol. Effect of pyridine[J]. Chem Phys Lett, 1984, 112: 65-68.
in silver sol. Effect of pyridine[J]. Chem Phys Lett, 1984, 112: 65-68.
[5] Mafune F, Kohno J, Takeda Y, Kondow T. Growth of gold clusters into nanoparticles in a solution following laser-induced fragmentation[J]. J Phys Chem B, 2002, 106: 8555-8561.
[6] Tsuji T, Iryo K, Watanabe N, Tsuji M. Preparation of silver nanoparticles by laser ablation in solution influence of laser wavelength on particle size[J]. Appl Surf Sci, 2002, 202: 80-85.
[7] Kazakevich P V, Simakin A V, Voronov V V, Shafeev G A. Laser induced synthesis of nanoparticles in liquids[J]. Appl Surf Sci, 2006, 252: 4373-4380.
[8] No?l S, Hermann J, Itina T. Investigation of nanoparticle generation during femtosecond laser ablation of metals[J]. Appl Surf Sci, 2007, 253: 6310-6315.
[9] Mafune F, Kohno J, Takeda Y, Kondow T. Formation of gold nanoparticles by laser ablation in aqueous solution of surfactant[J]. J Phys Chem B, 2001, 105: 5114-5120.
[10] Tsuji T, Watanabe N, Tsuji M. Laser induced morphology change of silver colloids: Formation of nano-size wires[J]. Appl Surf Sci, 2003, 211: 189-193.
[11] Tsuji T, Iryo K, Nishimur Y, Tsuji M. Preparation of metal colloids by a laser ablation technique in solution: Influence of laser wavelength on the ablation efficiency (Ⅱ)[J]. J Photochem Photobiol A, 2001, 145: 201-207.
[12] 陈宗淇, 王光信. 胶体和表面化学[M]. 北京: 高等教育出版社, 2001: 138.
CHEN Zong-qi, WANG Guang-xin. Colloid and interface chemistry[M]. Beijing: Higher Education Press, 2001, 138.
[13] Craciun N, Bassim V. Laser-induced explosive boiling during nanosecond laser ablation of silicon[J]. Appl Surf Sci, 2002, 186: 288-292.
[14] Hoheisel, Vollmer W, Traeger M. Desorption of metal atoms with laser light: Mechanistic studies[J]. F Phys Rev B, 1993, 481: 17463-17476.
[15] Mafune F, Kohno J, Takeda Y, Kondow T. Dissociation and aggregation of gold nanoparticles under laser irradiation[J]. J Phys Chem B, 2001, 105: 9050-9056.
[16] Mafune F, Kohno J, Takeda Y, Kondow T. Formation and size control of silver nanoparticles by laser ablation in aqueous solution[J]. J Phys Chem B, 2000, 104: 9111-9117.
[17] 陈学泽. 无机及分析化学[M]. 北京: 化学工业出版社, 2000: 251-252.
CHEN Xue-ze. Inorganic and analytical chemistry[M]. Beijing: Chemistry Industry Press, 2000: 251-252.
[18] Mafune F, Kohno J, Takeda Y, Kondow T. Structure and stability of silver nanoparticles in aqueous solution produced by laser ablation[J]. J Phys Chem B, 2000, 104: 8333-8337.
[19] Mafune F, Kohno J, Takeda Y, Kondow T. Full physical preparation of size-selected gold nanoparticles in solution: Laser ablation and laser-induced size control[J]. J Phys Chem B, 2002, 106: 7575-7577.
[20] Chen Y H, Yeh C H. Laser ablation method: Use of surfactants to form the dispersed Ag nanoparticles[J]. Colloids Surf A, 2002, 197: 133-139.
基金项目:浙江省自然科学基金青年科技人才培养资助项目(R405031); 浙江省教育厅专项任务资助项目(20051441)
收稿日期:2007-01-08;修订日期:2007-06-21
通讯作者:宋仁国,教授,博士;电话:0571-88320303;传真:0571-88320130;E-mail: songrg@zjut.edu.cn
(编辑 龙怀中)