中国有色金属学报 2004,(03),515-519 DOI:10.19476/j.ysxb.1004.0609.2004.03.033
铝酸钠 (钾) 溶液种分过程的分解率和粒度分布
中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院 长沙410083 ,长沙410083 ,长沙410083 ,长沙410083 ,长沙410083 ,长沙410083
摘 要:
采用等温间歇式反应器研究了纯铝酸钠和铝酸钾溶液在种分过程的分解率、粒度分布 (PSD) 的变化规律, 同时对分解产品进行了XRD、SEM和TG/DTG分析。结果表明, 在相同的分解条件下, 铝酸钾溶液的分解率大于铝酸钠溶液;铝酸钠和铝酸钾溶液中颗粒的粒度分布随时间变化具有显著差异;产品的XRD显示, 分解过程中铝酸钾比铝酸钠溶液中的晶体结晶度完整, 但产品的TG/DTG曲线却没有明显的差别。对于不同αk值的铝酸钠和铝酸钾溶液, 这些差异是相似的。铝酸钾与铝酸钠溶液在种分过程中的成核速率不同可能是引起分解率和粒度分布产生差异的原因。
关键词:
中图分类号: TF821
收稿日期:2003-06-17
基金:国家重点基础研究发展规划资助项目 (G1999064902);
Precipitation rate and particle size distribution of seeded precipitation proceeding in sodium and potassium aluminate solutions
Abstract:
The precipitation rate and particle size distribution (PSD) for pure sodium aluminate solution and potassium aluminate solutions were investigated. The XRD, SEM and TG/DTG curves were used to study the products of sodium aluminate solution and potassium aluminate solution. The results show that the precipitation rate of potassium aluminate solution is larger than that of sodium aluminate solution, and the rate increases with the decrease of (original) αk of caustic aluminate solution under the same conditions. There are dramatic discrepancies of PSD during the same seeded precipitation condition between sodium aluminate solution and potassium aluminate solution. The XRD patterns of products show that the crystals of potassium aluminate solution have better crystallinity than that of sodium aluminate solution, but the TG/DTG curves of products of sodium aluminate solution and potassium aluminate solution have no obvious difference. These discrepancies are similar in solutions of different αk (1.45, 1.55, 1.65) . It is considered that the difference of nucleation rate between sodium aluminate solution and potassium aluminate solution is the reason for the discrepancy of precipitation rate and PSD during seeded precipitation.
Keyword:
Received: 2003-06-17
世界氧化铝工业生产中, 90%以上是采用拜尔法生产的。 种子分解过程是氧化铝生产过程中的一个极其重要的工序, 也是物料积压最多, 最耗时的一个工序, 研究者们已对该过程的机理和动力学等进行了大量的研究
1 实验
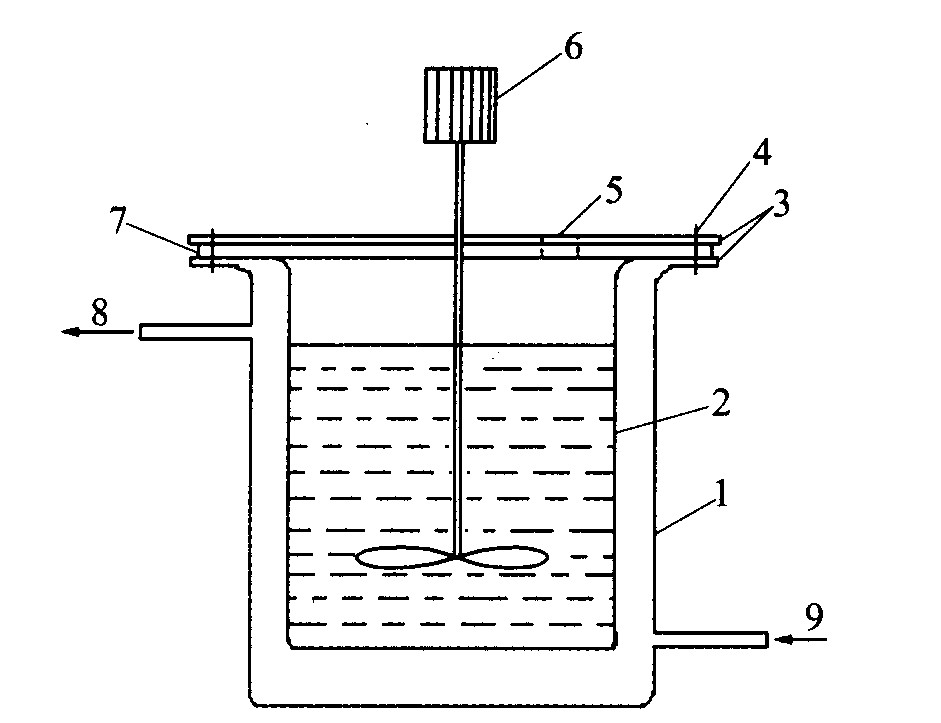
实验是在带水套的316L不锈钢间歇式反应槽中进行的, 反应槽的有效容积为1 L, 槽中心装有一个带有三叶片的搅拌装置, 槽内壁上有两个折流挡板, 以强化搅拌效果。 槽上部的密封盖板上有可封闭的加样、 取样孔, 如图1所示。 采用上海光学仪器厂生产的外循环式恒温水浴槽控温, 控温精度为0.5 ℃; 粒度测试采用Mastersizer2000型激光粒度分析仪; 采用日本JEOL JSM-5600LV型扫描电镜分析产品形貌。 铝酸钠 (钾) 溶液采用分析纯的NaOH (KOH) 和含量为99.5%的纯铝片配制。 称量好纯铝片和NaOH (KOH) , 将NaOH (KOH) 先在装有一定量蒸馏水的不锈钢容器中溶解, 之后缓慢加入处理过的铝片进行溶解, 然后过滤稀释到所需要的浓度。 再次过滤后的干净溶液放置到循环槽中
图1 种分反应器
Fig.1 Reactor for seed precipitation 1—Outer sleeve; 2—Inner couette; 3—Preform for sealing; 4—Clamping bolt; 5—Sampling aperture; 6—Stirring device; 7—Sheet gasket; 8—Outlet; 9—Inlet
预热, 达到预定温度后加入晶种, 反应开始。 定时取样, 试样离心, 清液做溶液分析; 固体样品用热水洗涤后离心, 重复3次, 之后再用蒸馏水浸泡着, 用以做粒度分析。 固体样品不能采用过滤后烘干再进行粒度分析的方法, 因为在过滤和烘干过程会使得一些细小的粒子损失, 而使实验结果失去真实性。
实验模拟工业生产条件: αk值分别为1.45、 1.55、 1.65, c (OH-) =5.16 mol/L, t=52.5 ℃, 溶液体积600 mL。 晶种来自平果铝业公司, 添加量为200 g。 为方便起见, 铝酸钠和铝酸钾溶液中Na2O和K2O的浓度都用[OH-]浓度表示, 这样, 两种溶液的苛性比仍然采用αk ( OH-与Al2O3的摩尔比) 表示。
2 结果与讨论
2.1 种分过程的分解率
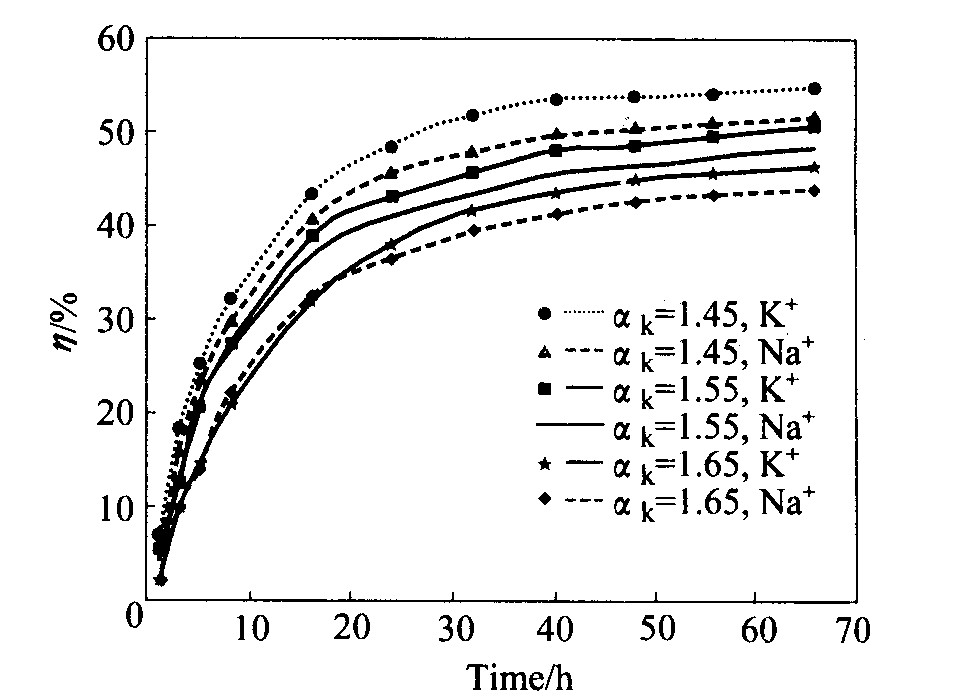
实验研究了在不同αk值条件下, 铝酸钠和铝酸钾溶液种分过程分解率的变化规律, 如图2所示。 从图2可以看出, 随着αk值的降低, 铝酸钠和铝酸钾溶液的分解率均升高, 这同文献报道的结果一致; 在相同的分解条件下, 铝酸钾溶液的分解率都比铝酸钠溶液的大; 而且随着αk值的降低, 分解率的差别变大; 显然, 铝酸钠和铝酸钾分解率的差异同碱金属离子的作用有关。 为此我们还分析了分解过程粒度分布的变化规律。
2.2 种分产品的粒度分布
图3所示为αk=1.65的铝酸钠和铝酸钾溶液在种分过程中晶体的粒度分布图。 图3 (a) 所示为分
图2 分解率与时间的关系
Fig.2 Relation of precipitation rate to time
解3 h时的粒度分布曲线, 可以看到铝酸钠和铝酸钾溶液的PSD曲线基本重合。 图3 (b) 所示为分解8 h时粒度分布曲线, 在小于56.368 μm处, 铝酸钠溶液的曲线还处于铝酸钾的上方, 曲线的其它部分基本也是重叠的。 图3 (c) 所示为分解达到16 h时的粒度分布曲线, 可以看出, 铝酸钠和铝酸钾溶液的PSD开始出现显著的差别, 铝酸钾溶液的粒度分布曲线在粒径小于44.774 μm处开始出现一个突起峰; 而在44.774~126.19 μm处, 铝酸钠溶液的粒度分布曲线始终处于铝酸钾的曲线上方, 在大于126.19 μm的范围内, 两条曲线基本重叠。 到分解后期, 差异越加明显, 如图3 (d) 所示。 铝酸钠和铝酸钾溶液在粒度分布变化上的这些差异, 主要是由于铝酸钠和铝酸钾溶液的成核差异引起的。 在分解初期, 铝酸钾溶液所产生的晶核量远大于铝酸钠溶液, 但由于它们所占的体积非常小, 因此在粒度分布图上无法明显地表现出来; 随着分解过程的进行, 铝酸钾溶液中大量的细晶核逐渐长大, 它们已可以明显影响晶体的粒度分布, 因此在分解到一定时间后, 就可以在粒度分布图上明显看到两种溶液中颗粒粒度分布变化的差异。 同时, 这些差异也可以从它们的平均粒径的变化上非常直观地看出, 如表1所示。
有文献认为
图3 铝酸钠和铝酸钾种分过程晶体的粒度分布
Fig.3 PSD of crystal of seeded precipitation of sodium aluminate and potassium aluminate solutions (t=52.5 ℃, c (OH-) =5.16 mol/L, αk=1.65) 1—Potassium aluminate; 2—Sodium aluminate; (a) —3 h; (b) —8 h; (c) —16 h; (d) —40 h
表1 铝酸钠和铝酸钾种分过程中颗粒平均粒径的比较
Table 1 Comparison of mean diameter ofparticle in seeded precipitation ofsodium and potassium aluminate solutions
| Time | Volume mean diameter D/μm | |
| Sodium aluminate solution | Potassium aluminate solution | |
| 0 h | 103.01 | 103.01 |
| 3 h | 101.906 | 101.898 |
| 8 h | 99.648 | 99.654 |
| 16 h | 98.465 | 94.516 |
| 24 h | 96.848 | 92.839 |
| 40 h | 95.296 | 89.13 |
2.3种分产品的SEM、 XRD及TG/DTG分析
图4所示为铝酸钠和铝酸钾溶液分解产品的扫描电镜照片, 可以看到铝酸钾溶液分解产品中含有大量的小颗粒, 而铝酸钠的分解产品中的细颗粒则要少得多, 这同它们的粒度分布结果是十分吻合的。
从分解产品的X射线衍射谱中, 我们可以发现, 虽然两种溶液的分解产品都是Al (OH) 3, 但是在铝酸钾溶液分解过程中, 晶体的结晶度要比其在铝酸钠溶液中的完整, 如图5所示。
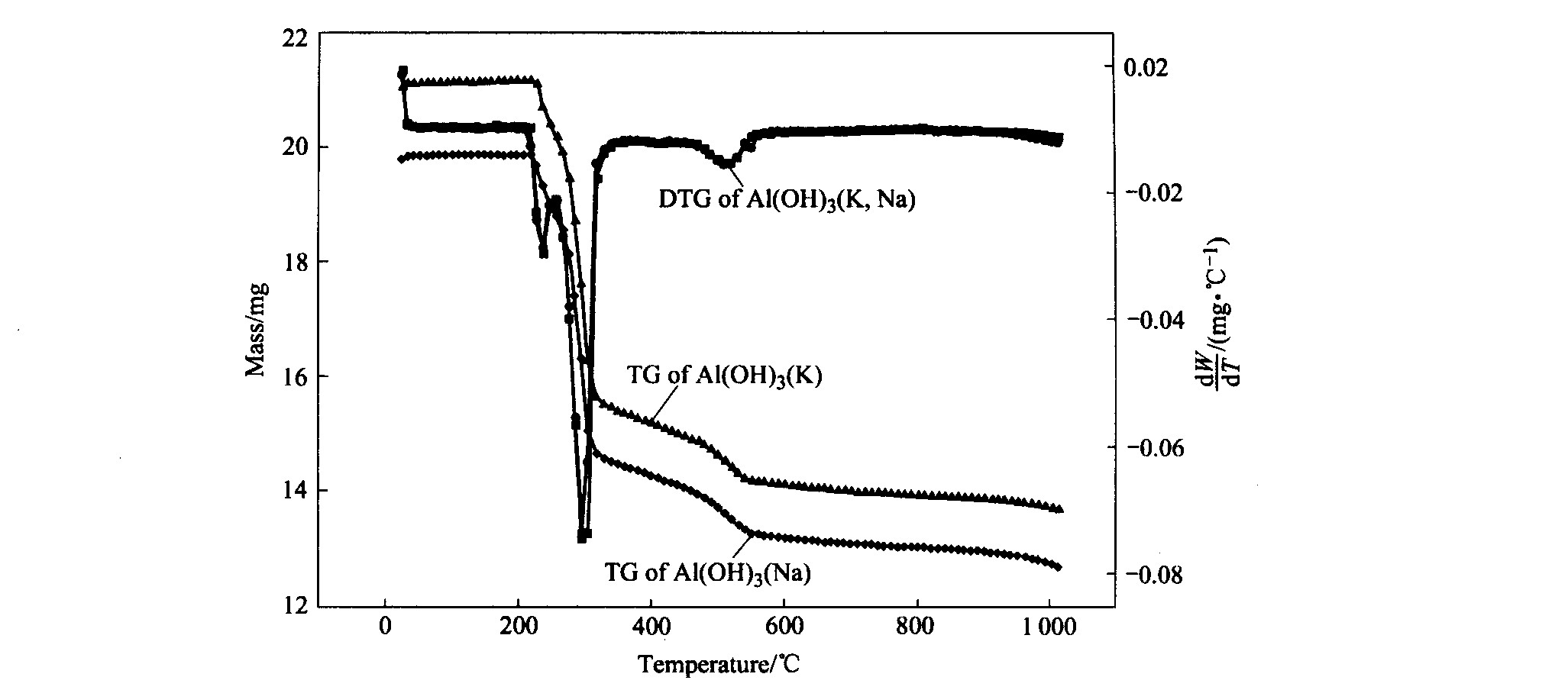
对这两种分解产品做热重分析, 没有发现它们在热分解过程中有明显差别, 如图6所示。
图4 铝酸钠和铝酸钾溶液种分产品的电镜照片
Fig.4 SEM photographs of products of seeded precipitation of sodium aluminate and potassium aluminate solutions
图5 铝酸钠和铝酸钾溶液种分产品的X射线衍射谱
Fig.5 XRD patterns of product of seeded precipitation of sodium and potassium aluminate solutions (a) —Potassium aluminate solution; (b) —Sodium aluminate solution
图6 铝酸钠和铝酸钾溶液种分种过程晶体的热重分析曲线
Fig.6 TG/DTG curves of crystal for seeded precipitation of sodium and potassium aluminate solutions
3 结论
在铝酸钠和铝酸钾的种分过程中, 相同的分解条件下, 两种溶液的分解率、 颗粒的粒度分布及分解产品的XRD和SEM上都表现出一定的差异, 但产品的TG/DTG曲线则没有明显的差异; 在种分过程中, 由于铝酸钾比铝酸钠溶液产生了更为大量的晶核, 导致了它们在种分过程中粒度分布的显著差异; 同时铝酸钾溶液中的大量细粒子具有多的活性中心和大的比表面积, 从而导致了铝酸钾溶液的分解率大于铝酸钠溶液。
参考文献
[2] KingWR.Somestudiesinaluminatrihydrateprecipitationkinetics[J].LightMetals, 1973:551563.
[3] BrownN.Secondarynucleationofaluminiumtrihydroxide Kineticsmechanism[J].LightMetals, 1977:14.
[4] MisraC, WhiteET.CrystallizationofBayeraluminiumtrihydroxide[J].JCrystalGrowth, 1971, 8:172178.