稀有金属2009年第4期
无载体铂钌合金催化水解硼氢化钠的研究
杨民力 蒋文全
北京有色金属研究总院分析测试研究所
摘 要:
研究了无载体铂钌合金所催化的硼氢化钠水解。试验结果表明, 采用葡聚糖dextran为软模板所制备催化剂的催化产氢活性呈现出如下顺序:Pt33Ru67>Pt63Ru37>Ru>Pt76Ru24>>Pt。铂钌的原子比例影响着合金的晶体结构和晶粒尺寸, 进而成为引起所制备催化剂活性变化的主要因素。本研究试验条件下, 合金Pt33Ru67催化水解硼氢化钠的平均产氢速率为1.96 L (H2) min-1.g-1, 氢气产率达到了98.2%。
关键词:
硼氢化钠 ;催化水解 ;铂 ;钌 ;
中图分类号: O643.3
作者简介: 蒋文全 (E-mail:jiangwenquan@grinm.com) ;
收稿日期: 2008-10-15
基金: 国家工艺性行业科研专项项目 (2008424742) 资助;
Sodium Borohydride Hydrolysis Catalyzed by Supportless Platinum-Ruthenium Alloys
Abstract:
Preparation and catalytic activity of supportless platinum, ruthenium and their alloys for the hydrolysis of sodium borohydride were studied.Catalysts were synthesized with dextran as soft template.Their activity on hydrogen generation rate decreased in the following order Pt33Ru67>Pt63Ru37>Ru>Pt76Ru24> >Pt.The atom ratio of Pt to Ru influenced crystal structures and average particle size of the catalysts and resulted in catalytic activity change.Under the experimental conditions, the average hydrogen generation rate for Pt33Ru67 was 1.96 L (H2) min-1 · g-1, and the hydrogen yield reached to 98.2%.
Keyword:
sodium borohydride;catalytic hydrolysis;platinum;ruthenium;
Received: 2008-10-15
硼氢化钠, 作为一种优良的氢能源化合物, 已吸引了越来越多科研工作者的研究兴趣。 含氢密度高 (理论含量10.9%) 、 碱性水溶液的良好化学稳定性及其可控的催化剂释氢
[1 ,2 ]
, 是硼氢化钠作为氢载体的优势所在。 目前, 硼氢化钠在新能源领域的应用可以分为两类:作为燃料电池中还原性物质的直接电化学氧化和其碱性水溶液的催化水解释氢
[3 ]
。 虽然直接电化学氧化是硼氢化钠应用于燃料电池的一个最近的研究方向, 但其碱性水溶液的催化水解释氢可与目前质子交换膜燃料电池技术的良好衔接 (所产氢纯度高、 可含适度水蒸汽而非常适于作为质子交换膜燃料电池的氢源) , 使得催化水解释氢依然占据着其在新能源应用研究中的中心地位。
高稳定性的硼氢化钠碱性溶液, 可以通过加入催化剂而实现可控释氢。 在目前的催化剂研究中, 虽然已有一些非贵金属催化剂的报道, 但得到关注最多的仍然是铂
[4 ,5 ,6 ]
, 钌
[7 ,8 ,9 ,10 ]
, 和铂钌合金
[11 ]
, 这些有效催化成分均负载于不同载体之上, 如阴离子树脂、 碳、 三氧化二铝、 钴酸锂、 二氧化钛等。 需要指出的是, 对于Pt, Ru, PtRu合金的催化性能之优劣, 不同的作者根据各自工作得出了不同的结论, 如Krishnan等
[11 ]
认为以LiCoO2 为载体时催化活性顺序是PtRu>Ru>Pt, PtRu中Pt和Ru的原子分数分别为48.57%和51.43%, 并且推断Pt, Ru之间存在协同作用, 但Simagina等
[12 ]
采用TiO2 和Al2 O3 为载体, 得出的结论是Pt与Ru催化性能接近, Demirci和Garin
[13 ]
同样使用TiO2 作载体, 得到的结果却是Ru?Ru2 Pt1 >RuPt?Ru1 Pt2 >Pt。 这些文献中不相一致的研究结果促使了本工作的开展, 为了排除不同载体可能带来的复杂性, 本文采用葡聚糖dextran为软模板
[14 ,15 ,16 ]
制备了无载体Pt, Ru, PtRu催化剂, 对其催化水解硼氢化钠碱性溶液的性能进行了初步研究。
1 实 验
1.1 催化剂的制备
H2 PtCl6 ·6H2 O, NaOH和NaBH4 购自北京化学试剂公司, RuCl3 ·n H2 O购自北京贵研铂业股份有限公司, Dextran (Mr70000) 为Pharmacia公司产品, 所用试剂均为分析纯。 将预制备催化剂的酸或盐溶解在去离子水中, 搅拌加入一定量的dextran, 形成粘稠的液体, 再超声振荡15 min使之进一步混合均匀, 所得到溶胶在室温下静置24 h以上, 直至形成凝胶, 然后将此凝胶置于马弗炉中 (升温速度2~3 ℃·min-1 ) , 于600 ℃下煅烧1 h, 最后在氢气气氛中处理0.5 h (温度为350 ℃, 氢气流速为30 ml·min-1 ) 得到最终催化剂。
所制备的3种PtRu合金的理论原子比形式分别为Pt0.33 Ru0.67 , Pt0.62 Ru0.38 , Pt0.72 Ru0.28 。
1.2 催化剂的表征
采用荷兰PANalytical的X射线仪对样品的物相进行分析。 测试条件为, Cu Kα辐射, 石墨单色器, 40 kV管压, 40 mA管流。 采用JSM-840扫描电镜对催化剂的表面进行形貌观察和能谱分析。
1.3 硼氢化钠水溶液的催化水解实验
将预先润湿的催化剂 (20 mg) 置于三口瓶中, 在室温25 ℃下, 加入15 ml NaBH4 溶液 (质量分数为: 1%NaBH4 , 3%NaOH, 96%H2 O) , 用排水集气法收集反应生成的氢气, 测量氢气产生速率和产氢量。
2 结果与讨论
2.1 催化剂的组成分析和SEM表征
首先, 用扫描电镜考察了所制备无载体催化剂的微观形貌。 图1是Pt, Ru和3种PtRu合金催化剂的扫描电镜图, 从图中可以看出, Ru呈片状而Pt为多孔网状, 3种PtRu合金呈现为Pt和Ru的混合形貌。 扫描电镜的能谱分析表明, 3种PtRu合金中的Pt, Ru质量比分别为1∶1 (图1 (b) ) , 3.3∶1 (图1 (c) ) 和6∶1 (图1 (d) ) , 其原子比形式则为Pt33 Ru67 , Pt63 Ru37 和Pt76 Ru24 , 与其理论原子比Pt0.33 Ru0.67 , Pt0.62 Ru0.38 和Pt0.72 Ru0.28 相比较, 可以认为在计算误差范围 (±4%) 内Pt和Ru完全形成了合金。
2.2 催化剂的XRD分析
图2是所制备5种催化剂的XRD图。 金属Pt在39.8°, 46.3°, 67.5°和81.3°处出现了相应的 (111) , (200) , (220) 和 (311) 晶面特征衍射峰 (图2中 (1) 线) , 表明其为完好的面心立方结构。 图2 (2) 线是所制备金属Ru的XRD图, 可观察到38.4°, 42.1°, 44.0°, 58.3°, 69.4°和78.3°处的衍射峰, 此为六方密堆结构金属Ru 中 (100) , (002) , (101) , (102) , (110) 和 (103) 晶面的特征峰。 图2 (4) 和图2 (5) 线分别是Pt63 Ru37 和Pt76 Ru24 的XRD图谱, 从中可以看到向更高角度正移的 (111) , (200) , (220) 和 (311) 的晶面衍射峰, 表明得到的是面心立方结构的富Pt 的PtRu合金, 同时, 44.0°附近的 (101) 微弱衍射峰也显示了富Ru 的六方密堆结构PtRu合金的存在。 最为突出的是Pt33 Ru67 的XRD图谱, 对应于 (111) , (200) , (220) 和 (311) 晶面的4个衍射峰除正移之外均发生了非常显著的宽化和弱化, 在43.7°处出现的六方密堆结构的 (101) 面衍射峰亦有宽化, 反映了具有面心立方和六方密堆两种结构的Pt33 Ru67 合金的晶粒细化。
图1 Pt, Ru, PtRu的扫描电镜图Fig.1 SEM images of Pt, Ru, PtRu
(a) Ru; (b) Pt33 Ru67 ; (c) Pt63 Ru37 ; (d) Pt76 Ru24 ; (e) Pt catalysts
2.3 硼氢化钠水溶液的催化水解
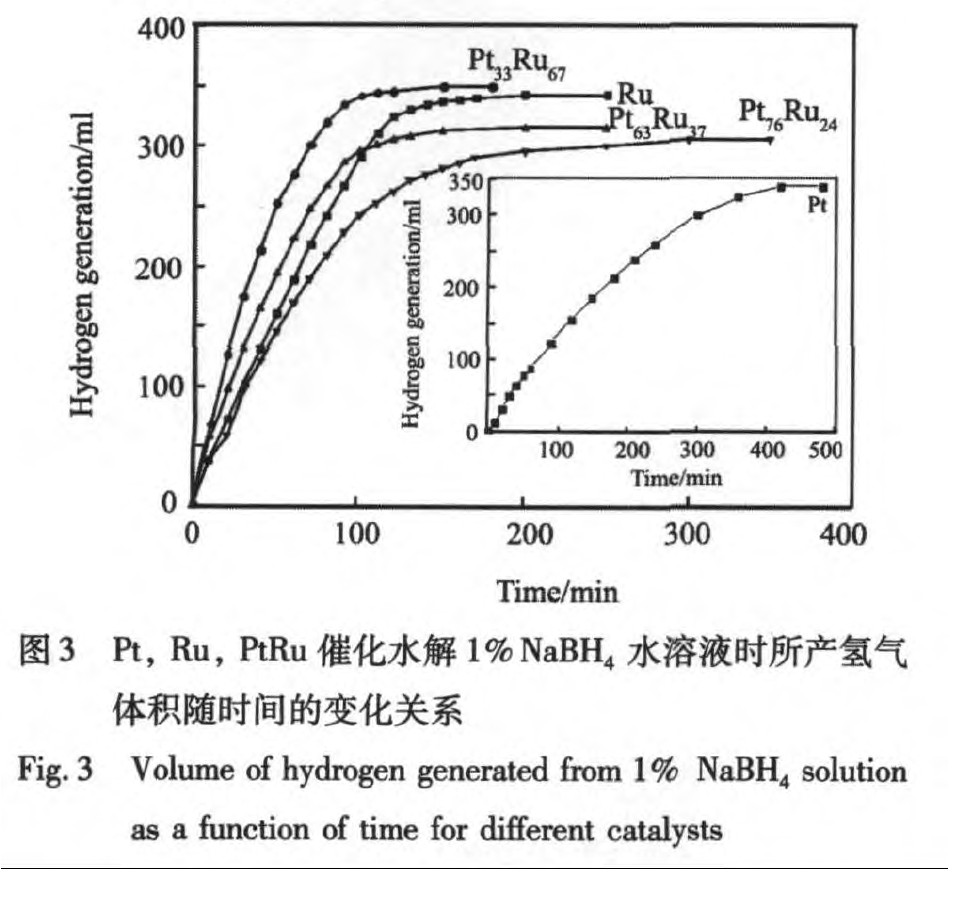
为了了解所制备催化剂对硼氢化钠碱性溶液的催化水解效果, 在室温25 ℃下, 我们采用排水集气法测量了1%NaBH4 的水解产氢速率和产氢量。 图3是催化剂作用下NaBH4 的水解产氢量 (已扣除水蒸气的影响) 随时间的变化曲线, 从图中可以定性地看出, 与Pt催化剂相比, Ru和含Ru合金催化的NaBH4 水解产氢具有更快速的产氢速率。
为了定量地比较所制备催化剂对NaBH4 的水解的催化活性, 选取图3各曲线中拐点以前的数据点进行了线性拟合, 根据拟合所得斜率, 计算得到5种催化剂作用下NaBH4 水解产氢的平均速率 (表1) 。
表1所制备催化剂作用下的硼氢化钠水解的平均产氢速率比较
Table 1 Comparison of the average hydrogen generation rates for the prepared catalysts
Catalysts
Ru
Pt33 Ru67
Pt63 Ru37
Pt76 Ru24
Pt
2 ) ·min-1 ·g-1 ) 1.36
1.96
1.54
1.20
0.05
数据表明, 在5种催化剂中金属Pt的催化活性最低, 这与文献
[
11 ,
13 ]
中的结论相一致, 但Ru以及3种PtRu合金催化活性之间的比较却显示了与文献不尽相同的结果。 Krishnan等
[11 ]
认为协同作用的存在使得在催化活性上PtRu>Ru, 其中Pt和Ru分别为 (原子分数) 48.57%和51.43%, 所使用载体为LiCoO2 ; 而Demirci和Garin
[13 ]
所做的以TiO2 为载体的实验得出了相反的结论, 催化活性顺序是Ru?Ru2 Pt1 >RuPt?Ru1 Pt2 , 并且认为Pt和Ru不存在协同作用, 应该指出的是此工作中所表述的Pt和Ru的原子比仅是理论上比例。 我们认为, 上述文献中相互矛盾的结论可能部分由于不同载体的效果, 另外, 合金的组成和结构也有着很重要的影响。 本文的研究结果显示, 无载体铂钌合金催化剂的活性顺序为Pt33 Ru67 >Pt63 Ru37 >Ru>Pt76 Ru24 , 表明合金中Pt和Ru的原子比是影响其催化活性的一个主要因素。 催化活性上Pt33 Ru67 >Pt63 Ru37 >Ru, 说明Pt和Ru存在着协同作用, 但Ru>Pt76 Ru24 也同时表明此协同效应的产生受Pt与Ru原子比例的影响。 结合XRD图谱分析, Pt和Ru原子比例影响着晶体结构和晶粒尺寸, 在3种合金中, 表现出最高催化活性的Pt33 Ru67 同时含有面心立方和六方密堆两种结构而且具有最小的平均晶粒尺寸, 昭示了从晶体结构和尺寸角度阐释合金催化剂性能的必要性。 另外, 在本试验条件下, 合金Pt33 Ru67 催化水解硼氢化钠的平均产氢速率为1.96 L (H2 ) ·min-1 ·g-1 , 氢气产率达到了98.2%, 显示了无载体催化剂的良好性能和开发潜力。
3 结 论
本工作研究了无载体铂、 钌及其合金对NaBH4 水解的催化活性。 从平均产氢速率看, 催化活性顺序为Pt33 Ru67 >Pt63 Ru37 >Ru>Pt76 Ru24 >>Pt。 无载体合金Pt33 Ru67 催化水解硼氢化钠的平均产氢速率为1.96 L (H2 ) ·min-1 ·g-1 , 氢气产率达到了98.2%。 与金属Pt和Ru相比, 铂钌合金对NaBH4 水解的更高催化活性反映了Pt和Ru之间存在着一定的协同作用, 但这种作用受合金中Pt与Ru原子比例的影响。 Pt和Ru原子比例影响着晶粒尺寸, 小晶粒尺寸合金显示了高催化活性。
参考文献
[1] Amendola S C, Sharp-Goldman S L, Janjua MS, Spencer N C, Kelly MT, Petillo P J, Binder M.A safe, portable, hydrogengas generator using aqueous borohydride solution and Ru catalyst[J].International Journal of Hydrogen Energy, 2000, 25 (10) :969.
[2] Kojima Y, Suzuki K I, Fukumoto K, Kawai Y, Kimbara M, Na-kanishi H, Matsumoto S.Development of10 kW-scale hydrogengenerator using chemical hydride[J].Journal of Power Sources, 2004, 125 (1) :22.
[3] Wee J H.Acomparison of sodium borohydride as a fuel for pro-ton exchange membrane fuel cells and for direct borohydride fuelcells[J].Journal of Power Sources, 2006, 155 (2) :329.
[4] Kojima Y, Suzuki K, Fukumoto K, Sasaki M, Yamamoto T, Kawai Y, Hayashi H.Hydrogen generation using sodium boro-hydride solution and metal catalyst coated on metal oxide[J].In-ternational Journal of Hydrogen Energy, 2002, 27 (10) :1029.
[5] Wu C, Zhang HM, Yi B L.Hydrogen generation fromcatalytichydrolysis of sodium borohydride for proton exchange membranefuel cells[J].Catalysis Today, 2004, 93-95:477.
[6] Demirci UB, Garin F.Pt catalysed hydrogen generation by hy-drolysis of sodium tetrahydroborate[J].International Journal ofGreen Energy, 2008, 5 (3) :148.
[7] 王涛, 张熙贵, 李巨峰, 钦佩, 夏保佳.硼氢化钠水解制氢的研究[J].燃料化学学报, 2004, 32 (6) :723.
[8] Amendola S C, Sharp-Goldman S L, Janjua M S, Kelly M T, Petillo P J, Binder M.An ultrasafe hydrogen generator:aque-ous, alkaline borohydride solutions and Ru catalyst[J].Journalof Power Sources, 2000, 85 (2) :186.
[9] Demirci UB, Garin F.Kinetics of Ru-promoted sulphated zir-conia catalysed hydrogen generation by hydrolysis of sodium tetra-hydroborate[J].Journal of Molecular Catalysis a-Chemical, 2008, 27, 9 (1) :57.
[10] Zahmakiran M, Ozkar S.Intrazeolite ruthenium (0) nanoclus-ters:a superb catalyst for the hydrogenation of benzene and thehydrolysis of sodium borohydride[J].Langmuir, 2008, 24:7065.
[11] Krishnan P, Yang TH, Lee W Y, Kim C S.PtRu-LiCoO2-anefficient catalyst for hydrogen generation from sodium borohydridesolutions[J].Journal of Power Sources, 2005, 143 (1-2) :17.
[12] Simagina V I, Storozhenko P A, Netskina O V, Komova O V, Odegova G V, Samoilenko TY, Gentsler AG.Effect of the na-ture of the active component and support on the activity of cata-lysts for the hydrolysis of sodium borohydride[J].Kinetics andCatalysis, 2007, 48 (1) :168.
[13] Demirci UB, Garin F.Ru-based bimetallic alloys for hydrogengeneration by hydrolysis of sodium tetrahydroborate[J].Journalof Alloys and Compounds, 2008, 463 (1-2) :107.
[14] Gonzalez-McQuire R, Green D, Walsh D, Hall S, Chane-Ching JY, Oreffo R O C, Mann S.Fabrication of hydroxyapatite spon-ges by dextran sulphate/amino acid templating[J].Biomateri-als, 2005, 26 (33) :6652.
[15] Walsh D, Kulak A, Aoki K, Ikoma T, Tanaka J, Mann S.Preparation of higher-order zeolite materials by using dextran tem-plating[J].Angewandte Chemie-International Edition, 2004, 43 (48) :6691.
[16] Walsh D, Arcelli L, Ikoma T, Tanaka J, Mann S.Dextrantemplating for the synthesis of metallic and metal oxide sponges[J].Nature Materials, 2003, 2 (6) :386.