网络首发时间: 2015-04-07 09:25
钪基Laves相合金Sc0.8Zr0.1Y0.1Mn2-xNix(x=0~2.0)的微观结构和储氢性能
兰州理工大学材料科学与工程学院
兰州理工大学有色金属先进加工与再利用省部共建国家重点实验室
摘 要:
用真空电弧熔炼制备AB2型Sc0.8Zr0.1Y0.1Mn2-xNix(x=0~2.0)储氢合金,利用X射线衍射(XRD)和扫描电镜/能谱分析(SEM/EDS)研究了吸氢前后Ni元素替代Mn对Sc Mn2基合金微观结构的影响,用Sievert装置和热重-差热分析仪(TG/DSC)测试了合金的压力-组成-温度(P-C-T)曲线和吸放氢动力学。研究结果表明,合金铸态组织主要由Laves主相和少量Sc Ni及富Y的第二相组成,其中稀土Sc和Y元素易与Ni形成相应的金属间化合物相。随Ni含量x的增加,合金基体的Laves相组织结构由C14型向C15型转变,x=0时,合金组织基本为C14型Laves相单相组织,x=2.0时,合金组织则完全转变为C15型Laves相单相组织。Ni元素替代Mn对合金的气态吸放氢动力学行为和吸氢P-CT曲线影响较大。随Ni含量的增加,合金吸氢动力学与活化性能逐渐变慢,但其放氢温度明显降低,氢化物生成焓减小(-35.05~-18.72k J·mol-1),储氢平台压升高,储氢容量降低;室温时合金最大储氢量达2.18%(质量分数),储氢后其晶格膨胀率ΔV/V为10.63%~27.32%,吸氢前后合金主相仍保持C14型或C15型相结构,并未发生新的氢致相变,亦无氢致非晶化现象。
关键词:
Sc基Laves相合金;Ni元素替代影响;微观结构;储氢性能;
中图分类号: TG139.7
作者简介:王稳(1987-),男,陕西渭南人,硕士研究生,研究方向:储氢合金;E-mail:w497731376@163.com;;罗永春,教授;电话:0931-2974813;E-mail:luoyc@lut.cn;
收稿日期:2014-03-31
基金:国家科技部高技术研究发展计划项目(2011AA03A408)资助;
Microstructure and Hydrogen Storage Properties of Sc-Based Laves Phase Alloys Sc0.8Zr0.1Y0.1Mn2-xNix(x =0~2.0)
Wang Wen Luo Yongchun Qiu Jianping Kang Long
College of Materials Science and Engineering,Lanzhou University of Technology
State Key Laboratory of Advanced Processing and Recycling of Nonferrous Metals,Lanzhou University of Technology
Abstract:
Sc0. 8Zr0. 1Y0. 1Mn2- xNix( x = 0 ~ 2. 0) AB2-type hydrogen storage alloys were prepared by vacuum arc furnace melting. The influences of Ni substitution for Mn on the microstructure and hydrogen storage properties of Sc Mn2-based alloys before and after the hydrogen absorption were investigated by X-ray diffraction( XRD) and scanning electron microscope / energy dispersive spectroscopy( SEM/EDS). Pressure-composition-temperature( P-C-T) curves and kinetics of hydrogen absorption were tested by Sievert type device and thermo gravimetric-differential scanning calorimetry( TG / DSC). The research results showed that the alloys were composed of Laves type main phase and minor Sc Ni phase and Y-rich phase as second phase. The rare earth elements Sc and Y could easily form intermetallic phase with Ni. With the increase of Ni content,the structure of Laves phase changed from C14 type to C15 type. Thereinto,the alloy structure was Laves single-phase of C14-type when the value of x was 0,while it was completely transformed into Laves singlephase of C15-type when the value of x was 2. 0. Substitution of Mn by Ni had a significant effect on the kinetics of hydrogen absorption behavior and the equilibrium pressure of hydrogen absorbing P-C-T curve. As Ni content increased,the hydrogen absorption kinetics and activation performance of the alloys gradually deteriorated and hydrogen absorption storage capacity decreased,but the hydrogen desorption temperature was lowered significantly and the formation enthalpy of hydride reduced significantly(- 35. 05 ~- 18. 72 k J·mol- 1) and the equilibrium pressure of hydrogen absorbing P-C-T rose. Although the maximum hydrogen capacity reached 2. 18%( mass fraction) at room temperature and the lattice expansion rate ΔV/V was 10. 63%~ 27. 32% after hydriding,the main phases of hydrides were still C14 type phase and C15 type phase and the phenomena of phase transition and non-crystallizing were not found.
Keyword:
Sc-based Laves phase alloys; Ni element substitution; microstructure; hydrogen storage properties;
Received: 2014-03-31
AB2型Laves相储氢合金由于具有较高储氢容量和较好的电化学循环稳定性,是重要的储氢和镍氢电池负极材料[1,2,3,4]。迄今已研究的AB2型Laves相储氢合金主要有Zr基和Ti基合金,但这类合金在储氢量、抗中毒性以及活化和动力学性能等方面仍有待进一步提高。根据组成储氢合金元素的特性,制备新型合金是改善合金储氢性能的有效途径。
Sc是最轻的过渡族稀土元素 ( 3. 0 g·cm- 3) , 具有与钇( Y) 和镧( La) 等稀土元素类似的化学性质,在远低于0. 1 MPa的氢压下可与氢发生反应, 形成具有fcc型晶体结构的二元氢化物Sc H2( 氢气的质量分数为4. 3% )[5]。早期对Sc基金属间化合物及其储氢和电化学性能研究表明[6,7,8],Sc与一些过渡族金属( Fe,Ni,Co,Cr ,Mn等) 可形成Sc基AB2型Laves相[9],B端过渡族元素对Sc基AB2型合金的储氢特性影响较大,其中Sc M2( M = Ni,Co,Fe) 具有可逆吸放氢容量较高 ( 1. 22% ~ 1. 88% ,质量分数) 、无氢致非晶化倾向以及适宜的氢化物生成焓( - 16 ~- 30 k J·mol- 1) 等性能。最近Angstrom等[10]对( Sc1 - xZrx) ( Co1 - yNiy)2合金储氢性能的研究表明,Zr部分替代Sc可增大合金的储氢平台压和改善其放氢动力学,但由于Zr元素的比重较大( 6. 52 g·cm- 3) ,合金储氢容量随Zr的增加而减小。Kumar等[11]采用Ni部分替代Mn,研究了Zr Mn2 - xNix合金的组织和储氢行为,发现随Ni含量增加,合金主相由C14型结构向C15型转变,其放氢动力学明显改善但储氢量下降。近期李武会等[12,13]系统研究了Sc Mn2基合金的储氢性能,研究表明,C14型结构的Sc Mn2和Sc Cr Mn合金具有极优异的活化性能、高的储氢容量和滞后小等特点,其中Sc Mn2合金在298 K和100 k Pa氢压下的储氢量达到2. 41% ( 质量分数) ,合金氢化物生成焓 ΔH为 - 45 k J·mol- 1,储氢后的C14型结构保持不变,其储氢性能优于Sc M2( M = Ni,Co, Fe) 和Zr Mn2合金[7,14]。尽管Sc Mn2型Laves相合金的储氢性能优越,但其氢化物热力学较稳定,放氢条件比较苛刻,因此Sc基Laves相合金的综合储氢性能仍有待进一步提高。Matsumura等[15]通过理论计算和分析后认为,Zr Mn2氢化物的稳定性主要与所储H原子与Mn原子之间高的键合强度有关,通过适当的元素替代和合金化可调节Zr - Mn, Mn - Mn和Mn - H之间的键合强度,从而能改善合金的储氢性能。Zr和Y是典型AB2型合金中A端位置的吸氢 元素[16,17,18,19],为了研究改 善Sc基Laves相合金的储氢和电化学性能,本文通过在Sc Mn2中掺杂少量Y和Zr元素部分替Sc,用具有电催化活性的Ni替代Mn,系统研究了Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金的微观组织转变规律及其气态储氢性能。
1实验
合金试样按化学计量比Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0,0. 1,0. 3,0. 5,0. 7,1. 0,1. 5,2. 0) 进行配比,所用金属原材料的纯度均大于99. 95% ( 质量分数) ,考虑到高温熔炼时金属Mn有一定的挥发,合金中加入过量Mn。将配比后的试样经抽真空后在氩气保护下用真空电弧炉进行熔炼,为保证成分均匀,合金翻转熔炼4次后在水冷铜模中冷却,制成约30 g重的合金锭。
合金铸态的物相组成和晶体结构采用日本Rigaku D / MAX-2400型X射线衍射仪 ( XRD ) 并结合Jade6. 5软件进行测试与分析。采用Cu Kα 辐射和石墨单色器并除去Kβ,工作电压和电流分别为40 k V和150 m A,阶梯扫描步长为0. 02°( 2θ) ,每步计数时间为2 s,2θ 角范围为15° ~ 90°。用日产JSM-6700F场发射扫 描电镜 ( SEM ) 和能谱仪 ( EDS) 对合金微观组织及物相组成进行分析。合金的吸氢性能在Sieverts型P-C-T装置上进行测试。 先将合金破碎并研磨至粒径在75 ~ 150 μm范围内,取2 g左右的合金粉体样品置于P-C-T装置反应釜中,密闭后充入高纯Ar气进行多次清洗和抽真空,随后再通 入压力为4 MPa的高纯H2( 99. 999% ) 在373 K进行活化,每次吸氢活化后将样品加热到573 K后连续抽真空2 h进行放氢, 待合金完全活化后,再测试合金在氢压力4 MPa和温度分别为287,333和373 K时的吸氢动力学曲线及吸氢P-C-T曲线。完成P-C-T测试后,将合金再次吸氢至饱后取出置于约 - 30 ℃ 的液氮-酒精混合液中保存,之后分别快速进行氢化物XRD和差热/热重( DSC /TG) 热分析测试。热分析测试时采用高纯Ar( 99. 999% ) 对样品清洗5 min,然后在流动高纯Ar保护下以10 K·min- 1的升温速率对氢化物进行放氢性能测试。
2结果与讨论
2.1合金的组织结构
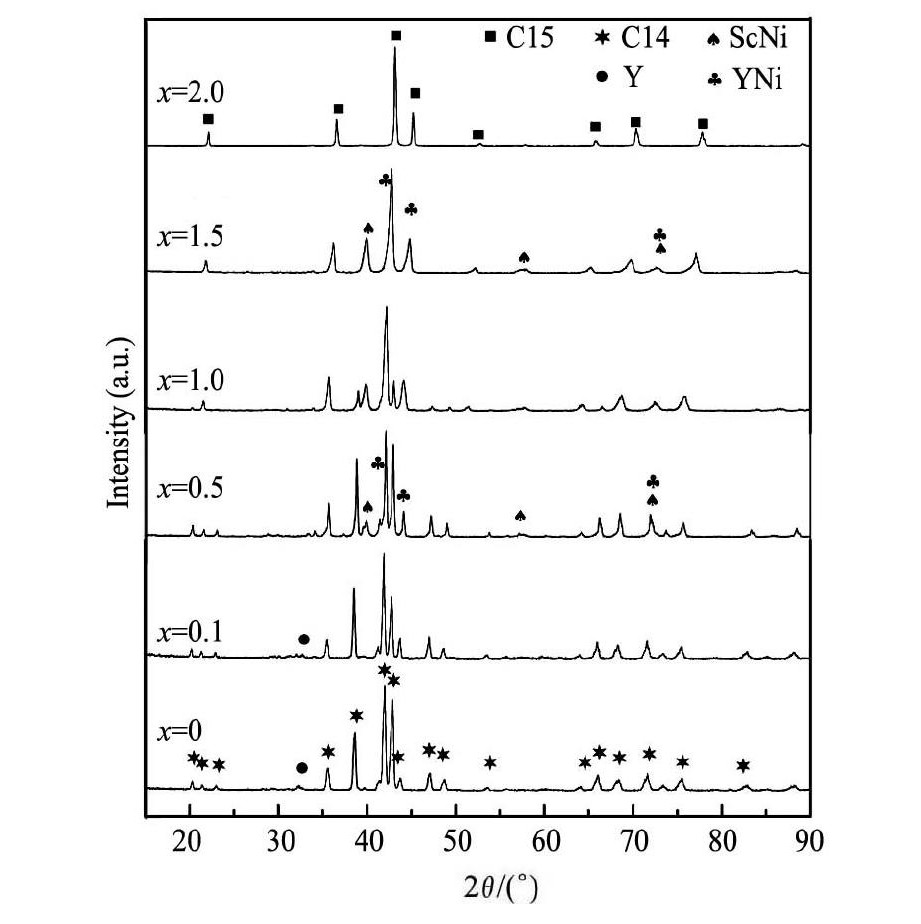
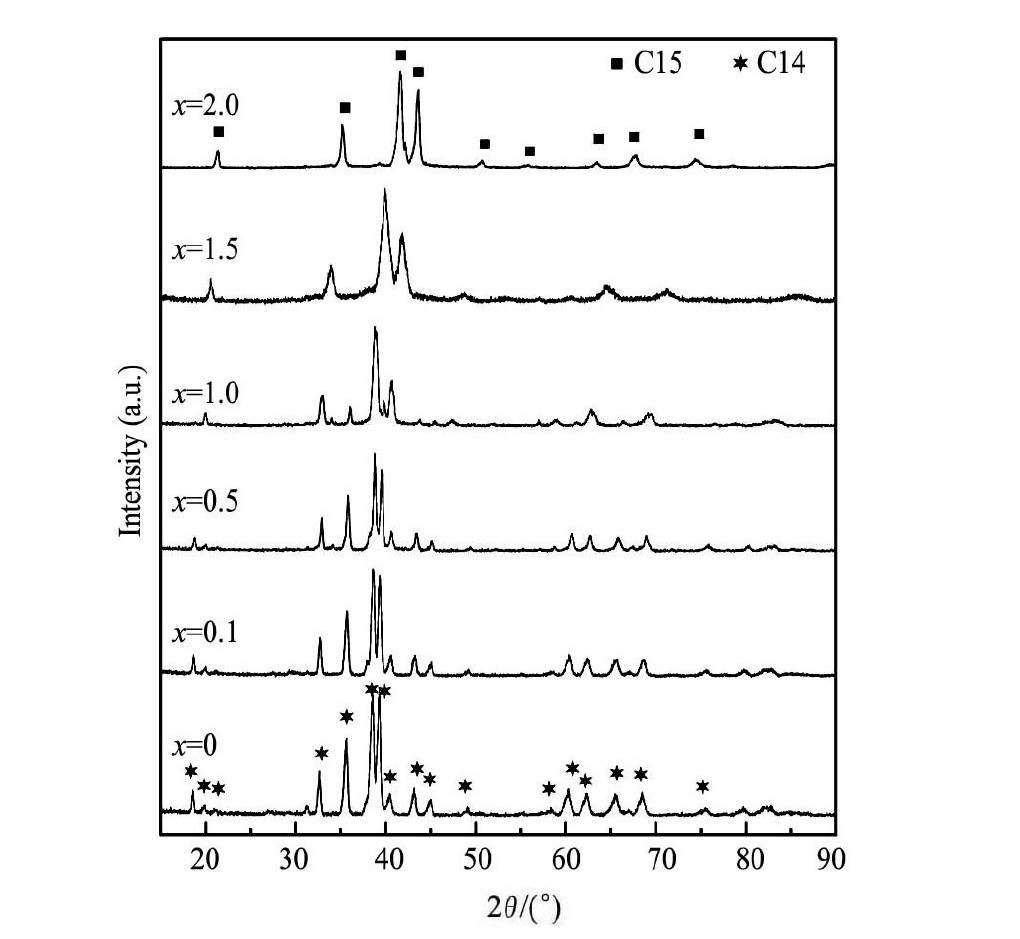
图1为铸态合金Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 的XRD图谱。从图1中可知,当x = 0时, 合金组织基本为C14型Laves相单相组织,随Ni含量x增加,合金主相由C14型相向C15相转变, 同时在XRD图谱中出现了强度较小的未知衍射峰,x = 2. 0时,合金组织基本转变为C15型Laves相单相组织。为了准确描述合金微观组织,本文通过SEM背散射电子图像和EDS能谱分析各物相的成分组成,并结合XRD图谱进一步分析合金的物相和组织结构。
图2是Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金铸态组织的SEM背散射电子( BSE) 图像,其各物相成分组成的EDS能谱分析结果列于表1。由图2和表1可知,当0 ≤x < 0. 5时,合金组织衬度由灰白( α 相区) 和深色( β 相区) 基体相组成,其中少量的白色第二相( γ 相区) 分布在 β 相区基体上。EDS能谱分析结果表明,该灰白和深色基体相组成计量比均为AB2型相,白色的 γ 区则为高度富集稀土Y的未知第二相。当0. 5≤x < 1. 5时,合金主相仍为C14型Laves相,但原富集稀土Y的白色γ 相区此时则转变为YNi相( δ 区) ,其中当x≥1. 0时,除C14型主相和少量YNi相外,还形成了Cs Cl型的Sc Ni相( 深色 η 区) 。由图2可知,随Ni含量x的增加,YNi和Sc Ni相丰度逐步减少; 当x = 1. 5时,合金主相由C14型相转变为C15型相( ε 区) , 此时第二相Sc Ni呈网状分布; 当x = 2. 0时,Sc Ni与YNi基本消失,合金基本呈单一的C15型Laves相组织。
图1 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金的 XRD 图谱 Fig.1XRD patterns of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) alloys
图2 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金铸态组织的 SEM 背散射电子图像 Fig.2 BSE-SEM images of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) alloys
( a) x = 0,( b) x = 0. 1,( c) x = 0. 5,( d) x = 1. 0,( e) x = 1. 5,( f) x = 2. 0 ( α: C14,β: C14,γ: Y-riched,δ: YNi,ε: C15,φ: C15,η: Sc Ni)
表1 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金物相成分的 EDS 分析 Table 1EDS analysis of phase composition for Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys 下载原图
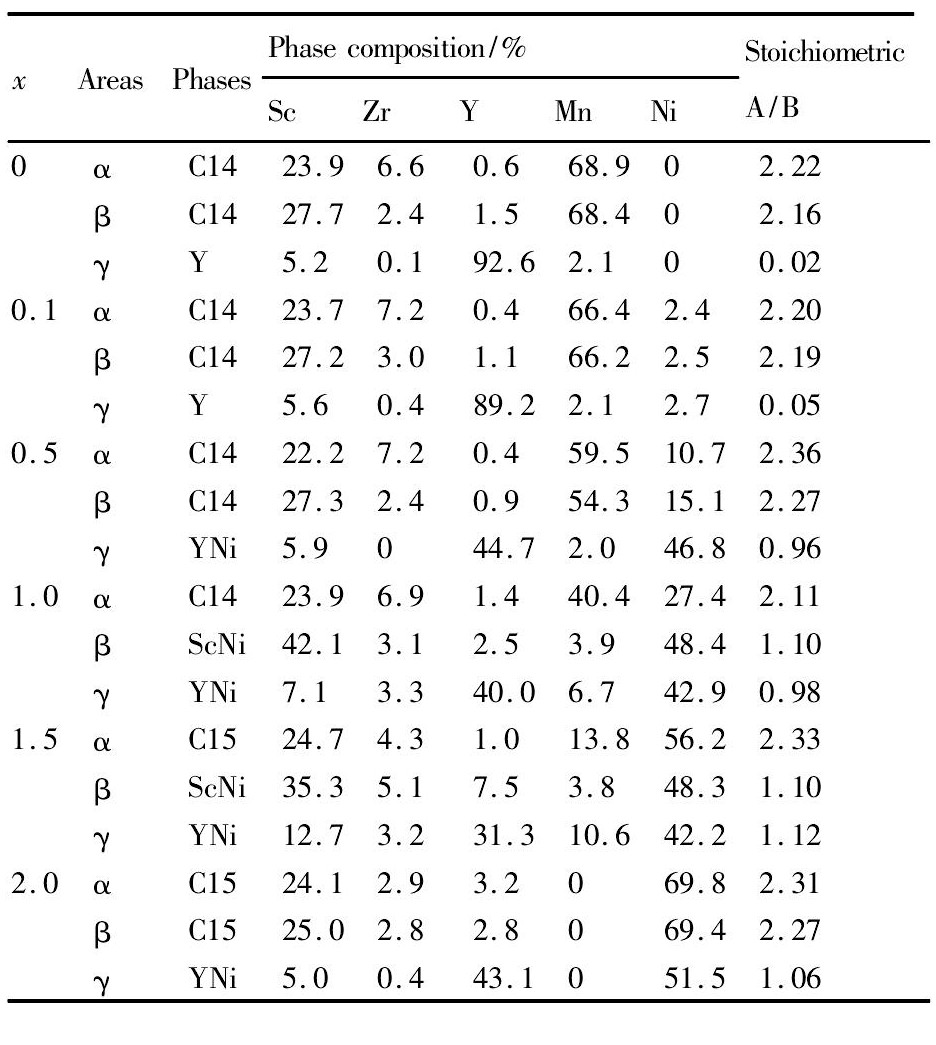
表1 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金物相成分的 EDS 分析 Table 1EDS analysis of phase composition for Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys
结合以上物相组成和成分分析,对XRD图谱进行拟合与计算后得出合金组织中各物相的晶胞参数和相丰度,结果如表2所示。
从表2可知,随替代元素Ni含量x的增加, C14型相丰度逐渐减小,C15型相丰度逐渐增大, 由于Mn的原子半径( rMn= 0. 127 nm) 大于Ni的原子半径( rNi= 0. 124 nm) ,主相C14型或C15型的Laves相晶胞参数均随x的增加而逐渐减小。另一方面,因为金属间化合物Sc Ni和YNi的生成焓分别为 -39和 -31 k J·mol- 1,其值明显比Sc Mn的生成焓 ( -8 k J·mol- 1) 和YMn的生成焓( -1 k J·mol- 1) 数值要负[20],故在相同凝固制备条件下,随Ni含量的增加,合金中Sc和Y更易与Ni形成相应的金属间化合物相。
2.2合金的储氢性能
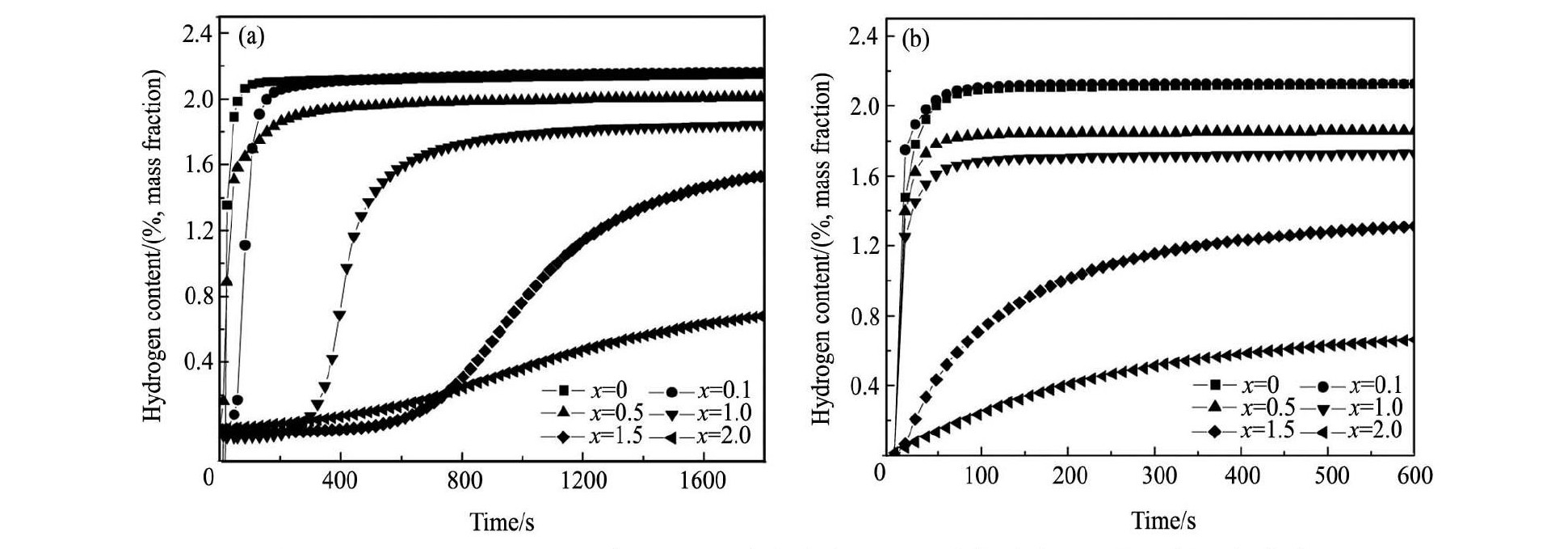
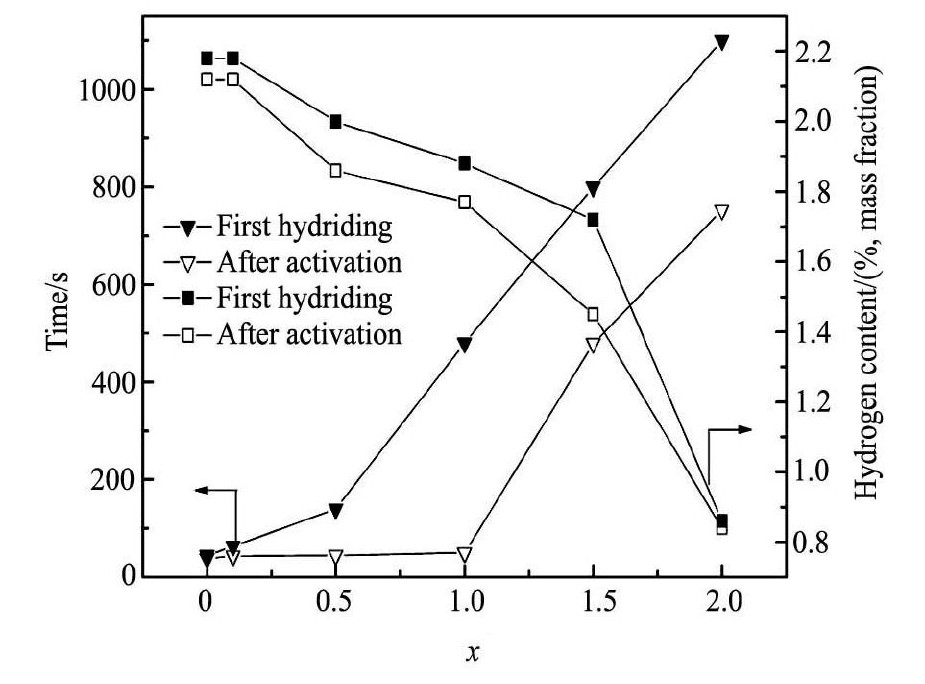
合金吸氢活化时的难易程度是储氢合金性能的重要标志。图3中( a) 和( b) 分别为Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金在298 K时的首次及活化后的吸氢曲线。由图3( a) 可知,当x = 0 ~ 0. 5时,合金首次活化时的吸氢动力学性能良好,经过1次吸放氢即可活化,其中x = 0合金首次吸氢时的最大储氢量达到2. 18% ( 质量分数) ,具有与ScMn2合金相似的优良活化性能[12],当x > 0. 5时, 此时合金首次吸氢时则需要一定的孕育期方才明显吸氢。图3( b) 结果表明,对x < 1. 0合金,经过1 ~ 3次活化后,合金吸氢即达到完全活化,而当x = 1. 5 ~ 2. 0时,合金经6次以上活化后其吸氢性能依然难以达到理想活化状态。可以看出,经活化后合金的最大吸氢容量随Ni含量x的增加而依次减小,其储氢量从x = 0时的2. 18% 减小至x = 2. 0时的0. 87% ( 质量分数) 。众所周知,一般Laves相结构的晶胞中含17个四面体间隙,然而实际合金的Laves相晶胞中却很难储存17个氢原子。理论分析表明,由于氢原子与过渡金属原子之间发生电荷转移,致使氢原子带负电荷而引起氢原子之间的相互排斥,根据Westlake和Switendick提出的合金吸氢几何模型及氢原子占位规则,当氢原子优先占据间隙半径Rh≥0. 04 nm晶位以及合金氢化物结构中H - H原子间距大于0. 21 nm时,这在能量和几何构型上有利于合金的储氢[21,22]。
表2 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金和氢化物结构参数 Table 2 Crystal structure parameters of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys and hydrides 下载原图
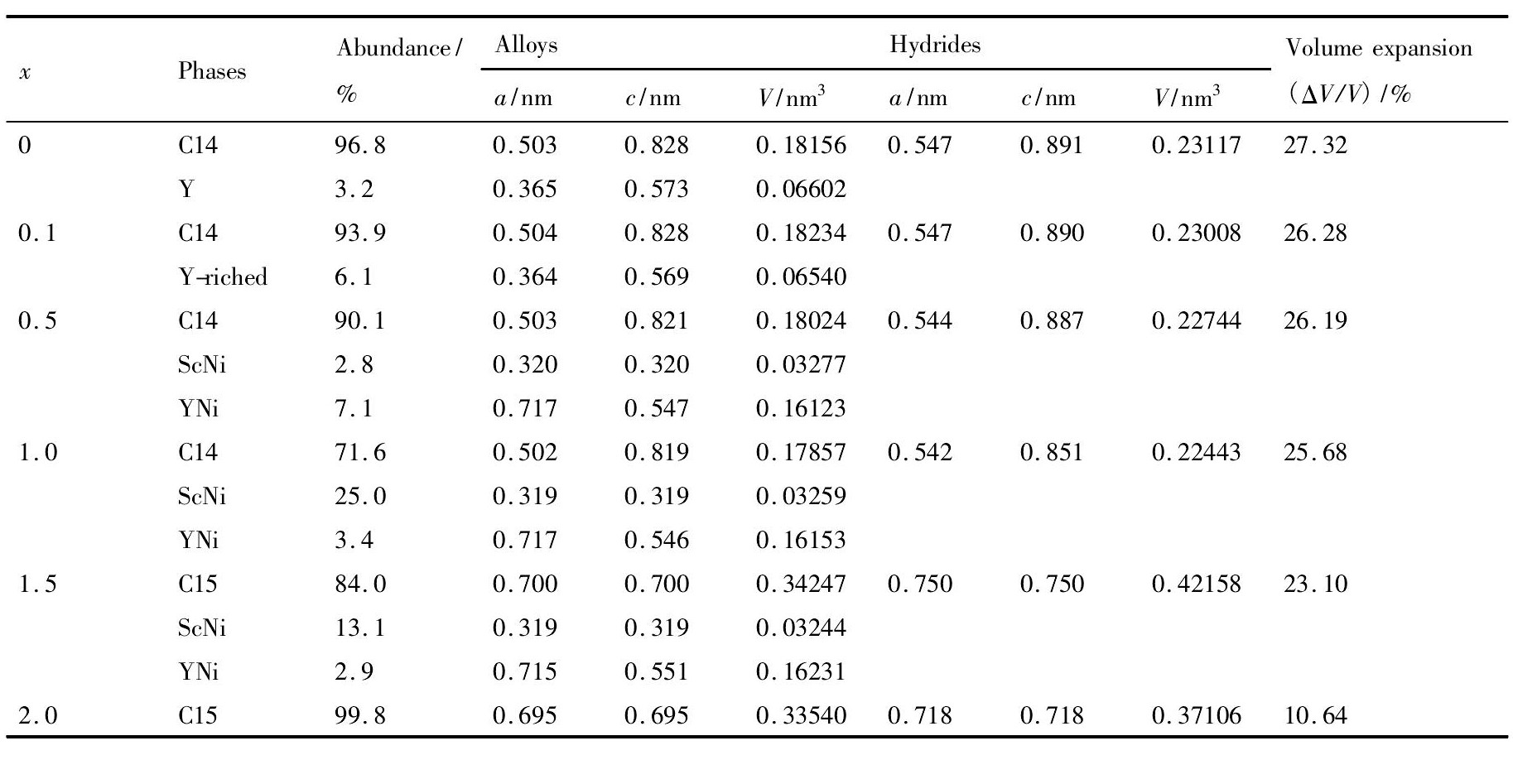
表2 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金和氢化物结构参数 Table 2 Crystal structure parameters of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys and hydrides
由表2可知,由于Mn的原子半径 ( 0. 1363 nm) 大于Ni的原子半径 ( 0. 1246 nm) ,C14型和C15型吸氢主相的晶胞参数和体积随Ni含量x的增加而逐渐减小,致使四面体间隙大小和间隙之间的距离变小,氢原子之间排斥作用增加,最终使易于宿氢的A2B2四面体间隙数量减少,储氢量降低。另一方面,合金吸氢时氢原子的1S轨道主要与过渡金属核外的d电子轨道成键形成很强的共价作用,因而d轨道填充电子数目的增加使这种作用减弱[23,24]。由于Sc,Mn和Ni的核外电子结构分别为[Ar]4S23d1,[Ar]4S23d5和[Ar]4S23d8,可见吸氢元素Sc的d层有大量空轨道,与H化合后可以容纳大量电子,有利于降低体系的电子浓度, 提高氢化物的稳定性,而Mn和Ni的d轨道电子数明显比Sc的多,其中Ni的d轨道电子数比Mn多,因此当用Ni替代Mn后使体系中d层的空轨道减少,导致合金Laves主相氢化物体系的稳定性降低、吸氢量减小以及平台压升高。储氢合金在与氢发应时,其反应过程主要受气相氢分子输运、合金表面物理吸附与解离为H原子、氢原子进入合晶体间隙中形成 α 相以及氢化物 β 相的形核与长大的影响。研究表明,合金储氢时的反应动力学主要与( α + β) 两相区中 β 相的形核和长大过程有关[25,26],根据描述氢化物形核长大的Johnson-Mehl-Avrami( JMA) 动力学方程[27]:ln[- ln( 1 - ζ( t) ) ]= nlnt + nlnk( 1) 式中,ζ( t) 为反应分数,n是Avrami指数,t为反应时间,k为反应速率常数。式( 1) 表明在给定温度下,ln[- ln( 1 - ζ( t) ) ]与lnt之间存在线性关系,斜率为反应级数n,于是有下式:

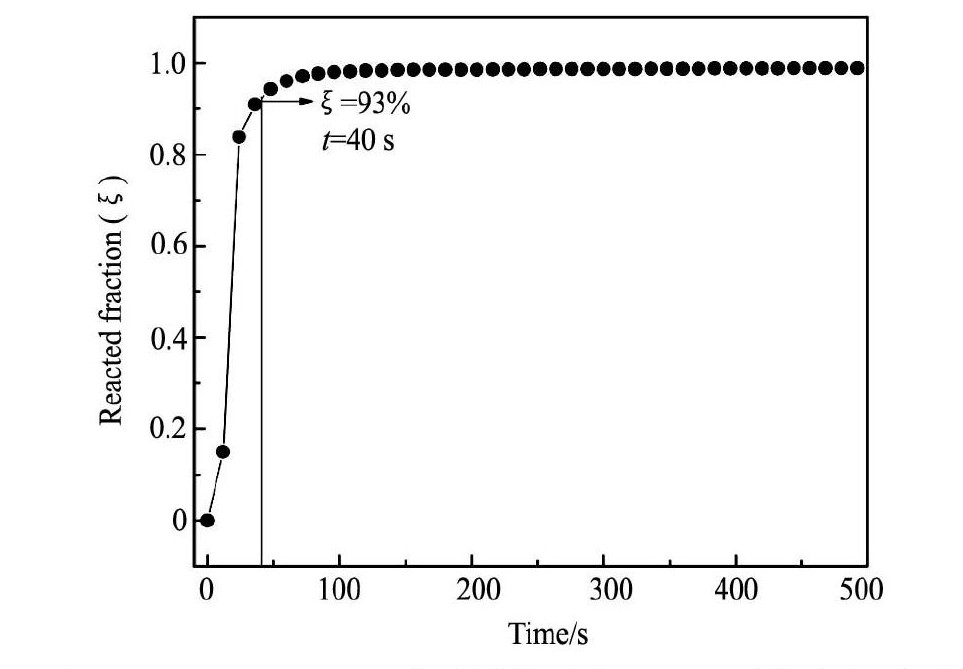
式中,p0是最初给定压力,pt是在时间t时的压强,pe是最终到达平衡时的系统压强。本文采用储氢反应分数 ζ = 93% 时所需时间t93%来表征合金的吸氢速率和动力学,反应时间t93%越小,则储氢速率越大。图4为合金Sc0. 8Zr0. 1Y0. 1Mn2氢化反应分数ζ 与时间t的关系,图5为合金活化前后吸氢量及储氢速率t93%与Ni含量x的关系曲线。由图5可知,Ni元素替代对合金的吸氢量和吸氢动力学行为影响显著,合金在初次吸氢时与活化后的储氢速率均随Ni含量的增加而减小,其中活化后的合金吸氢速率明显得到改善,此时当x≤1. 0时,氢化反应时间t93%为45 ~ 52 s,而x = 1. 5,2. 0时, 其t93%值分别为500和785 s,储氢速率急速减小。
图3 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金在 298 K 时的首次及活化后的吸氢曲线 Fig.3 Curves of first time hydrogen absorption ( a) and activation-induced hydrogen absorption ( b) for Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) alloys at 298 K
图4 Sc0. 8Zr0. 1Y0. 1Mn2合金活化后在 298 K 下的动力学反( ζ) 与时间( t) 的关系曲线 Fig.4 Curves of reacted fraction ( ζ) vs. hydrogen absorption time ( t) for Sc0. 8Zr0. 1Y0. 1Mn2alloy at 298 K
图6是Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金吸氢后的XRD图谱,其吸氢后主相的晶体结构和晶胞参数分析结果如表2所示。可以看出,合金经活化和多次储氢后,其主相仍为C14型或C15型相结构,并未发生新的氢致相变,亦无氢致非晶化现象,此时合金C14型或C15型主相由于吸氢后晶格膨胀其衍射峰向小角度发生偏移。从表2分析和计算结果可知,合金主相氢化后的晶胞体积膨胀率 ΔV/V随Ni含量x的增加逐渐减小,其变化范围在10. 64%~ 27. 32% 之间,x = 0时,Sc0. 8Zr0. 1Y0. 1Mn2氢化物体积膨胀最大( 27. 32% ) ,当Ni完全替代Mn后,合金Sc0. 8Zr0. 1Y0. 1Ni2氢化物体积膨胀最小( 10. 64% ) 。
图5 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金的储氢量及 Ni 含量 x 的关系曲线 Fig.5 Ni content vs. hydrogen storage capacity and hydrogen absorption rate
图6 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金氢化后的 XRD 图谱 Fig.6 XRD patterns of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) alloys after hydriding
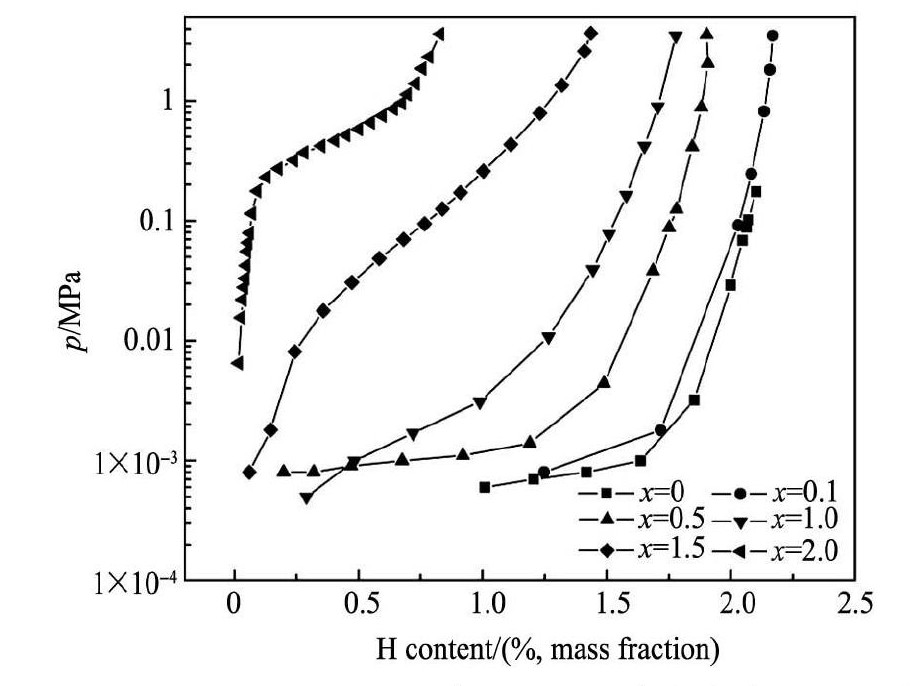
图7为Sc0. 8Zr0. 1Y0. 1Mn2 - xNix合金在373 K温度下的吸氢P-C-T曲线。图7表明,随Ni元素逐渐替代Mn元素,合金最大储氢容量逐渐减少,吸氢平台压增高,平台压宽度逐渐减小。在298 K温度下,当x = 0和2. 0时,合金Sc0. 8Zr0. 1Y0. 1Mn2和Sc0. 8Zr0. 1Y0. 1Ni2的储氢平 台压分别 为0. 21和552. 89 k Pa,而文献[7,12]中报道,Sc Mn2和ScNi2合金的平台压分别为0. 03和1500 k Pa,可见Zr和Y元素对Sc的少量替代提高了Sc Mn2的平台压,却降低了Sc Ni2的平台压。这是因为Sc H2的生成焓 ( - 199. 8 k J·mol- 1) 相比Zr H2的生成焓 ( - 169. 95 k J·mol- 1) 要负,而在C15型相中原子半径较大的Y元素趋于完全固溶,因此加入Zr与Y后使得C14型Sc Mn2相和C15型Sc Ni2相的吸氢平台压力发生相应变化。
图7 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金在 298 K 时 P-C-T 曲线 Fig.7 P-C-T curves of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) alloys at 298 K
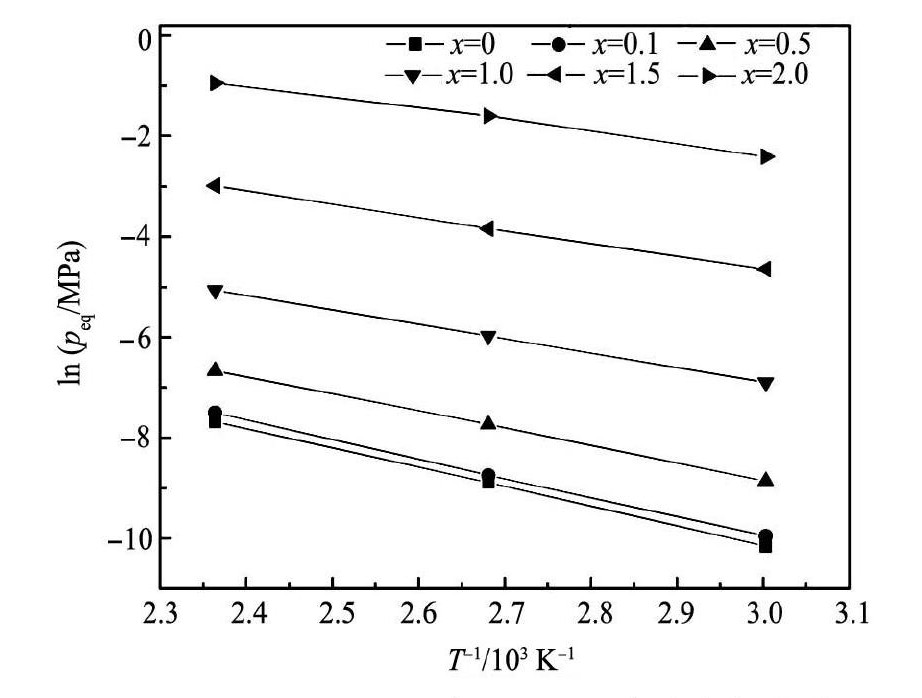
通过测定合金在不同温度下的P-C-T曲线,根据温度T和合金储氢平台压peq的关系得到图8所示的合金氢化物lnpeq- 1 / T曲线,依据Van' t Hoff公式,由图8经最小二乘法拟合后计算得出合金氢化物的生成焓和熵值,结果如表3所示。由表3可知,合金氢化物生成焓 ΔH随Ni含量的增加而逐步减小,当x = 0时,ΔH为 - 35. 05 k J·mol- 1,x = 2. 0时,ΔH增大至 - 18. 72 k J·mol- 1,说明Ni替代Mn后有助于降低Sc0. 8Zr0. 1Y0. 1Mn2 - xNix合金氢化物的稳定性。此外,已有研究表明,合金Sc Mn2和Sc Ni2与氢形成氢化物的生成焓分别为 - 44和 - 16 k J·mol[7,12],可见当Zr和Y元素少量替代Sc后即可比较明显地降低Sc M2( M = Mn,Ni) 合金氢化物的稳定性,而Ni替代Mn元素对储氢性能的影响规律与文献[11]报道Ni对合金Zr Mn2储氢性能的影响结果相似。
图8 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金氢化物 lnpeq- 1 / T 曲线 Fig.8 lnpeqvs 1 / T curves of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) hydrides
表3 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金储氢性能和 Table 3Hydrogen storage properties and thermodynamics of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys 下载原图
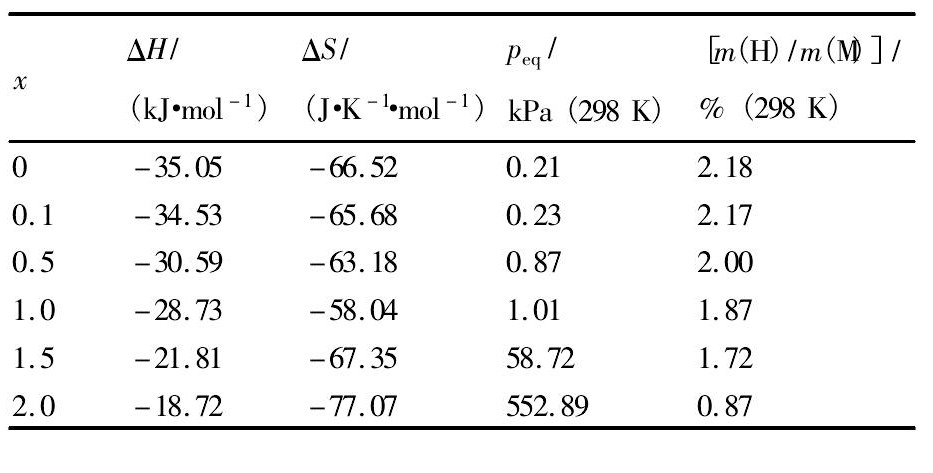
表3 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) 合金储氢性能和 Table 3Hydrogen storage properties and thermodynamics of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x =0 ~ 2. 0) alloys
2.3合金氢化物的放氢性能
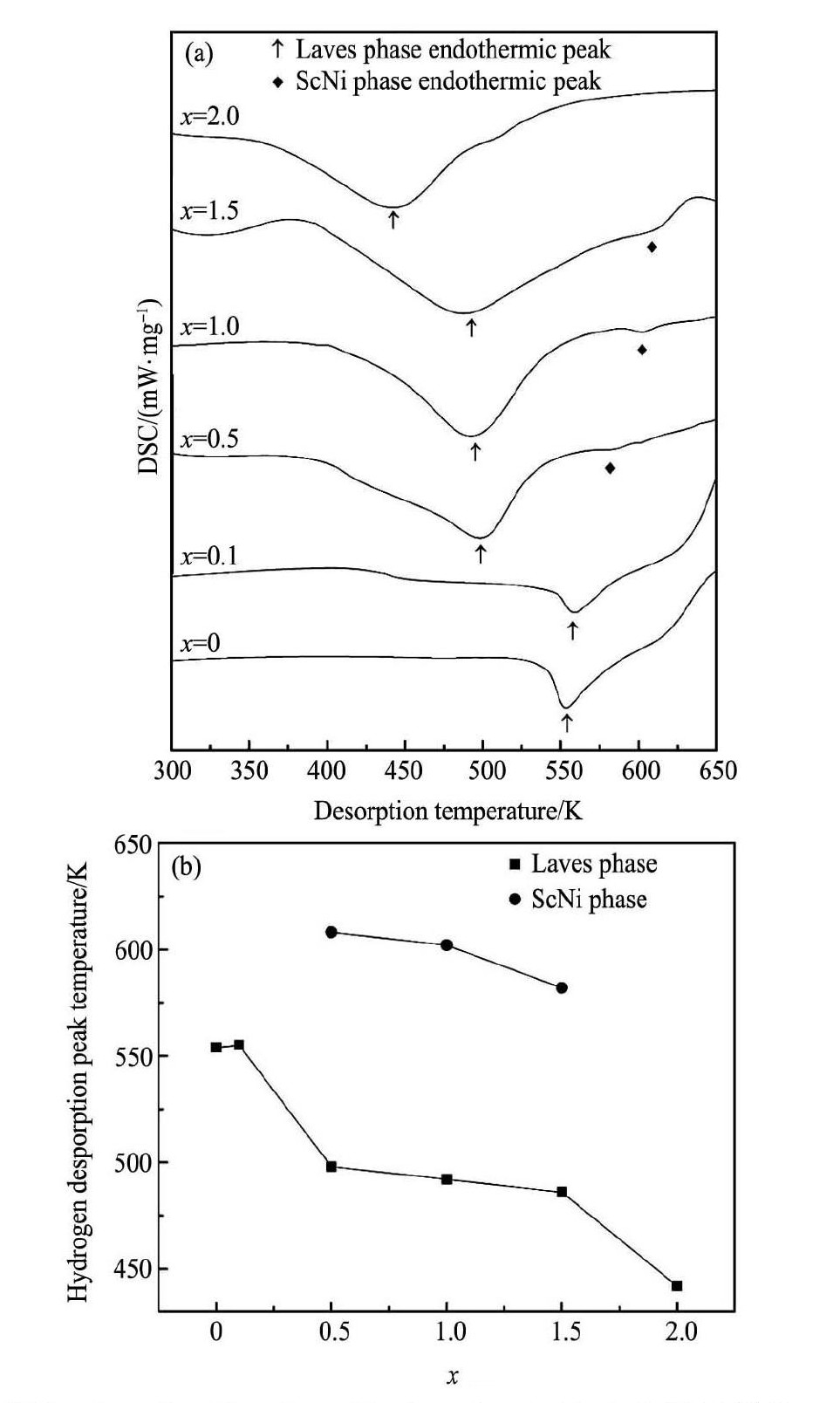
图9( a) 为Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金氢化物加热放氢时的DSC曲线,图9( b) 为放氢温度与Ni含量x的关系。从图9( a) 可知,合金氢化物的放氢温度随Ni含量x的增加逐渐减小, 当x = 0,0. 1时,氢化物最稳定,其放氢温度约为554 K; 当x = 2. 0时,合金氢化物放氢温度降低至约为442 K。当x = 0. 5,1. 0,1. 5时,合金氢化物除上述较大的放氢吸热峰外,在550 ~ 700 K温度区间还出现一较小的吸热峰。对比图6中XRD图谱和表2可知,图9( a) 中的最大吸热峰对应合金Laves主相的放氢,而小的吸热峰可能是Sc Ni第二相放氢所致,说明Sc Ni氢化物的稳定性高于合金Laves主相氢化物。另外,根据文献[12]报道,ScMn2合金氢化物的放氢温度为673 K,而本实验中Sc0. 8Zr0. 1Y0. 1Mn2的放氢温度为553. 4 K,表明Zr和Y对Sc的少量替代可降低Sc基laves相合金氢化物的分解温度。上述有关合金的DSC放氢曲线结果与表3中合金储氢性能规律相一致。
3结论
铸态合金Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 组织由Laves主相和少量Sc Ni及富稀土Y的第二相组成。随Ni含量x的增加,合金的基体组织由C14型Laves主相向C15型转变,x = 0时,合金组织基本为C14型Laves相单相组织,x = 2. 0时,合金组织则完全转变为C15型Laves相单相组织。合金中Sc和Y元素易与Ni形成相应的金属间化合物相。Ni元素对合金气态吸放氢动力学行为和吸氢P-C-T曲线影响显著。合金Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 的吸氢速率和活化性能随Ni含量增加而逐渐变差,但其放氢温度逐渐降低,氢化物生成焓减小( - 35. 05 ~- 18. 72 k J·mol- 1) ,合金储氢平台压升高,储氢容量降低,室温时其最大储氢量达2. 18% ( 质量分数) ; 储氢后合金晶格膨胀率为10. 63%~ 27. 32% ,其主相仍为C14型或C15型相结构,并未发生新的氢致相变,亦无氢致非晶化现象。
图9 Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) 合金吸氢后的 DSC 曲线以及放氢温度与 Ni 含量的关系 Fig.9 DSC curves of Sc0. 8Zr0. 1Y0. 1Mn2 - xNix( x = 0 ~ 2. 0) hydrides ( a) and dependence of Ni content on hydrogen desorption temperature of hydrides ( b)