非有机溶剂萃取光度法测定镍的研究
宿州师范专科学校化学系,宿州师范专科学校化学系,宿州师范专科学校化学系 安徽宿州234000 ,安徽宿州234000 ,安徽宿州234000
摘 要:
研究了亚硝基R盐 (nitrosoRsalt) 作为萃取剂和显色剂 , 在聚乙二醇 (PEG) nitrosoRsalt (NH4 ) 2 SO4 体系中的非有机溶剂萃取光度法测定镍。将nitrosoRsalt Ni (Ⅱ ) 配合物从pH 5 .8 (HAc NaAc缓冲溶液 ) 的溶液中萃取至PEG相 , 其最大吸收波长位于 490nm , 摩尔吸光系数为 1.40× 10 4 L·mol- 1 ·cm- 1 , Ni (Ⅱ ) 的线性范围为 0~ 3 0 μg·ml- 1 , Ni (Ⅱ ) 与nitrosoRsalt的配合比为 1∶3。此方法用于铝合金中镍的测定 , 获得满意结果。
关键词:
中图分类号: O657.3
收稿日期:2003-09-19
基金:安徽省自然科学基金资助项目 (2 0 0 1kj2 45zc);
Extraction-Spectrophotometric Determination of Ni (Ⅱ) by Using Non-Organic Solvents
Abstract:
In PEG-nitroso R salt- (NH 4) 2SO 4 system, the spectrophotometric determination of Ni (Ⅱ) by using nitroso R salt as extractant and devolopment agent of non-organic solvents was studied. Complex was extracted by PEG phase from the water solution of pH 5 8 (HAc-NaAc) . The maximum absorption of the complex is at 490 nm and the molar absorptivity 1.34×104 L·mol -1·cm -1. Beer′s raw was obeyed in the range of Ni (Ⅱ) 0~30 μg·ml -1. The molar ratio of Ni (Ⅱ) and nitroso R salt in a stable complex is 1∶3. The method has been applied to the determination of nickel in aluminium alloy with satisfactory results.
Keyword:
nickel; nitroso R salt; extraction spectrophotometry; non-organic solovents;
Received: 2003-09-19
虽然亚硝基R盐已被用作有机溶剂萃取光度法测定镍的显色剂
1 实验部分
1.1 主要仪器和试剂
DMS-200型光度计; 722S分光光度计; pHS-3D型酸度计。
亚硝基R盐溶液: 1.33×10-2 mol·L-1水溶液。 镍 (Ⅱ) 标准溶液: 20 μg·ml-1, 称取0.25 g镍粉溶于4 ml浓硝酸中, 配成250 ml溶液, 用时稀释50倍即成20 μg·ml-1的标准溶液。 PEG溶液: 30% (w/v) 水溶液; 缓冲溶液: 1 mol·L-1 NaAc和1 mol·L-1 HAc溶液, 按比例混合得到所需pH值的缓冲溶液; 无水硫酸铵: 固体。 所用试剂均为分析纯或优级纯, 实验用水为离子交换水再蒸馏一次。
1.2 实验方法
在比色管中, 依次加入pH 5.8的缓冲溶液4.0 ml, 20 μg·ml-1 Ni (Ⅱ) 标准溶液1.0 ml, nitroso R salt溶液1.0 ml, 加水至10.0 ml刻度, 摇匀。 同时另取一支比色管, 除不加Ni (Ⅱ) 外, 按上述步骤进行得试剂空白。 将以上两组溶液分别转入2支60 ml分液漏斗中, 然后各加入10.0 ml 30% PEG溶液和3.5 g (NH4) 2SO4, 振荡2~3 min, 静置。 待两相分层清楚后, 弃去下层盐水相, 并向上层PEG萃取相加入1.0 ml水 (以溶解带入的固体盐微粒) , 摇匀后, 以试剂空白的萃取相作参比, 用1 cm比色皿, 在490 nm下测定含镍 (Ⅱ) 萃取相中配合物的吸光度。
2 结果与讨论
2.1 吸收光谱的测定
选用pH 5.8的HAc-NaAc缓冲溶液, 按实验方法进行反应和萃取, 所得萃取相在400~700 nm范围内测定吸收光谱。 配合物的测定是以不加Ni (Ⅱ) 的试剂空白萃取相作参比; 亚硝基R盐的测定是以不加Ni (Ⅱ) 也不加亚硝基R盐的空白萃取相作参比, 结果如图1所示。 由测定结果可知, 试剂最大吸收波长为450 nm, 配合物最大吸收波长是490 nm, 对比度为40 nm, 说明Ni (II) 在PEG相中是以络合物形式存在的, 实验所选用测定波长为490 nm。
2.2 实验条件
2.2.1 酸度条件的实验
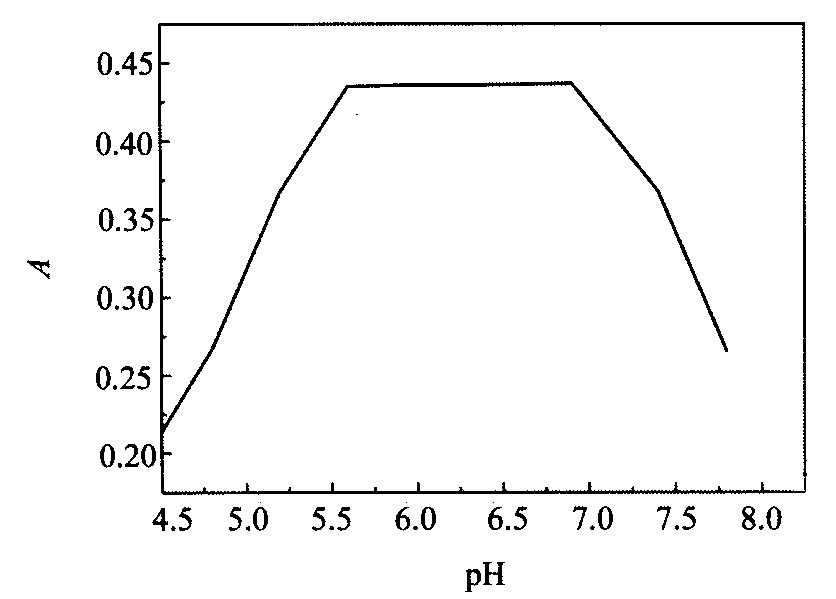
按实验方法, 固定其他条件, 改变不同pH的缓冲溶液, 测定萃取相中Ni (Ⅱ) -nitroso R salt配合物的吸光度, 结果如图2所示。 当溶液的pH值在5.6~6.8范围内吸光度值达到最大, 且基本不变。 本实验选用pH为5.8。
2.2.2 缓冲溶液用量实验
改变pH 5.8的缓冲溶液用量进行测定, 结果表明, 当缓冲溶液加入量大于3.5 ml时, 配合物吸光度基本不变, 本实验选用4.0 ml。
2.2.3 亚硝基R盐用量实验
固定其他条件, 改变亚硝基R盐的加入量。 测定结果表明, 加入
图1 亚硝基R盐和镍-亚硝基R盐配合物的吸收光谱 (1) nitroso R salt的吸收曲线; (2) nitroso R salt-Ni (Ⅱ) 配合物的吸收曲线 Fig.1 nitroso R salt and nitroso R salt-Ni (Ⅱ) absorption spectra
图2 酸度对萃取率的影响 Fig.2 Effect of acidity on extraction effciency
1.33×10-2 mol·L-1亚硝基R盐溶液0.75~2.0 ml, 吸光度达最大值且基本不变, 本实验的用量选用1.0 ml。
2.2.4 固体硫酸铵用量试验
在萃取体系中加入适量的固体硫酸铵时, 由于离子强烈水化作用, 破坏了PEG表面水化膜, 使PEG失去稳定性发生聚集, 从而与水相分离, 产生高聚物相。 将大体积溶液中的待测金属离子配合物浓缩于小体积的PEG相中, 从而提高测定金属离子的灵敏度。
固定其他条件, 改变固体硫酸铵的用量进行实验。 结果表明, 当其用量小于2 g时, 溶液不分层, 3~5 g时分层较好, 吸光度达最大值且基本不变。 当硫酸铵用量再增大时, 由于盐效应, 会影响配合物的稳定性, 使吸光度有所下降。 故本实验选用硫酸铵4.0 g。
2.2.5 络合物的稳定性
本实验条件下, Ni (Ⅱ) -nitroso R salt络合物显色迅速, 被萃取进PEG相后, 由于细小 (NH4) 2SO4盐粒的带入, 会影响吸光度的稳定性。 因此, 可在放出萃余相后, 向PEG相准确加入0.50 ml水, 摇匀后再测吸光度。 络合物如在此处理的PEG相中放置80 min, 吸光度基本不变。 故本实验均可在萃取后80 min内测定吸光度值。
2.2.6 工作曲线的测定
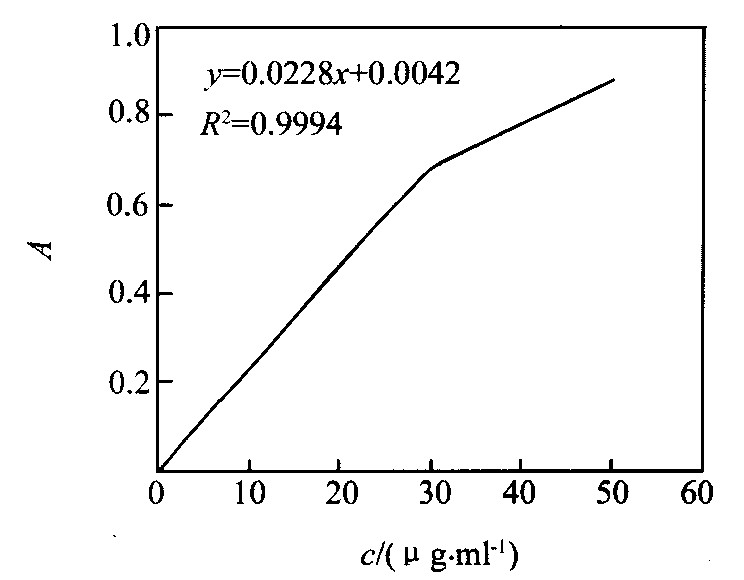
固定其他试剂用量, 仅改变Ni (Ⅱ) 的加入量, 按所选定的实验条件进行测定, 结果如图3所示。 由图3可知, 在该实验条件下, Ni (Ⅱ) 量在0~30 μg·ml-1范围内符合比尔定律, 一元线性回归方程为y=0.0228x+0.0042, R2=0.9994, 配合物的摩尔吸光系数为1.34×104 L·mol-1·cm-1。
图3 镍 (Ⅱ) 的工作曲线 Fig.3 Working curve of Ni (Ⅱ)
2.2.7 共存离子的影响
按实验方法加入20 μg Ni (Ⅱ) , 再加入不同量的其它离子, 测定误差小于±5%时, 即为允许量, 其测定结果列于表1。 由表1可知, Cu2+, Fe2+, Fe3+, Co2+, Mo (Ⅵ) , V (Ⅵ) 干扰严重。
表1 共存离子的允许量Table 1 Tolerance of coexisting foreign ions
| 离子名称 | 允许量/μg | 离子名称 | 允许量/μg | 离子名称 | 允许量/μg |
| Al3+ | ≤1000 | Ag+ | ≤500 | Mo (VI) | ≤10 |
| Pb2+ | ≤1000 | Zr (Ⅳ) | ≤400 | Fe3+ | ≤4 |
| Ca2+ | ≤1000 | Mn2+ | ≤80 | Fe2+ | ≤4 |
| Hg2+ | ≤1000 | As (Ⅲ) | ≤50 | Cu2+ | ≤2 |
| Sr2+ | ≤1000 | Mg2+ | ≤50 | Co2+ | ≤1 |
| Cr (Ⅲ) | ≤500 | Sb (Ⅲ) | ≤40 | V (Ⅴ) | ≤0.8 |
2.3 配合物组成比的测定
用摩尔比法和连续变化法测定PEG萃取相中Ni (Ⅱ) -nitroso R salt配合物的组成比。 结果为Ni (Ⅱ) ∶nitroso R salt=1∶3。 用同样方法测定了水溶液中络合物的组成比, 其结果为Ni (Ⅱ) ∶nitroso R salt=1∶2。 由测得的组成比可知, Ni (Ⅱ) 与nitroso R salt的络合物萃取进PEG相中被高配位化了, 可能是由于聚乙二醇参与配位作用的结果, 因而吸收光谱红移, 摩尔吸光系数增大, 使测定Ni (Ⅱ) 具有高的灵敏度。
3 样品分析
称取铝合金标准试样1.00 g, 加入HNO3∶HCl∶H2O=1∶3∶4 的混合酸约15 ml, 缓慢加热直至残渣完全溶解
表2 铝合金试样中Ni (Ⅱ) 的测定Table 2 Analytical results of Ni (Ⅱ) samples
| 取样量/ g |
测定Ni量/ μg |
百分含量/ % |
平均值/ % |
标准值/ % |
RSD/ % |
回收率/ % |
| 0.080 | 10.3 | 0.0129 | ||||
| 0.080 | 10.4 | 0.0130 | ||||
| 0.080 | 10.4 | 0.0130 | 0.0132 | 0.0120 | 2.6 | 96 |
| 0.080 | 10.6 | 0.0133 | ||||
| 0.080 | 10.7 | 0.0134 |
参考文献
[2] ZvarovaTI, ShkinevVM , VorobevaGAI, etal. Mikrochim, Ac ta, 1984, 3:449.
[3] 石 影, 邓凡政, 董环文. 聚乙二醇偶氮胂Ⅲ萃取光度法测定锆的研究[J].冶金分析, 2000, 20 (5) :4.
[4] 邓凡政, 石 影, 谭润林. 高聚物萃取光度法测定钯[J].岩矿测试, 2000, 19 (3) :238.
[5] 蔡 红, 许秀丽, 石 影. 聚乙二醇硫酸铵邻苯三酚红萃取光度法测定铋的研究[J].光谱学与光谱分析, 2003, 23 (2) :345.
[6] 邓凡政, 石 影, 江玉波. 双水相体系中钛、锆的分离[J].稀有金属, 2001, 25 (60) :441.
[2] ZvarovaTI, ShkinevVM , VorobevaGAI, etal. Mikrochim, Ac ta, 1984, 3:449.
[3] 石 影, 邓凡政, 董环文. 聚乙二醇偶氮胂Ⅲ萃取光度法测定锆的研究[J].冶金分析, 2000, 20 (5) :4.
[4] 邓凡政, 石 影, 谭润林. 高聚物萃取光度法测定钯[J].岩矿测试, 2000, 19 (3) :238.
[5] 蔡 红, 许秀丽, 石 影. 聚乙二醇硫酸铵邻苯三酚红萃取光度法测定铋的研究[J].光谱学与光谱分析, 2003, 23 (2) :345.
[6] 邓凡政, 石 影, 江玉波. 双水相体系中钛、锆的分离[J].稀有金属, 2001, 25 (60) :441.