PdCl2-CuCl2液相催化氧化净化黄磷尾气中PH3
宁 平1,易玉敏2,瞿广飞1,李军燕3,陈思思1,张仁锋1
(1. 昆明理工大学 环境科学与工程学院,云南 昆明,650093;
2. 云南省建设项目环境审核受理中心,云南 昆明,650034;
3. 云南省化工研究院,云南 昆明,650000)
摘 要:
摘 要:以自主筛选的PdCl2-CuCl2作为模拟黄磷尾气中PH3液相催化氧化净化催化剂。研究催化剂中PdCl2和 CuCl2的不同配比、pH值、氧含量、温度、流速、PH3浓度及催化剂含量对净化效率的影响规律。实验结果表明:催化剂中PdCl2和CuCl2的最佳配比为n(PdCl2)?n(CuCl2)=1?10;混合气中氧含量为2%时就可以满足需要;较佳的pH值为1.0;混合气速和入口PH3质量浓度的降低有利于催化剂催化效果的发挥;较佳的反应温度为37 ℃。当混合气速为300 mL/L,PH3入口质量浓度为850 mg/m3,催化剂中PdCl2浓度为0.03 mol/L时,在850 min之内对磷化氢的净化效率都能达到100%。 催化剂净化机理为:含有3个氧化还原反应,同时完成PH3的氧化和催化剂的再生;另含2个络合反应,可降低PH3的相间传质阻力。
关键词:
中图分类号:X701 文献标识码:A 文章编号:1672-7207(2009)02-0340-06
Catalytic oxidation PH3 in yellow phosphoric tail gas with PdCl2 and CuCl2 solution
NING Ping1, YI Yu-min2, QU Guang-fei1, LI Jun-yan3, CHEN Si-si1, ZHANG Ren-feng1
(1. Faculty of Environmental Science and Engineering, Kunming University of Science and Technology,
Kunming 650093, China;
2. Yunnan Appraisal Center for Environment and Engineering, Kunming 650034, China;
3. Yunnan Research Institute of Chemistry, Kunming 650093, China)
Abstract: The solution of PdCl2 and CuCl2 was used as a self-screened catalyst of liquid phase catalytic oxidation to purify phosphine in simulated yellow phosphorus tail gas. The influence laws of different proportion of PdCl2 and CuCl2, pH value, oxygen content, temperature, flow rate, PH3 concentration and catalyst amount on the purification efficiency of PH3 were explored. The results show that the optimal proportion of PdCl2 and CuCl2 is 1?10 and the oxygen content 2% can meet the requirements, the optimal pH and temperature is 1.0 and 37 ℃, respectively. The decreases of flow rate of gas mixture and mass concentration of PH3 are in favor of the exertion of the catalytic effects. When the flow rate of gas mixture is 300 mL/min, the concentration of PH3 is 850 mg/m3 and the concentration of PdCl2 is 0.03 mol/L, the purification efficiency of PH3 can reach 100% within 850 min. There are three oxidation-reduction reactions that can purify PH3 and regenerate the catalyst, and two complex reaction, which can decrease the mass transfer resistance of interphase.
Key words: yellow phosphorus tail gas; phosphine; catalytic oxidation; transition metal ion; purification
黄磷尾气是黄磷生产过程产生的主要大气污染物,每生产1 t黄磷排放尾气2 500~3 000 m3,其中,含有85%~95%的CO及PH3(500~1 000 mg/m3),H2S (60~3 000 mg/m3),HF(400~500 mg/m3)和CO2(2%~6%)等杂质[1-2]。这些杂质会使CO羧基化过程中的催化剂中毒[2],若能有效地去除这些杂质,黄磷尾气将会是有用的C1化工原料,能将其合成甲酸甲醋、甲醚、醋酸、甲醇、碳酸二甲酯等各种极有经济价值的有机化合物[3]。采用水洗串碱洗法可以有效地去除黄磷尾气中的P4,CO2,H2S,HF和 CO2[4],但PH3不是酸性气体,且在标准状态下在100 cm3水中的溶解度仅为26 cm3[5],很难用水洗碱洗法去除。
目前,国内外对低浓度PH3的净化方法较多,主要有吸附法和化学吸收法。吸附法中较典型的是浸渍活性炭催化氧化法[6-7]及变温变压吸附法[8-10],其中,浸渍活性炭吸附法存在活性炭消耗大且催化剂再生困难等缺点;而变温变压吸附法的工艺复杂,投资大,能量耗费大。化学吸收法以化学氧化吸收法为主,它利用次磷酸钠[11]、高锰酸钾[12]、硫酸[13]、过氧化氢[14]等与PH3进行化学反应,从而实现PH3的净化,但化学氧化吸收法存在氧化剂消耗量大、不易操作及净化效率随氧化剂浓度变化波动大等缺陷。
利用过渡金属离子对SO2和H2S等具有还原性的气体进行催化氧化净化,受到了研究人员的高度关 注[15]。此催化剂具有配置简单,催化剂用量小,能在常压、低温、微氧条件下对黄磷尾气中的PH3实现净化的特点。另外,催化剂有较强的选择性、净化效率高、稳定时间长,反应进行的温度较低,无需附属的加热设备,净化过程能耗低。瞿广飞等[16]从过渡金属离子中筛选出了对PH3有较佳净化作用的PdCl2-CuCl2催化剂。在此,本文作者对催化剂的催化氧化规律进行研究。
1 实 验
采用CO,O2和质量浓度为6 040 mg/m3的PH3对黄磷尾气进行动态模拟。实验所需动力由钢瓶压力提供,玻璃转子流量计用来调节气体流量及控制气体组成。由钢瓶流出的气体经混合罐混合后进入装有10 mL吸收液的吸收管中催化净化,恒温水浴锅用来控制反应温度,经吸收液吸收后的气体经含浓硫酸尾气吸收瓶进一步吸收后排空,气相色谱仪GC-14C测定净化后气体中PH3的浓度。吸收液由PdCl2(分析纯)和CuCl2(分析纯)配置而成,吸收液的pH值由HCl和NaOH调节。
进行单因素实验时,改变当时所需研究的变量,其余的变量保持不变:PdCl2的浓度为0.01 mol/L;CuCl2的浓度为0.1 mol/L;在研究CuCl2的量、pH和氧含量对溶液净化效率的影响时,控制混合气入口流量为200 mL/min,其余实验中流量控制为300 mL/min,溶液pH值为1.0,入口氧的体积分数为2%,入口磷化氢的质量浓度为850 mg/m3。除特殊说明外,反应温度控制在25 ℃。
2 结果与讨论
2.1 吸收液中CuCl2的浓度对PH3净化效果的影响
固定PdCl2的浓度为0.01 mol/L,逐步增加CuCl2的浓度,CuCl2的添加量对PH3净化效率的影响如图2所示。从图2可知,吸收液的磷容随着溶液中CuCl2物质的量的增加而增加,当CuCl2与PdCl2的物质的量比达到10?1时,吸收液在6 h之内对PH3的吸收保持在90%以上,但此时吸收液的净化效率的增大趋势开始减缓,可以认为此时CuCl2的物质的量可满足实验的需要。

1—PH3钢瓶;2—CO钢瓶;3—O2钢瓶;4—截止阀;5—玻璃转子流量计;6—气体混合罐;
7—玻璃三通;8—恒温水浴锅;9—气体吸收管;10—尾气吸收瓶
图1 实验装置流程图
Fig.1 Flow sheet of experiment

n(Cu)?n(Pd): 1—1?1; 2—4?1; 3—8?1; 4—10?1; 5—14?1
图2 不同催化配比下净化效率随时间变化曲线
Fig.2 Variation curves of purity rate under different catalyst proportioning
CuCl2在此反应中的作用主要有以下几点:a. CuCl2是此氧化还原体系的必要组成之一,使催化剂对PH3的净化和催化剂的再生能顺利进行;b. CuCl2及反应中间产物CuCl均能与PH3形成络合物,降低PH3从气相向液相传质的阻力;c. 实验过程中发现CuCl2的引入对吸收液有较强的起泡作用,能够增大PH3与吸收液的接触面积,增大传质效率。
2.2 pH值对PH3净化效率的影响
pH值变化对净化效率的影响如图3所示。可见,吸收液对PH3的净化作用随着吸收液pH值的升高而逐步降低,反应进行300 min时,pH值分别为0.4和2.8的溶液对PH3的净化效率分别为98%和80%。pH值较高时,催化剂不能较好发挥催化作用,其原因是:当pH值超过1.0以后,催化剂中的Pd2+便开始以Pd(OH)2的形式沉淀,不能稳定地存在于液相催化系统中,降低了吸收液中催化剂的浓度。同时,PH3溶于水后形成的水溶液具有类似氨水的碱性,吸收液酸性的增加有利于PH3的溶解,增大传质速率。

pH值: 1—0.4; 2—1.0; 3—1.8; 4—2.8
图3 不同pH值下净化效率随时间变化曲线
Fig.3 Variation curves of purity rate under different pH values
2.3 氧含量对PH3净化效率的影响
O2作为此催化反应的氧化剂,O2含量将极大地影响此反应的进行。氧含量对PH3净化效率的影响如图4所示。可见,无氧时,吸收液很快失效,此时吸收液内进行的仅是以化学计量比的化学反应,而非催化反应。当催化剂中的氧含量为1%时,吸收剂对PH3在10 h之内对PH3的净化效率均能达到80%以上,此时氧含量与黄磷尾气中的氧含量相当,即催化剂可以满足净化黄磷尾气的需要;当氧含量达到3%时,吸收剂对PH3的净化效率进一步升高,但升高幅度不是很大;当氧含量为2%时,氧的过剩系数为12.5,说明O2从气相向液相的传质成为此反应的控制步骤。

氧含量/%: 1—0; 2—2; 3—3
图4 不同氧含量下净化效率随时间变化曲线
Fig.4 Variation curves of purity rate under different oxygen contents
2.4 温度对PH3净化效率的影响
升高反应温度,有利于提高化学反应速率,但不利于PH3的液膜溶解过程。温度对PH3净化效率的影响如图5所示。从图5可以看出,当温度从25 ℃升至37 ℃后,吸收液对PH3的净化作用明显增强,说明温度升高对提高化学反应速率所造成的有利影响要大于对液膜溶解所造成的不利影响,化学反应速率为此时的控制步骤。当温度为37~75 ℃时,吸收液对PH3的净化作用随温度的升高而逐渐降低,特别是在温度为75 ℃时,吸收液对PH3的净化效率在60 min内就快速下降到30%。其原因是,对于活化能一定的反应,反应速率在低温范围内对温度的敏感程度要高于其在高温范围内对温度的敏感程度,即当温度升高到一定程度时,温度升高不会引起反应速率明显增加,同时,随着温度的升高,PH3的物理溶解过程会变弱,所以,反应温度不是越高越好,37 ℃为反应的较佳温度[17]。而黄磷尾气经水洗碱洗后的温度仍高达60~ 70 ℃,所以,只需将黄磷尾气经过换热设备降温后便可进行PH3的催化氧化,不需附加的加热设备。
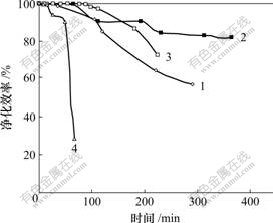
温度/℃: 1—25; 2—37; 3—50; 4—75
图5 不同温度下净化效率随时间变化曲线
Fig.5 Variation curves of purity rate under different temperatures
2.5 PH3入口质量浓度对净化效率的影响
控制反应温度为37 ℃,研究混合气中PH3的入口质量浓度对催化剂净化性能的影响,结果如图6所示。当混合气中PH3的质量浓度为550 mg/m3时,在220 min之前吸收液净化效率能温度保持至100%。但当PH3的质量浓度提高至1 200 mg/m3后,吸收液净化效率达到100%的时间仅为5 min,在100 min时降至20%以下,吸收液快速失活。混合气中PH3浓度的提高可以增加吸收过程的传质动力,从而加快吸收速率,但是,从图6可看出,当混合气中PH3质量浓度升至1.2 g/m3后,所带来的是吸收液的快速失活。入口浓度过高,使氧化PH3产生的PO43-与吸收液中的金属离子形成大量沉淀,而这些沉淀又来不及与O2反应而再生,金属离子脱离液相催化系统,吸收液失活。
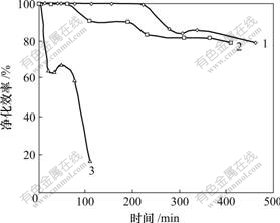
浓度/(mg?m-3): 1—550; 2—850; 3—1 200
图6 不同PH3浓度下净化效率随时间变化曲线
Fig.6 Variation curves of purity rate under different PH3 concentrations
2.6 混合气速对PH3净化效率的影响
当反应温度为37 ℃时,混合气流量对PH3净化效率曲线如图7所示。可见,当混合气流速为200 mL/min,吸收液对PH3净化效率达到100%的时间为440 min。但当流量升高至400 mL/min后,净化效率达到100%的时间低于16 min。流速升高后,气体在吸收液中的停留时间缩短,PH3与吸收液还来不及反应就已经脱离反应体系,净化效率不高。当混合气流速为200 mL/min,净化效率维持100%时,1 mol PdCl2可吸收23.43 mol PH3,,相当于处理黄磷尾气937.2 m3。

流速/(mL?min-1): 1—200; 2—300; 3—400
图 7 不同流速下净化效率随时间变化曲线
Fig.7 Variation curves of purity rate under different flow rates
2.7 催化剂用量对净化效率的影响
保持催化剂配比n(PdCl2)?n(CuCl2)=1?10,改变催化剂中PdCl2的浓度,研究催化剂用量对净化效率的影响,结果如图8所示。当催化剂中Pd的浓度从0.005 moL/L上升至0.03 mol/L时,催化剂的活性和稳定性都得到提高。在反应器中,不仅存在PH3的氧化,同时也存在催化剂的再生,以维持催化剂的高稳定性。当催化剂含量较低时,催化剂在氧化PH3的过程,催化剂中一定比例的催化剂失活,而其再生速度又低于其失活速度,催化剂失效。当催化剂浓度达到0.03 mol/L,催化剂在850 min时的净化效率仍为100%,此时催化剂仍失活,但部分催化剂得到再生,最终催化剂的失活速度等于其再生速度,系统中催化剂含量保持一定,系统达到一个动态平衡状态。值得注意的是,当催化剂浓度为0.02 mol/L时,净化效率有一个先降低后升高的过程,其原因可能是PH3最终的氧化产物有一定的氧化性,当其累积到一定水平时,它又能与PH3发生反应。即此时系统中不仅含有催化反应,还含有已化学计量比进行的化学反应。

催化剂含量/(mol?L-1):1—0.005; 2—0.01; 3—0.02; 4—0.03
图 8 不同催化剂用量下净化效率随时间变化图
Fig.8 Variation curves of purity rate under different catalyst amounts
3 液相催化氧化PH3机理
PH3具有强还原剂,O2具有氧化性,两者具有发生氧化还原反应的可能。在标准状态下,PH3与O2的![]() =-1 168.7 kJ/mol,平衡常数
=-1 168.7 kJ/mol,平衡常数![]() =6.68×10204[16],说明反应不但可以进行,而且可以进行得比较彻底。但是,PH3与O2反应的活化能较高,且PH3和O2的溶解度都较低,使得气体向液相传质阻力增加,加大了此反应的难度。本研究所筛选出的催化剂能较好地解决以上问题。
=6.68×10204[16],说明反应不但可以进行,而且可以进行得比较彻底。但是,PH3与O2反应的活化能较高,且PH3和O2的溶解度都较低,使得气体向液相传质阻力增加,加大了此反应的难度。本研究所筛选出的催化剂能较好地解决以上问题。
对于PdCl2和CuCl2联合催化氧化PH3的机理,涉及的主要方程式有:

总反应为:
![]()
式(1)完成PH3的净化,式(2)和(3)为催化剂的再生过程。反应所涉及的金属离子在此过程中并未消耗,这就变单纯的以化学计量比进行的反应为催化反应。
同时,在此过程中还存在的反应还有:
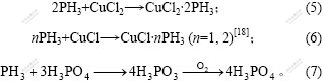
从式(5)和(6)可知,CuCl2及反应中间产物CuCl均可与PH3形成络合物,降低PH3从气相向液相扩散的传质阻力。同时,随着反应的进行,溶液中累积的PO43-可与PH3发生氧化还原反应,进一步促进PH3的净化。
4 结 论
a. 模拟了黄磷尾气的组成,以水为溶剂,PdCl2- CuCl2为催化剂,最佳的催化剂配比n(PdCl2)?n(CuCl2)= 1?10;当催化剂中Pd浓度为0.03 mol/L时,在850 min时净化效率仍为100%。
b. pH值较低更有利于PH3的液相催化净化,因为pH值较低更有利于吸收液中金属离子的稳定存在,且有利于PH3向液相的传质。
c. 无氧时,吸收液对PH3的净化属于以化学计量比进行的化学吸收过程,氧含量为2%时便可实现PH3的催化氧化过程,可满足黄磷尾气净化的需要,氧的传质是此反应的控制步骤;反应压力为常压,易操作。
d. 低温(25~75 ℃)下便能实现对PH3的净化,当温度为25~37 ℃时,化学反应过程为控制步骤;当温度高于37 ℃时,气体向液相的传质逐渐变为控制 步骤。
e. PdCl2-CuCl2溶液净化PH3的过程中含有3个氧化还原过程,能同时实现PH3的净化和催化剂的再生,同时,CuCl2和反应中间物CuCl能与PH3形成络合物,可有效降低PH3的相间传质系数。
参考文献:
[1] 熊 辉, 杨晓利, 李光兴. 次氢酸钠氧化脱除黄磷尾气中的硫、磷杂质[J]. 化工环保, 2002, 22(31): 161-164.
XIONG Hui, YANG Xiao-li, LI Guang-xing. Removal of sulfur and phosphorus from tail gas in yellow phosphorus production by sodium hypochlorite oxidation process[J]. Environmental Protection of Chemical Industry, 2002, 22(31): 161-164.
[2] 任占东, 陈 樑, 宁 平, 等. 黄磷尾气净化脱除磷化氢、硫化氢中试实验[J]. 现代化工, 2005, 25(12): 48-52.
REN Zhan-dong, CHEN Liang, NING Ping, et al. Pilot test of removal of PH3 and H2S from yellow phosphorus tail gas[J]. Modern Chemical Industry, 2005, 25(12): 48-52.
[3] 宁 平, Bart H J, 王学谦, 等. 催化净化氧化黄磷尾气中的磷和硫[J]. 中国工程科学, 2005, 7(6): 27-35.
NING Ping, Bart H J, WANG Xue-qian, et al. Removal of P4, PH3 and H2S from yellow phosphoric tail gas by a catalytic oxidation process[J]. Engineering Science, 2005, 7(6): 27-35.
[4] 任占东, 陈 樑, 宁 平. 活性炭法净化黄磷尾气中的硫化氢、磷化氢的研究进展[J]. 现代化工, 2006,26(11): 25-28.
REN Zhan-dong, CHEN Liang, NING Ping. Progress in purification of PH3, H2S in yellow phosphorus tail has with activated carbon[J]. Modern Chemical Industry, 2006, 26(11): 25-28.
[5] Dévai I, Felfǒldy L, Wittner I. Detection of phosphine: New aspects of the phosphorus cycle in the hydrosphere[J]. Nature, 1988, 333(26): 343-345.
[6] 宁 平, 潘克昌, 谢有畅, 等. 黄磷尾气固定床催化氧化净化的方法: 中国, CN1398658A[P]. 2003-02-26.
NING Ping, PANG Ke-chang, XIE You-chang, et al. Catalytic oxidation of yellow phosphoric tail gas using fixed bed: China, CN 1398658A[P]. 2003-02-26.
[7] Juergen W. Absorbent mass for phosphine: Internationle Vera ffentlichungsummer, WOOO/21644 A3[P]. 2000-04-20.
[8] 魏玺群, 郑才平, 张 杰, 等. 黄磷尾气净化回收新工艺探讨[J]. 化肥工业. 2001, 28(6): 29-32.
WEI Xi-qun, ZHENG Cai-ping, ZHANG Jie, et al. Inquiry into new process for purification and recovery of tail gas from yellow phosphorus[J]. Journal of the Chemical Fertilizer Industry, 2001, 28(6): 29-32.
[9] 陈中明, 武立新, 魏玺群, 等. 变温和变压吸附法从黄磷尾气净化回收一氧化碳[J]. 天然气化工, 2001(26): 24-26, 39.
CHEN Zhong-ming, WU Li-xin, WEI Xi-qun, et al. Purification and recovering of CO from yellow phosphorus tail gas by TSA and PSA[J]. Natural Gas Chemical Industry, 2001(26): 24-26, 39.
[10] Smith J R R, Timms P L. Gas stream purification apparatus: EP0611140[P]. 1994-08-17.
[11] 程建忠, 张英喆, 张宝贵. 次磷酸钠生产中磷化氢尾气处理技术的研究[J]. 南开大学学报: 自然科学版, 2001, 34(2): 31-34.
CHENG Jian-zhong, ZHANG Ying-zhe, ZHANG Bao-gui. Study on the treatment of PH3 in the process of making sodium hypophosphite[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis, 2001, 34(2): 31-34.
[12] TimHerman, Soden S. Efficiently handing effluent gases through chemical scrubbing[J]. AIP Conf Pro, 1988, 166: 99-108.
[13] 张建华. 硫化氢, 磷化氢脱除新工艺[J]. 河南化工, 1995(10): 21-22.
ZHANG Jian-hua. A new technics wipe off PH3 and H2S[J]. Henan Chemical Industry: 1995(10): 21-22.
[14] 丁百全, 徐 周, 房鼎业, 等. 熏蒸杀虫余气PH3的吸收净化研究[J]. 环境污染治理技术及设备, 2003, 4(1): 29-32.
DING Bai-quan, XU Zhou, FANG Ding-ye, et al. Study of absorbing purification for phosphine from fumigated disinfestation of pests[J]. Techniques and Equipment for Environmental Pollution Control, 2003, 4(1): 29-32.
[15] 唐晓龙, 易红宏, 宁 平. 低浓度硫化氢废气的液相催化氧化法净化实验研究[J]. 环境污染治理技术与设备, 2005, 6(9): 33-36.
TANG Xiao-long, YI Hong-hong, NING Ping. Study of liquid phase catalytic oxidation of hydrogen sulfide in low concentration[J]. Techniques and Equipment for Environmental Pollution Control, 2005, 6(9): 33-36.
[16] 瞿广飞, 宁 平, 李军燕. 磷化氢液相催化氧化净化催化剂的初筛[J]. 环境工程, 2007, 25(5): 70-71, 75.
QU Guan-fei, NING ping, LI Jun-yan. Screening of catalysts for phosphine catalytic oxidation in aqueous solution[J]. Environmental Engineering, 2007, 25(5): 70-71, 75.
[17] 刘常青, 张平民, 陈启元. 温度对含硫化氢废气氧化吸收的影响[J]. 中南工业大学学报: 自然科学版, 1998, 29(4): 347-350.
LIU Chang-qing, ZHANG Ping-min, CHEN Qi-yuan. Fluences of temperature on the process of oxdo-absorbing hydrogen sulfide[J]. Journal of Central South University of Technology: Natural Science, 1998, 29(4): 347-350.
[18] 马世昌. 基础化学反应[M]. 西安: 陕西科学技术出版社, 2001: 210.
MA Shi-chang. Basic chemical reaction[M]. Xi’an: Shanxi Science & Technology Press, 2001: 210.
收稿日期:2008-05-16;修回日期:2008-10-18
基金项目:高等学校博士学科点专项科研基金资助项目(20050052);云南省教育厅科研基金资助项目(5Y0553D)
通信作者:宁 平(1958-),男,山西太原人,教授,博士生导师;电话:0871-5189366;E-mail: ningping58@sina.com
[8] 魏玺群, 郑才平, 张 杰, 等. 黄磷尾气净化回收新工艺探讨[J]. 化肥工业. 2001, 28(6): 29-32.
[9] 陈中明, 武立新, 魏玺群, 等. 变温和变压吸附法从黄磷尾气净化回收一氧化碳[J]. 天然气化工, 2001(26): 24-26, 39.
[10] Smith J R R, Timms P L. Gas stream purification apparatus: EP0611140[P]. 1994-08-17.
[15] 唐晓龙, 易红宏, 宁 平. 低浓度硫化氢废气的液相催化氧化法净化实验研究[J]. 环境污染治理技术与设备, 2005, 6(9): 33-36.
[17] 刘常青, 张平民, 陈启元. 温度对含硫化氢废气氧化吸收的影响[J]. 中南工业大学学报: 自然科学版, 1998, 29(4): 347-350.
" target="blank">[18] 马世昌. 基础化学反应[M]. 西安: 陕西科学技术出版社, 2001: 210.MA Shi-chang. Basic chemical reaction[M]. Xi’an: Shanxi Science & Technology Press, 2001: 210.


