网络首发时间: 2018-05-04 17:19
稀有金属2019年第5期
氢纯化用 Pd合金膜的研究进展
向富乐 郭秀梅 蒋利军
北京有色金属研究总院能源材料与技术研究所
摘 要:
钯及钯合金膜具有极高的氢气选择性和可观的氢渗透速率, 机械性能稳定, 可在高温高压条件下工作, 一直是石化产业和水煤气变换工程中H2 分离纯化工艺用膜材料的研究热点。总结了氢渗透钯合金膜所遵循的“溶解-扩散”机制, 据此给出了氢渗透流量的数学计算公式;综述了膜层结构以及渗透性能表征方法方面的最新进展, 对膜层结构与透氢性能之间的关系作了探讨;重点介绍了近年来国外在纯Pd膜, PdCu和PdAu合金膜渗透性和抗毒化性能方面取得的研究进展;详细讨论了H2 S对膜层的毒化机制, Pd和钯合金膜都会与H2 S生成Pd4 S, PdCu膜更接近被整体硫化, 而PdAu仅仅是表层有硫化物层生成, 这些硫化物层会使H2 的渗透性变差。最后对钯合金膜开发与应用的发展趋势作了展望。
关键词:
氢纯化 ;钯合金膜 ;抗H2S毒化 ;水煤气变换 ;
中图分类号: TQ051.893;TQ116.2
作者简介: 向富乐 (1990-) , 男, 陕西安康人, 硕士研究生, 研究方向:储氢材料, E-mail:xiang_fule@126.com; *郭秀梅, 副教授;电话:18612291978;E-mail:xiumei418@163.com;
收稿日期: 2018-04-03
基金: 国家科技部ITER计划专项 (2010GB113003) 资助;
Progress in Pd Alloy Membranes for Hydrogen Purification Xiang Fule Guo Xiumei Jiang Lijun
Institute of Energy Materials and Technology, General Research Institute for Nonferrous Metals
Abstract:
Palladium and palladium alloy membranes have extremely high hydrogen selectivity, good hydrogen permeation rate, stable mechanical properties, and can work under high temperature and high pressure conditions. They have been a research hotspot for membrane materials used in H2 separation and purification process in petrochemical industry and water gas shift engineering. This article summed up the “dissolving-diffusion” mechanism followed by hydrogen-penetrating palladium alloy membranes. Based on this, a mathematical formula for the hydrogen permeation flux was given. The latest developments in membrane structure and characterization of permeability properties were reviewed, and the relationship between membrane structure and hydrogen permeability properties was discussed. The toxicity mechanism of H2 S to the membrane was discussed in detail. The Pd and palladium alloy membranes all produced Pd4 S with H2 S, and the PdCu film was closer to the whole vulcanization, and the PdAu was only formed by the sulfide layer on the surface, and these sulfide layers would make the permeability of H2 worse. Finally, the prospects for the development and application of palladium alloy membranes were forecasted.
Keyword:
hydrogen purification; palladium alloy membrane; anti-H2 S poisoning; water gas shifting;
Received: 2018-04-03
化石能源储量丰富, 开发成本相对低廉, 数十年来一直作为燃料或中间化学品广泛使用。 尽管可再生能源和核能正在大力发展, 国际能源署 (IEA) 表示, 在可预见的将来, 化石燃料仍将继续成为全球的基础能源
[1 ]
。 环境保护和资源节约的需求正催生着众多领域的技术进步, 包括材料创新, 反应器设计和工艺优化等。 无论是作为中间产物或是最终产品, H2 的纯化工艺是石化产业和其他化工产业的关键过程。
目前, 工业上将H2 从混合气中分离/纯化出来的方法包括溶剂法, 吸附法和低温工艺。 在石化产业中, 从含有烃类和CO2 的气流中纯化H2 需要使用上述多种技术。 由于这样的系统非常昂贵且能耗巨大, 近年来, 基于膜分离方法的H2 纯化技术越来越受到关注。 氢纯化膜的类型取决于具体的纯化工艺: 致密的金属膜可以在严苛的条件下工作, 被认为是煤炭转化过程中纯化H2 的最佳选择。 在高温和高压 (6.9 MPa) 下, 致密金属膜依然有很好的氢纯化功能, 非常适合应用于蒸汽重整过程 (SR) 和水煤气变换 (WGS) 过程
[2 ,3 ]
。 此外, 这些金属膜层对H2 具有无限大的选择性, 而且机械性能良好, 易于制造
[4 ]
。
然而, 致密金属膜的应用也面临着一些挑战。 钯和钯的合金是非常昂贵的, 这阻碍了它们工业上的广泛应用; 即使纯Pd在高温下能表现出高的H2 渗透性, 在含有杂质气体时 (H2 S, NH3 , CO和CO2 等) , 纯化性能会大为下降。 与之相比的Pd合金表现出更好的化学稳定性和机械性能, 但这往往是以牺牲氢渗透性为代价的。 美国能源部
[3 ]
制定的金属膜纯化氢气的技术目标包括: 材料成本<$1000/m2 ; 操作温度为250~500 ℃, ΔP (内外压力差) 为2.75~6.90 MPa; 超过5年的使用寿命; 氢气回收率大于90%; 纯度为99.99%。 为了达到这些目标, 并且使致密的金属膜更具商用价值, 研究人员正在开发新的多组分Pd合金膜和其他先进材料以优化金属膜分离系统。
1 钯金属膜的氢纯化机制
1.1 溶解-扩散机制
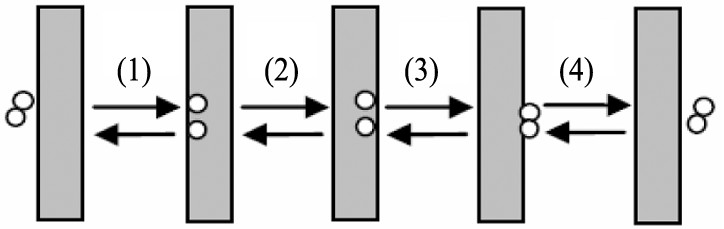
H2 通过致密金属膜的一系列传输过程可总结为“溶液-扩散”机制 (图1) 。 首先, H2 分子吸附在膜的外侧 (上游) 并且在具有催化活性的膜层表面解离成H原子 (1) ; 然后 H原子溶解在金属晶格中并向内层持续扩散 (2) ; 直到在内表层 (下游) 重新结合成氢分子 (3) ; 然后解吸 (4) 。 由于其他大分子气体在钯膜中没有明显的扩散能力, 因此H2 可以从混合物中分离出来, 具有十分理想的选择性。
在实际应用中, H原子在金属膜层基体中的扩散速率明显低于H2 分子在膜层表面上的解离速率。 因此, 氢扩散速率是H2 在钯膜上传输过程的决速步。 H原子稳定通过膜层的流量J H 可由菲克定律 (Fick′ Law) (1) 描述
[2 ,5 ,6 ,7 ,8 ]
:
图1 氢透过钯膜的溶解-扩散机制示意图
Fig.1 Mechanism of hydrogen permeation through palladium membrane
J Η = D Ρ d ( c 1 - c 2 ) x Ρ d ? ? ? ? ? ? ? ? ? ( 1 )
式中, J H 是H原子通过膜的流量 (原子/面积/时间) ; D Pd 是氢原子在Pd晶格中的扩散系数; c 1 和c 2 分别是H原子在膜上游浓度 (“滞留面”) 和下游 (“渗透面”) 浓度。 x Pd 是Pd膜的厚度, 膜厚度出现在这个表达式的分母中, 意味着氢通量随膜的厚度增加而减小。 基于这个原因, 致密金属膜层应设计制造得足够薄。
平衡状态下, c 1 和c 2 是H2 分压的函数, 可由下述Sievert定律 (2) 描述
[2 ,5 ,6 ,7 ,8 ]
:
c 1 =S Pd P
0 . 5 Η 2 , 1 , c 2 =S Pd P
0 . 5 Η 2 , 2 (2)
式中, S Pd 是氢原子在Pd膜层基体中的溶解度; P H2 , 1 和P H2 , 2 是上游和下游的H2 分压。 分压的0.5次幂表示在吸附和解离过程中, 每个H2 分子在膜层表面分解成两个H原子。 将上式 (2) 代入菲克定律 (1) 中, 则有
[2 ,5 ,6 ,7 ,9 ]
:
J Η = D Ρ d S Ρ d ( Ρ 0 . 5 Η 2 , 1 - Ρ 0 . 5 Η 2 , 2 ) x Ρ d = 2 k Ρ d ( Ρ 0 . 5 Η 2 , 1 - Ρ 0 . 5 Η 2 , 2 ) x Ρ d ? ? ? ? ? ? ? ? ? ( 3 )
其中k Pd 即氢原子渗透率 (两个 H原子) , 定义为:
k Ρ d = D Ρ d S Ρ d 2 ? ? ? ? ? ? ? ? ? ( 4 )
渗透性k Pd 是比较膜材料性能的最常用属性。 渗透性是氢气溶解度和扩散系数的乘积, 而且其中每个参数都可以根据合金成分、 合金结构和操作条件
[10 ,11 ,12 ,13 ]
而独立变化。
1.2 选择性的定义
金属膜层在制造和使用过程中, 都会出现一些缺陷。 这些缺陷会导致在使用过程中, 非H2 杂质气体的通过。 因此实际在用的膜层并没有完美的选择性。 膜的选择渗透性 (α ) 可定义为:
α H2 -B =k H2 /k B (5)
比值表示H2 的渗透率与其他气体 (B) 的渗透率之比。 通常情况下, α 的值以在实际应用中有重要意义的CO2 为参比标准; 在实验环境中, 可使用惰性气体 (如N2 ) 作比照。 连续无缺陷Pd膜的α H2 -N2 通常可达到1×104 。
2 氢渗透性的实验表征方法
2.1 膜层的制备
由于膜层测试方法以及具体使用方式不同, 金属膜可以用不同的方法制备成不同的形状。 很多学者都提供了详尽的制备方案
[2 ,7 ,9 ,14 ]
, 在此对一些有工业化应用的膜层制备方法作一总结。
钯合金膜可以是独立式的或是作为多层复合膜结构的核心层。 独立式的膜通常采用冷轧工艺, 根据合金元素组分配比熔化, 在高温下充分混合均匀, 通过多次轧制和退火工艺减小厚度, 获得钯合金箔
[9 ]
。
更薄的独立式钯合金膜可以通过溅射沉积的方法来制备
[7 ,9 ,15 ]
。 将成膜金属制成靶材, Ar离子在电场作用下加速飞向阴极靶, 并以高能量轰击靶表面, 使靶材溅射在基板上
[15 ]
。 但是, 以聚合物或硅片为基板沉积的金属膜很容易脱落
[15 ]
。 实际上, 独立式膜层是需要多孔材料支撑的, 否则在进行渗透性实验时, 前后压差会使薄膜损坏
[15 ,16 ,17 ]
。
在钯复合膜制备中化学镀法应用最为广泛, 是制备致密钯膜最成功的方法之一
[7 ,9 ,14 ]
。 为了方便测试, 元素常被沉积在多孔陶瓷或多孔金属基材上。 陶瓷基材很脆弱, 难以密封在夹具中进行渗透性测试。 多孔金属支撑材料制造简单, 但是孔隙相对较大, 并有可能与Pd合金膜层组分相互扩散, 需要在两者之间附着一层氧化物中间层
[14 ]
。 合金的不同成分通常以序贯沉积的方式依次沉积在基体表面, 镀覆成膜后需要高温退火以形成均一的合金。
2.2 氢纯化性能实验
独立式膜层在进行氢纯化性能实验时, 需要把样品制成圆形平板状, 然后把盘体置于夹具中以提供可靠的物理支撑, 同时也要消除样品边缘的渗漏间隙
[15 ,16 ,17 ]
, 避免膜层与夹具组件金属元素的相互扩散。 管状膜通常以化学镀的方式沉积在多孔陶瓷或多孔不锈钢管上
[18 ,19 ]
。 无论是有支撑的独立式膜层还是管状膜结构, H2 与惰性气体 (N2 ) 或者H2 与WGS组分 (即H2 O, CO和CO2 ) 都位于膜的上游侧, 纯化后的H2 要在膜下游侧收集。 要得到有效的渗透性实验数据, 必须确保膜层本身没有缺陷, 纯化装置密封性良好, 没有泄漏缝隙。
为了得到氢渗透率k 值 (式 (3) ) , 需要测定P H2 , 1 , P H2 , 2 , J H 和x (式 (1~3) ) 。 J H 的测量需要测定通过膜的H2 流速 (总流量乘以H2 浓度) 和膜的有效表面积; 膜层的厚度可由扫描电子显微镜 (SEM) 分析截面加以确定; 通过气相色谱法 (GC) 可测定上游气体组分和下游气体组分; P H2 , 1 和P H2 , 2 可在膜层上下游表面测定。
2.3 膜层的物性表征
渗透性是膜材料的功能特性, 膜材料的物理和化学性质会对功能有重要影响, 需要加以分析。 显然, 弄清合金膜层的元素组成 (包括微量元素) 非常重要。 膜层基体成分通常可通过电感耦合等离子体光谱法 (ICP) 与质谱法联用, ICP-原子发射光谱法或能量色散X射线法 (EDS) 进行分析。 合金膜中的一种或多种元素会富集在膜层表面, 造成膜表面成分与内部基体组成不同。 这种成分偏析会影响膜的渗透性能, 例如, Pd-Ag-Au三元系中, Au会游离到膜层表面, 降低合金的抗H2 S腐蚀能力
[20 ]
。 因此, 对膜层表面组成的表征对于评价膜层腐蚀程度, 分析腐蚀机制有重要意义。 X射线光电子能谱法 (XPS) 可用于测定膜层表面成分偏析以及Pd合金使用后的腐蚀情况
[20 ,21 ,22 ,23 ,24 ,25 ,26 ]
。
膜的结构和组成也影响氢渗透性。 X射线衍射分析 (XRD) 已被广泛应用于膜相结构的表征, 特别是用于确定多组分合金膜材料的结构和检测膜在使用后的腐蚀情况。 扫描电子显微镜 (SEM) 和原子力显微镜 (AFM) 可用于膜表面形貌的表征, 分析膜层功能失效机制。 透射电子显微镜 (TEM) 和电子背散射衍射 (EBSD) 这些更先进的方法也正为分析膜层结构和功能发挥作用。
3 膜层的氢纯化功能
3.1 单金属Pd膜层
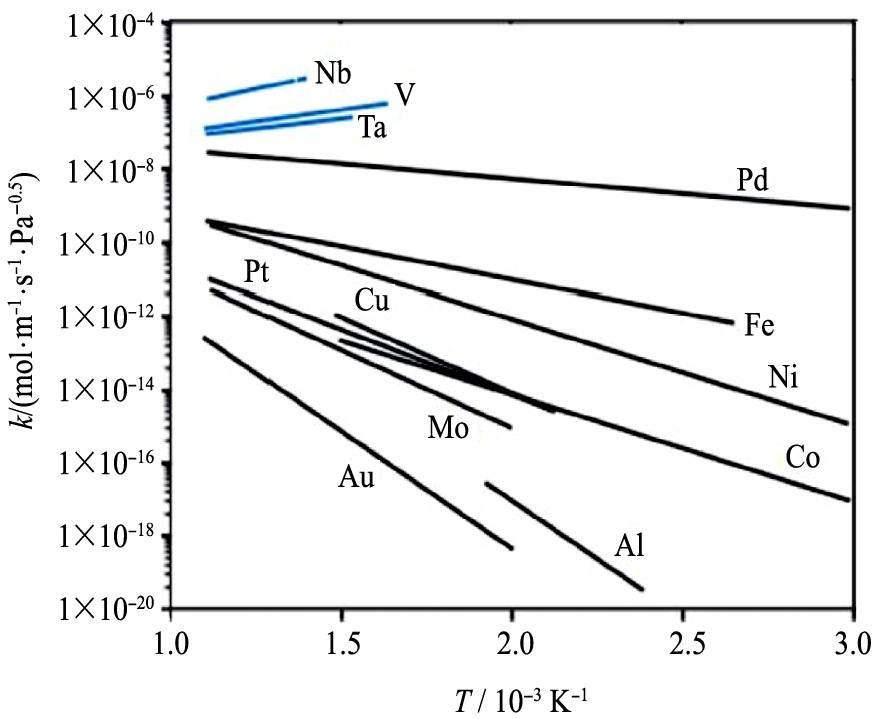
许多金属都有H2 渗透性能, 图2列举了一些金属材料的氢渗透率。 这些材料的氢渗透性都不高: 例如Pd, k =1×10-8 mol·m-1 ·s-1 ·Pa-0.5 , 且厚度须小于20 μm。 V族金属V, Nb和Ta表现出最高的渗透性
[2 ,5 ]
, 它们通常被称为“超透气”金属。 V族金属的高渗透性与它们的体心立方 (BCC) 结构有关。 相比于面心立方 (FCC) 结构, BCC结构的金属每个晶胞原子数更少, 这意味着该结构具有较低的原子堆积密度, 因而具有较高密度的八面体和四面体间隙, 这些特征都有利于降低氢原子的扩散阻碍
[2 ,5 ]
。 然而, 即使是在室温下, V族金属的表面也会在空气中迅速氧化
[27 ]
, 这层氧化膜对H2 不具有解离催化活性。 为此有学者开发出多层复合膜结构, 以抗氧化的Pd膜层包覆高通透性易氧化核心层
[5 ,8 ]
。 在这种结构中, 整体的渗透率与各个膜层均相关
[8 ]
。 采用这种方法必须考虑不同膜层之间的元素互扩散。
图2 一些纯金属的氢渗透率
Fig.2 Hydrogen permeabilities of pure metals as functions of temperature
Pd因为具有高的H2 渗透性 (至少比其他FCC结构单金属膜渗透性高一个数量级, 图3) 和H2 分子表面解离活性而被广泛用于氢气分离/纯化研究中。 这些属性反映了H2 与Pd的独特相互作用机制。 H原子在Pd表面上能稳定存在, 这有助于提高H解离活性; 而且H原子在Pd基体内也很稳定, 因而具有高的溶解度。
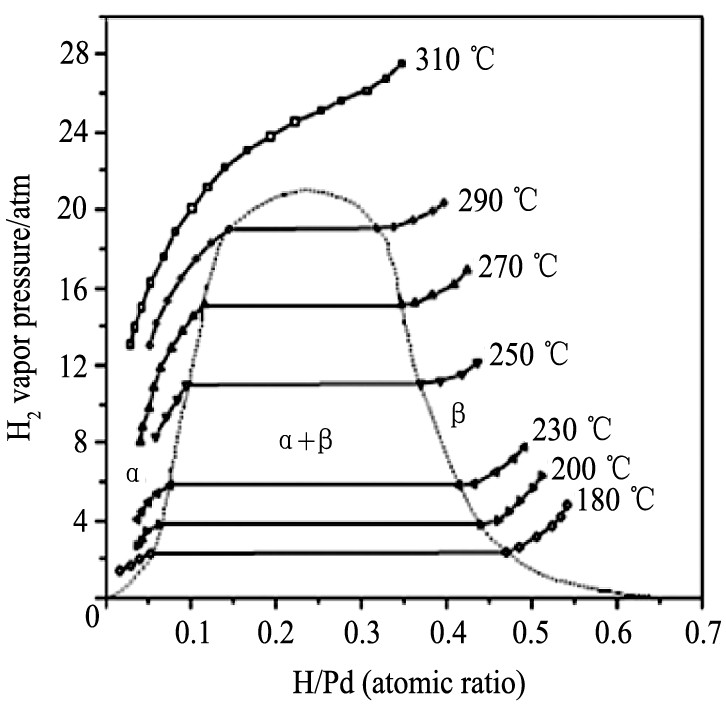
图3 Pd-H相图
Fig.3 Pd-H phase diagram
[7]
然而由于一些实际原因, 纯Pd很少用作氢纯化材料。 最主要的是成本问题: 即使是较薄的Pd层也会显著增加了氢气的纯化成本, 一平方米 20 μm厚的钯膜需要的钯金属原料成本约为4000元。 另一个原因是在吸氢过程中, Pd的机械性能会受到影响。 Pd-H相图如图3所示
[7 ]
。 钯的氢化物 (Pd-H) 可以有两个不同的相: α相和β相。 在β相中, H原子有序填充于八面体间隙中, 保持稳定; 而α相是H原子无规则分布的固溶体相, H原子能够在整个空隙中活动
[5 ]
。 温度低于295 ℃ (相转变临界温度) 时, α相和β相的相互转变引起的晶格体积变化高达10%, 这会导致钯膜的内部应力过大, 使膜层断裂
[5 ,7 ]
。
混合气体中的非氢组分也会造成Pd膜纯化性能下降。 在化石燃料加工过程中, 含硫化合物无处不在, 这些硫化物对Pd膜有很强的毒化作用
[16 ,28 ]
。 图4显示了H2 S对纯Pd膜渗透性的影响
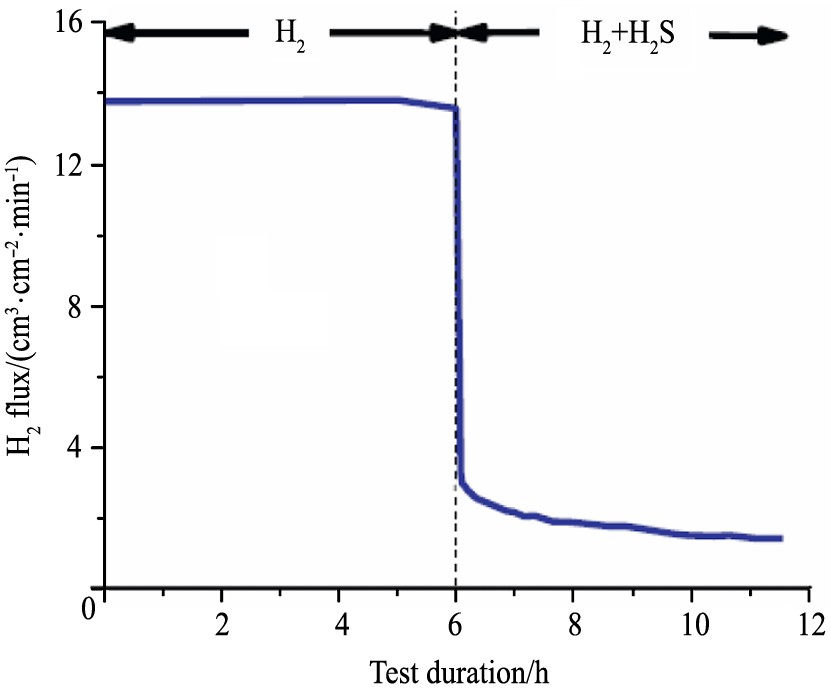
[25 ]
。 研究人员首先在350 ℃下, 向25 μm厚的Pd膜上通入纯H2 。 流量稳定后, 向H2 中加入1000×10-6 H2 S, 此时, H2 渗出量立即下降了75%。 这说明H2 S能显著降低Pd膜的氢渗透速率, 其原因是膜表面上H2 解吸速率的降低。 具体而言, 渗透性的缓慢下降与低渗透率Pd4 S垢层的形成和增长有关
[16 ,25 ]
。
图5的热重分析实验结果显示, Pd箔暴露在H2 S期间会吸收S元素
[16 ]
, 生成Pd4 S。 而Pd4 S的渗透性比Pd小一个数量级
[6 ,16 ,29 ]
。 同时, 第一性原理计算表明, 在Pd4 S上H2 的解吸能为0.8 eV, 而纯钯为0 eV
[21 ]
, 这足以大幅降低氢解吸速率。 通过H2 -D2 微观交互动力学实验分析发现, 在一定浓度H2 S存在下, Pd4 S的生成提高了氢原子解吸能
[30 ]
。 同时, 实验结果还显示H2 S能进一步通过阻隔一部分H2 解吸活性位点来降低渗透效率。
图4 向25 μm厚钯膜引入1000×10-6的H2S后氢渗透量的显著下降情况 (350 ℃)
Fig.4 Hydrogen flux through 25 μm thick Pd membrane at 350 ℃
[25]
图5 热重分析测定钯的硫化物生成厚度随暴露时长的关系
Fig.5 S uptake in a thermogravimetric experiment and scale layer growth at similar conditions
其他杂质气体, 包括CO和H2 O, 也可以降低渗透速率。 CO可以吸附在Pd膜表面, 阻断H2 解吸位点; H2 O解离出的O占据在Pd膜层表面, 抑制氢原子的解吸。
3.2 Pd合金其他成分的作用
为了克服纯Pd所面临的问题, 可通过加入其他元素对纯Pd膜进行合金化。 二元甚至多元素组分的合金化, 可对Pd膜结构进行调控, 有助于多维度调整合金膜氢渗透性能。 用Ag
[31 ,32 ]
, Ni
[33 ]
或Pt
[34 ]
合金化Pd可以降低Pd的α-β相转变温度, 并且减小由此引发的晶格畸变的程度
[7 ]
。 用Y, Cu或Ru合金化Pd会增加膜层硬度和极限拉伸强度
[35 ]
。
合金组分也可以增加Pd膜的H原子渗透性。 如前所述, 渗透性取决于H原子溶解度和在基体中的扩散性两个方面, 合金元素的引入对上述两个因素均有影响
[10 ,11 ,12 ]
。 从结构上来说, 合金元素的原子会增大FCC相Pd的晶格参数, 从而提高H原子溶解度, 使氢原子的扩散更容易
[7 ]
。 图6显示了氢渗透率如何随着合金元素组分的原子半径变化而变化情况
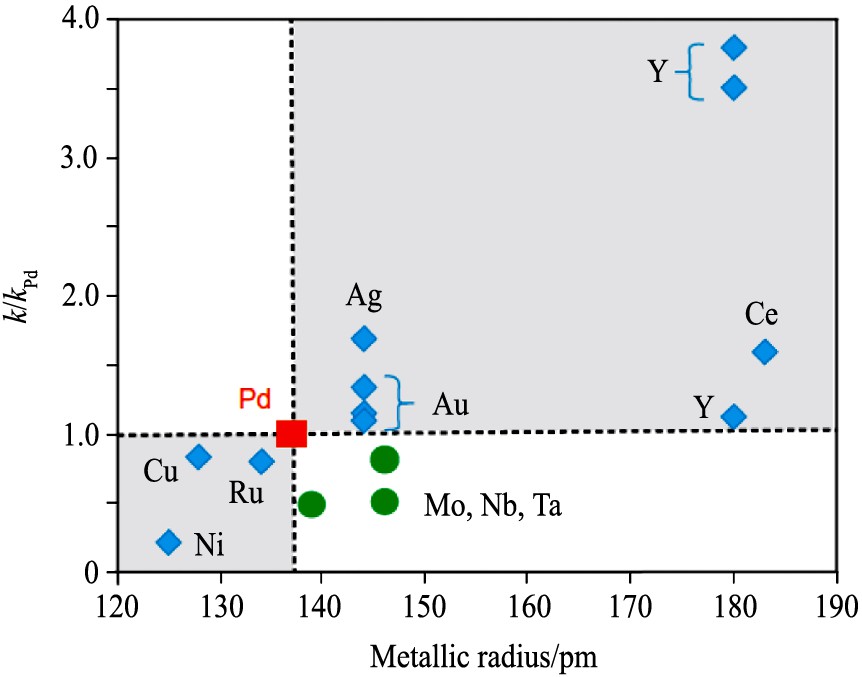
[7 ,36 ,37 ,38 ]
(相对于400 ℃时的纯Pd, 合金组分含量<10%) 。 原子半径比Pd小的元素, 例如Cu, Ru和Ni, 降低了Pd膜的渗透性。 而原子半径较大的元素, 通常包括Au, Ag, Ce和Y等, 增加Pd膜的渗透性
[7 ,39 ]
。 Mo, Nb和Ta的原子半径均大于Pd, 它们使合金渗透性降低的原因可能是它们的对氢的溶解度过低
[38 ]
。
图6 不同元素 (比例<10%) 与钯合金化后的氢渗透率 (400 ℃)
Fig.6 Permeabilities of Pd alloys relative to Pd at 400 ℃ with minor components present at <10%
Semidey-Flecha和Shell
[40 ]
通过第一性原理计算, 得到了一系列Pd96 M4 (M表示金属元素) 二元合金的氢渗透率。 这与实验测量值 (图5) 基本一致: M=Cu, Ni和Ru的计算渗透率都低于Pd; 对于M=Ag, 则高于纯Pd; 当M=Au时, 计算结果显示会对氢渗透性起一定的抑制作用。
3.2.1 Pd-Cu
由于PdCu具有抗H2 S毒化的潜力, 因此受到了广泛关注。Howard等
[17 ]
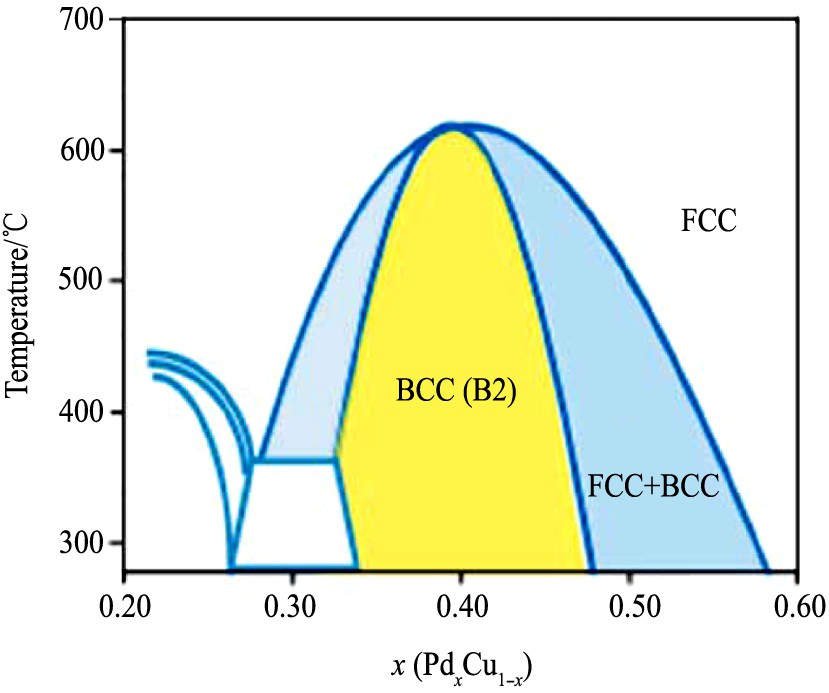
全面汇总了有关PdCu合金氢渗透性的文献报道。在实际工业纯化应用中, 不同温度范围内PdC u显示不同的结构 (图7)
[41 ]
。在大部分组成-温度区间内, PdC u以低渗透率随机无序的FCC固溶体结构
[42 ,43 ]
存在。Cu的原子半径小于Pd, 会降低合金的晶格参数。但是, 在中间浓度下和较低低温度下 (<600℃) , PdCu呈现BCC结构, 表现出更高的渗透性
[42 ,43 ]
。
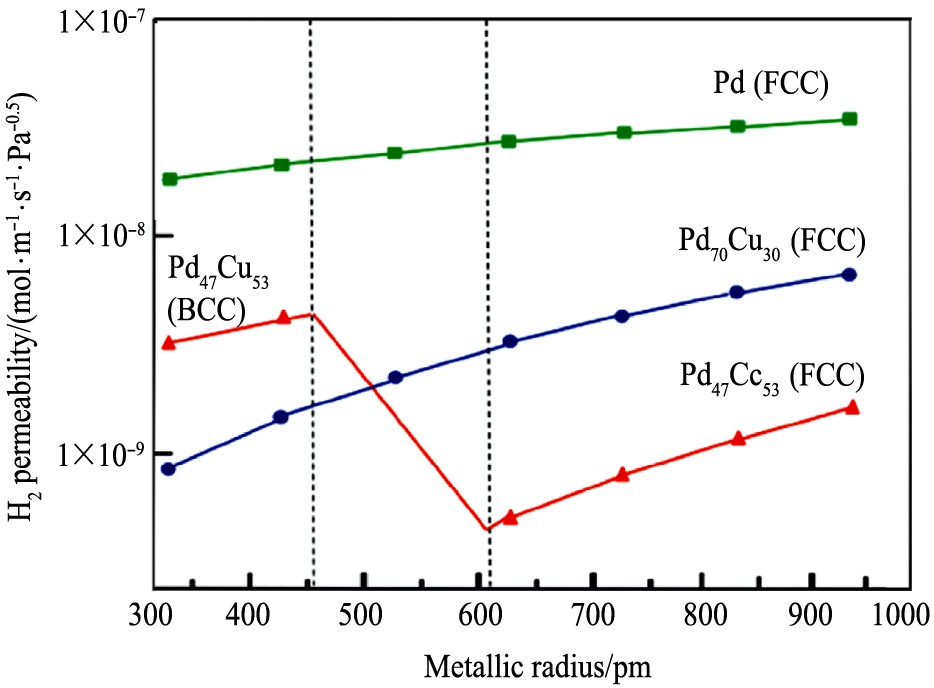
图8是用第一性原理计算的方法, 比较了Pd, Pd70 Cu30 和Pd47 Cu53 的渗透率
[43 ]
。 Pd70 Cu30 仅以FCC形式存在, 且渗透性比纯Pd要低, 随着使用温度升高, 合金渗透性增加。 Pd47 Cu53 的渗透率也低于纯Pd, 而且不随温度的升高而单调增加, 在低温下呈BCC相, 具有较高的渗透性。
图7 Pd-Cu相图
Fig.7 Pd-Cu phase diagram
[41]
图8 第一性原理计算得到的Pd, Pd70Cu30和Pd47Cu53的渗透率
Fig.8 Computed permeabilities for Pd, Pd70 Cu30 , and Pd47 Cu53
[43]
最早关于PdCu膜抗H2 S毒化能力的报道是McKinley 1967年的专利
[37 ]
。 他发现高渗透性的Pd47 Cu53 在通过含有5×10-6 H2 S的 H2 两天后 (350 ℃) , 氢渗透能力下降了93% (相对于纯H2 ) 。 作为参考, 纯Pd样品在相同条件下只损失了69%的渗透性能
[37 ]
。 这表明, 合金的抗H2 S毒化能力可能不如纯Pd。 但是, PdCu合金的抗H2 S毒化性能与很多因素都可能有关, 包括合金成分, H2 S浓度和实验温度等, 该专利没能做进一步的探讨。
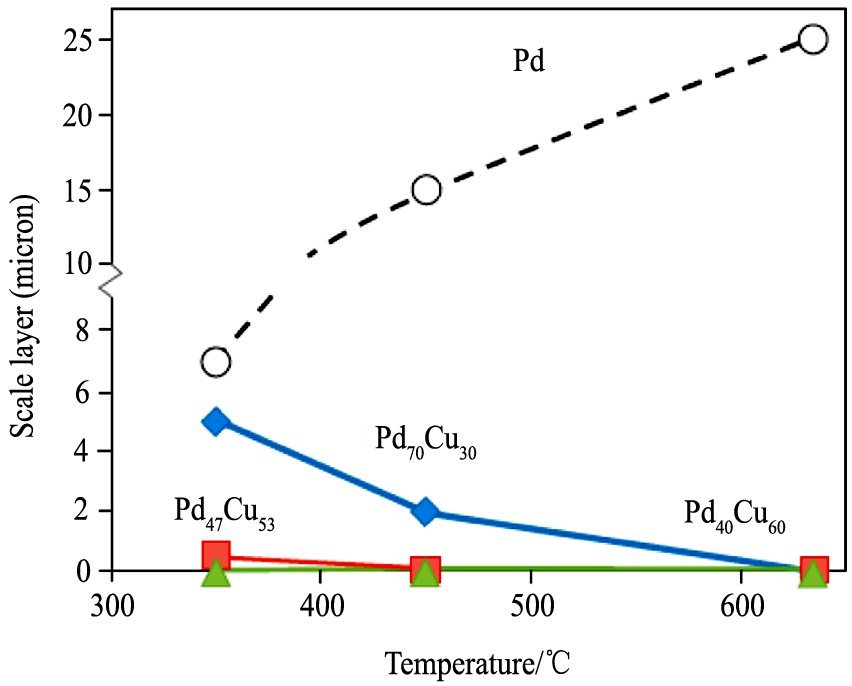
Morreale
[16 ]
将纯Pd, Pd70 Cu30 , Pd47 Cu53 和Pd40 Cu60 在一定的温度范围内, 进行H2 S浓度为1000×10-6 的氢渗透实验, 为期5 d。 结果发现 (图9) , 随着温度从350升至635 ℃, 纯Pd表面上形成的硫化物的厚度随着温度升高而快速增加, 这说明H2 S和Pd之间的反应速率随温度的升高而增加。 而Cu元素的引入能使硫化物的厚度减小, 取得良好的抗硫化性能。 在635 ℃和1000×10-6 H2 S的存在下, 所有3种合金的H2 渗透量接近通过纯H2 时的流量, 说明抗硫化性能良好。 当温度更低时, Cu含量越大合金的抗硫化性能越好。
图9 纯Pd, Pd70Cu30, Pd47Cu53和Pd40Cu60氢渗透性实验 (1000×10-6 H2S ) 5 d形成的硫化物厚度
Fig.9 Thickness of sulfide scale forming on Pd and Pd70 Cu30 , Pd47 Cu53 , and Pd40 Cu60 alloys upon exposured to 1000×10-6 H2 S in H2 for 5 d as functions of temperature
[16]
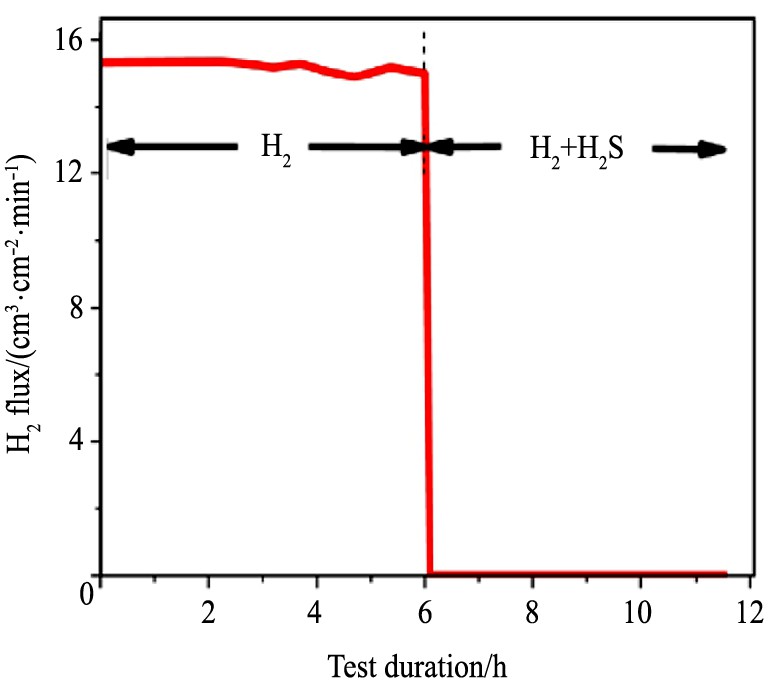
但是, 硫化物膜的减少并不能保证H2 的高渗透性。 在较低的温度下, H2 S会抑制H2 通过, 即使合金膜层表面没有明显的硫化物层出现。 例如 (图10) , 在350 ℃时, 向纯H2 中加入1000×10-6 H2 S后, 通过Pd47 Cu53 膜的H2 流量立即下降至零
[25 ]
。
图10 25 μm厚Pd47Cu53膜的氢气通量 (350 ℃)
Fig.10 Hydrogen flux through 25 μm thick Pd47 Cu53 membrane at 350 ℃
[25]
这种现象的出现是因为H2 S抑制了H2 分子在膜表面的解吸。
对PdCu膜进行H2 -D2 微动力学交互实验, 发现在较低温度时, 合金渗透性下降的原因是H2 S既提高了H2 的解吸能, 又阻隔了膜表面一部分用于氢解吸的活性位点
[30 ]
。 解吸能的增加可能与形成的一层极薄 (未被XRD检测到) 硫化层有关
[25 ]
。 随着温度增加, 硫化氢易从表面脱附, 会空出更多的活性位点使H2 解吸。 因此活性位点被阻隔可能是降低氢渗透的主要原因。
PdCu膜与H2 S的作用机制也可以用来讨论PdCu膜纯化WGS混合气的过程。 Roa等
[19 ]
进行了分别将Pd90 Cu10 膜暴露于添加H2 S和未添加H2 SWGS混合气 (CO, CO2 , H2 O, H2 ) 的氢渗透实验。 他发现WGS混合气体组分本身会抑制H2 的渗透, 400 ℃时, WGS混合气中的H2 渗透量比H2 ∶N2 (各50%) 混合气低30%。 向WGS混合气中仅添加5×10-6 的H2 S, 当前氢渗透流量会迅速减半。 值得注意的是, 对于Pd90 Cu10 , 加入硫化氢造成的渗透性损失是可通过升温快速恢复的。 这表明, 在WGS混合气中少量 (10×10-6 ~50×10-6 ) H2 S抑制氢渗透的原因是合金膜层表面解吸活性位点被H2 S阻隔。
由于膜制备方法, 合金组成, 混合气体组成和H2 S浓度的不同, 很难总结出PdCu膜氢渗透性能的归一化结论。 很明显, 表面解吸活性位点阻隔机制很好地解释了PdCu膜在H2 S存在下氢渗透性降低的原因, 在低温和浓H2 S下, 毒化效果更为明显。
3.2.2 Pd-Au
通过添加Au元素也可改善Pd膜的抗H2 S毒化性能。McKinley
[37 ]
在他的专利中报道了H2 S对PdAu氢渗透性能的影响。 他向H2 中通入5×10-6 H2 S进行Pd73 Au26 膜氢渗透实验, 持续两天后, 发现H2 渗透流量仅减少了13%。 这比纯Pd膜 (降低了69%) 以及PdCu合金膜 (降低了93%) 的渗透性都要好。 在20×10-6 H2 S时, 相似组分的膜只损失了57%的H2 渗透性能。 Braun等
[44 ]
将Pd91 Au9 置于100×10-6 H2 S浓度下进行24 h氢渗透性实验 (400 ℃) , 合金的渗透率损失了60%, 移除H2 S后, 损失的渗透能力大幅恢复。 Chen等
[18 ]
将Pd95.5 Au4.5 置于100×10-6 H2 S浓度下进行氢渗透性实验 (400 ℃) , 4 h后发现氢渗透率损失了85%。 移除H2 S后, 损失的渗透能力也能大幅恢复, 将合金膜在纯H2 中加热至500 ℃后, 渗透能力完全恢复。 将在纯氢中恢复后的膜层进行XRD分析, 结果显示没有硫化物生成
[18 ]
。 这些现象说明H2 S对PdAu合金的毒化是一种表面解吸活性位点阻隔机制。
Coulter等
[36 ]
和Gade等
[45 ]
测试了Pd94 Au6 和Pd88 Au12 合金在纯H2 和WGS混合气中的氢渗透能力。 他们发现, 400 ℃时, 这两种合金的氢渗透率大于纯Pd。 在WGS混合物中, Pd94 Au6 的H2 渗透性降低了约30%
[36 ,45 ]
。 添加20×10-6 的H2 S后, 渗透性进一步降低。 在WGS混合气中, Pd88 Au12 膜的氢渗透量与通入纯H2 的量相同, 说明Au元素比例的上升改善了膜层在WGS中的氢渗透能力
[45 ]
。 继续以Gade的Pd88 Au12 样品为研究对象, 向WGS混合气中添加20×10-6 的H2 S, 膜的渗透性降低了40%。 XRD检测发现有Pd4 S的生成, 这可能是膜层渗透性损失的原因
[45 ]
。
由于合金成分、 制造方法、 混合气体浓度和测试条件的不同都会对氢纯化性能产生影响, 通过上述文献来比较Au和Cu元素的引入对膜层渗透性的影响是较为困难的。 例如, 在低温 (350 ℃) 条件下, 仅有H2 S混入的情况下, PdAu合金比PdCu合金表现出更高的抗硫化性能
[37 ]
; 在WGS混合气中, Pd94 Au6 和Pd90 Cu10 在有H2 S时, 渗透性都损失了约50%。 但是PdCu膜和PdAu膜被H2 S毒化的机制不尽相同。 PdCu膜更接近被整体硫化, 而PdAu仅仅在表层形成硫化物层。
4 展 望
Pd基合金膜具有接近完美的氢气选择性和可在高温下工作的能力, 在纯化H2 方面具有广阔的应用前景。 但是其在工业化应用方面面临的挑战依然存在。 首先是在严苛的工艺条件下, 膜层的机械稳定性和抗毒化性能有待提高, 基于计算和实验开发出的一系列Pd合金膜正在改善这些性能。 第二个挑战是低成本制造大面积无缺陷合金膜的工艺有待进一步开发。
Pd基合金膜纯化氢的独特功能及其为提高氢纯化效率的巨大潜力推动了相关课题的研究。 相信在不久的将来, 氢纯化用Pd基合金膜能为人类获得清洁能源做出贡献。
参考文献
[1] Energy Information Administration.International energy outlook 2013 [R].Washington, DC:U.S.2013.2.
[2] Ockwig N W, Nenoff T M.Membranes for hydrogen separation.[J].Chemical Reviews, 2007, 107 (10) :4078.
[3] Department of Energy 2010.Hydrogen from coal program:research, development and demonstration plans, 2010~2016 [R].2010.10.
[4] Morreale B, Ciferno J, Howard B.Gasification and associated degradation mechanisms applicable to dense metal hydrogen membranes [J].Inorganic Membranes for Energy & Environmental Applications, 2009:173.
[5] Dolan M D.Non-Pd BCC alloy membranes for industrial hydrogen separation [J].Journal of Membrane Science, 2010, 362 (1-2) :12.
[6] O′Brien C P, Gellman A J, Morreale B D.The hydrogen permeability of Pd4 S [J].Journal of Membrane Science, 2011, 371 (1-2) :263.
[7] Yun S, Oyama S T.Correlations in palladium membranes for hydrogen separation:a review [J].Journal of Membrane Science, 2011, 375 (1) :28.
[8] Morreale B, Ciferno J, Howard B.Gasification and Associated Degradation Mechanisms Applicable to Dense Metal Hydrogen Membranes [M].Inorganic Membranes for Energy and Environmental Applications.New York:Springer, 2009.173.
[9] Basile A, Iulianelli A, Longo T.Pd-Based Selective Membrane State-of-the-Art [M].Membrane Reactors for Hydrogen Production Processes.London:Springer, 2011.21.
[10] Chen L, Semidey-Flecha L, Sholl D S.First-principles screening of PdCuAg ternary alloys as H2 , purification membranes [J].Journal of Membrane Science, 2011, 371 (1-2) :189.
[11] Sholl D S.Using density functional theory to study hydrogen diffusion in metals:a brief overview [J].Journal of Alloys & Compounds, 2007, s446-447 (22) :462.
[12] Sholl D S, Ma Y H.Dense metal membranes for the production of high-purity hydrogen [J].Mrs.Bulletin, 2006, 31 (10) :770.
[13] Sonwane C G, Wilcox J, Ma Y H.Solubility of hydrogen in PdAg and PdAu binary alloys using density functional theory [J].Journal of Physical Chemistry B, 2006, 110 (48) :24549.
[14] Morreale B D, Ciferno J, Howard B H, Ciocco M V, Marano J, Iyoha O.Gasifaction and associated degradation mechanisms applicable to dense metal hydrogen membranes.In:Bose AC, editor.Inorganic membranes for energy and environmental applications.New York:Springer Sciencet Business Media, LLC, 2009.173.
[15] Lanning B R, Ishteiwy O, Way J D.Un-supported palladium alloy membranes for the production of hydrogen [J].2009.
[16] Morreale B D.The Influence of H2 S on Palladium and Palladium-Copper Alloy Membranes [D].Chemical Engineering, University of Pittsburgh, 2006.
[17] Howard B H, Killmeyer R P, Rothenberger K S.Hydrogen permeance of palladium-copper alloy membranes over a wide range of temperatures and pressures [J].Journal of Membrane Science, 2004, 241 (2) :207.
[18] Chen C H, Ma Y H.The effect of H2 S on the performance of Pd and Pd/Au composite membrane [J].Journal of Membrane Science, 2010, 362 (1) :535.
[19] Roa F, Thoen P M, Gade S K.Palladium-Copper and Palladium-Gold Alloy Composite Membranes for Hydrogen Separations [M].Inorganic Membranes for Energy and Environmental Applications.New York:Springer, 2009.221.
[20] Braun F, Miller J B, Gellman A J.PdAgAu alloy with high resistance to corrosion by H2 S [J].International Journal of Hydrogen Energy, 2012, 37 (23) :18547.
[21] Miller J B, Alfonso D R, Howard B H.Hydrogen dissociation on Pd4 S surfaces [J].Office of Scientific & Technical Information Technical Reports, 2009, 113 (43) :18800.
[22] Miller J B, Matranga C, Gellman A J.Surface segregation in a polycrystalline Pd70 Cu30 alloy hydrogen purification membrane [J].Surface Science, 2008, 602 (1) :375.
[23] Miller J B, Morreale B D, Gellman A J.The effect of adsorbed sulfur on surface segregation in a polycrystalline Pd70 Cu30 alloy [J].Surface Science, 2008, 602 (10) :1819.
[24] Miller J B, Priyadarshini D, Gellman A J.Segregation at the surfaces of Cux Pd1 -x alloys in the presence of adsorbed S [J].Surface Science, 2012, 606 (19-20) :1520.
[25] O′Brien C P, Howard B H, Miller J B.Inhibition of hydrogen transport through Pd and Pd47 Cu53 membranes by H2S at 350 ℃ [J].Journal of Membrane Science, 2010, 349 (1-2) :380.
[26] Priyadarshini D, Kondratyuk P, Picard Y N.High-throughput characterization of surface segregation in Cux Pd1 -x alloys [J].Journal of Physical Chemistry C, 2011, 115 (20) :10155.
[27] Buxbaum R E, Marker T L.Hydrogen transport through non-porous membranes of palladium-coated niobium, tantalum and vanadium [J].Journal of Membrane Science, 1993, 85 (1) :29.
[28] Morreale B D, Ciocco M V, Howard B H.Effect of hydrogen-sulfide on the hydrogen permeance of palladium-copper alloys at elevated temperatures [J].Journal of Membrane Science, 2004, 241 (2) :219.
[29] Morreale B D, Howard B H, Osemwengie Iyoha.Experimental and computational prediction of the hydrogen transport properties of Pd4 S [J].Ind.Eng.Chem.Res., 2007, 46 (19) :6313.
[30] Casey P O′ Brien, Miller J B, Morreale B D.The kinetics of H2 -D2 exchange over Pd, Cu, and PdCu surfaces [J].The Journal of Physical Chemistry C, 2011, 115 (49) :24221.
[31] Timofeev N I, Berseneva F N, Gromov V I.Influence of preliminary hydrogen impregnation on the mechanical properties of palladium and its alloys with silver [J].Soviet Materials Science:a Transl.of Fiziko-Khimicheskayamekhanikamaterialov/Academy of Sciences of the Ukrainian SSR, 1982, 17 (5) :417.
[32] Hunter J B.Commercial development of palladium alloy diffusion cells [J].Platinum Mat.Rev., 1960, 4:130.
[33] Sakamoto Y, Yuwasa K, Hirayama K.X-ray investigation of the absorption of hydrogen by several palladium and nickel solid solution alloys [J].Journal of the Less Common Metals, 1982, 88 (1) :115.
[34] Yoshida H, Okuno K, Kashiwai T.Metallurgical considerations of Pd, Pd-alloy and metal-hydrogen systems [J].International Journal of Applied Radiation & Isotopes, 1985, 36 (7) :591.
[35] Burkhanov G S, Gorina N B, Kolchugina N B.Palladium-based alloy membranes for separation of high purity hydrogen from hydrogen-containing gas mixtures [J].Platinum Metals Review, 2011, 55 (55) :3.
[36] Coulter K E, Way J D, Gade S K.Sulfur tolerant PdAu and PdAuPt alloy hydrogen separation membranes [J].Journal of Membrane Science, 2012, s405-406 (s405-406) :11.
[37] Mckinley D L.Metal alloy for hydrogen separation and purification [P].US:US3350845.1967.
[38] Peters T A, Kaleta T, Stange M.Development of thin binary and ternary Pd-based alloy membranes for use in hydrogen production [J].Journal of Membrane Science, 2011, 383 (1) :124.
[39] Gryaznov V.Metal containing membranes for the production of ultrapure hydrogen and the recovery of hydrogen isotopes [J].Separation & Purification Methods, 2000, 29 (2) :171.
[40] Semideyflecha L, Sholl D S.Combining density functional theory and cluster expansion methods to predict H2 permeance through Pd-based binary alloy membranes [J].Journal of Chemical Physics, 2008, 128 (14) :144701.
[41] Subramanian P R.Cu-Pd (copper-palladium) [J].Journal of Phase Equilibria, 1991, 12 (2) :231.
[42] Kamakoti P, Sholl D S.A comparison of hydrogen diffusivities in Pd and CuPd alloys using density functional theory [J].Journal of Membrane Science, 2003, 225 (1-2) :145.
[43] Kamakoti P, Morreale B D, Ciocco M V.Prediction of hydrogen flux through sulfur-tolerant binary alloy membranes.[J].Science, 2005, 307 (5709) :569.
[44] Braun F, Tarditi A M, Miller J B.Pd-based binary and ternary alloy membranes:morphological and perm-selective characterization in the presence of H2 S [J].Journal of Membrane Science, 2014, 450 (2) :299.
[45] Gade S K, Devoss S J, Coulter K E.Palladium-gold membranes in mixed gas streams with hydrogen sulfide:effect of alloy content and fabrication technique [J].Journal of Membrane Science, 2011, 378 (1) :35.