离子液体中置换法制备镁/铜双金属粉的动力学研究
昆明理工大学冶金与能源工程学院
昆明理工大学省部共建复杂有色金属资源清洁利用国家重点实验室
摘 要:
研究了氯代1-丁基-3-甲基咪唑(BMIC)离子液体中镁置换铜制备镁/铜双金属粉的动力学行为,探讨了搅拌速率、反应温度、铜离子浓度和镁粉颗粒大小等参数对反应速率常数的影响。动力学数据结果表明,在离子液体中镁置换铜的反应符合一级反应速率方程。反应速率常数随着搅拌速率增加、反应温度升高、铜离子浓度降低和镁粉粒径减小而增大。搅拌可使反应速率常数增大1倍左右;Cu(II)离子浓度较小时,反应速率常数随Cu(II)离子浓度的增加而迅速减小,当Cu(II)离子浓度增大到0.25 mol·L-1时,速率常数的减小趋势逐渐变缓;镁粉粒径范围从50~74μm增加到74~100μm,置换反应的速率常数从0.334 h-1减小到0.255 h-1;反应速率常数与反应温度的关系符合阿伦尼乌斯方程,求得置换反应表观活化能为13.6 k J·mol-1,说明置换过程受扩散控制。此外,Evans图研究也表明,置换反应受Cu(II)离子向电极表面扩散过程控制。这一结果与动力学数据的实验结果完全一致。
关键词:
中图分类号: TG139.7;TB383.3
作者简介:刘海鹏(1985-),男,甘肃张掖人,硕士研究生,研究方向:有色金属冶金;E-mail:419175008@qq.com;;徐存英,教授;电话:0871-65198154;E-mail:xucunying@aliyun.com;
收稿日期:2014-04-01
基金:国家自然科学基金项目(21263007,51274108);云南省自然科学基金重点项目(2011FA009);昆明理工大学人才培养项目(14118441)资助;
Kinetics of Preparation of Mg/Cu Bimetallic Powder in Ionic Liquid by Displacement Method
Liu Haipeng Xu Cunying Hua Yixin Li Jian Zhao Jiwen Wang Zhen
Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology
State Key Laboratory of Complex Nonferrous Metal Resources Cleaning Utilization,Kunming University of Science and Technology
Abstract:
The kinetics of preparation of Mg / Cu bimetallic powder in 1-butyl-3-methylimidazolium chloride( BMIC) ionic liquid by displacement method was studied. The influence of initial concentration of copper ions,reaction temperature,grain size of magnesium and stirring speed on the reaction rate constant was investigated. Dynamic results indicated that the replacement reaction followed first order reaction kinetics equation,and the reaction rate constant increased with the increase of temperature and stirring rate and the decrease of Cu(Ⅱ) concentration in ionic liquid. The reaction rate constant could be increased by about one time through stirring. As the concentration of Cu(Ⅱ) was lower,the reaction rate constant quickly decreased with the concentration of Cu(Ⅱ) increasing. When the concentration of Cu(Ⅱ) increased to 0. 25 mol·L- 1,the reaction rate constant decreased slowly as the concentration of Cu(Ⅱ) further increased. With the grain size of magnesium increasing from 50 ~ 74 μm to 74 ~ 100 μm,the reaction rate constant decreased from0. 334 to 0. 255 h- 1. The temperature dependence of reaction rate constant followed Arrhenius equation. The apparent activation energy of the reaction was 13. 6 k J·mol- 1and the replacement process was controlled by diffusion. Furthermore,Evans diagram showed that the replacement process was controlled by the diffusion of Cu(Ⅱ) to the surface of the electrode. These results were entirely consistent with the experimental results of kinetic data.
Keyword:
displacement method; Mg / Cu bimetallic powder; kinetics; ionic liquid;
Received: 2014-04-01
镁铜储氢合金具有吸氢量大、电化学储氢容量高、资源丰富、价格低廉、环境负荷小以及吸放氢平台好等优点,成为最具开发前景的储氢材料之一[1,2,3]。目前,制备镁铜储氢合金的主要方法有高温熔炼法、粉末烧结法、机械合金法、氢化燃烧合成法、置换扩散法等[4,5,6,7,8,9]。而利用置换反应制备镁/铜双金属粉,然后通过热扩散形成镁铜合金的置换扩散法,具有设备及操作简单、能耗低、而且所得合金粉末易于活化,吸放氢动力学性能较好等特点,是一种制备镁铜储氢合金的有效方法[10]。 但镁是一种活泼金属,不能采用水溶液作为镁置换铜反应的介质。虽然有机溶剂可用于镁置换铜, 但有机溶剂挥发性大、毒性强、对无机盐的溶解能力有限,金属粉体在有机溶剂中分散困难。因此, 科技工作者们正在寻找一种性能更好的溶剂来制备镁/铜双金属粉,而离子液体的出现为该项研究提供了可能。
离子液体是由特定阳离子和阴离子构成的在室温或近于室温下呈液态的熔盐体系,具有挥发性小、热稳定性高、液态范围大、电化学窗口宽 ( 一般大于4 V) 、可溶解高浓度的金属盐( 可达5 mol·L- 1以上) 等优点,其应用领域十分广阔[11,12,13,14,15]。 在用置换法制备双金属粉方面,离子液体是一种优越的溶剂,不仅可以用Al,Mg等活泼金属置换其他电位较正的金属,而且可使反应在较高的温度( 可达300 ℃) 下进行。置换反应的动力学参数控制是制备包覆型双金属粉的关键,因此,研究离子液体中制备镁/铜双金属粉的动力学行为对于控制制备包覆型镁/铜双金属具有重要意义。
本文通过研究离子液体中置换反应制备镁 /铜双金属粉的动力学及其影响因素,为镁置换铜制备特定组成包覆型镁/铜双金属粉提供理论指导, 以期通过热扩散得到高质量的镁铜储氢合金。
1实验
1.1试剂和设备
试剂: N-甲基咪唑( ≥99% ,上海三微实业有限公司) ,氯代正丁烷( 化学纯) ,甲苯( 分析纯) , 乙酸乙酯( 分析纯) ,无水氯化铜( 分析纯) ,无水氯化镁( 分析纯) ,镁粉( 99% ,上海化学试剂有限公司) 。除氯代正丁烷经过蒸馏提纯外,其它试剂均未进一步提纯。
设备: CHI1760电化学工作站( 上海辰华仪器公司) ,RET basic恒温磁力加热搅拌器( 德国IKA公司) ,EYEL4N-1100型旋转蒸发仪( 上海爱朗仪器有限公司) ,TGL-12GB-C高速台式离心机( 上海安亭科学仪器厂离心机) 。
1.2氯化1-丁基-3-甲基咪唑(BMIC)的制备
将N-甲基咪唑和氯代正丁烷以摩尔比1. 0∶ 1. 2加到三颈瓶中,用甲苯作溶剂,在氩气气氛保护下,加热回流24 h后停止反应,静置分层除去甲苯和未反应完全的氯丁烷,然后用乙酸乙酯重结晶除去残余的杂质,最后在80 ℃ 真空干燥48 h, 得到淡黄色的BMIC离子液体,放置到真空干燥器中备用。
1.3溶液的配置
含Cu( II) 离子的BMIC离子液体溶液配制: 将无水Cu Cl2溶解于BMIC离子液体中,分别配制成Cu( II) 离子浓度为0. 005,0. 010,0. 050,0. 150, 0. 250,0. 350,0. 450,0. 550,0. 500 mol·L- 1的离子液体溶液。
含Mg( II) 离子的BMIC离子液体溶液配制: 将无水Mg Cl2溶解于BMIC离子液体中,分别配制成Mg( II) 浓度为0. 005,0. 050,0. 500 mol·L- 1的离子液体溶液。
1.4置换实验
将粒径为50 ~ 100 μm的适量镁粉分散到含不同浓度Cu( II) 离子的BMIC离子液体溶液中,反应一段时间,然后过滤,取滤液进行分析。铜的含量用二乙氨 基二硫代 甲酸钠萃 取光度法 测定 ( GB7474-87)[16]。铜置换率按式( 1) 计算:

式中: η 为置换率,% ; C0,C分别为置换反应前后溶液中的Cu( II) 离子浓度,mol·L- 1。
1.5极化曲线测试
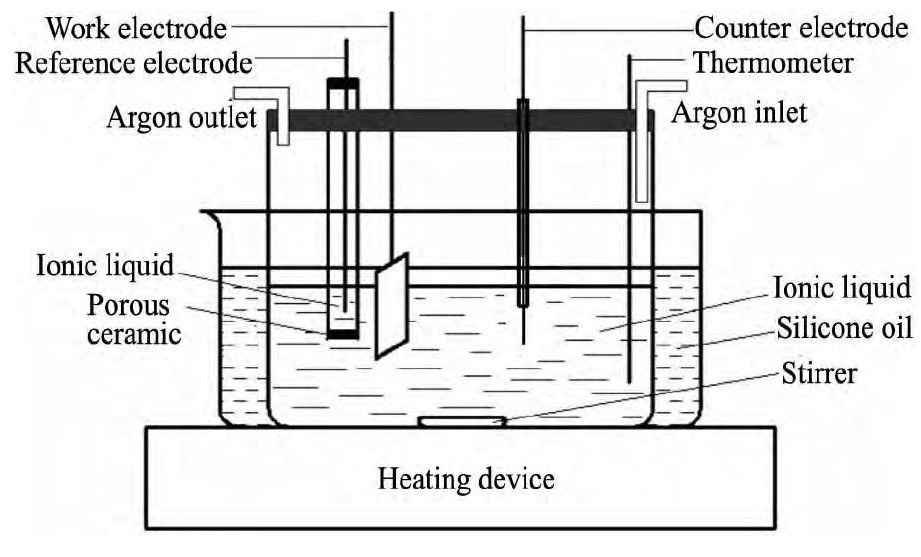
采用CHI1760电化学工作站分别测定铜电极在含Cu( II) 的离子液体中和镁电极在含Mg( II) 的离子液体中的极化曲线。三电极极化曲线测试装置如图1所示,辅助电极为Pt电极,准参比电极为直径为0. 5 mm的银丝,银丝插入下端多孔陶瓷密封,装有离子液体的石英管中。铜电极的有效面积为浸入到离子液体中的铜片面积 ( A = 1 cm2) , 实验前用金相砂纸打磨光亮,而后用蒸馏水冲洗; 镁电极的有效面积为浸入到离子液体中的镁片面积 ( A = 1 cm2) ,用金相砂纸打磨光亮,然后用丙酮清洗; Pt电极需经稀盐酸活化,而后用蒸馏水超声清洗。
图1 三电极极化曲线测试示意图 Fig.1 Schematic diagram of three-electrode polarization curve
2结果与讨论
2.1搅拌对反应速率的影响
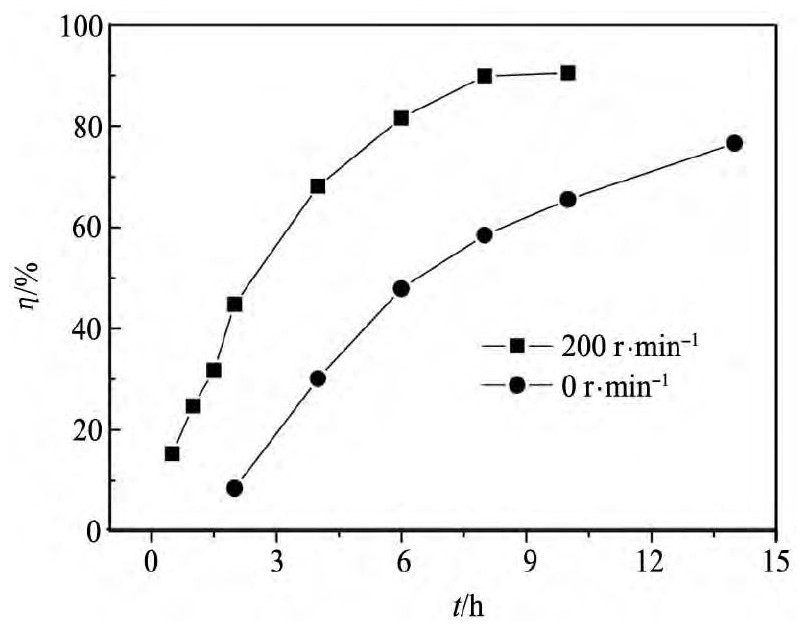
为了研究搅拌对反应速率的影响,分别在搅拌和静置的条件下于含有0. 15 mol·L- 1Cu( II) 离子的BMIC溶液中进行镁置换铜的反应,得到铜置换率随反应时间的变化关系,结果如图2所示。从图2可以看出,当反应过程中进行搅拌时,其反应速率明显加快,大约8 h达到反应平衡,置换率高达90% ; 而无搅拌时,反应进行14 h仍未达到平衡,置换率仅为76. 6% 。以上结果表明,搅拌对反应速率有较明显的影响,镁置换铜的反应可能主要受扩散控制。
图2 搅拌对置换速率的影响 Fig.2 Effect of stirring on replacement rates
在一般情况下,置换过程的动力学方程符合一级反应动力学规律,即:

式中,kd为液相传质系数,A为有效反应面积,V为反应体系中溶液的体积。假设反应的有效面积和溶液体积不变,令k = kdA / V,并对式 ( 2 ) 积分得:

式中: C0为离子液体中Cu( II) 离子的初始浓度, mol·L- 1; C为反应一段时间( t) 后,溶液中的Cu ( II) 离子的浓度,mol·L- 1; k为反应速率常数, h- 1; t为反应时间,h。
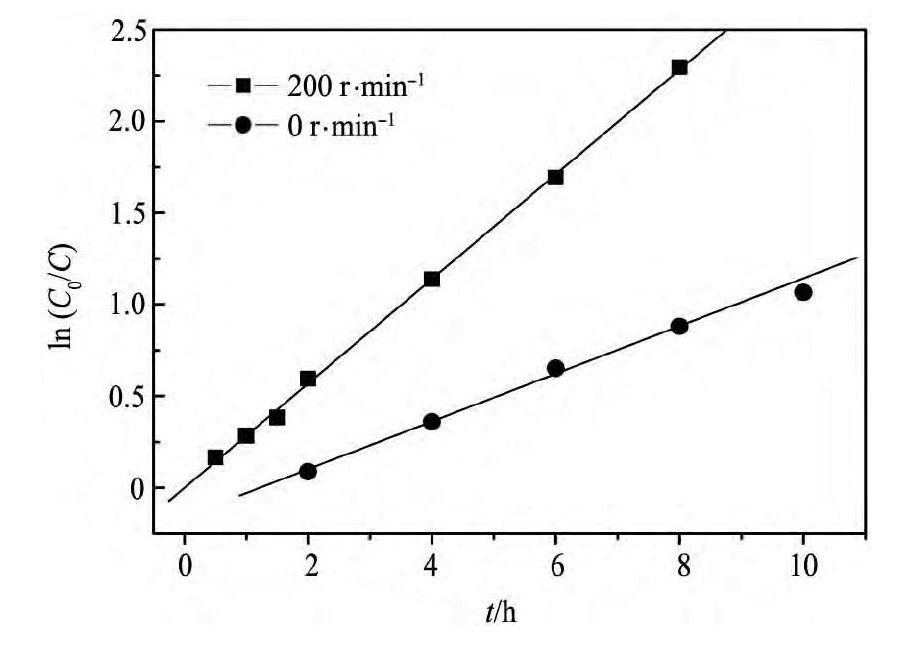
采用以上不同反应时间的Cu( II) 离子浓度,以ln ( C0/ C) 对t作图,结果如图3所示。从图3可知,离子液体中镁置换铜的反应动力学过程符合一级反应速率方程。由直线的斜率求得不搅拌和搅拌条件下的反应速率常数( k) 分别为0. 124和0. 285 h- 1,即搅拌条件下的速率常数是不搅拌的2倍左右。
2.2温度对反应速率的影响
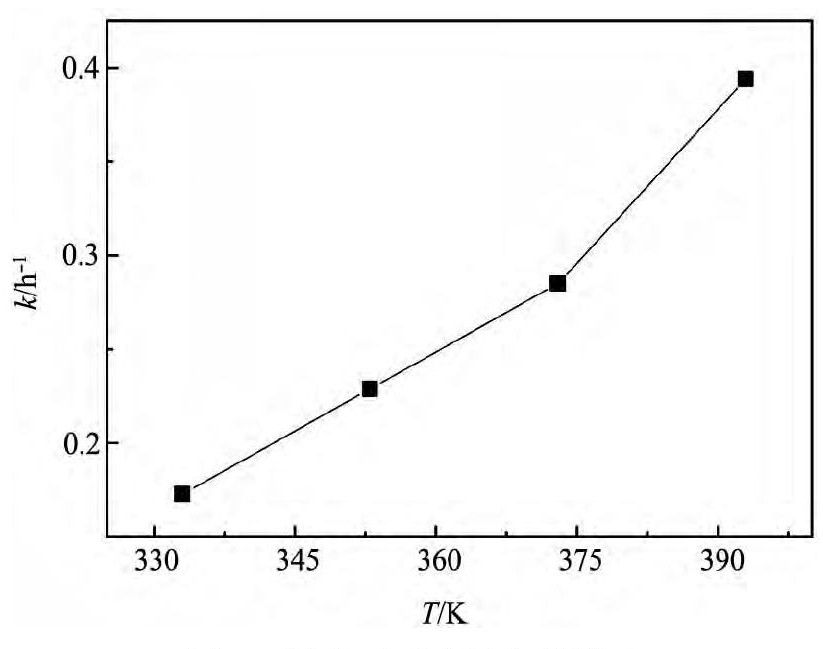
在含有0. 15 mol·L- 1Cu ( II) 离子的溶液中, 考察搅拌条件下温度对镁置换铜的反应速率常数的影响,结果如图4所示。从图4可以看出,随着反应溶液温度的升高,置换反应速率增加。这是由于温度升高,离子液体黏度降低,Cu( II) 离子运动的阻力减小,迁移速率加快。
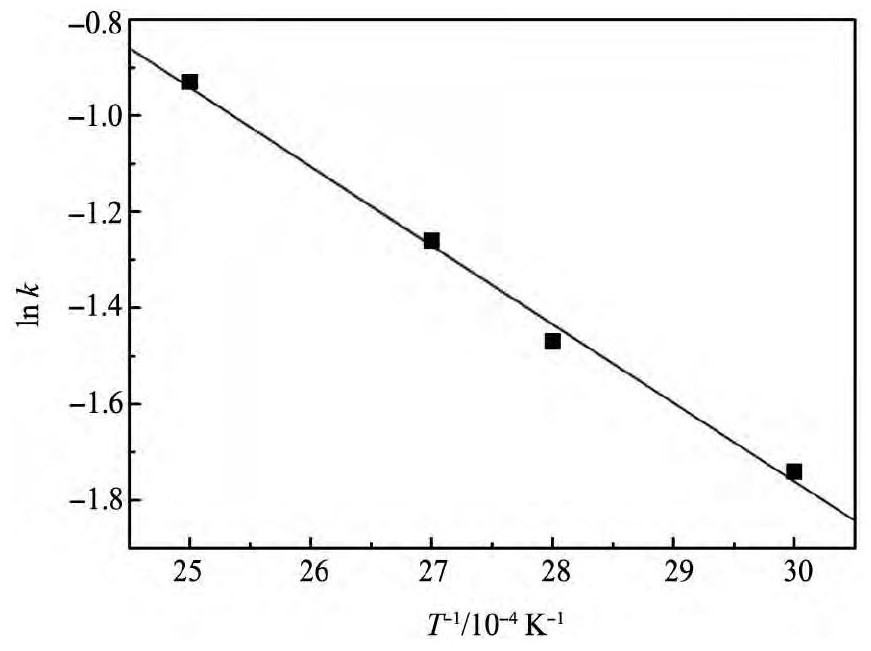
对图4中的反应速率常数与温度进行回归分析到图5,从图5知反应速率常数和温度的关系符合Arrhenius方程。
图3 置换过程中 ln( C0/ C) 与 t 的关系 Fig.3 Relationships of ln ( C0/ C) and t in replacement process
图4 温度对反应速率的影响 Fig.4 Effect of temperature on reaction rate
图5 lnk 与 T- 1的相互关系 Fig.5 Interrelationship of lnk and T- 1

其中,k为反应速率常数,h- 1; T为反应温度,K; R为气体常数,8. 314 J·mol- 1·K- 1; B为常数。
由图5直线斜率可以求得置换反应的活化能Ea= 13. 6 k J·mol- 1,属于扩散控制,符合一级反应动力学规律。
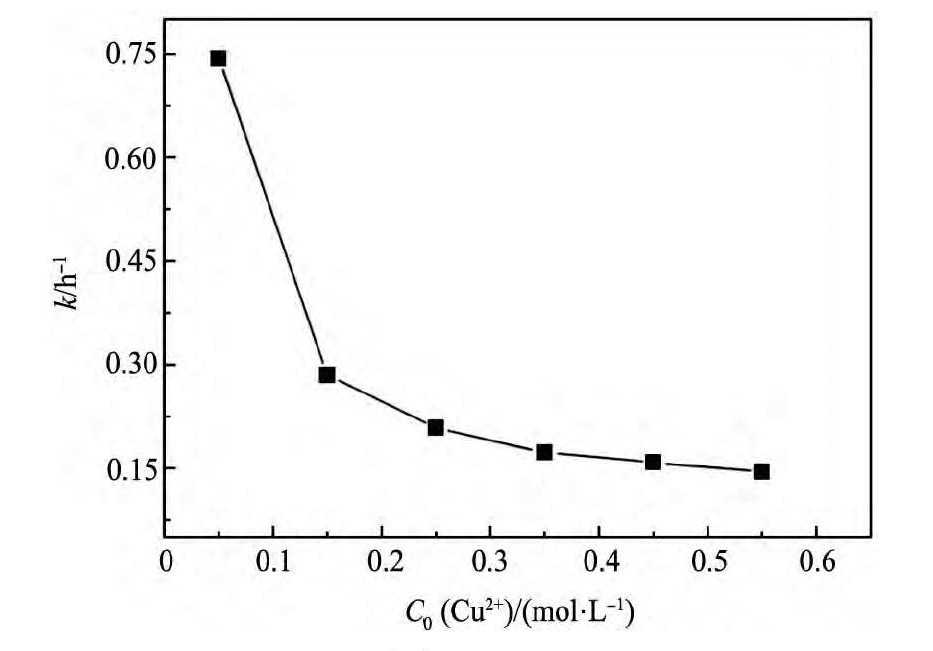
2.3Cu(II)离子浓度对反应速率的影响
图6为溶液中的Cu( II) 离子浓度与反应速率常数的相互关系。由图6可知,反应速率常数随Cu( II ) 离子浓度 的增加而 逐渐减小,而且当Cu( II) 离子浓度较小时,Cu( II) 离子浓度变化对速率常速的影响较大; 当Cu( II) 离子浓度大于0. 25 mol·L- 1时,Cu( II) 离子浓度增大,速率常数的减小缓慢。Cu( II) 离子浓度的增大,减小了Cu( II) 离子的扩散速率,所以速率常数减小。
图6 离子液体中 Cu( II) 离子浓度对反应速率的影响 Fig.6 Effect of Cu( II) concentration in ionic liquids on reaction rate
2.4镁粉粒度对反应速率的影响
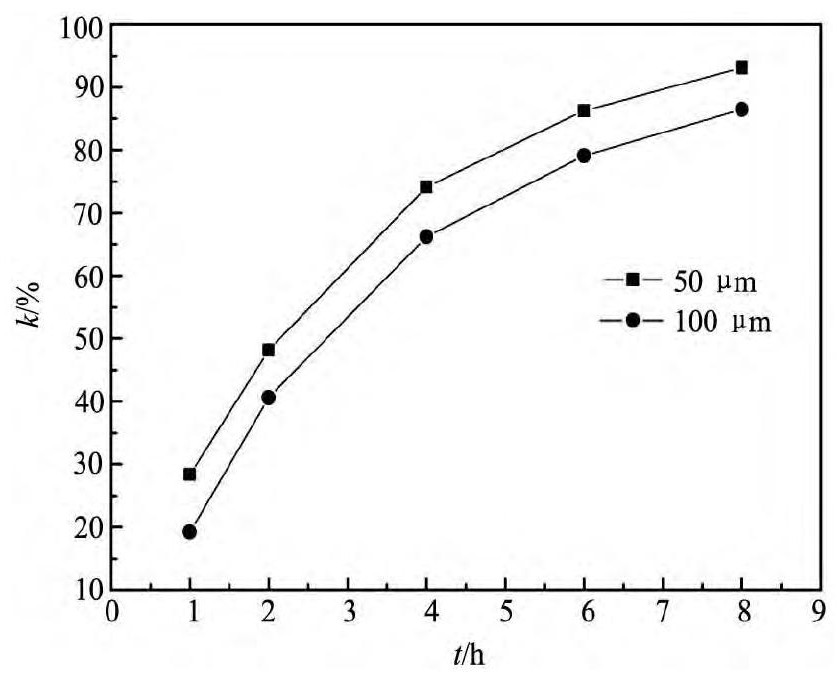
在同样0. 15 mol·L- 1Cu( II) 离子的溶液中及搅拌条件下考虑镁粉粒度对反应速率的影响,做了50 ~ 74 μm,74 ~ 100 μm两种不同镁粉粒度的对比实验。结果如图7所示。
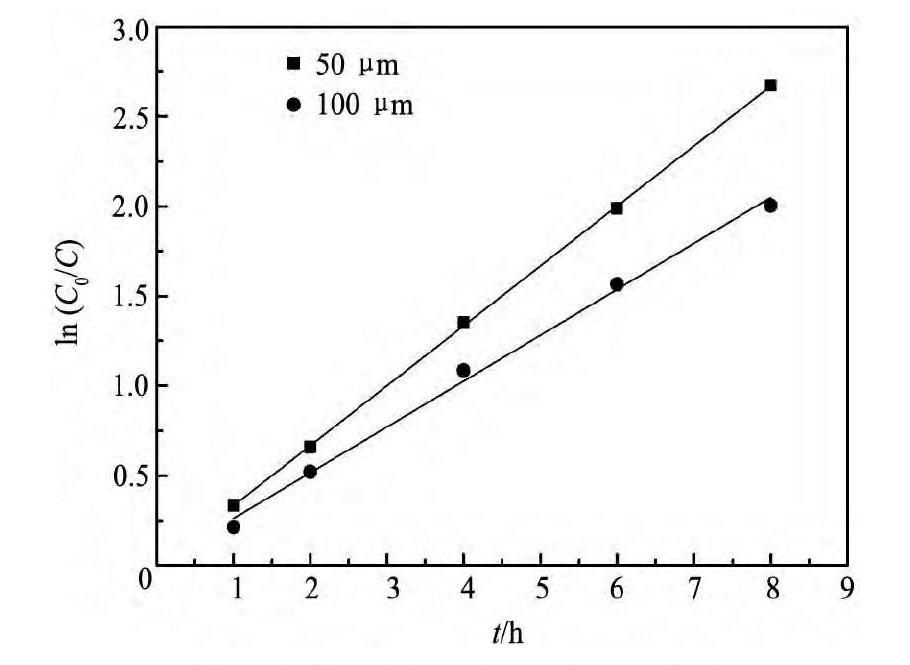
从图7可以看出,镁粉粒度越小,反应速率越快,这是因为镁粉粒度越小,其比表面积越大,与离子液体中铜离子的接触面积越大,所以反应加快。对图7以ln( C0/ C) 对t作图,结果如图8所示。由图8直线的斜率求得不同镁粉粒度下的反应速率常数( k) 分别为0. 334和0. 255 h- 1。
2.5Evans图分析
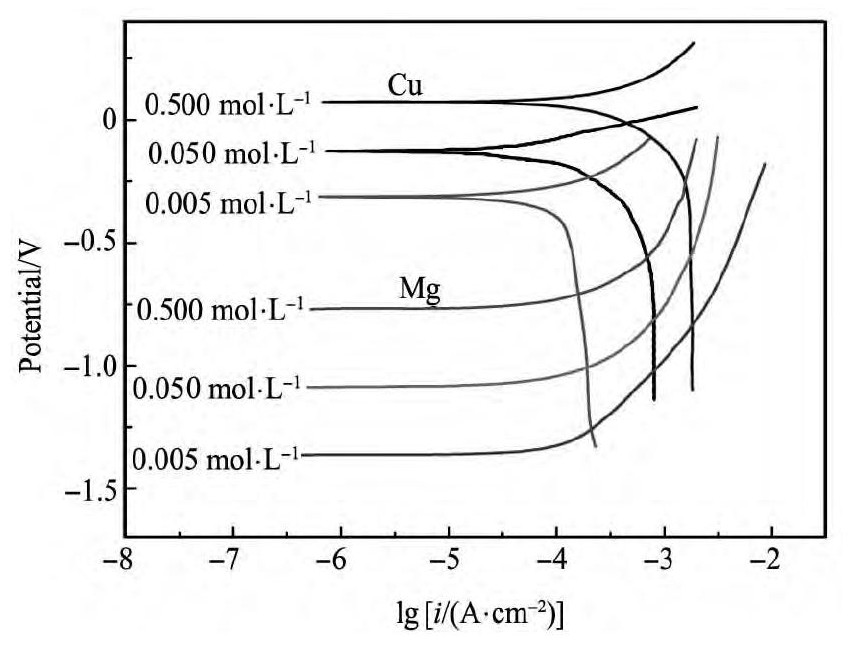
置换反应是典型的电化学过程,其反应动力学过程的控制步骤可以采用Evans图进行判断[6]。 离子液体中镁置换铜离子的反应由以下两个半电池反应组成。
图7 镁粉粒度对反应速率的影响 Fig.7 Effects of Mg powder size on rate of reaction
图8 置换过程 ln( C0/ C) 与 t 关系 Fig.8 Relationships of ln ( C0/ C) and t in replacement process
图9 Mg/Cu( II) 体系的 Evans 图 Fig.9 Evans figure of Mg / Cu( II) system
通过测定铜电极在含Cu( II) 离子溶液中的极化曲线和镁电极在含Mg( II) 离子溶液中的阳极极化曲线,叠加在一起构成Mg /Cu( II) 体系的Evans图( 见图9) 。
从图9中可以看出,Mg /Cu( II) 体系中,镁离子的阳极极化曲线与铜离子的阴极极化曲线的交点位于扩散控制区域,故Mg /Cu( II) 体系的置换反应速率受Cu( II) 向阴极表面的传质所控制。这结果与实验测定的结果一致,在BMIC离子液体中镁置换铜反应的动力学过程主要受扩散控制。
3结论
1. 在BMIC离子液体中,镁置换铜反应过程主要受扩散控制,其动力学数据符合一级反应速率方程。置换反应的活化能约为13. 6 k J·mol- 1。
2. Evans表明,溶液中铜离子的浓度在0. 005 ~ 0. 500 mol·L- 1的范围内,镁置换铜的反应速率均受扩散控制,与实验结果一致。
3. 在BMIC离子液体中,镁置换铜的速率受搅拌、温度、初始铜离子浓度的影响,通过搅拌, 升高温度,降低Cu( II) 离子的初始浓度,可以有效提高反应的速率常数。