文章编号: 1004-0609(2006)07-1264-05
锂离子电池正极材料LiFePO4的改性
张 宝, 李新海, 王晓琼, 王志兴, 郭华军
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要:
采用高温固相法合成了锂离子电池正极材料LiFePO4及改性的LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C材料。 采用X射线衍射仪和扫描电镜分析样品的晶体结构和表面形貌。 结果表明: 改性后的LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C材料与LiFePO4一样均为单一的橄榄石结构。 以20mA/g电流密度充放电, LiFe0.9Ni0.1PO4的首次放电容量为140mA·h/g, 较LiFePO4增加了12%; 而复合掺杂得到的含碳量为2.8%的LiFe0.9Ni0.1PO4/C材料, 首次放电容量达162mA·h/g, 充放电循环30次后放电电容量仍为147mA·h/g, 容量衰减仅为9%。 当充放电电流密度提高到80mA/g时, LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C的放电容量分别为86、 114和140mA·h/g。 改性后的LiFe0.9Ni0.1PO4/C的电化学性能得到了较大的改善。
关键词: LiFePO4; Ni掺杂; 碳包覆; 电化学性能
中图分类号: TM912.9 文献标识码: A
Performance enhancement of LiFePO4 for
cathode material of lithium-ion battery
ZHANG Bao, LI Xin-hai, WANG Xiao-qiong, WANG Zhi-xing, GUO Hua-jun
(School of Metallurgical Science and Engineering, Central South University,
Changsha 410083, China)
Abstract: LiFePO4, LiFe0.9Ni0.1PO4 and LiFe0.9Ni0.1PO4/C were synthesized by solid-state reaction and all samples were characterized by XRD, SEM and electrochemical performance. The results show that LiFe0.9Ni0.1PO4 and LiFe0.9Ni0.1PO4/C are still olivine type with good electrochemical performance. When the cathode materials are cycled at 20mA/g, the LiFe0.9Ni0.1PO4 can delivered 140mA·h/g at the first discharge which is 12% higher than that of LiFePO4, while LiFe0.9Ni0.1PO4/C can reach 162mA·h/g at the first discharge and only lost about 9% after 30 cycles. When the discharge current density reaches up to 80mA/g, the capacity of LiFePO4, LiFe0.9Ni0.1-PO4 and LiFe0.9Ni0.1PO4/C are 86, 114 and 140mA·h/g, respectively.
Key words: LiFePO4; Ni doping; carbon coating; electrochemical performance
LiFePO4目前被认为是最具有潜力的正极材料之一[1]。 而LiFePO4较低的离子传导率及电子传导率是制约其实用化的瓶颈[2, 3]。 提高LiFePO4的电导率是目前研究的热点, 主要有如下几种方法: 1) 包覆碳或纳米金属粒子形成中间导电体[4-11]; 2) 使合成物具有细小均匀的晶粒尺寸[12]; 3) 掺杂, 即掺杂少量金属离子合成缺陷半导体[13]。 本文作者在前期的研究工作中采用固相法制备了铁位掺杂的LiFe0.9Ni0.1PO4材料[14], 实验结果与Wang等[15]的研究结果相符, Ni在Fe位的掺杂在一定程度上改善了LiFePO4的性能。 虽然LiFe0.9Ni0.1PO4的比容量较纯相LiFePO4的提高了近32%, 有较大的提高, 但仍然存在循环性能和极化等方面的问题, 需要对其进行进一步改性。 对LiFePO4进行铁位掺镍后, 其电子导电性有了一定的改善, 但是颗粒与颗粒间的导电性仍旧没有得到改观。 Cushing等[16]研究表明, 导电碳分散或包覆在正极材料的表面一方面可以增强粒子与粒子之间的导电性, 减少极化; 另一方面还能提供电子隧道。 因此, 本文作者结合两种掺杂方式, 在合成LiFe0.9Ni0.1PO4的基础上对其进行表面包覆碳, 以期通过这种复合掺杂的方式能够进一步改善LiFePO4的性能。 并对LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C 3种材料的性能进行了比较。
1 实验
1.1 LiFe0.9Ni0.1PO4的合成
所用原料为分析纯的Li2CO3、 FeC2O4·2H2O、 NH4H2PO4和Ni(CH3COO)2·4H2O, 以组成LiFe0.9Ni0.1PO4的化学计量比混合均匀, 并以葡萄糖为碳源。 混合物在乙醇介质中球磨5h, 所得粉体在低温下烘干以除去乙醇, 然后将混合粉体压片后转移至程序控温的管式炉内, 通高纯氩气保护, 升温至320℃, 预分解一段时间后, 然后升温至指定温度, 保温一段时间后自然降至室温, 所得样品用玛瑙研钵磨细后备用。 未掺杂样品的制备方式与上述方式相同。 主要区别为不添加镍源及碳源。
1.2 材料的表征
采用日本Rigaku D/max2550VB+18kW转靶X射线衍射仪进行物相分析。 物相分析的条件是: Cu Kα辐射, 40kV, 50mA, 步宽0.02°, 扫描速度2(°)/min, 扫描范围(2θ)为10°~90°。 用JEOL公司的JSM-5600LV扫描电子显微镜在20kV下分别以不同的放大倍数对样品的表面形貌进行观察。 合成物质的含碳量由CS800高频红外碳硫分析仪(德国)来测定, 含碳量为3%。
1.3 实验电池组装和测试
通过组装的CR2025型扣式电池测试材料的电化学性能。 正极材料、 乙炔黑(电池级, 广东省化工进出口公司)和PVDF(聚偏二氟乙烯, 法国阿托化学)按质量比为8∶1∶1混合并研磨均匀后, 加入适量的有机溶剂NMP(N-甲基吡咯烷酮, 99.9%, 南京京龙化工厂), 研磨成均匀糊状物后涂于20μm的铝箔上, 在120℃下真空干燥12h得到正极片。 在充满高纯氩的手套箱内, 以金属锂片为负极, Celgard2400微孔聚丙烯膜(Celgard Inc. USA)为隔膜, 以溶于EC(碳酸乙烯脂)/DMC(1, 2-二甲基碳酸脂)/EMC(碳酸甲乙脂)的体积比1∶1∶1的1mol/L的LiPF6为电解液, 组装成CR2025型扣式电池。 在BTS-51二次电池性能检测仪(深圳新威尔多电子设备有限公司)上测试充放电性能。 采用恒流/恒压方式对电池充电, 以恒流方式进行放电。 恒流充电电流分别为20mA/g和50mA/g, 终止电压为4.1V; 恒流放电电流分别为20mA/g和50mA/g, 终止电压为2.3V。
2 结果及讨论
2.1 合成样品的物相分析
图1所示为合成的LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C样品的X射线衍射谱。 由于在合成LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1-PO4/C样品时, 是严格按照化学计量比来配置原料的, 如果Ni不是取代了Fe的位置, 必然会造成某个元素过量, 从而产生第二相。 从图1中可以看出, 所有的样品都没有检测到杂相, 且在X射线衍射谱上也观察不到晶态或无定型碳的衍射峰存在。 3种样品都保持了与LiFePO4相同的橄榄石晶型结构(标准JCPDS卡40-1499), 属正交晶系的Pnmb空间群。 由此证明了掺杂样品中的掺杂原子进入了晶格内部, 占据的位置为铁位, 掺杂后形成了完全连续的固溶体, 而且说明包覆碳不会影响其内部的晶体结构, 但碳的存在使得峰强有所降低。
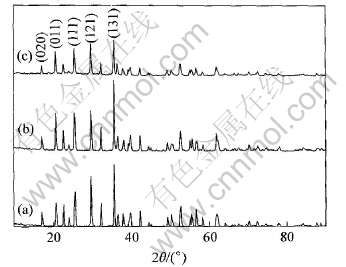
图1 相同反应条件下合成的LiFePO4、 LiFe0.9Ni0.1PO4和 LiFe0.9Ni0.1PO4/C的X射线衍射谱
Fig.1 XRD patterns of LiFePO4(a), LiFe0.9Ni0.1PO4(b) and LiFe0.9Ni0.1PO4/C(c) synthesized under same reaction conditions
2.2 合成条件对LiFe0.9Ni0.1PO4表面形貌的影响
电极材料的表面形貌对电极材料的电化学性能存在很大的影响。 图2所示为相同条件下合成的LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C样品的SEM像。 从图2中可以看出, 纯相LiFePO4生长得比较完整, 粒度较大, 表面粗糙, 并可以发现大部分一次粒子团聚形成大颗粒的二次粒子; 而掺杂后样品颗粒粒径明显变小, 表明Ni离子掺杂可改善LiFePO4的表面形态, 在一定程度上降低LiFePO4的粒径, 而碳处理材料粒度进一步减小。 这是由于葡萄糖在300℃附近开始热解为中空多孔、 类似蜂窝状的物质, 葡萄糖的液化和热解气体溢出过程对原料进行不断的混合和搅拌, 使得原料混合更均匀、 反应更彻底。 从图2中还可以看出, 经葡萄糖处理的材料表面呈絮状, 比表面积较大, 这有利于充放电过程中更多正极活性物质被利用。

图2 相同反应条件下合成的LiFePO4、 LiFe0.9Ni0.1PO4和 LiFe0.9Ni0.1PO4/C的SEM像
Fig.2 SEM images of LiFePO4(a), LiFe0.9Ni0.1PO4(b) and LiFe0.9Ni0.1PO4/C(c) synthesized under same reaction conditions
当Li+在LiFePO4中嵌入和脱出时, LiFePO4晶格会相应地产生膨胀和收缩, 但其晶格中八面体之间的FePO4四面体使体积变化受到限制, 导致Li+的扩散速率很低。 因此, LiFePO4的粒子半径的大小对电极容量有很大影响。 粒子半径越大, Li+粒子的固相扩散路程越长, Li+的嵌入脱出就越困难, LiFePO4容量的发挥就愈受到限制。 且Li+在LiFePO4中的脱嵌过程是一个两相反应[1], LiFePO4相和FePO4相共存, Li+的扩散要经过两相的界面, 这更增加了扩散的困难。 因此有效控制LiFePO4的粒子尺寸是改善LiFePO4中锂离子的扩散能力的关键, 而对LiFePO4的体相掺Ni和表面包覆碳在一定程度上实现了细化晶粒的效果。
2.3 电化学性能测试与表征
图3所示为LiFePO4、 LiFe0.9Ni0.1PO4及LiFe0.9Ni0.1PO4/C在20mA/g的电流密度下的首次充放电曲线。 从图3中可以看出, 3种样品在3.5V左右具有平坦的充电平台, 在3.4V左右具有平坦的放电平台。 由于纯相LiFePO4电导较低导致电极极化较大, 因此在3种材料中其放电平台最低,首次放电比容量也最小, 为119mA·h/g; LiFe0.9Ni0.1PO4的充电放电比容量次之, 为145mA·h/g; 而LiFe0.9Ni0.1PO4/C的充放电电压变化非常平缓, 首次放电比容量达162mA·h/g, 为理论容量的95%。
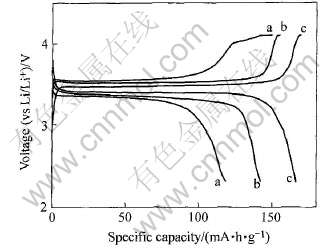
图3 20mA/g 电流密度下LiFePO4、 LiFe0.9Ni0.1PO4和 LiFe0.9Ni0.1PO4/C样品的充放电曲线
Fig.3 Charge-discharge curves of LiFePO4(a), LiFe0.9Ni0.1PO4(b) and LiFe0.9Ni0.1PO4/C(c) at current density of 20mA/g
在前期的研究中已得出结论, 少量Ni的掺杂对提高LiFePO4正极材料的充放电性能有很大的正面影响[14], 这是由于镍的体相掺杂可以提高晶格的无序化程度, 引起缺陷, 因而提高材料的离子导电性和电子导电性, 从而改善材料的电化学性能[15, 16]。
将LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1-PO4/C 3种材料在80mA/g的电流密度下进行充放电, 结果如图4所示。 从图4中可以看出, LiFe0.9Ni0.1PO4/C样品的高倍率充放电容量明显高于其他两种样品的。 该条件下LiFe0.9Ni0.1PO4/C的首次放电为140mA·h/g, 而LiFePO4和LiFe0.9Ni0.1PO4样品的高倍率放电性能较差, 放电容量仅为86和114mA·h/g。
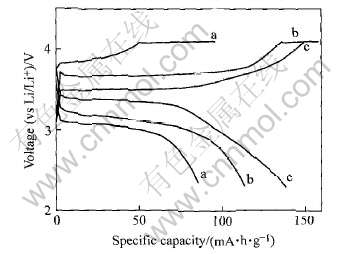
图4 80mA/g 电流密度下LiFePO4、 LiFe0.9Ni0.1PO4和 LiFe0.9Ni0.1PO4/C样品的充放电曲线
Fig.4 Charge-discharge curves of LiFePO4(a), LiFe0.9Ni0.1PO4(b) and LiFe0.9Ni0.1PO4/C(c) at current density of 80mA/g
镍的掺杂在一定程度上实现了细化晶粒, 导致了烧结过程产生晶体结构缺陷, 提高了材料的电子导电性, 从而使得材料的高倍率充放电性能有所改善。 然而进一步将体相掺杂与包覆碳结合起来, 采用含碳有机物做碳源, 由于有机物分解的过程抑止了颗粒的长大, 使材料的粒径分布均匀, 且导电碳分散或包覆在正极材料的表面不仅可以增强粒子与粒子之间的导电性, 减少极化, 还可以提供电子隧道, 因此得到的LiFe0.9Ni0.1PO4/C材料的电化学性能有了较大的改善。
2.4 样品循环性能测试
图5所示为LiFePO4、 LiFe0.9Ni0.1PO4及LiFe0.9Ni0.1PO4/C在20mA/g的电流密度下充放电的循环性能曲线。 从图5中可以看出, 未掺杂LiFePO4的容量一直呈下降趋势, 30次循环后的放电容量为94mA·h/g; LiFe0.9Ni0.1PO4的容量从第三周期开始, 基本稳定在135mA·h/g左右, 没有很明显的衰减趋势; LiFe0.9Ni0.1PO4/C有很高的初始比容量, 循环过程中比容量有一定波动, 但循环30次后基本平稳在145mA·h/g左右, 与LiFe0.9Ni0.1PO4的初始比容量接近。 由此可见, 在相同条件下合成的LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1-PO4/C较LiFePO4而言, 不仅初次放电比容量有较大的提高, 而且循环性能也有一定的改善。
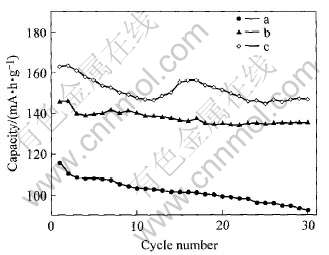
图5 LiFePO4、 LiFe0.9Ni0.1PO4和 LiFe0.9Ni0.1PO4/C样品的循环性能曲线
Fig.5 Cycle performance curves of LiFePO4(a), LiFe0.9Ni0.1PO4(b) and LiFe0.9Ni0.1PO4/C(c)
3 结论
1) 采用高温固相烧结法制备的改性LiFe0.9-Ni0.1PO4和LiFe0.9Ni0.1PO4/C材料与LiFePO4均为单一的橄榄石结构。
2) 以20mA/g电流密度充放电, LiFe0.9Ni0.1-PO4的首次放电容量为140mA·h/g, 较LiFePO4增加了12%; 而当充放电电流密度提高到80mA/g时, 其放电容量仍为114mA·h/g, 较LiFePO4增加了32%; 而复合掺杂得到的含碳量为2.8%的LiFe0.9Ni0.1PO4/C材料, 首次放电容量达162mA·h/g。 充放电循环30次后LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C的放电比容量分别为94、 135和147mA·h/g, 与初始比容量相比, LiFe0.9Ni0.1PO4/C容量衰减最小仅为9%。
3) 当充放电电流密度提高到80mA/g时, LiFePO4、 LiFe0.9Ni0.1PO4和LiFe0.9Ni0.1PO4/C的放电比容量分别为86、 114和140mA·h/g。 改性后的LiFe0.9Ni0.1PO4/C的电化学性能得到了较大的改善。
REFERENCES
[1]Padhi A K, Nanjundas W K S, Goodenough J D. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. Journal of Electrochemical Society, 1997, 144(4): 1188-1194.
[2]Andersson A S, Thomas J O, Beata K, et al. Thermal stability of LiFePO4-based cathodes[J]. Electrochemical and Solid State Letters, 2000, 3(2): 66-68.
[3]Andersson A S, Thomas J O. The source of first-cycle capacity loss in LiFePO4[J]. Journal of Power Sources, 2001, 97-98: 498-502.
[4]Kim H Y, Cho B W, Cho W Ⅱ. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Journal of Power Sources, 2004, 132(1-2): 235-239.
[5]Marie H, Marten S, Anton N, et al. Surface chemistry of carbon-treated LiFePO4 particles for Li-ion battery cathodes studied by PES[J]. Electrochemical and Solid State Letters, 2003, 6(9): 202-206.
[6]Yang S, Song Y, Zowalij P Y, et al. Reactivity, stability and electrochemical behavior of lithium iron phosphates[J]. Electrochemistry Communications, 2002, 4(3): 239-244.
[7]Ravet N, Chouinard Y, Magan J F. Electroactivity of natural and synthetic triphylite[J]. Journal of Power Sources, 2001, 97-98: 503-507.
[8]Bauer M E, Bellitto C, Pasoualli M, et al. Versatile synthesis of carbon-rich LiFePO4 enhancing its electrochemical properties[J]. Electrochemical and Solid State Letters, 2004, 7(4): A85-A87.
[9]Park K S, Son J T, Chuang H T, et al. Surface modification by silver coating for improving electrochemical properties of LiFePO4[J]. Solid State Communications, 2004, 129: 311-314.
[10]Prosini P P, Carewska M, Scaccia S, et al. Long-term cyclability of nanostructured LiFePO4[J]. Electrochimica Acta, 2003, 48: 4205-4211.
[11]Chuan L, James A. Carbonization and activation of sol-gel derived carbon xerogels[J]. Carbon, 2000, 38: 849-861.
[12]Franger S, Le C F, Bourbon C, et al. Comparison between different LiFePO4 synthesis routes and their influence on its physico chemical properties[J]. J Power Sources, 2003, 119-121: 252-2571.
[13]Chung S Y, Bloking J T, Chiang Y M. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nature Materials, 2002, 1(2): 123-128.
[14]王晓琼, 李新海, 王志兴, 等. LiFePO4掺镍的改性研究[J]. 电池, 2005, 35(5): 371-373.
WANG Xiao-qiong, LI Xin-hai, WANG Zhi-xing, et al. Effect of Ni doping on LiFePO4 cathode material for lithium-ion battery[J]. Battery, 2005, 35(5): 371-373.
[15]WANG De-yu, LI Hong, SHI Si-qi, et al. Improving the rate performance of LiFePO4 by Fe-site doping[J]. Electrochemica Actra, 2005, 50: 2955-2958.
[16]Cushing B L, Goodenough J B. Influence of carbon coating on the performance of a LiMn/sub 0.5/Ni/sub 0.5/O/sub 2/ cathode[J]. Solid State Sciences, 2002, 4(11-12): 1487-93.
(编辑李艳红)
收稿日期: 2005-12-12; 修订日期: 2006-03-19
通讯作者: 张 宝, 博士; 电话: 0731-8836357; E-mail: zhangb@qianlong.com


