锆掺杂改性Bi2O3的比较研究
张昭,樊国栋,郑彦春
(陕西科技大学 教育部轻化工助剂化学与技术重点实验室,陕西 西安,710021)
摘 要:
锆为起始原料,分别采用共沉淀法和聚丙烯酰胺凝胶法制备系列锆掺杂改性Bi2O3的混合氧化物Bi2-xZrxO3+x/2(x=0~1.0)。采用XRD,FTIR和SEM对样品的结构及微观形貌进行分析。研究结果表明:于650 ℃焙烧处理后,由以上2种方法制备的纯Bi2O3的主晶相均为单斜晶型α-Bi2O3,其中采用聚丙烯酰胺凝胶法及乙二醇和水混合溶剂反序滴定共沉淀法可制备出纯度较高的单斜相α-Bi2O3。锆掺杂改性制备的系列混合氧化物中,当ZrO2掺杂量(摩尔分数)为10%(x=0.2)时,反序滴定共沉淀法能实现均匀共沉淀,形成了组成为Bi1.8Zr0.2O3.1的类似立方相δ-Bi2O3的单一结构固溶体,顺序滴定共沉淀法会产生相分离,导致四方相Bi7.38Zr0.62O12.31固溶体的出现。然而,当采用聚丙烯酰胺凝胶法时,没有得到类似立方相δ-Bi2O3结构的固溶体,主相结构为单斜相α-Bi2O3以及混合部分四方相Bi7.38Zr0.62O12.31和立方相ZrO2。由此可见:采用反序滴定共沉淀法,在650 ℃低温及合适条件下,掺杂适量的ZrO2能稳定立方相结构的高温离子传导相δ-Bi2O3。
关键词:
Bi2O3;ZrO2;Bi2-xZrxO3+x/2;共沉淀法;聚丙烯酰胺凝胶法;
中图分类号:O643.36 文献标志码:A 文章编号:1672-7207(2011)09-2600-06
Comparative study of Bi2O3 doped ZrO2 prepared by
coprecipitation and polyacrylamide gel process
ZHANG Zhao, FAN Guo-dong, ZHENG Yan-chun
(Key Laboratory of Auxiliary Chemistry & Technology for Chemical Industry, Ministry of Education,
Shaanxi University of Science & Technology, Xi’an 710021, China)
Abstract: ZrO2-doped Bi2O3 powders Bi2-xZrxO3+x/2(x=0-1.0) were prepared by coprecipitation and polyacrylamide gel method using Bi(NO3)3∙5H2O and Zr(NO3)4∙5H2O as materials. The products were characterized using XRD, FTIR and SEM. The results show that after calcined at 650 ◦C, for the pure Bi2O3, in the process of coprecipitation with reverse dropping method (adding precipitant to a solution of Bi3+), and using ethylene glycol-water system as the dissolvent, pure α-Bi2O3 powder is obtained. But using water as the dissolvent, α-Bi2O3 powder is impurities. And in the process of polyacrylamide gel, pure α-Bi2O3 powder is obtained too. When Bi2O3 is doped with ZrO2 at x=0.2, the process of coprecipitation with reverse dropping method can precipitate Bi and Zr ions simultaneously and form a cubic δ-Bi2O3 phase solid solution with the general formula of Bi1.8Zr0.2O3.1. The process of coprecipitation with natural dropping method results in the phase separation, and the tetragonal Bi7.38Zr0.62O12.31 solid solution is observed. However, the samples prepared by polyacrylamide gel method show no cubic δ-Bi2O3 phase, but only a mixture of α-Bi2O3, the tetragonal Bi7.38Zr0.62O12.31 and the cubic ZrO2. Consequently, the highly conducting phase δ-Bi2O3 can be obtained at 650 ℃ by solid solution formation of Bi2O3 with ZrO2, using reverse dropping coprecipitation method.
Key words: Bi2O3; ZrO2; Bi2-xZrxO3+x/2; coprecipitation; polyacrylamide gel
Bi2O3作为一种电子功能材料,广泛用于压敏电阻、氧化锌避雷针器、彩色显像管、电容器等电子工业产品的制造[1-2]。Bi2O3共有4种晶型[3],其中:β-Bi2O3和γ-Bi2O3是介稳状态晶型;低温热力学稳定相α-Bi2O3一般由低温反应得到,高温离子传导相δ-Bi2O3由α-Bi2O3高温相变而得;纯的δ-Bi2O3只能在730~ 825 ℃条件下稳定存在,为了在低温条件下制得稳定的δ-Bi2O3,常采用掺入其他氧化物形成固溶体的方 法[4-6]。由于ZrO2具有较高的导电性和稳定性,常用作掺杂改性Bi2O3[7-9]。目前,掺杂Bi2O3的制备方法主要有化学共沉淀法、溶胶-凝胶法、微乳法、水热合成法、雾化-燃烧法、固相室温法、等离子体法 等[10-12]。其中共沉淀法条件简单,操作方便,可以先得到前驱体氢氧化物或直接得到氧化物,是大规模工业生产制备掺杂Bi2O3较理想的方法,但关键是要处理好溶液中前驱体微小颗粒的团聚问题以及均匀沉淀问题。高分子凝胶法是在溶胶-凝胶法基础上发展起来的一种新的制备纳米粉体的方法[10],聚丙烯酰胺凝胶法是其中之一,该法能在低温条件下,快速和便易地制出超细的纳米粉体。从文献[4-15]可知:ZrO2-Bi2O3体系形成固溶体时,ZrO2的最高溶解度差异较大,这可能与热处理温度、ZrO2前驱体的原料以及制备的方法等相关。在此,本文作者分别采用共沉淀法和聚丙烯酰胺凝胶法制备纯Bi2O3和ZrO2掺杂的Bi2O3,探讨2种制备方法以及ZrO2的加入对氧化铋晶型的影响。
1 实验
1.1 试剂和仪器
试剂有:硝酸铋(Bi(NO3)3·5H2O)、硝酸锆(Zr(NO3)4·5H2O)、乙二醇、柠檬酸、N,N-亚甲基双丙烯酰胺、丙烯酰胺、葡萄糖、亚硫酸氢钠和过硫酸钾,以上试剂均为分析纯。
仪器有:Rigaku D/max-2200PC型X线衍射仪(日本理学仪器公司制造);VECTOR-22傅里叶变换红外分析仪(德国BRUKER公司制造);JSM-6360型SEM(日本JEOL制造)。
1.2 制备方法
(1) 共沉淀法。按照产物计量式的Bi/Zr配比,分别以水以及体积比V(乙二醇):V(水)=2:1混合液体为溶剂,配制金属离子总浓度为0.2 mol/L的混合溶液,配制3.0 mol/L的氨水溶液。分别采用反序和顺序2种不同加料方式。反序加料是将Bi3+盐或Bi3+/Zr4+混合盐溶液滴加到沉淀剂氨水溶液中,顺序加料则相反。沉淀完全后陈化12 h,过滤洗涤,在60 ℃烘箱中干燥 2 h,然后于650 ℃焙烧2 h,得固体产品。
(2) 聚丙烯酰胺凝胶法。取适量以V(乙二醇):V(水)=2:1为溶剂,浓度为0.2 mol/L的Bi3+盐或Bi3+/Zr4+混合盐溶液,在搅拌情况下,按照n(金属离子):n(柠檬酸):n(葡萄糖)=1:1:2比例依次加入柠檬酸和葡萄糖,然后,加入质量为总质量10%的丙烯酰胺单体及交联剂N,N-亚甲基双丙烯酰胺,其中交联剂的用量为单体质量的10%,全部溶解后升温到50 ℃,加入质量为单体质量5%的NaHSO3-K2SO3(摩尔比为1.1:1.0)引发剂,当反应体系转变为凝胶后停止反应并冷却。将所得凝胶捣碎干燥,于650 ℃焙烧5 h得固体产品。
1.3 测试与表征
D/max2200pc型X线衍射仪上进行粉体结构分析,Cu Kα靶,管压为40 kV,管流为20 mA,扫描速度为8 (°)/min,扫描范围为10°~70°;VECTOR-22傅里叶变换红外分析仪测定样品的FTIR光谱,KBr压片。JSM-6360型SEM观察粉体的形貌和粒度,加速电压为20 kV。
2 结果与讨论
2.1 制备方法对纯Bi2O3性能的影响
图1所示为不同方法制备的Bi2O3的XRD谱图。从图1可以看出:共沉淀法和聚丙烯酰胺凝胶法制备的纯Bi2O3主相均为单斜相;当选用水为溶剂时,反序共沉淀法制备的单斜Bi2O3相中含有少量的三斜相Bi2O3和四方相Bi2O3,选用V(乙二醇):V(水)=2:1液体为溶剂时,三斜和四方相杂质含量较少。图2所示为不同溶剂时反序共沉淀法制备的Bi2O3的FTIR谱图。由图2可见:以水为溶剂时,在1 000~1 500 cm-1区间有几个较弱的吸收峰,这可能是主相单斜相中含有少量三斜和四方相杂质所致。从图2还可知:峰值在大约542,507和432 cm-1处的吸收峰为单斜Bi2O3相特征峰。
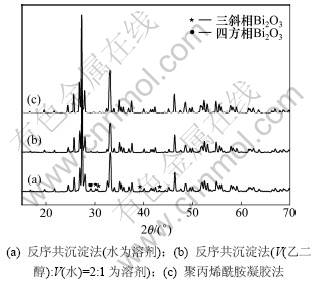
图1 不同方法制备的Bi2O3的XRD谱图
Fig.1 XRD patterns of Bi2O3 prepared by different methods
表1所示为取所有衍射峰利用谢乐公式计算的平均晶粒粒径和计算的Bi2O3单斜相晶胞常数。由表1可见:2种不同方法制备的Bi2O3均为纳米级粉体,计算的晶胞常数与文献报道的单斜相晶胞常数一致,说明其晶型为单斜相。图3所示为反序共沉淀法选取不同溶剂的SEM图。由图3可见:以V(乙二醇):V(水)=2:1液体为溶剂时,颗粒粒径相对比较均匀;而以水为溶剂时,颗粒多孔且大小不一,SEM显示的颗粒粒径远大于XRD测试的晶粒粒径,说明Bi2O3团聚比较严重。
由此可见:采用聚丙烯酰胺凝胶法和乙二醇和水混合溶剂反序共沉淀法可制备出纯度较高的单斜相Bi2O3。
2.2 ZrO2掺杂对Bi2O3性能的影响
图4所示是V(乙二醇):V(水)=2:1为溶剂的反序共沉淀法制备的不同比例ZrO2掺杂混合氧化物Bi2-xZrx O3+x/2(x=0~1.0)的XRD谱图。由图4可见:当x=0.2时,样品组成为Bi1.80Zr0.20O3.10的谱图与立方相的Bi2O3的谱图非常吻合,只有稍微的位移,且无ZrO2的特征谱线出现,说明ZrO2溶解于Bi2O3中形成了立方相的Bi2-xZrxO3+x/2固溶体。ZrO2含量高达20%(摩尔分数)时,组成为Bi1.60Zr0.40O3.20的样品出现了相分离,除检测到单斜相Bi2O3外,还检测到四方相Bi7.38Zr0.62- O12.31和四方相ZrO2,随着ZrO2含量的增加,2θ=30.25°处的四方相ZrO2特征峰愈来愈强,说明相分离更加严重,说明适量ZrO2掺杂能形成稳定的立方相结构固溶体。
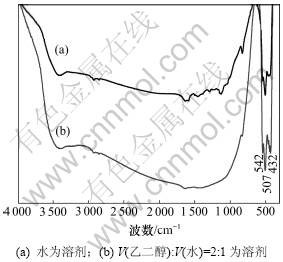
图2 不同溶剂时反序共沉淀法制备的Bi2O3的FTIR谱图
Fig.2 FTIR spectra of Bi2O3 prepared by reverse dropping coprecipitation method
表1 不同方法制备的Bi2O3的晶粒尺寸和晶胞常数
Table 1 Crystallite size and lattice parameters of Bi2O3 prepared by different methods
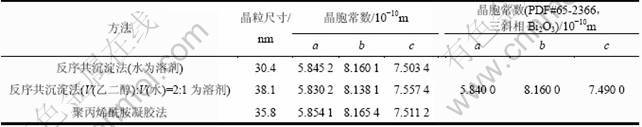

图3 不同溶剂时反序共沉淀法制备的Bi2O3的SEM
Fig.3 SEM images of Bi2O3 prepared by reverse dropping coprecipitation method

图4 反序共沉淀法制备的Bi2-xZrxO3+x/2的XRD谱图
Fig.4 XRD patterns of Bi2-xZrxO3+x/2 prepared by reverse dropping coprecipitation method
图5所示为聚丙烯酰胺凝胶法制备的不同比例ZrO2掺杂混合氧化物Bi2-xZrxO3+x/2(x=0~1.0)的XRD谱图。由图5可见:当Zr掺杂量为x=0.2时,样品谱图主相是单斜Bi2O3,同时出现少量立方相Bi2O3与四方相Bi7.38Zr0.62O12.31固溶体;随着Zr掺杂量的增加,除上述3个相外,立方相ZrO2特征峰峰强增加,相分离更加明显。由此可见:在所有不同Zr掺杂量范围内,无法形成稳定的单一立方相结构的固溶体。表2所示为不同ZrO2掺杂量时Bi2-xZrxO3+x/2的平均晶粒粒径。由表2可见:不论采用共沉淀法还是聚丙烯酰胺凝胶法,随着ZrO2掺杂量的增加,Bi2-xZrxO3+x/2的平均晶粒粒径变小。这是因为热处理主要是以晶界扩散的方式长大,晶界扩散速度控制晶粒的长大速度,而由于Zr含量的增加,虽然在Bi2O3中形成固溶体,但在晶粒表面浓度相对较高,增加了表面扩散势垒,使得晶界扩散激活能增大,从而阻碍晶界的扩散移动。这就是Zr含量增加而使纳米粉末晶粒度减少的主要原因。
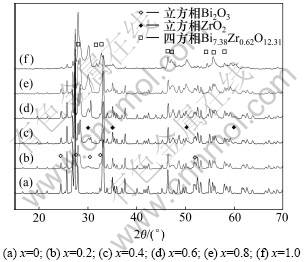
图5 聚丙烯酰胺凝胶法制备的Bi2-xZrxO3+x/2的XRD谱图
Fig.5 XRD patterns of Bi2-xZrxO3+x/2 prepared by polyacrylamide gel method
表2 不同方法制备的Bi2-xZrxO3+x/2的平均晶粒粒径
Table 2 Crystallite size of Bi2-xZrxO3+x/2 prepared by different methods nm
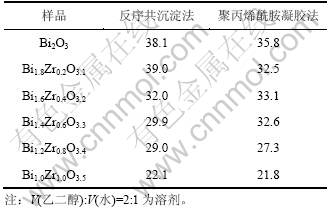
2.3 制备方法对Bi1.8Zr0.2O3.1性能的影响
图6所示为不同方法制备的Bi1.8Zr0.2O3.1的XRD谱图。由图6可以看出:当以V(乙二醇):V(水)=2:1为溶剂时,共沉淀法制备的样品主相均为类似立方相Bi2O3的结构。采用反序加料时样品纯度最高,几乎无其他杂相,说明ZrO2能完全溶解于Bi2O3中形成了单一的立方相固溶体结构,这是因为反序共沉淀法过程中pH变化较小,从而保证了Bi3+和Zr4+的共沉淀要求。采用顺序加料时样品主相结构为立方相固溶体结构,但存在少量四方相Bi7.38Zr0.62O12.31固溶体,这是不均匀沉淀导致的结果。然而,当采用聚丙烯酰胺凝胶法时,主相结构为单斜相Bi2O3。其可能的原因是:当采用硝酸盐作为前驱体时,![]() 作为配位离子,会滞留在中心离子Zr4+和Bi3+周围,延迟了单斜相晶粒的成核与生长,作为点缺陷抑制了四方相ZrO2或立方相Bi2O3向单斜相的转变[10]。然而,当采用聚丙烯酰胺凝胶法时,具有三维网络结构的聚丙烯酰胺凝胶能将
作为配位离子,会滞留在中心离子Zr4+和Bi3+周围,延迟了单斜相晶粒的成核与生长,作为点缺陷抑制了四方相ZrO2或立方相Bi2O3向单斜相的转变[10]。然而,当采用聚丙烯酰胺凝胶法时,具有三维网络结构的聚丙烯酰胺凝胶能将![]() 与水合氢氧化锆和氢氧化铋相隔离,其抑制作用消除,过早出现了单斜相Bi2O3结构。
与水合氢氧化锆和氢氧化铋相隔离,其抑制作用消除,过早出现了单斜相Bi2O3结构。
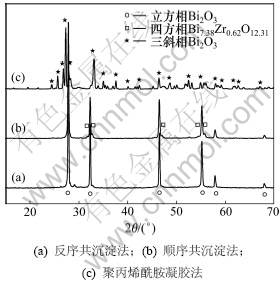
图6 不同方法制备的Bi1.8Zr0.2O3.1 XRD谱图
Fig.6 XRD patterns of Bi1.8Zr0.2O3.1 prepared by different methods
图7所示为不同方法制备的样品IR图。由图7可见:反序共沉淀法制备的样品在590 cm-1处有一强吸收峰,这是立方相固溶体特征峰;顺序共沉淀法制备的样品在588 cm-1处峰的强度下降,并在530 cm-1处出现肩峰,这可能是体系中出现少量四方相Bi7.38Zr0.62O12.31固溶体杂相所致;聚丙烯酰胺凝胶法制备的样品在542,507和436 cm-1处出现单斜Bi2O3特征峰,这与XRD分析结果一致。
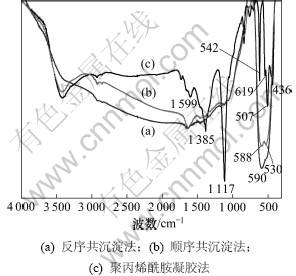
图7 不同方法制备的Bi1.8Zr0.2O3.1 FTIR谱图
Fig.7 FTIR spectra of Bi1.8Zr0.2O3.1 prepared by different methods
图8所示为不同方法制备的样品SEM图。由图8可以看出:顺序共沉淀法制备的样品为不规则的实心固体;反序共沉淀法制备的样品为不规则的多孔状固体,具有较大的比表面积,这可能与其形成单一立方相固溶体相关;聚丙烯酰胺凝胶法制备的样品表面蓬松,具有三维网络结构,其表面积最大。
图8 不同方法制备的Bi1.8Zr0.2O3.1 SEM照片
Fig.8 SEM images of Bi1.8Zr0.2O3.1 prepared by different methods
3 结论
(1) 采用共沉淀法和聚丙烯酰胺凝胶法制备的纯Bi2O3主相均为单斜相晶型即α型,晶粒粒径均在30~39 nm之间。当采用聚丙烯酰胺凝胶法以及选用V(乙二醇):V(水)=2:1液体为溶剂的反序滴定共沉淀法时,制备的单斜Bi2O3相纯度较高;当选用水为溶剂时,采用反序滴定共沉淀法制备的单斜Bi2O3相不纯,含有少量的三斜相Bi2O3和四方相Bi2O3。
(2) 以锆掺杂改性制备的系列混合氧化物Bi2-xZrxO3+x/2(x=0~1.0)中,选用V(乙二醇):V(水)=2:1液体为溶剂,采用反序滴定共沉淀法时,当Zr掺杂量x=0.2,于650 ℃焙烧2 h,ZrO2能完全溶解于Bi2O3中,形成组成为Bi0.9Zr0.1Ox的单一立方相固溶体结构。而采用顺序滴定共沉淀方法,样品主相结构为立方相固溶体结构,但存在少量四方相Bi7.38Zr0.62O12.31固溶体,这是不均匀沉淀导致出现相分离的结果;采用聚丙烯酰胺凝胶法没有得到稳定的立方相固溶体,主相结构为单斜相Bi2O3。由此可见:制备方法不同,ZrO2的最高溶解度不同,同时形成的掺杂Bi2O3会有不同的晶型结构。
(3) 不论采用共沉淀法还是聚丙烯酰胺凝胶法,随着ZrO2掺杂量的增加,Bi2-xZrxO3+x/2的平均晶粒尺寸变小。在一系列的掺杂中,只有乙二醇和水混合溶剂的反序滴定共沉淀法形成了掺杂比例为Bi1.8Zr0.2O3.1的单一立方相固溶体结构,说明采用共沉淀法在650 ℃及合适条件下,适量ZrO2的掺杂能稳定立方相结构的Bi2O3。
参考文献:
[1] 肖政伟. 超细Bi2O3的制备[D]. 长沙: 中南大学冶金科学与工程学院, 2004: 4-9.
XIAO Zheng-wei. Preparation for bismuth trioxide superfine powder[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2004: 4-9.
[2] Punn R, Feteira A M, Sinclair D C, et al. Enhanced oxide ion conductivity in stabilized δ-Bi2O3[J]. J Am Chem Soc, 2006, 128(48): 15386-15387.
[3] Ayala A, Lopez-Garcia A, Leyva A G, et al. Stabilization of β-Bi2O3 by hafnia[J]. Solid State Communications, 1996, 99(6): 451-455.
[4] Sorokina S L, Sleight A W. New phases in the ZrO2-Bi2O3 and HfO2-Bi2O3 systems[J]. Materials Research Bulletin, 1998, 33: 1077-1081.
[5] Wrobel W, Abrahams I, Krok F, et al. Phase stabilization and electrical characterisation in the pseudo-binary system Bi2ZrO5-Bi2VO5.5[J]. Solid State Ionics, 2004, 175(1/2/3/4): 425-429.
[6] Fruth V, Dobrescu G, Bratan V, et al. Structural and electrochemical features of Bi2O3-based fast oxide ion conductors[J]. Journal of the European Ceramic Society, 2007, 27: 4421-4424.
[7] Depero L E, Sangaletti L. Structural disorder and ionic conduction: The case of Bi2O3[J]. Journal of Solid State Chemistry, 1996, 122: 439-443.
[8] Abrahams I, Bush A J, Chan S C M, et al. Stabilisation and characterisation of a new β III-phase in Zr-doped Bi2O3[J]. J Mater Chem, 2001, 11(6): 1715-1721.
[9] Meatza I, Chapman J P, Mauvy F, et al. Novel composition above the limit of Bi:Zr solid solution: Synthesis and physical properties of Bi1.33Zr0.67O3+δ[J]. Materials Research Bulletin, 2004, 39(12): 1841-1847.
[10] Tahmasebpour M, Babaluo A A, Razavi Aghjeh M K. Synthesis of zirconia nanopowders from various zirconium salts via polyacrylamide gel method[J]. Journal of the European Ceramic Society, 2008, 28: 773-778.
[11] 吴绍华, 刘进, 兰尧中. Bi2O3制备方法的研究现状及发展趋势[J]. 湿法冶金, 2005, 24(3): 121-127.
WU Shao-hua, LIU Jin, LAN Yao-zhong. Research status and development trend of preparation methods of bismuth trioxide[J]. Hydrometallurgy of China, 2005, 24(3): 121-127.
[12] CHEN Pei-rong, JI You-zhang, FENG Shi-fen. Preparation of spherical Bi2O3 powder by plasma and precipitation processes[J]. Plasma Science & Technology, 2005, 7(6): 3139-3142.
[13] Hund F. Fluoritmischphasen der dioxide von uran, thorium, cer und zirkonium mit wismutoxid[J]. Zeitschrift für anorganische und allgemeine Chemie, 1964, 333(4/5/6): 248-255.
Hund F. Fluorite-type mixed phases between the dioxides of uranium, thorium, cerium and zirconium with bismuth(Ⅲ) oxide[J]. Journal for Inorganic and General Chemistry, 1964, 333(4/5/6): 248-255.
[14] Levin E M, Roth R S. Polymorphism of bismuth sesquioxide: Ⅱ. Effect of oxide additions on the polymorphism of Bi2O3[J]. J Res Natl Bur Stand A: Phys Chem, 1968, 68A: 197-206.
[15] Jovalekić C, Zdujić M, Poleti D, et al. Structural and electrical properties of the 2Bi2O3·3ZrO2 system[J]. Journal of Solid State Chemistry, 2008, 181(6): 1321-1329.
收稿日期:2010-10-09;修回日期:2011-02-20
基金项目:陕西省科技攻关项目(2008K07-32);陕西省教育厅专项科研计划项目(08JK228)
通信作者:张昭(1963-),女,江苏沛县人,高级工程师,从事无机纳米功能材料研究;电话:029-33579225;E-mail: zhangzhao@sust.edu.cn
摘要:以硝酸铋和硝酸锆为起始原料,分别采用共沉淀法和聚丙烯酰胺凝胶法制备系列锆掺杂改性Bi2O3的混合氧化物Bi2-xZrxO3+x/2(x=0~1.0)。采用XRD,FTIR和SEM对样品的结构及微观形貌进行分析。研究结果表明:于650 ℃焙烧处理后,由以上2种方法制备的纯Bi2O3的主晶相均为单斜晶型α-Bi2O3,其中采用聚丙烯酰胺凝胶法及乙二醇和水混合溶剂反序滴定共沉淀法可制备出纯度较高的单斜相α-Bi2O3。锆掺杂改性制备的系列混合氧化物中,当ZrO2掺杂量(摩尔分数)为10%(x=0.2)时,反序滴定共沉淀法能实现均匀共沉淀,形成了组成为Bi1.8Zr0.2O3.1的类似立方相δ-Bi2O3的单一结构固溶体,顺序滴定共沉淀法会产生相分离,导致四方相Bi7.38Zr0.62O12.31固溶体的出现。然而,当采用聚丙烯酰胺凝胶法时,没有得到类似立方相δ-Bi2O3结构的固溶体,主相结构为单斜相α-Bi2O3以及混合部分四方相Bi7.38Zr0.62O12.31和立方相ZrO2。由此可见:采用反序滴定共沉淀法,在650 ℃低温及合适条件下,掺杂适量的ZrO2能稳定立方相结构的高温离子传导相δ-Bi2O3。
Phase stabilization and electrical characterisation in the pseudo-binary system Bi2ZrO5-Bi2VO5.5[J]. Solid State Ionics, 2004, 175(1/2/3/4): 425-429." target="blank">[5] Wrobel W, Abrahams I, Krok F, et al. Phase stabilization and electrical characterisation in the pseudo-binary system Bi2ZrO5-Bi2VO5.5[J]. Solid State Ionics, 2004, 175(1/2/3/4): 425-429.



