嗜铁钩端螺旋菌对黄铁矿浸出的影响
顾帼华,孙小俊,李建华,苏丽君,刘玉林,赵开乐
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
摘 要:
摘 要:以嗜铁钩端螺旋菌(L. ferriphilum)为实验菌株,考察不同矿浆浓度、接种量、初始pH和初始Fe3+浓度对黄铁矿浸出的影响。试验结果表明:提高矿浆浓度和初始Fe3+浓度会降低黄铁矿浸出率;增大接种量和降低初始pH有利于黄铁矿浸出;在浸出试验过程中定期调整pH,浸出几天后,由于黄钾铁矾生成,不利于黄铁矿浸出;在浸出过程中,生成的黄钾铁矾以结晶颗粒的形式覆盖在黄铁矿表面,表明L. ferriphilum浸出黄铁矿的机制以间接作用为主。
关键词:
中图分类号:TF18 文献标志码:A 文章编号:1672-7207(2010)04-1223-06
Bioleaching of pyrite by L. ferriphilum
GU Guo-hua, SUN Xiao-jun, LI Jian-hua, SU Li-jun, LIU Yu-lin, ZHAO Kai-le
(School of Resources Processing and Bio-engineering, Central South University, Changsha 410083, China)
Abstract: Pyrite oxidation rates were examined in various conditions in the presence of L. ferriphilum, in which different pulp concentrations, inoculation amounts, initial Fe3+ concentrations and initial pH were performed. The results show that increasing pulp concentration can decrease the leaching rate of iron, and high initial Fe3+ concentration is also adverse to leach pyrite. Increasing inoculation amount and lowering initial pH are beneficial to leach pyrite. Adjusting pH in leaching process makes against leaching pyrite due to formed jarosite. Jarosite formed in leaching process is observed with XRD, SEM and EDS analysis, and a considerable amount of debris, with a crystalline morphology is present on the surface of pyrite. Indirect action is more important in bioleaching pyrite.
Key words: pyrite; L. ferriphilum; bioleaching; jarosite; redox potential
随着经济的发展,对矿产资源的开发利用越来越多,矿产资源日趋贫乏,人们不得不考虑采用新方法开发利用低品位、难处理矿产资源。微生物冶金由于其成本低、污染小、工艺流程短、资源利用广等优点越来越受到研究者的关注。黄铁矿是自然界中最常见的硫化矿物之一,几乎与所有的金属硫化矿伴生。同时,它又是许多稀贵金属如金、银、铂族金属等的载体矿物。研究黄铁矿微生物浸出过程的溶解对低品位矿中有价金属的回收及难处理复杂硫化矿的生物预氧化有重要意义。许多研究者对黄铁矿微生物浸出进行了研究[1-11],如:Boon等[4-5]研究了黄铁矿的Thiobacillus ferrooxidans和Leptospirillus菌淋洗动力学以及进出反应器的空气组分,发现氧气消耗主要发生在溶液中,而不是发生在黄铁矿表面,认为Thiobacillus ferrooxidans和Leptospirillus菌所起的作用是氧化溶液中的亚铁,维持较高的氧化还原电势;Magdalena等[6]研究了不同溶解氧浓度下黄铁矿的Acidithiobacillus ferrooxidans菌氧化行为,发现黄铁矿的氧化速率与溶解氧、Fe3+及细菌的浓度有关;May[7]采用动态的氧化还原电位确定Fe3+浸出黄铁矿的动力学,发现黄铁矿的浸出率随电位的下降而降低,浸出率与电位的关系同电化学反应的Butler-Volmer关系相似,说明电化学机理在起作用,黄铁矿的细菌浸出是间接作用的结果;张东晨等[8]借助XRD和SEM/TEM等表面分析测试技术,对煤中黄铁矿表面经过Thiobacillus ferrooxidans菌作用前后的表面微观结构的变化进行研究,发现氧化亚铁作用后的黄铁矿表面呈坑蚀状,是吸附氧化作用所致。Hiltunen[9]对Thiobacillus ferrooxidans菌氧化FeS2时Fe2+的释出及显微结构进行了研究,扫描电镜显示,经6 d浸出的黄铁矿表面有广泛分布的蚀坑,刮下的浸渣中有黄钾铁矾,除渣后矿物表面有零星的细菌,可见细菌始终与矿物表面接触,认为细菌通过直接机理氧化黄铁矿;蒋磊等[10-11]也用扫描电镜研究了黄铁矿浸渣,发现黄铁矿的平整表面和溶蚀坑中均有Thiobacillus ferrooxidans菌吸附,而且溶蚀坑的形状与细菌外形相似,为直接作用提供了依据;Rodríguez等[12]研究了高、低温条件下黄铁矿的微生物浸出机理,发现黄铁矿的溶解受Fe2+和Fe3+在矿物表面的竞争吸附控制,细菌附着在矿物表面的速率与黄铁矿溶解速率之间也存在着某种关系,因此,认为在黄铁矿浸出过程中,初始附着是引起溶解速率占优势的主要原因,黄铁矿的溶解是直接机理和间接机理共同作用的结果。嗜铁钩端螺旋菌(L. ferriphilum)属螺旋菌,严格好氧,可以氧化溶液中的Fe2+获得能量而生长。纯L. ferriphilum菌株对黄铁矿具有较大的氧化作用。目前,关于嗜铁钩端螺旋菌(L. ferriphilum)浸出黄铁矿的报道很少,在此,本文作者以嗜铁钩端螺旋菌(L. ferriphilum)为实验菌株,研究矿浆浓度、接种量、不同初始初始pH和不同Fe3+浓度对黄铁矿浸出的影响,并对嗜铁钩端螺旋菌(L. ferriphilum)黄铁矿浸出机理进行探讨。
1 材料与方法
1.1 黄铁矿的制备
试验用黄铁矿来自广东云浮硫铁矿厂。矿物经破碎、手选和磨矿之后,筛选出粒度小于0.045 mm的部分作为试验矿样。矿样的XRD分析结果见图1。由图1可知:矿样中主要成分为黄铁矿和极少量的石英。对黄铁矿中化学元素进行分析,矿样中含铁46.19%,硫48.99%。
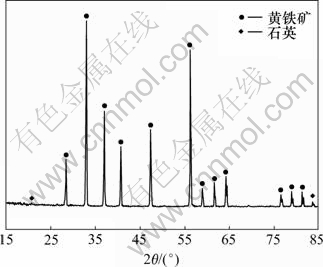
图1 矿样的XRD图
Fig.1 XRD pattern of mineral sample
1.2 细菌的培养
本实验以嗜铁钩端螺旋菌(L. ferriphilum)为实验菌株,由中南大学湿法冶金实验室提供,并于9K培养基中培养。L. ferriphilum菌生长的最佳条件如下:pH=1.6,温度为40 ℃,恒温振荡器转速为170 r/min。9K培养基的组成为:(NH4)2SO4 3 g/L,KCl 0.13 g/L, K2HPO4 0.53 g/L, MgSO4·7H2O 0.53 g/L, Ca(NO3)2 0.013 g/L,FeSO4·7H2O 44.73 g/L。在进行浸出实验前,将L. ferriphilum菌接入黄铁矿浓度为4%的无铁9K培养基转接培养5次以上。将培养好的细菌经离心机离心,用无铁9K培养基制成细菌悬浮液,并用血球计数板计数。细菌悬浮液浓度为2×108 个/mL。
1.3 实验方法
实验在250 mL的锥形瓶中进行,浸出体系为100 mL无铁9K培养基,矿浆质量分数为2%~8%,接种量为5%~15%,初始Fe3+质量浓度为0~1.0 g/L,初始pH为1.6。将锥形瓶放在空气浴恒温振荡器中振荡培养18 d,转速为170 r/min,温度为40 ℃,定期用质量分数为20%的H2SO4调整pH至初始值。
在浸出过程中,每隔3 d取2 mL浸出液,采用滴定法测定溶液中的全铁含量,并用饱和甘汞电极和铂电极测定浸出体系的氧化还原电位。将浸出后的矿渣进行X线衍射、扫描电镜和能谱分析。
2 结果与讨论
2.1 矿浆浓度对黄铁矿浸出的影响
图2所示为不同矿浆浓度下,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和矿浆氧化还原电位与浸矿时间的关系,固定L. ferriphilum菌接种量为10%。
由图2可知:提高矿浆浓度会降低黄铁矿浸出率,这主要是因为矿浆中的矿物颗粒会阻碍O2和CO2传输给菌种,且矿浆中矿物剪切力也会影响细菌生长,造成细菌停滞期延长,当矿浆浓度为2%时,黄铁矿浸出率在第12天达到最大值后下降。这与铁离子形成黄钾铁矾沉淀造成溶液中的铁浓度降低[13]有关。这一点在浸渣的XRD分析中可以得到证实。
K++3Fe3++![]() +6H2O→KFe3(SO4)2(OH)6+6H+ (1)
+6H2O→KFe3(SO4)2(OH)6+6H+ (1)
从图2还可看到:浸出体系的氧化还原电位随着时间延长而上升,不同矿浆浓度之间的电位有明显差别;矿浆浓度为2%的电位在第10天达到600 mV (SCE),明显高于矿浆浓度为 4%和8%时的电位。这与Boon的研究结果一致,即高氧化还原电位有利于黄铁矿浸出[14]。
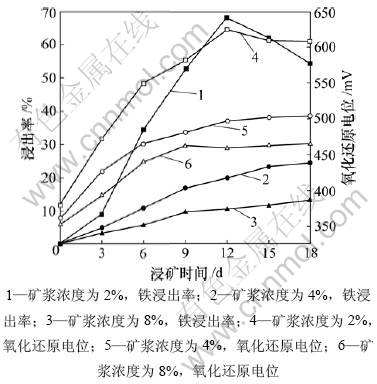
图2 不同矿浆浓度下,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和矿浆氧化还原电位与浸矿时间的关系
Fig.2 Relationship among leaching rate of pyrite and redox potential and time in leaching process by L. ferriphilum with different pulp concentrations
2.2 接种量对黄铁矿浸出的影响
图3所示为不同接种量下,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和氧化还原电位与浸矿时间的关系,固定矿浆浓度为4%。由图3可知:在不同接种量下,浸出体系中的铁浸出率和氧化还原电位在初期都上升较快,之后增长缓慢;接种量为15%的体系中,铁浸出率在第12天达到33%,明显高于接种量为5%和10%的体系中的铁浸出率。这可能是因为 L. ferriphilum菌生长速率缓慢,接种量较低时无法产生较高的细菌浓度,造成黄铁矿浸出速率降低。从图3还可以看出:矿浆氧化还原电位高,黄铁矿的浸出率更高。
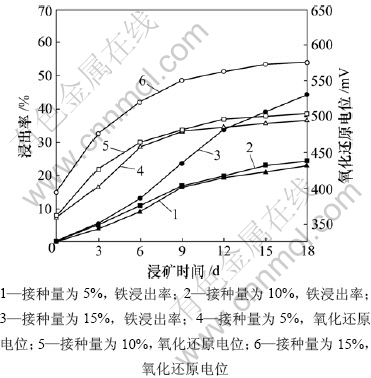
图3 不同接种量下,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和氧化还原电位与浸矿时间的关系
Fig.3 Relationship among leaching rate of pyrite and redox potential and time in leaching processing L. ferriphilum with different inoculation amounts
2.3 不同初始pH对黄铁矿浸出的影响
图4为初始pH不同时,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和矿浆氧化还原电位与浸矿时间的关系,图5所示为浸出过程中pH随时间的变化规律。固定L. ferriphilum菌接种量为10%,矿浆浓度为4%,在浸出过程中不调整pH。
从图4可知:在初始pH较低时,在浸矿3 d后矿浆电位较高,有利于黄铁矿浸出。由图5可知:黄铁矿的浸出是一个产酸过程。在浸出过程中,溶液pH一直下降,尤其是在浸出初期降低较快;当初始pH为1.6时,浸出18 d后,溶液的pH下降到0.74。一般随着pH下降,细菌活性降低[15-16],但是,溶液中的铁浓度仍然上升,这说明溶液中主要发生了如下 反应[17]:
![]() →
→![]() (2)
(2)
![]() (3)
(3)
![]() →
→![]() (4)
(4)
当溶液pH低于1.0时,也会发生如下反应[18]:
![]() →
→![]() (5)
(5)
在pH较低时,溶液中的Fe3+浓度升高。高浓度Fe3+加快了黄铁矿的氧化速率,即黄铁矿浸出是以化学浸出为主。
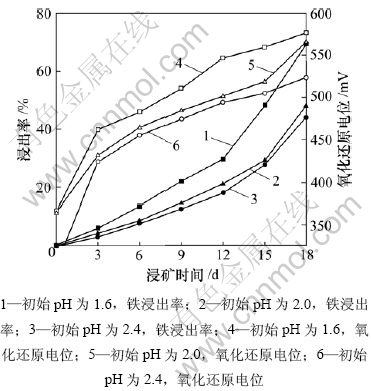
图4 不同初始pH下,黄铁矿L. ferriphilum菌浸出体系铁浸出率和矿浆氧化还原电位与浸矿时间的关系
Fig.4 Relationship among leaching rate of iron and redox potential and time in leaching process by L. ferriphilum with various initial pH
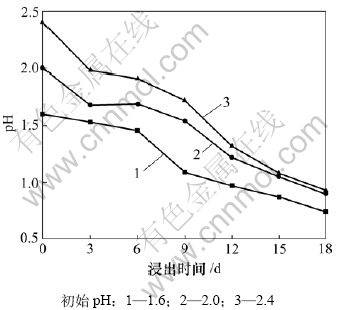
图5 黄铁矿L. ferriphilum菌浸出体系的pH与时间的关系
Fig.5 Relationship between pH and time in leaching process by L. ferriphilum with various initial pH
在相同条件下的浸出过程中,不调整pH更有利于黄铁矿的浸出,因为pH低会抑制黄钾铁矾的形成。
2.4 不同初始Fe3+质量浓度对黄铁矿浸出的影响
图6所示为不同初始Fe3+质量浓度下,黄铁矿 L. ferriphilum菌浸出体系的铁浸出率和矿浆氧化还原电位与浸矿时间的关系,固定L. ferriphilum菌接种量为10%,矿浆浓度为4%,初始pH为1.6。
从图6可知:高初始Fe3+质量浓度其初始氧化还原电位提高,但是不能维持;电位在浸出初期下降,3 d后开始缓慢上升;在高初始Fe3+质量浓度体系中,在6 d后氧化还原电位比不加Fe3+体系中的氧化还原电位低(小于500 mV),不利于黄铁矿的浸出。这说明高质量浓度的Fe3+会抑制细菌的生长,降低细菌的氧化能力。这与文献[19-20]中的研究结果一致。
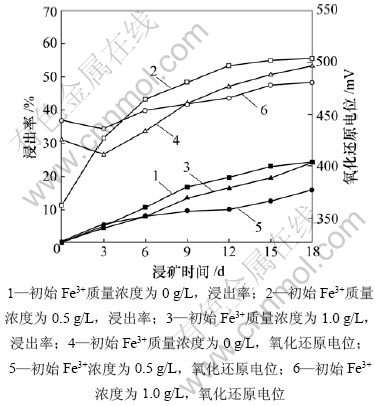
图6 不同初始Fe3+浓度下,黄铁矿L. ferriphilum菌浸出体系的铁浸出率和矿浆氧化还原电位与浸矿时间的关系
Fig.6 Relationship among leaching rate of pyrite and redox potential and time in leaching process by L. ferriphilum with different initial Fe3+ concentrations
2.5 浸渣的X线衍射、扫描电镜和能谱分析
对矿浆浓度为2%、接种量为10%的黄铁矿 L. ferriphilum菌浸出18 d后的浸渣用X线衍射进行分析,结果如图7(a)所示。与浸出前的矿样(图1)相比,浸渣的黄铁矿含量降低,有黄钾铁矾出现。这表明在浸出过程中确实有黄钾铁矾生成。在衍射图中没有发现元素硫的波峰,说明黄铁矿浸出过程中可能没有生成元素硫。图7(b)所示为浸渣的扫描电镜图,可见:黄铁矿表面被具有一定晶体结构的颗粒所覆盖。

图7 黄铁矿L. ferriphilum菌浸出体系浸渣的XRD谱图和扫描电镜(SEM)图
Fig.7 XRD pattern and SEM image of residues leached by L. ferriphilum
表1所示是矿浆浓度为2%、接种量为10%的黄铁矿L. ferriphilum菌浸出18 d后的浸渣的能谱分析结果。可见:浸出前,黄铁矿中铁的质量分数为46.19%,硫的质量分数为48.99%,铁与硫的物质的量比为1.00?1.86;浸出后,黄铁矿中铁的质量分数为55.79%,硫的质量分数为25.39%,铁与硫的物质的量比为1.00?0.79。由于硫被氧化为硫酸,造成浸渣中铁的含量提高,硫的含量下降。
表1 浸出后L. ferriphilum菌浸渣能谱分析结果
Table 1 Results of energy dispersion spectrum(EDS) of leached residues by L. ferriphilum %

从表1还可以发现:浸渣中有K元素存在,说明浸渣中含有黄钾铁矾,这与XRD的分析结果一致。
3 结论
(1) 矿浆质量浓度和接种量对L. ferriphilum菌浸出黄铁矿有明显影响。在低矿浆质量浓度下, L. ferriphilum菌浸出黄铁矿的速率大于高矿浆浓度下L. ferriphilum菌浸出黄铁矿的速率;增大接种量,也会提高L. ferriphilum菌浸出黄铁矿的速率。
(2) 高氧化还原电位和低初始pH有利于黄铁矿浸出。但是,在浸出过程中,调整pH会引起黄钾铁矾生成,不利于浸出。浸渣的X线衍射(XRD)、扫描电镜(SEM)和能谱(EDS)分析结果也证明了这一点。
(3) 黄铁矿的L. ferriphilum菌浸出以间接作用 为主。
参考文献:
[1] Yu J Y, McGenity T J, Coleman M. Solution chemistry during the lag phase and exponential phase of pyrite oxidation by Thiobacillus ferrooxidans[J]. Chemical Geology, 2001, 175(3/4): 307-317.
[2] Oswaldo G J, Jerry M B, Olli H T. Oxidation of isochemical FeS2(marcasite-pyrite) by Acidithiobacillus thiooxidans and Acidithiobacillus ferrooxidans[J]. Minerals Engineering, 2007, 20(1): 98-101.
[3] 蒋磊, 周怀阳, 彭晓彤. 黄铁矿生物氧化过程的阶段性[J]. 金属矿山, 2007, 376(10): 59-63.
JIANG Lei, ZHOU Huai-yang, PENG Xiao-tong. Phasess in pyrite-oxidation process[J]. Metal Mine, 2007, 376(10): 59-63.
[4] Boon M, Heijnen J J. Chemical oxidation kinetics of pyrite in bioleaching processes[J]. Hydrometallurgy, 1998, 48(1): 27-41.
[5] Boon M. The use of off-gas analyses and stoichiometry in the biooxidation kinetics of sulphide minerals[J]. Hydrometallurgy, 1998, 48(1): 1-26.
[6] Magdalena G, Herbert Jr Roger B, Frogner Kockum Paul C. Pyrite oxidation by Acidithiobacillus ferrooxidans at various concentrations of dissolved oxygen[J]. Chemical Geology, 2006, 225(1/2): 16-19.
[7] May N. Chemical and electrochemical basis of bioleaching processes[J]. Minerals Engineering, 1999, 10(9): 1023.
[8] 张东晨, 张明旭, 陈清如. 煤中黄铁矿表面细菌氧化的XRD及SEM/TEM研究[J]. 中国矿业大学学报, 2005, 6(10): 761-765.
ZHANG Dong-chen, ZHANG Ming-xu, CHEN Qing-ru. Research on SEM/TEM and XRD of germ oxidizing pyrite surface in coal[J]. Journal of China University of Mining & Technology, 2005, 6(10): 761-765.
[9] Hiltunen P. Bacterial pyrite oxidation: Release of iron and scanning electron microscopic observations[J]. Hydrometallurgical, 1981, 7(10): 147-157.
[10] 蒋磊, 周怀阳, 彭晓彤. 氧化亚铁硫杆菌对黄铁矿、黄铜矿和磁黄铁矿的生物氧化作用研究[J]. 科学通报, 2007, 52(15): 1802-1812.
JIANG Lei, ZHOU Huai-yang, PENG Xiao-tong. Oxidization effect of Thiobacillus ferroxidans on pyrite, chalcopyrite and pyrrhotine[J]. Chinese Science Bulletin, 2007, 52(15): 1802-1812.
[11] 蒋磊, 周怀阳, 彭晓彤. 氧化亚铁硫杆菌对黄铁矿的氧化作用初探[J]. 矿物学报, 2007, 27(1): 25-29.
JIANG Lei, ZHOU Huai-yang, PENG Xiao-tong. Preliminary study on bio-oxidation of pyrite by A.ferrooxidans[J]. Acta Mingeralogica Sinica, 2007, 27(1): 25-29.
[12] Rodríguez Y, Ballester A, Blázquez M L, et al. New information on the pyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003, 71(1/2): 37-46.
[13] Deveci H, Akcil A, Alp I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: Comparative importance of pH and iron[J]. Hydrometallurgy, 2004, 73(3/4): 293-303.
[14] Boon M, Heijnen J J. Solid-liquid mass transfer limitation of ferrous iron in the chemical oxidation of FeS2 at high redox potential[J]. Hydrometallurgy, 2001, 62(1): 57-66.
[15] 路殿坤, 刘大星, 蒋开喜, 等. 硫化矿物细菌氧化机理研究进展[J]. 有色金属: 冶炼部分, 2001, 8(1): 2-5.
LU Dian-kun, LIU Da-xing, JIANG Kai-xi, et al. The research progress about mechanism of bacteria oxidizing sulfide minerals[J]. Nonferrous Metals: Extractive Metallurgy, 2001, 8(1): 2-5.
[16] Hansford G S, Vargas T. Chemical and electrochemical basis of bioleaching processes[J]. Hydrometallurgy, 2001, 59(2/3): 135-145.
[17] 柳建设. 硫化矿生物提取及腐蚀电化学研究[D]. 长沙: 中南大学资源加工与生物工程学院, 2002: 82-96.
LIU Jian-she. Bioextraction and corrosion electrochemistry of sulfide minerals[D]. Changsha: Central South University. School of Resource Processing and Bioengineering, 2002: 82-96.
[18] 王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科技出版社, 1988: 1-343.
WANG Dian-zuo, HU Yue-hua. Solution chemistry of flotation[M]. Changsha: Hunan Science and Technology Press, 1988: 1-343.
[19] 谢海云, 刘中华, 周峨. 高铁离子浓度下氧化亚铁硫杆菌的生长行为[J]. 过程工程学报, 2004, 15(1): 43-46.
XIE Hai-yun, LIU Zhong-hua, ZHOU E. Growth of Thiobacillus ferrooxidan in high concentration ferrous ion culture medium[J]. The Chinese Journal of Process Engineering, 2004, 15(1): 43-46.
[20] Sharma P K, Dasb A, Hanumantha R K, et al. Surface characterization of Acidithiobacillus ferrooxidans cells grown under different conditions[J]. Hydrometallurgy, 2003, 71(3): 285-292.
收稿日期:2009-10-21;修回日期:2010-01-12
基金项目:国家自然科学基金资助项目(50621063);国家重大基础研究发展规划(“973”计划)项目(2004CB619204)
通信作者:顾帼华(1969-),女,江西南昌人,博士,教授,从事矿物加工及生物冶金研究;电话:0731-88877867;E-mail: guguohua@126.com
(编辑 陈灿华)
[3] 蒋磊, 周怀阳, 彭晓彤. 黄铁矿生物氧化过程的阶段性[J]. 金属矿山, 2007, 376(10): 59-63.
[8] 张东晨, 张明旭, 陈清如. 煤中黄铁矿表面细菌氧化的XRD及SEM/TEM研究[J]. 中国矿业大学学报, 2005, 6(10): 761-765.
[10] 蒋磊, 周怀阳, 彭晓彤. 氧化亚铁硫杆菌对黄铁矿、黄铜矿和磁黄铁矿的生物氧化作用研究[J]. 科学通报, 2007, 52(15): 1802-1812.
[11] 蒋磊, 周怀阳, 彭晓彤. 氧化亚铁硫杆菌对黄铁矿的氧化作用初探[J]. 矿物学报, 2007, 27(1): 25-29.
[15] 路殿坤, 刘大星, 蒋开喜, 等. 硫化矿物细菌氧化机理研究进展[J]. 有色金属: 冶炼部分, 2001, 8(1): 2-5.
[17] 柳建设. 硫化矿生物提取及腐蚀电化学研究[D]. 长沙: 中南大学资源加工与生物工程学院, 2002: 82-96.
[18] 王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科技出版社, 1988: 1-343.
[19] 谢海云, 刘中华, 周峨. 高铁离子浓度下氧化亚铁硫杆菌的生长行为[J]. 过程工程学报, 2004, 15(1): 43-46.


