中国有色金属学报 2004,(04),591-595 DOI:10.19476/j.ysxb.1004.0609.2004.04.013
Ni-Fe-Cu惰性金属阳极的抗氧化和耐蚀性能
东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院 沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004
摘 要:
对Ni Fe Cu合金的抗氧化和耐熔盐腐蚀性能进行了研究。结果显示,该合金的氧化动力学曲线符合抛物线规则。静态电解质中的溶解腐蚀速率随温度的增高和NaF与AlF3的摩尔分子比的降低而增大。在不同电解条件下,组成为NaF AlF3 NaCl CaF2 Al2O3的电解质体系中电解时,该阳极周围产生大量气泡,槽电压在3.6~4.2之间波动,阳极的电解极化腐蚀速率随电解质中氧化铝浓度的增高、温度的降低而减小,产品铝的纯度达到97%~98%。
关键词:
惰性金属阳极;Ni-Fe-Cu合金;低温铝电解;氧化;熔盐冰晶石腐蚀;
中图分类号: TF351
作者简介:石忠宁(1975),男,博士研究生.;
收稿日期:2003-07-11
基金:国家重点基础研究与发展规划资助项目(G1999064903);国家863计划资助项目(2001AA33501);
Anti-oxidation and anti-corrosion properties of Ni-Fe-Cu inert metal anodes
Abstract:
The anti-oxidation and anti-corrosion properties in molten cryolite of Ni-Fe-Cu alloys were studied. The results indicate that the oxidation kinetic curves follow the parabolic law. The dissolution rate in static melt increases with increasing temperature and decreasing cryolite ratio of NaF/AlF3. When electrolysis test was conducted in molten salts consisting of NaF-AlF3-NaCl-CaF2-Al2O3 under different conditions, abundant gas bubble evolved around the used anode and the cell voltage fluctuated from 3.6 V to 4.2 V. The polarization corrosion rate decreases with increasing concentration of Al2O3 in melts and decreasing temperature. The purity of aluminum product is 97%98%.
Keyword:
Received: 2003-07-11
以往铝电解惰性阳极研究的重点和热点是金属陶瓷, 目前对合金阳极的研究已逐渐引起重视。 虽然陶瓷阳极的研究取得了一定进展, 但尚未工业化成功应用, 主要是因为金属陶瓷表现出陶瓷的缺陷: 抗热震性差, 与电源连接困难等问题难以彻底解决
惰性金属阳极工作时, 其表面析出的氧气会与金属基体反应生成相应的氧化物, 该氧化物与基体金属的粘附性、 致密性、 导电性及其在冰晶石熔盐中的稳定性是否良好就决定了该合金材料是否适用于铝电解工业应用。 由于氧化镍、 氧化铁、 氧化锌等金属氧化物或复合氧化物在冰晶石熔盐中溶解度相对较小, 故常为惰性阳极选用材料。
本文作者选用相应氧化物在冰晶石中溶解度相对较低的Ni-Fe-Cu合金做阳极, 对其抗氧化和耐熔盐腐蚀性能进行了研究。
1 实验
1.1 阳极试样制作
阳极材料选用粒度小于74 μm的分析纯试剂铜粉、 镍粉和还原铁粉。 合金成分中镍、 铜、 铁的质量比按58∶22∶20混合, 球磨24 h后, 在600 MPa下冷压成型, 然后在通入氩气保护的硅碳棒炉中, 在1 125 ℃下烧结。 烧结后阳极试样规格为d 40.50 mm×14.05 mm。 采用排水法测得其表观密度为8.52 g/cm3。
1.2冰晶石熔盐中的静态溶解腐蚀实验
为了测定试样在静态熔盐电解质中的溶解腐蚀速率, 截取规格为4 mm×8 mm×20 mm的合金阳极试样4块, 分别在750 ℃和800 ℃且NaF/AlF3摩尔分子比为1.5和1.8的电解质中浸蚀。 电解质的其余组成为10.0%NaCl、 5.0%CaF2、 3.0%Al2O3。 溶解腐蚀实验在电阻炉内进行。 试样放于石墨坩埚中, 使其最大表面积与电解质接触, 恒温浸蚀72h后, 取出试样, 待其冷却后, 在65 ℃、 30%的AlCl3溶液中浸洗残余电解质。
1.3 金属阳极氧化实验
准备规格为4 mm×8 mm×20 mm的试样3块, 用700#水砂纸磨光, 用酒精和丙酮清洗, 干燥后在管状电阻炉进行氧化实验。 实验前, 对悬吊用的Ni-Cr丝在相同的条件下进行预氧化校正。 采用岛津AY120型热天平连续称量, 氧化实验分别在600 ℃、 800 ℃的静态空气和800 ℃流量为0.25 m3/h的氧气中进行。 用XRD分析氧化产物。
1.4 金属阳极电解实验
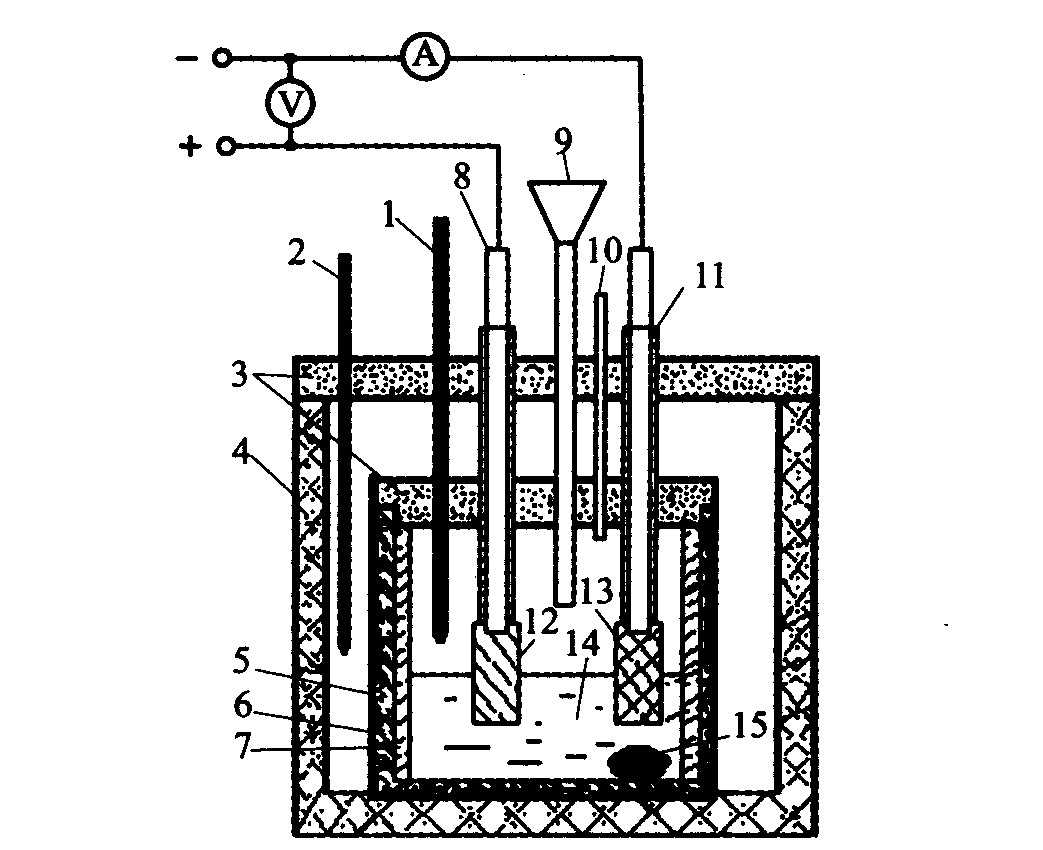
电解用阳极规格为32.50 mm×20.00 mm×10.50 mm。 金属阳极通过不锈钢导杆与电源连接, 导杆用氧化铝刚玉做保护管以延长其使用寿命。 电解在加有绝缘侧壁以提高阴极电流密度的石墨坩埚内进行, 电解实验装置如图1所示。 3次实验均采用相同的电流密度、 NaF/AlF3摩尔分子比和极间距, 它们分别为1.0 A/cm2、 1.8和2.5 cm。 电解温度和氧化铝质量分数不同。 电解质组成NaF-AlF3- 10%NaCl-5%CaF2-Al2O3, 实验原料中Na3AlF6、 Al2O3为工业产品, 其余均为分析纯试剂, 所有化学药品均烘焙干燥。 在实验过程中每间隔30 min加入定量氧化铝, 以保证氧化铝浓度在一定范围内稳定。 电解时, 每隔5 min记录一次槽电压。
图1 Ni-Fe-Cu阳极电解装置图 Fig.1 Schematic diagram of electrolysis cell installed with Ni-Fe-Cu anode 1—Measuring thermocouple; 2—Temperature controlling thermocouple; 3—Lids; 4—Furnace; 5—Iron crucible; 6—Graphite crucible; 7—Insulation wall; 8—Anode rod; 9—Alumina feeder pipe; 10—Vent pipe; 11—Cathode rod; 12—Anode; 13—Cathode; 14—Electrolyte; 15—Liquid aluminum
2 结果与讨论
2.1 静态腐蚀结果
用分析天平(精度0.1 mg)称重并测量腐蚀后试样的几何尺寸, 发现阳极尺寸在测量误差范围内无明显变化, 可认为其反应总表面积s为常数。 阳极腐蚀的平均速率计算公式为
式中 ω—腐蚀速率, cm/h; ρ—阳极的表观密度,g/cm3; Δw—质量变化量, g; s—阳极反应表面积, cm2; t—电解反应时间, h。
根据实验结果, 由上式计算得, 在750 ℃和800 ℃、 NaF/AlF3摩尔分子比为1.5时, 腐蚀速率分别为1.39×10-4 cm/h和1.95×10-4 cm /h; NaF/AlF3摩尔分子比为1.8时, 腐蚀速率分别为1.02×10-4 cm/h和1.30 ×10-4 cm/h。 电解质的NaF/AlF3摩尔分子比和温度均对其腐蚀速率有很大影响。 温度较高时, 活性金属合金元素向表面扩散速度增大, 加快溶解腐蚀。 而AlF3的影响机理比较复杂, 与电解质成分结构密切相关。
2.2 氧化结果与讨论
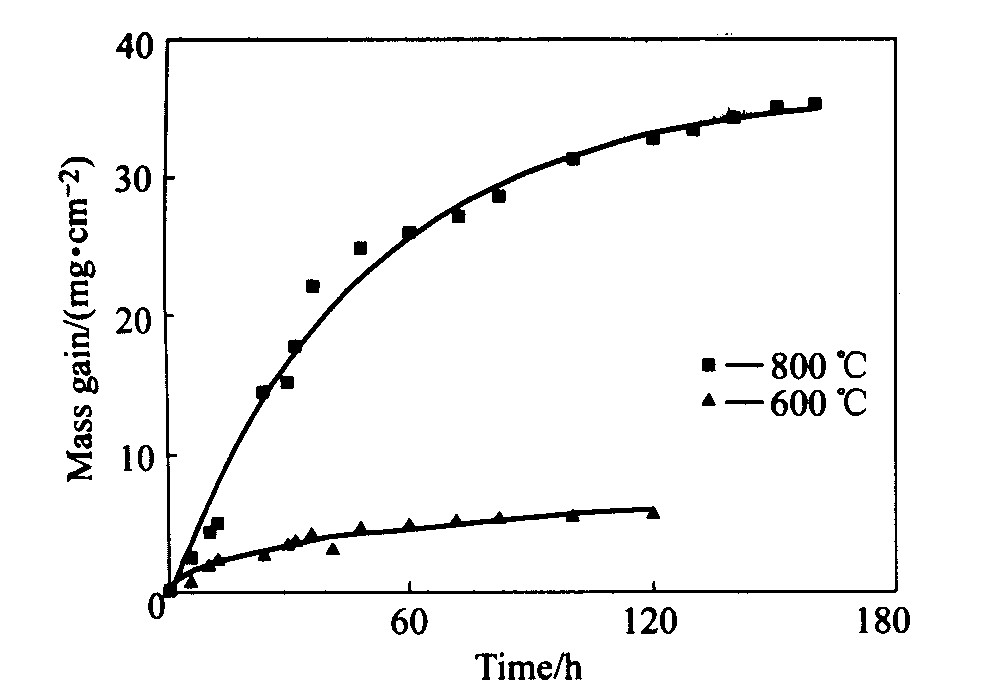
合金阳极试样的氧化增重曲线随时间变化关系如图2和3所示。 由图2可知, 氧化曲线随时间变化呈抛物线关系, 说明合金氧化时能形成致密的氧化物保护膜。
图2 Ni-Fe-Cu合金在空气中的氧化动力学曲线 Fig.2 Oxidation kinetic curves of Ni-Fe-Cu alloys in air
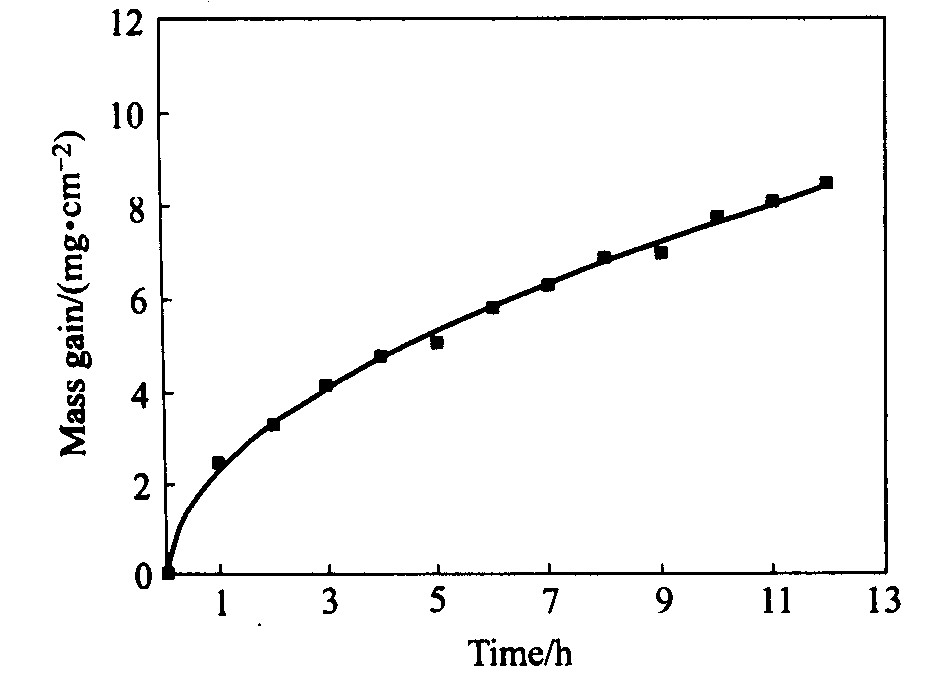
图3 Ni-Fe-Cu合金在氧气氛中的氧化动力学曲线 Fig.3 Oxidation kinetic curve of Ni-Fe-Cu alloy at 800 ℃ in flowing oxygen of 0.25 m3/h
由图2知, 在600 ℃的空气中, Ni-Fe-Cu合金经过120 h的氧化后质量增加为5.23 mg/cm2, 而在800 ℃时其质量增加达到32.7 mg/cm2。 这说明温度的增高加快了氧化反应的速度。 在800 ℃的空气中, 氧化12 h后, 其质量增加为5.1 mg/cm2, 而在800 ℃的氧气中氧化12 h后, 其质量增加为8.62 mg/cm2。 显然, 纯氧气氛明显加速氧化反应速度。
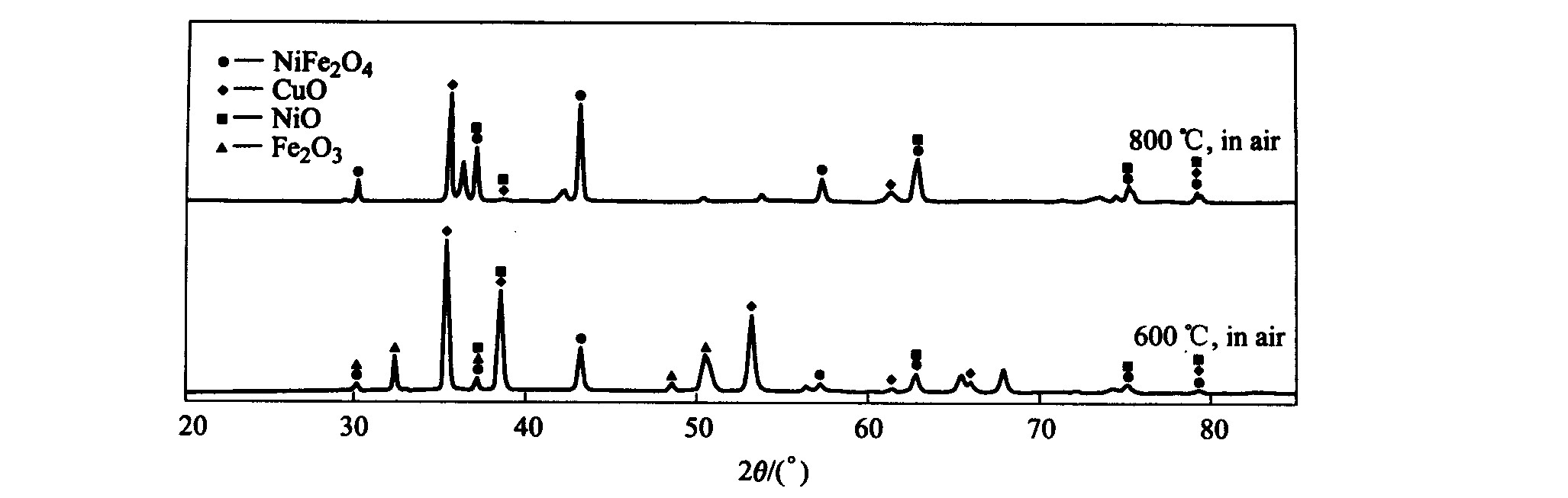
X射线衍射分析发现氧化膜由3种金属组元的氧化物及其复合氧化物组成的混合物NiO、 CuO、 Fe2O3和NiFe2O4组成, 如图4所示。 NiO、 Fe2O3、 NiFe2O4在电解质中溶解度较小, 均能较好抵抗电解质腐蚀, 这正是铝电解惰性阳极所需的
2.3 电解腐蚀与讨论
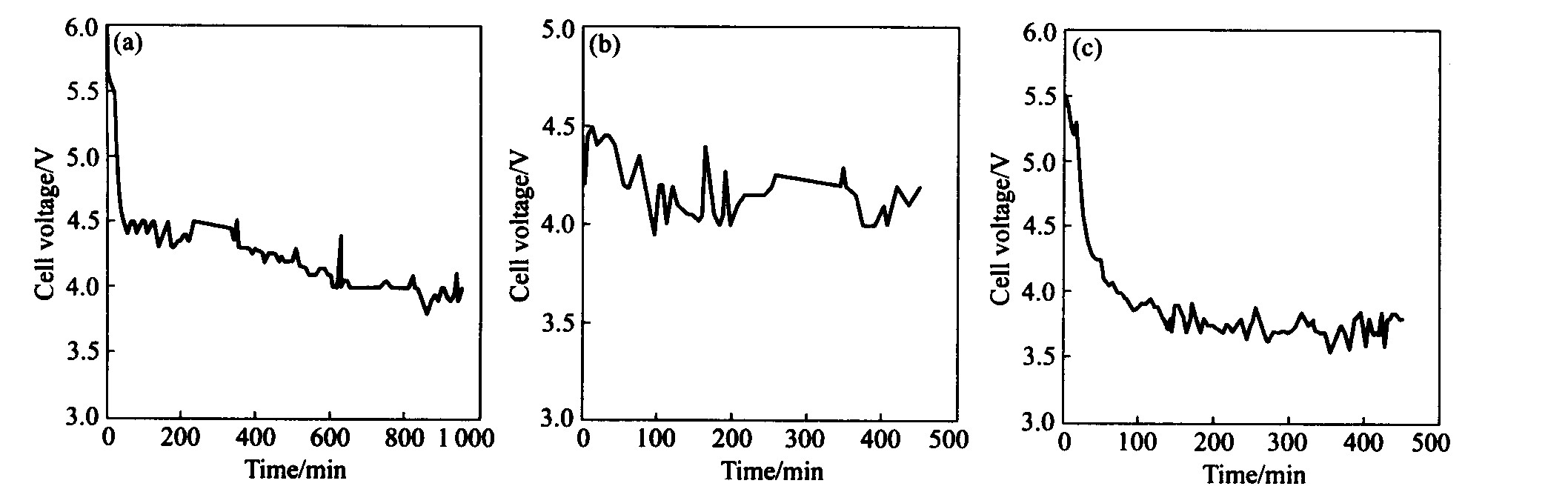
电解试验的槽电压与时间的变化关系如图5所示。
电解实验发现, 刚开始槽电压较高, 经过一段时间后, 槽电压逐渐下降, 最后在相对稳定的范围内变化。 尽管槽电压高出理论分解电压1.2~2.2V
在低氧化铝浓度下开始电解时, 阳极产生的气泡小而多, 并沿阳极表面往外逸出, 槽电压比较正常, 阳极的腐蚀速率由式(1)计算。 图5(a)所示为800 ℃、 2.5%Al2O3条件下电解时的槽电压变化曲线, 阳极的腐蚀速率为6.30×10-4 cm/h; 图5(b)所示为900 ℃、 2.5%Al2O3条件下电解时的槽电压变化曲线, 阳极的腐蚀速率为8.60 ×10-4 cm/h; 图5(c)所示为800 ℃、 3.0%Al2O3条件下电解时的槽电压变化曲线, 阳极的腐蚀速率为5.71 ×10-4 cm/h。 从上述结果看, 在相同氧化铝浓度下电解时, 温度越高, 阳极腐蚀速率越快; 在相同温度下电解时, 氧化铝浓度越高, 阳极腐蚀速率越小。 其原因是氧化铝浓度增加使得反应式(2)平衡向左移动, 阳极表面氧化膜(MexOy)的溶解得到一定程度抑制。
图4 Ni-Fe-Cu合金氧化膜X射线衍射分析图 Fig.4 XRD patterns of Ni-Fe-Cu alloy oxide coating
图5 Ni-Fe-Cu阳极电解槽电压与时间的变化关系 Fig.5 Fluctuation of cell voltage in electrolysis by Ni-Fe-Cu anode (a)—800 ℃, 2.5%Al2O3; (b)—900 ℃, 2.5%Al2O3; (c)—800 ℃, 3.0%Al2O3
在电解过程中, 阳极周围的电解液面偶尔有噼啪声, 可见火花伴随上冒气泡产生。 其原因是阳极排放的氧气在电解质中涌动, 搅动整个电解质, 使部分氧扩散到阴极区, 与生成的阴极铝发生燃烧反应而产生火花。
电解后收集的阴极产品铝用EPM-810型电子探针分析仪进行分析, 发现铝的纯度达到97.5%~98.0%, 其中镍<0.81%, 铁<0.53%, 铜<0.77%。 这说明Ni-Fe-Cu合金作阳极时的电解铝质量好于Cu-Ni-Al合金作阳极时的电解铝质量
3 结论
1) 在静态电解质中, Ni-Fe-Cu合金阳极的溶解速率随温度的增高、 NaF/AlF3摩尔分子比的降低而增大。 合金在空气、 氧气中氧化动力学曲线为抛物线规则, 能形成致密氧化物保护膜。
2) 较高的氧化铝浓度有利于减少阳极的腐蚀, 低温电解有利于发挥金属阳极的优越性。 阳极在电解极化条件下的腐蚀速度大于它在静态电解质中的腐蚀速度。
3) Ni-Fe-Cu合金阳极电解过程平稳, 槽电压在3.6~4.2 V之间变动, 产品铝的纯度达到97%~98%。
参考文献
[3] HrynJN,PellinMJ.Adynamicinertmetalsanode[A].EckertCE.LightMetals[C].Warrendale:TMS,1999.377381.
[5] SekharJA,LiuJ.Non consumableanodematerials[A].LightMetals[C].Warrendale:TMS,1998.597603.
[6] SekharJA,DuruzJ,LiuJ.StableAnodesforAluminumProductionCells[P].US5510008,1996.