四氯化钛低温水解直接制备金红石型纳米二氧化钛
中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室 湖南长沙410083,湖南长沙410083,湖南长沙410083,湖南长沙410083,湖南长沙410083
摘 要:
以四氯化钛为原料, 在低温条件下水解, 直接得到金红石型纳米二氧化钛粉体。通过对粉体进行XRD, TEM和BET等的表征表明, 四氯化钛的盐酸溶液在低温水解中直接生成金红石相质量分数高达99.24%的沉淀产物, 经干燥或进一步在较低温度 (200, 300, 400℃) 下煅烧即可得到金红石型二氧化钛粉体, 制得的粉体粒子呈椭圆形, 粒径为1030 nm, 且分散性好, 比表面积大。
关键词:
中图分类号: TB383.1
收稿日期:2005-10-18
Preparation of Nanosized Rutile TiO2 Powders by Direct Hydrolysis of TiCl4
Abstract:
A simple technology processing using TiCl4 as raw material at low temperature to prepare directly nanosized rutile TiO2 powders was presented.The products were characterized by XRD, TEM and BET.The results show that the precipitates with 99.24% rutile content are directly produced by hydrolysis of HCl solution of TiCl4 at low temperature and nanosized rutile TiO2 powders are obtained by direct drying the precipitates, or further baking at low temperatures (200, 300, 400 ℃) ;and that the particles of TiO2 powders are of ellipsoid wise, 10~30 nm in diameter, with good dispersity and large surface area.
Keyword:
nanosized TiO2;rutile;TiCl4;hydrolysis;
Received: 2005-10-18
金红石型纳米二氧化钛在精细陶瓷、高档涂料、防晒化妆品等许多领域有极广泛的用途
但是, 传统金红石型二氧化钛的制备需经高温固相反应, 经历由无定形※锐钛矿※金红石的转化过程
1 实验
1.1 原料
四氯化钛 (化学纯, 金山区塔美化工厂) ;异丙醇 (分析纯, 广东汕头市西陇化工厂) ;钛酸丁酯 (分析醇, 天津市科密欧化学试剂开发中心) ;盐酸 (分析纯, 湖南株洲市化学工业研究所) ;聚乙二醇-200 (分析醇, 广东汕头市西陇化工厂) ;无水乙醇 (分析纯, 湖南汇虹试剂有限公司) ;氨水 (分析纯, 长沙延风化学试剂有限公司) 。
1.2 实验方法
取100 ml去离子水加入到四口烧瓶中, 并将该烧瓶置于冰水浴中, 按异丙醇∶H2O=1∶5, 取20 ml异丙醇加入烧瓶中作为分散剂, 将浓盐酸滴加到水溶液中, 调节水溶液的pH值为0.5~3.0之间, 再缓慢滴加浓度为0.5 mol·L-1的TiCl4溶液, 滴加氨水调节溶液的pH约为8, 加热至70℃保温3 h, 陈化24 h, 过滤, 用无水乙醇洗2~3次, 80℃干燥, 得到TiO2粉末。然后分别在300, 400℃煅烧2 h得到样品。
1.3 分析测试
采用Rigaku D/max255VB+18 kW转靶X射线衍射仪, 对所制备的TiO2样品进行物相分析与表征;采用HIACHI H-800 Electron MICROSCPOE透射电镜, 对所制备的TiO2样品微观结构进行分析与表征;采用英国康塔 (Quamtachrome) Autosorb-1静态体积吸附分析仪, 对制备的不同TiO2样品进行比表面积的检测与表征
2 结果与讨论
2.1 水解机制
二氧化钛有金红石、锐钛矿和板钛矿3种结构, 前两者为四方晶系, 后者为斜方晶系, 金红石和锐钛矿结构虽均为四方晶系, 但由于锐钛矿、板钛矿和金红石的结构不同, 稳定性不同, 板钛矿和锐钛矿是低温相, 金红石是高温相, 前二者可以在600℃以上转变为金红石型, 这种转化不是突跃式的, 而是渐进的和不可逆的, 这个转化除了受温度影响外, 还受到能加速或阻止晶型转化的促进剂和抑制剂的影响。
TiCl4和水之间的反应剧烈且复杂, 这与温度和其他条件有关。其反应产物通常为TiCl4·5H2O (水量充足) 或TiCl4·2H2O (水量不足或低温) , 然后该化合物继续发生如下水解反应

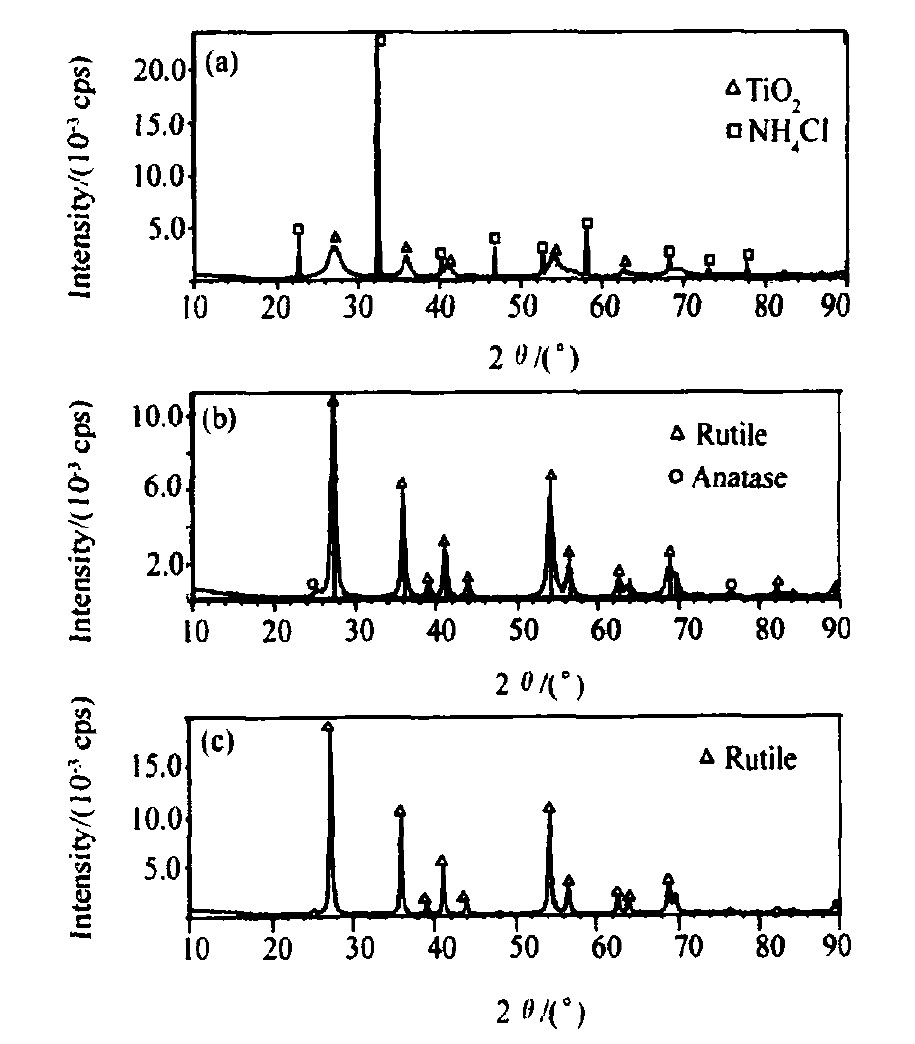
水解产物Ti (OH) 4·H2O在静置、洗涤或加热过程中会逐渐失去水而变成 (H2TiO3) , 以上反应是可逆、分步水解反应过程, 同时水解产物Ti (OH) 4·H2O将发生如 (6) 式的聚合反应, 形成高相对分子质量的产物。实际上只要溶液中有OH-和Cl-存在, OH-和Cl-即可延伸至网状结构氧化物 (—Ti-O-Ti—) 链端, 致使水解产物不可能全部为Ti (OH) 4, 采用加入氨水来中和水解反应释放的H+和Cl-, 使反应趋于完全。由于水解产物为Ti (OH) 4·H2O, 而且Ti (OH) 4为类金红石相, 对于金红石型TiO2的生成有一定的促进作用, 因此我们认为氨水起到了晶型促进剂的作用。图1是加添加剂制备的TiO2粉体的XRD图, 室温干燥后不经过任何热处理即有金红石晶相存在, 并且没有出现明显的锐钛晶型。
2.2 XRD分析
将经80℃干燥后的沉淀产物以及分别在300, 400℃下空气气氛中煅烧2 h的粉体样品进行XRD分析, 如图1所示。从干燥后粉体的XRD图谱 (图1 (a) ) 可以看出, 出现的晶体衍射峰2θ对应的d值与JCPDS21-1276卡片上的d值基本吻合, 仅在25.38°处出现较弱锐钛矿型 (101) 衍射峰, 但2θ为22.84°和32.58°处出现了窄而尖锐的NH4Cl衍射峰, 这说明80℃干燥后的沉淀产物的晶相主要为金红石型, 但有NH4C杂质存在。300和400℃煅烧后的衍射峰 (图1 (b, c) ) 尖锐化, 窄而尖锐的NH4Cl衍射峰完全消失, 粉体的结晶度增加, 27.38°处的锐钛矿型 (101) 衍射峰更加明显地显露出来。煅烧温度达400℃时, 锐钛矿型 (101) 的衍射峰几乎完全消失, 粉体晶相向金红石型转化。
根据下面的公式计算干燥和煅烧后各粉体的金红石相含量

式中:Fr为粉体中金红石相的质量分数;IA和IR分别为锐钛矿相的 (101) 衍射面和金红石相的 (110) 衍射面的衍射强度。计算结果列于表1, 由表1可以看出, 干燥 (80℃) 后粉体中的金红石相质量分数高达99.24%, 这说明, TiCl4在含盐酸的水溶液中低温水解生成了以金红石相为主的白色沉淀产物。煅烧温度为300℃时, 金红石相的含量变为99.63%, 这说明煅烧温度在300℃以下时, 粉体中金红石相的含量变化不大, 在这个温度范围内只有少量锐钛矿相向金红石相转化, 当煅烧温度上升为400℃时, 粉体中金红石相的含量从300℃的99.63%上升到了100%, 此时粉体中锐钛矿相已经完全转化金红石相, 并且粉体的结晶度显著增大晶粒生长进一步完整, 得到的是纯金红石相的粉体。
图1 不同温度煅烧后TiO2的XRD
Fig.1 XRD patterns of TiO2powders calcined at different temper-atures
(a) 干燥后的样品; (b) 300℃; (c) 400℃
表1 不同温度煅烧后金红石相的含量 下载原图
Table 1 Rutile content of TiO2powders calcined at different temperatures

表1 不同温度煅烧后金红石相的含量
2.3 粉体的TEM和比表面积分析
图2为水解产物经80℃干燥及300, 400℃煅烧后所得样品, 用HITACHI H-800 Electron MI-CROSCPOE观测到的TEM照片。从图2 (a) 看出, 沉淀产物的颗粒呈椭圆形或近球形, 分散性好, 粒径大都在10~30 nm范围内。采用BET法测定粉体的比表面积, 表2列出了不同温度煅烧后金红石相二氧化钛纳米晶的比表面积的变化, 在真空80℃下干燥得到纳米金红石相的比表面积为154.53 m2·g-1。300℃煅烧后的粉体 (图2 (b) ) 粒子稍有团聚, 但颗粒大小变化不大, 这是因为在此煅烧温度内粒子生长速度较慢的缘故。煅烧后的粉体的比表面积为70.56 m2·g-1, 较未煅烧粉体的比表面积有所下降。400℃煅烧后 (图2 (c) ) 部分粒子团聚, 金红石相粒径迅速长大, 其比表面积下降为55.09 m2·g-1。随着煅烧温度的升高, 比表面积迅速减小, 粒子开始长大, 因此, 可以通过控制反应温度来制备粒子的大小, 制备不同颗粒尺寸和比表面积的纳米金红石型TiO2。
表2 不同温度煅烧后金红石相的比表面积 下载原图
Table 2 Specific surface area of rutile phase calcined at dif-ferent temperatures

表2 不同温度煅烧后金红石相的比表面积
图2 不同温度煅烧后TiO2的TEM照片
Fig.2 TEM images of TiO2powders calcined at different temperatures
(a) 80℃干燥; (b) 300℃煅烧; (c) 400℃煅烧
3 结论
1.以TiCl4为原料, 低温下液相水解可以直接制备金红石型纳米TiO2;异丙醇的加入起到一定的分散作用;只经干燥, 而不需煅烧即可得到金红石相质量分数高达99.24%的纳米TiO2粉体。该工艺大大降低了金红石相的转化温度, 具有原料便宜、能耗小的特点, 是一条粉体收率高、质量好、成本低的液相合成纳米TiO2粉体的新途径, 特别是对制备金红石型纳米TiO2粉体具有十分明显的优势。
2.以氨水作为添加剂使水解直接生成了金红石型TiO2, 可制得的TiO2粒径小且分散均匀, 粒径在10~30 nm;氨水不仅促进TiCl4水解而且起到了晶型转化促进剂的作用
3.煅烧温度越高, 结晶越好, 且粒径也明显增大, 因此可以通过控制反应条件得到不同粒径的金红石相纳米TiO2。如在400℃煅烧得到的产品的粒径为30 nm左右的金红石型二氧化钛, 非常适合作为抗紫外线的添加剂。
参考文献
[1] 高濂, 郑珊, 张青红.纳米氧化钛光催化材料及应用[M].北京:化学工业出版社, 2002.25.
[2] 魏刚, 黄海燕, 熊蓉春.纳米二氧化钛的光催化性能及其在有机污染物降解中的应用[J].现代化工, 2003, 23 (1) :20.
[3] 石玉龙, 谢光文.二氧化钛的用途及其薄膜的制备方法[J].材料与工艺, 2000, (3) :37.
[7] 侯强, 郭奋.金红石型纳米二氧化钛制备中的若干影响因素[J].北京化工大学学报, 2004, 31 (4) :16.
[8] 方晓明, 农云军, 杨卓如, 等.四氯化钛强迫水解制备金红石型纳米二氧化钛[J].无机盐工业, 2003, 35 (6) :24.
[1] 高濂, 郑珊, 张青红.纳米氧化钛光催化材料及应用[M].北京:化学工业出版社, 2002.25.
[2] 魏刚, 黄海燕, 熊蓉春.纳米二氧化钛的光催化性能及其在有机污染物降解中的应用[J].现代化工, 2003, 23 (1) :20.
[3] 石玉龙, 谢光文.二氧化钛的用途及其薄膜的制备方法[J].材料与工艺, 2000, (3) :37.
[7] 侯强, 郭奋.金红石型纳米二氧化钛制备中的若干影响因素[J].北京化工大学学报, 2004, 31 (4) :16.
[8] 方晓明, 农云军, 杨卓如, 等.四氯化钛强迫水解制备金红石型纳米二氧化钛[J].无机盐工业, 2003, 35 (6) :24.