AB5型贮氢合金结构分析
北京有色金属研究总院能源中心,北京有色金属研究总院能源中心,北京有色金属研究总院能源中心,北京有色金属研究总院能源中心 北京100088 ,北京100088 ,北京100088 ,北京100088
摘 要:
贮氢合金的电极性能取决于贮氢合金的微结构。从晶体结构、电子结构及化学键结构等各方面对市场上广泛应用的AB5型贮氢合金的结构进行综述 , 同时讨论合金结构与合金吸放氢性能之间的关系。
关键词:
中图分类号: TM912.2
收稿日期:2004-04-13
基金:国家“十五”863高技术资助课题 (2 0 0 2AA32 30 70 );
Structural Analysis of AB5 Type Hydrogen Storage Alloys
Abstract:
The electrochemical characteristics of hydrogen storage alloys is determined by the structure of hydrogen storage alloys in the nature. We review the crystal structure, the electronic structure and chemical bond of AB5 type hydrogen storage alloys and discuss the relationship between the structure and the electrochemical characteristics of hydrogen storage alloys.
Keyword:
hydrogen storage alloys; AB5; crystal structure; electronic structure;
Received: 2004-04-13
能源安全和环境保护迫使各国政府制定政策, 催生代替燃油汽车的交通工具。 贮氢合金材料的综合性能和合成成本, 是限制镍氢动力电池实用化的最大障碍, 研发低成本、 高性能贮氢合金材料是妥善解决上述问题的必由之路。 贮氢合金的电极性能内在地取决于贮氢合金的微结构。 本文从晶体结构、 电子结构及化学键结构等各方面对市场上广泛应用的AB5型贮氢合金的结构进行综述, 同时讨论合金结构与合金吸放氢性能之间的关系。
1 LaNi5合金的晶体结构
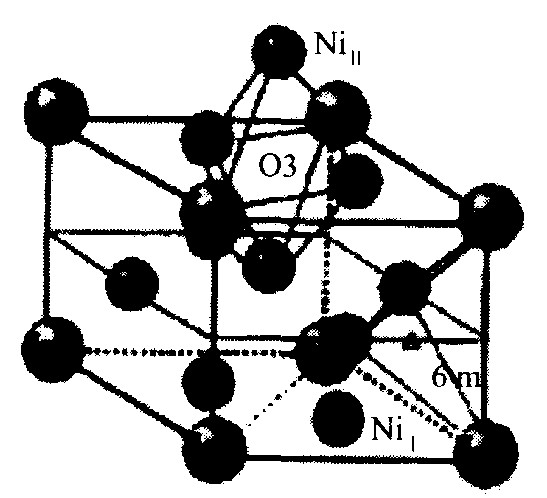
AB5型稀土系贮氢合金是在LaNi5合金的基础上发展起来的。 LaNi5合金的晶体结构为CaCu5型六方结构, 属P6/mmm空间群。 结构示意如图1。
该结构可分为两层, 在Z=0的底层La原子占据 (1a) 位置, Ni原子占据 (2c) 位置; 在Z=1/2的中间层只有Ni原子, 占据 (3g) 位置, 原子坐标分别为
图1 LaNi5合金的晶体结构示意图
Fig.1 Schematic of crystal structure of LaNi5 alloy
La (1a) : (0, 0, 0) ; Ni (2c) : (1/3, 2/3, 0) , (2/3, 1/3, 0) ; Ni (3g) : (1/2, 0, 1/2) , (0, 1/2, 1/2) , (1/2, 1/2, 1/2) 。
LaNi5合金的晶胞参数a=0.5017 nm, c=0.3982 nm, c/a=0.794, 晶胞体积V=0.0868 nm3
2 合金间隙数量和尺寸大小对储氢性能的影响
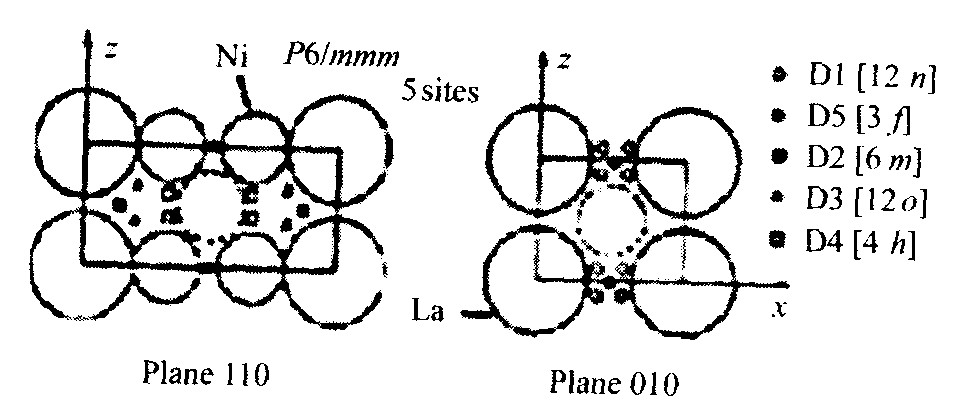
在LaNi5-xMx (M为多元合金元素) 合金晶格中, Ni原子、 M原子和La原子组成八面体间隙和四面体间隙。 按晶体学划分这些间隙可分为 (6m) , (12n) , (12o) , (4h) , (3f) 5种, 从晶面 (110) 和 (010) 上看5种间隙位置的分布如图2所示
由于La系收缩现象, Ce, Pr, Nd的原子半径均小于La的原子半径, 所以, 这些稀土元素以及它们的组合部分替代A侧的La, 各元素之间交互作用, 引起晶胞中a轴收缩。 替代La的多元稀土元素及其配比, 决定AB5合金晶格中间隙位置和尺寸大小
图2 LaNi5合金五种间隙位置的分布示意图 [5]
Fig.2 Distribution of five kinds of interstitial site on LaNi5
过化学计量比贮氢合金LaNi5+x, x值大小和取值范围影响LaNi5合金间隙位置和尺寸大小。 过化学计量比LaNi5+x合金晶体结构示意图如图3所示。 过化学计量比AB5+x的晶体结构不是由过剩的B原子随机取代CaCu5型点阵中的A原子构成, 而是形成了A2B17和AB2点阵结构, 由双相、 多相组成
图3 过化学计量比LaNi5+x合金晶体结构示意图
Fig.3 Schematic representation of the crystal structure of over-stoichiometrical LaNi5+x alloy
对过化学计量比La (Ni, Cu) 5+x和La (Ni, Sn) 5+x合金晶体结构的研究表明
3 化学环境对储氢性能的影响
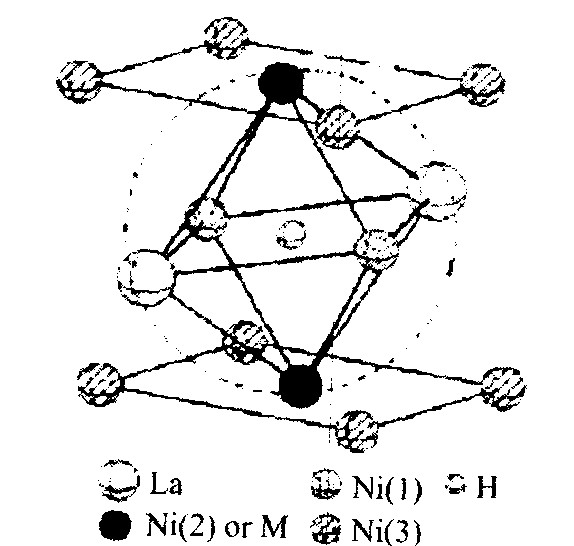
替代LaNi5合金B侧的多元合金元素, 构成LaNi5合金晶格内部及其周围的化学环境。 LaNi5-xMx (M为多元合金元素) 在x≤1.0仍是CaCu5型的晶体结构
图4 LaNi1-xMx晶格中Ni原子的位置示意图 [18]
Fig.4 Schematic of Ni sites in LaNi1-xMx crystal lattice
4 LaNi5Hx的晶体结构
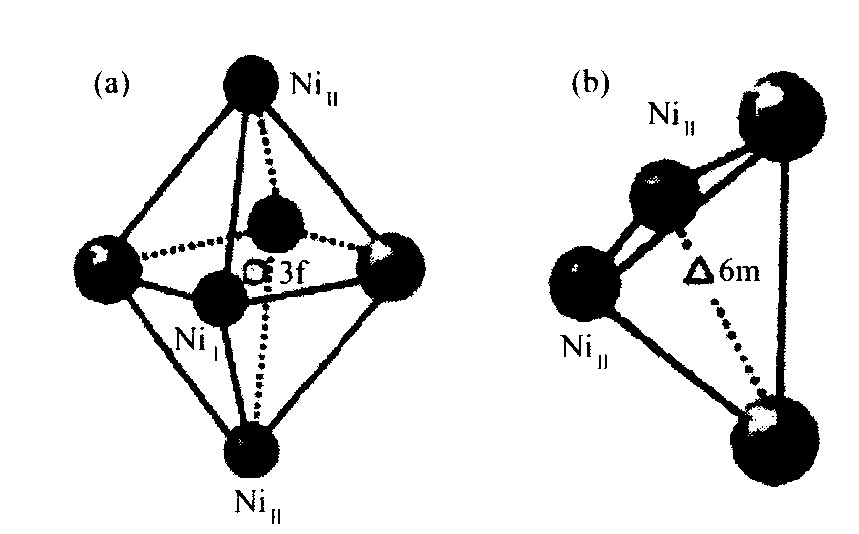
在合金表面氢-氢键解离为原子态氢, 进入金属的原子之间, 形成固溶性的金属氢金属间化合物。 氢在金属晶格中的位置有两种, 一种是六配位八面体间隙位置, 另一种是四配位四面体间隙位置, 图5表示氢在LaNi5晶格中的位置。
图5 氢在LaNi5晶格中的位置示意图
Fig.5 Schematic illustrations of H sites in LaNi5 crystal lattice
(a) 八面体间隙; (b) 四面体间隙
中子衍射实验证实
5 LaNi5Hx的电子结构与吸氢性能
按照Brewer-Engel理论
氢原子在合金中的溶解及金属氢化物的形成, 扰乱了金属晶格中大多数金属按化学计量比的电子分配。 H的存在影响Ni的电子云密度, 主要是Ni的4s, 4p, 3d轨道被H的存在而修饰。 贮氢合金吸氢后形成氢化物, 在此过程中电子结构随之发生了变化
6 贮氢合金氢化物键能大小
在AB5Hx电子结构中, H与氢形成元素A和氢非形成元素B之间化学键的性质, 决定着贮氢合金的稳定性和吸、 放氢速率。 键强大小理论计算的电子结构模型如图6所示。
LaNi5Hx电子结构中元素间化学键的性质由电子密度以及电子云重迭程度决定。 图7为LaNi5Hx电子密度分布图。
由图可知, LaNi5H6中, H周围的电子密度更倾向于与Ni原子重迭而不是与La原子重迭, 说明Ni-H的作用比La-H作用要强。 图8为AB5Hx能带结构说明图, B元素的价带在氢带的上面, 位于H与元素A的能带范围中间, B与H的原子轨道彼此之间易杂化产生分子轨道, 同时, B-H原子之间的距离要比A-H原子之间的距离短, 所以, 在贮氢合金中B-H之间的作用被加强而A-H之间的作用被减弱, 产生的是B-H之间的共价键而不是A-H之间的离子键。
图6 AB5Hx八面体键能计算模型
Fig.6 Octahedral cluster model used calculation for AB5Hx
图7 LaNi5Hx电子密度分布图 [19]
Fig.7 Electron density distribution in LaNi5Hx
图8 能带结构说明图 [20]
Fig.8 Schematic illustrations of the energy band structures
(a) 纯A金属氢化物; (b) 含A, B元素的贮氢合金中的氢化物
Morinaga等
AB5Hx贮氢合金中, 化学键的形成与合金化学成分有重要关系, B-H键是在A元素所营造的化学环境中形成的, Yukawa等
图9 氢与金属原子间键强和氢化物形成焓关系图 [21]
Fig.9 Bond orders between hydrogen and metal atoms in HM2Ni4 cluster and comparison with heat of hydride formation of M metal
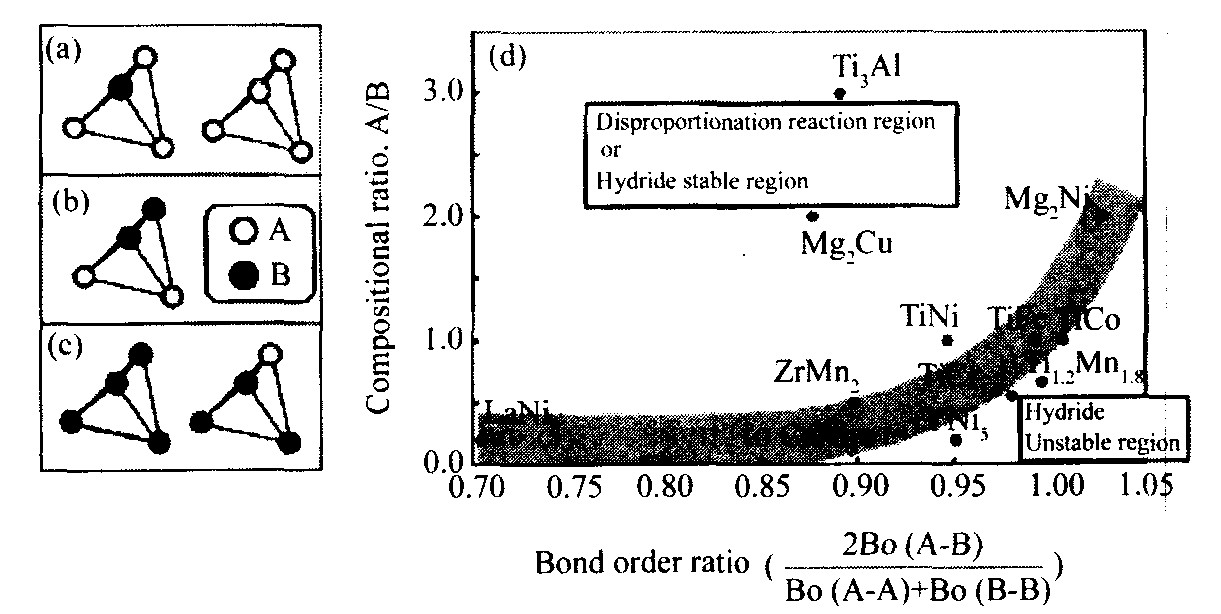
图10 化学组成比率与键强比率的关系 [21]
Fig.10 Correlation between compositional ratio A/B and bond order ratio
(a) ~ (c) 化学组成比率; (d) 化学组成比率与键强比率
综上所述, AB5型贮氢合金的微结构不仅可以从本质上解释合金所具有的各种性能, 同时, 也可以通过对合金各种电子结构的模拟与计算进行合金的设计, 初步确定特定性能贮氢合金的组分构成, 与经验式的、 带有一定盲目性的合金研究方法相比, 减少试验的盲目性和错误实验率, 可大幅度节约研究经费和时间。
参考文献
[1] 大角泰章. 金属氢化物的性质与应用[M ].第一版, 北京:化学工业出版社, 1990.
[2] 钱存富, 杜 昊, 王洪祥, 等. LaNi5型储氢材料最大储氢量的讨论[J].稀有金属材料与工程, 2000, 29 (1) :25.
[3] 马建新. 合金化、热处理及磁化处理对AB5型贮氢合金电极合金微结构与电化学性能的影响[D].杭州:浙江大学, 2002.
[8] 任 可, 雷永泉, 陈立新, 等. ML (Ni4.55-xCoxMn0.4Ti0.05) 合金的相结构与电化学性能[J].金属学报, 2000, 36 (4) :364.
[11] CoeneW , NottonPHL , HakkensFetal. Philos.Mag., 1992, 65:1485.
[15] BockrisJOM , KhanSUM , 冯宝义, 等译. 量子电化学[M ].1988.
[18] 陈 宁, 林 勤, 叶 文, 等. RENi5电子结构与吸氢性能关系研究[J].科学通报, 1995, 40 (24) :2234.
[1] 大角泰章. 金属氢化物的性质与应用[M ].第一版, 北京:化学工业出版社, 1990.
[2] 钱存富, 杜 昊, 王洪祥, 等. LaNi5型储氢材料最大储氢量的讨论[J].稀有金属材料与工程, 2000, 29 (1) :25.
[3] 马建新. 合金化、热处理及磁化处理对AB5型贮氢合金电极合金微结构与电化学性能的影响[D].杭州:浙江大学, 2002.
[8] 任 可, 雷永泉, 陈立新, 等. ML (Ni4.55-xCoxMn0.4Ti0.05) 合金的相结构与电化学性能[J].金属学报, 2000, 36 (4) :364.
[11] CoeneW , NottonPHL , HakkensFetal. Philos.Mag., 1992, 65:1485.
[15] BockrisJOM , KhanSUM , 冯宝义, 等译. 量子电化学[M ].1988.
[18] 陈 宁, 林 勤, 叶 文, 等. RENi5电子结构与吸氢性能关系研究[J].科学通报, 1995, 40 (24) :2234.